17β-雄甾醇-[3,2-b]-吲哚的合成
2016-02-25顾庆美刘祖朗周琢强
顾庆美, 刘 凯, 刘祖朗, 周琢强
(华南农业大学 理学院,广东 广州 510642)
·研究简报·

通信联系人: 周琢强,博士,副教授,硕士生导师, Tel. 020-85282078, E-mail: zqzhou@scau.edu.cn
17β-雄甾醇-[3,2-b]-吲哚的合成
顾庆美, 刘凯, 刘祖朗, 周琢强*
(华南农业大学 理学院,广东 广州510642)
摘要:以表雄酮为原料,经羟基氧化、羰基保护、还原、Fischer吲哚环化等反应合成了17-β-醇-雄甾-[3,2-b]-吲哚(5),总收率43.2%,其结构经1H NMR, IR和MS确证。生物活性初步测试结果表明:与雄诺龙相比,5对淡色库蚊的杀虫活性显著提高,在浓度为400 mg·L-1时,杀虫率为41.5%。
关键词:雄诺龙; 吲哚环; 表雄酮; Fischer合成法; 杀虫活性
雄诺龙(双氢睾酮)是人体内雄性激素的最主要成分,具有重要的生理作用。该甾体化合物和受体蛋白质在细胞内结合成的复合体进入附属腺的细胞核中,促进新的蛋白质合成,显示出比睾酮稍强的雄性激素作用。研究发现,具有甾核结构的甾体衍生物中,大多数都表现出良好的抗肿瘤、抗菌及抗炎等生物活性。因此,以具有生物活性的天然甾体化合物作为先导化合物,改变甾核结构,引入具有较高生理活性的官能团,并进行活性筛选开发新药,一直是医药合成研究的热点[1]。
许多生理活性很强的天然化合物具有吲哚环或为吲哚的衍生物,这类化合物不仅可以合成染料、香料、植物生长素及饲料添加剂,而且可用来治疗心血管病、糖尿病及肺癌等多种疾病,近年来吸引了越来越多的化学家们的关注[2]。
文献研究表明根据活性叠加原理,甾体环上引入芳香杂环后抑制肿瘤细胞生长活性、抗菌活性或者抑制某些酶活性的作用会有所增强[3]。周琢强研究小组[4]曾成功将吲哚环引入薯蓣皂素的结构,并得到较好的抗虫活性。
本文以表雄酮为初始原料,经氯铬酸吡啶鎓盐(PCC)氧化制得5α-雄甾烷二酮(1);在SeO2催化下1的3-位羰基与CH3OH反应形成缩醛[5]制得(5α)-3,3-二甲氧基雄甾烷-17-酮(2); 2的17-位羰基经还原制得(5α,17β)-3,3-二甲氧基雄甾烷-17-醇(3); 3经酸化脱除保护基制得中间产物雄诺龙(4);最后采用经典的Fischer吲哚合成法在甾体环上引入活性基团吲哚环[6]合成17β-雄甾醇-[3,2-b]-吲哚(5, Scheme 1),其结构经1H NMR, IR和MS确证。并对其生物活性进行了初步测试。
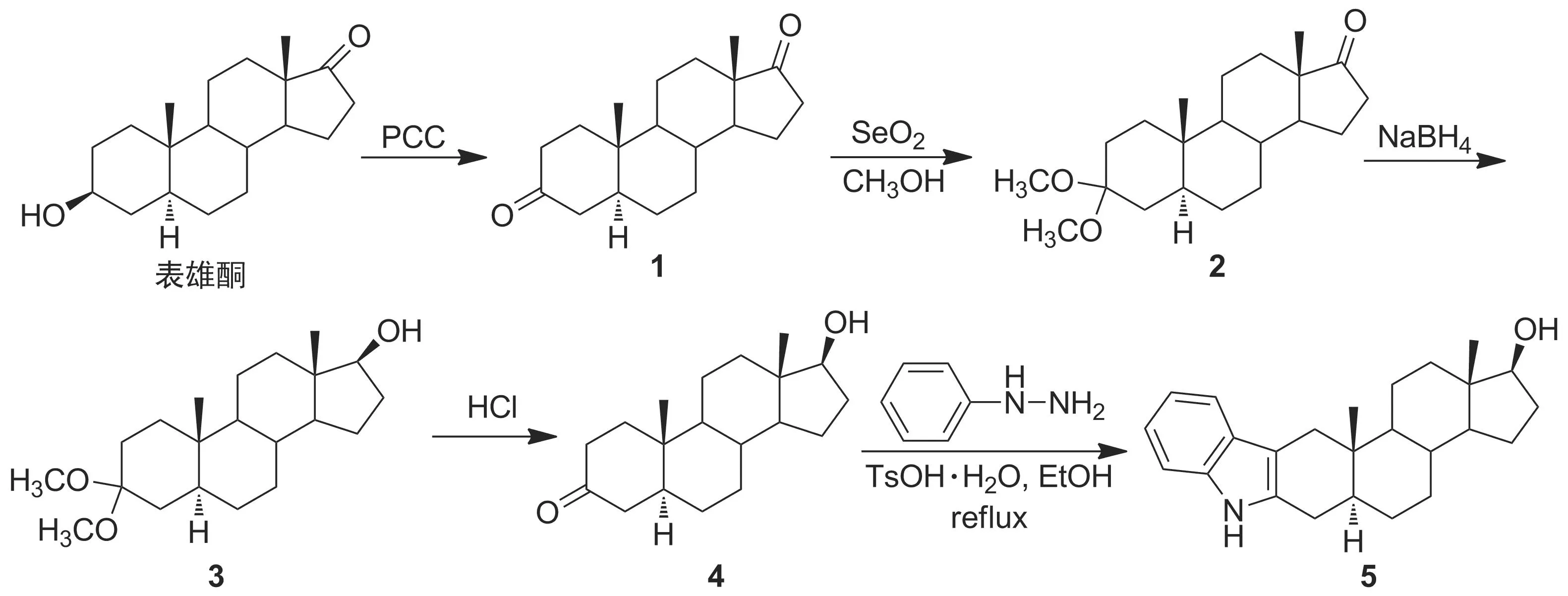
Scheme 1
1实验部分
1.1 仪器与试剂
X-4型数字显微熔点仪(温度未校正);ZF-I型三用紫外分析仪;Bruker AVANCE Ⅲ 600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet AVA7AR360-FT型红外光谱仪(KBr压片);Finnigan-4510型质谱仪。
表雄酮[7]和PCC[8]按文献方法合成;其余所用试剂均为分析纯。
1.2 合成
(1) 1的合成
在反应瓶中加入表雄酮4.35 g(15 mmol)和二氯甲烷50 mL,搅拌使其溶解;加入PCC 9.70 g(45 mmol),于室温反应至终点(TLC跟踪)。抽滤,有机相依次用水、饱和NaHCO3溶液及饱和NaCl水溶液洗涤,无水硫酸钠干燥,活性炭脱色,蒸除溶剂得白色固体1 3.80 g,收率89.7%, m.p.131~132 ℃(132 ℃[9]); IRν: 3 452(OH, H2O), 2 970(CH3), 2 932(CH2), 1 741, 1 713(C=O) cm-1。
(2) 4的合成
在反应瓶中加入1 1.0 g(3.5 mmol)和甲醇50 mL,搅拌使其溶解;冰浴冷却下加入SeO21.0 g(9 mmol),反应2 h(TLC跟踪);加入NaBH42.5 g(66 mmol)和NaOH 1.0 g(25 mmol)水(5 mL)溶液,搅拌下于室温反应24 h。倒入冰水中,用二氯甲烷萃取,萃取液用无水硫酸钠干燥,蒸干后加入丙酮50 mL和浓盐酸10 mL,回流反应4 h。减压蒸除丙酮,残余物用二氯甲烷溶解,依次用水、饱和NaHCO3溶液及饱和NaCl溶液洗涤,干燥,蒸除溶剂得白色固体4 0.6 g,收率60%(两步总收率53.8%), m.p.177~179 ℃(175~178 ℃[10]); IRν: 3 454(OH), 2 966(CH3), 2 922(CH2), 1 702(C=O), 1 078(C-O) cm-1。
(3) 5的合成
在反应瓶中依次加入4 0.87 g(3 mmol),无水乙醇30 mL,苯肼0.49 g(4.5 mmol)和TsOH·H2O 0.57 g(3 mmol),搅拌下回流反应至终点(TLC跟踪)。冷却至室温,旋蒸除去乙醇,残余物用二氯甲烷溶解,依次用水洗涤、无水硫酸钠干燥,蒸除溶剂后经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=2 ∶1]纯化得灰色固体5 0.97 g,收率89.5%, m.p.241~244 ℃;1H NMRδ: 0.79(s, 3H), 0.82(s, 3H), 0.95~2.21(m, 19H), 2.32(d,J=10.5 Hz, 1H), 2.56(dd,J=5.1 Hz, 14.8 Hz, 1H), 3.64~3.69(m, 1H), 6.99~7.10(m, 2H), 7.43(d,J=7.22 Hz, 1H), 7.68(s, 1H); IRν: 3 416(OH), 2 913(CH3), 2 848(CH2), 1 625, 1 469(C=C), 1 050(C-O), 742 cm-1; MS(APCI)m/z: 364.5{[M+H]+}, 346.5{[M-NH3]+}。
1.3 杀虫活性测定
供试昆虫:淡色库蚊(Culex pippens)幼虫。
实验方法:在100 mL烧杯中,配制不同浓度的试液,放入20条库蚊幼虫,以清水设空白对照,于室温放置24 h,记录死活虫虫数,活虫与死虫的鉴别用钢针触动蚊子幼虫,以不动为死亡。每个浓度测三次,计算平均值。
2结果与讨论
2.1 4的合成
选择性保护羰基是合成4的关键步骤,保护羰基的最常用方法是形成缩醛或缩酮。由于反应底物中3-位和17-位有两个羰基,而产物要使3-位羰基得到保留,因此选择性保护3-位羰基才能获得目标产物。 Andre等[11]用镧系元素(NdCl3, CeCl3和ErCl3), Gasparrini等[12]用正丙胺基硅胶盐酸盐, Piccolo[13]用1,2-二(三甲基硅氧)乙烷-三氟甲磺酸三甲基硅酯做催化剂,与甲醇反应均获得较好收率的3,3-二甲氧基缩酮而17-位羰基不发生变化;Samajdar等[14]以碘为催化剂,在THF中与丙硫醇反应,也获得高收率的3-位单硫缩酮。但在这些方法中,前者存在催化剂难以制备,后者存在反应中间体要分离的问题。而用SeO2做催化剂,与甲醇先形成3,3-二甲氧基缩酮,然后用NaBH4还原,再水解,反应中间体不需要分离,收率中等。SeO2一方面作为催化剂,另一方面作为脱水剂[5]。
2.2 不同催化剂对吲哚环合成的影响
吲哚合成方法一般有Fischer吲哚合成法、Madelong吲哚合成法、Witting吲哚合成法和Nenitzescu吲哚合成法等。其中Fischer吲哚合成法最为经典,迄今为止已有一百多年的历史。尽管这种方法古老但却比较有效,近年来常用该方法合成含有复杂吲哚环结构的药物。
吲哚合成法的反应机理表明:首先由芳香肼和羰基化合物反应形成腙,然后在酸的催化下发生[3,3]-σ迁移,最后放出NH3关环形成吲哚环。该反应决定速率步骤可能为[3,3]-σ迁移步骤。Fischer吲哚合成中常用的催化剂有无机酸(H2SO4, HCl, H3PO4和PPA等),有机酸(CH3SO3H,p-TsOH和AcOH等),Lewis酸(ZnCl2和AlCl3等)及有机碱[EtONa和NaB(OAc)3]等,其主要作用是有利于腙的重排。
4 3 mmol,其余反应条件同1.2(3),考察了不同催化剂对该反应的影响,结果见表1。由表1可见,TsOH·H2O为催化剂时,收率最高(89.5%); EtONa为催化剂时,收率最低(20%)。因此该反应以TsOH·H2O为催化剂较佳。
本文还尝试改变反应溶剂,采用冰乙酸作为溶剂兼催化剂[17],于110 ℃剧烈回流反应3 h也可获得吲哚化合物,但反应温度过高,副产物较多,产物颜色较深。因此,该反应以TsOH·H2O作催化剂,无水乙醇为溶剂,反应时间短,收率高,副反应少。

表1 不同催化剂对5收率的影响
2.3 杀虫活性
雄诺龙和5的杀虫活性结果见表2。从表2可以看出,雄诺龙的杀虫活性很小,在浓度为400 mg·L-1时,杀虫率为14.3%; 5的杀虫活性有显著增强,并且随着浓度的增大,杀虫活性增强,在浓度为400 mg·L-1时,杀虫率为41.5%。

表2 杀虫活性测试结果
3结论
以表雄酮为原料,成功合成了含吲哚环的甾体化合物17β-醇-雄甾-[3,2-b]-吲哚(5)。在Fischer吲哚合成法中,乙醇为溶剂,TsOH·H2O为催化剂,苯肼用量为1.5 eq.,反应效果最佳,收率89.5%。初步测定了其杀虫活性,与雄诺龙相比,5对淡色库蚊的杀虫活性得到显著提高。
参考文献
[1]甘春芳,盛海兵,戚斌斌,等. 具有特殊甾核结构甾体化合物的合成及生理活性研究进展[J].有机化学,2014,34:1737.
[2]石雷,王新平,蔡天锡. 吲哚环化合物合成方法的进展[J].有机化学,2001,21(3):200-204.
[3]崔建国,刘亮,甘春芳,等. 芳(杂)环载体化合物的合成及生理活性研究[J].化学进展,2014,26(2/3):332.
[4]甘继荣. 剑麻皂素结构修饰及其杀虫性研究[D].广州:华南农业大学,2006.
[5]Oliveto E P, Hershburg E B. Process for the manufacture of 3-ketals of polyketo steroids and products obtaind thereby:US 2 927 921[P].1960.
[6]Lim Y K, Cho C G. Expedient synthesis of indoles fromN-Boc arylhydrazines[J].Tetrahedron Letters,2004,45(9):1857-1859.
[7]张志花,倪珊梅,顾庆美. 表雄酮的合成[J].广东化工,2013,40(8):25-26.
[8]Piancatelli G, Scettri A, Dauria M. Pyridinium chlorochromate:A versatile oxidant in organic synthesis[J].Synthesis,1982:245-258.
[9]Westphal U, Serini A, Köster H. Hydroxy ketones of the cyclopentanopoly-hydrophenanthrene series and method of producting the same:US 2 294 433[P].1942.
[10]Oliveto E P, Bloomfield, Hershberg E B,etal. Process for the manufacture of 3-ketals of polyketo steroids and products obtaind thereby:US 2 773 888[P].1956
[11]Gemal A L, Luche J L. Lanthanoids in organic synthesis.4.Selective ketalization and reduction of carbonyl groups[J].J Org Chem,1979,44(23):4187-4189.
[12]Gasparrini F, Giovannoliand M, Misiti D. Synthesis of dimethyl acetals,diethyl acetals,and cyclic acetals catalyzed by aminopropylated silica gel hydrochloride(APSG·HCl)[J].Tetrahedron,1984,40(9):1491-1500.
[13]Hwu J R, Wetzel J M. The trimethylsilyl cationic specias as a bulky proton.Application to chemoselective dioxolanation[J].J Org Chem,1985,50:3946-3948.
[14]Samajdar S, Basu M K, Becker F F,etal.A new molecular iodine-catalyzed thioketalization of carbonyl compouds:Selectivity and scope[J].Tetrahedron Letter,2001,42:4425-4427.
[15]Hughes D L, Zhao D L. Mechanistic studies of the Fischer indole reaction[J].J Org Chem,1993,58:228-233.
[16]荣国斌,译. 有机人名反应及机理.第二版[M].上海:华东理工大学出版社,2003,28-138.
[17]Nerkar A G, Pawale D, Ghante M R,etal.Microwave assisted organic synthesis of some traditional and named reactions:A practical approach of green chemistry[J].International Journal of Pharmacy and Pharmaceutical Sciences,2013,5(Suppl.3):564-566.

Synthesis of Androstane-2-eno[3,2-b]-indol-17-ol
GU Qing-mei, LIU Kai, LIU Zu-lang, ZHOU Zhuo-qiang*
(College of Science, South China Agricultural University, Guangzhou 510642, China)
Abstract:Androstane-2-eno[3,2-b]-indol-17-ol(5) with the total yield of 43.2% was synthesized by hydroxyl oxidation, carbonyl protection, carbonyl reduction and Fischer indole synthesis using dehydroepiandrosterone as the starting material. The structure was confirmed by1H NMR, IR and MS. The results of the biological activity tests on culex pippens showed that comparing with dihydrotestosterone, the insecticidal activity of 5 increased significantly, and the insecticidal rate was 41.5% at 400 mg·L-1.
Keywords:dihydrotestosterone; indole ring; dehydroepiandrosterone; Fischer synthesis; insecticidal activity
中图分类号:R914.5; O629.2
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.01.15026
作者简介:顾庆美(1990-),女,汉族,安徽蚌埠人,硕士研究生,主要从事药物的设计、合成及应用研究。Tel. 020-85282078, E-mail: guqingmei1990@163.com
基金项目:国家自然科学基金资助项目(31171883)
收稿日期:2015-01-26;
修订日期:2015-10-16
