不同孔径丝素蛋白支架体内降解观察
2016-02-24千建峰蔡丽慧亓卫东
千建峰 蔡丽慧 亓卫东* 赵 霞 陈 新
1(复旦大学附属华山医院耳鼻咽喉-头颈外科,上海 200040)2(聚合物分子工程国家重点实验室,高分子及其先进复合材料协同创新中心,复旦大学高分子科学系先进材料实验室,上海 200433)3(郑州人民医院耳鼻咽喉-头颈外科, 郑州 450012)
不同孔径丝素蛋白支架体内降解观察
千建峰1,3蔡丽慧1亓卫东1*赵 霞1陈 新2
1(复旦大学附属华山医院耳鼻咽喉-头颈外科,上海 200040)2(聚合物分子工程国家重点实验室,高分子及其先进复合材料协同创新中心,复旦大学高分子科学系先进材料实验室,上海 200433)3(郑州人民医院耳鼻咽喉-头颈外科, 郑州 450012)
近年来,丝素蛋白支架因其固有的低免疫原性、良好的生物相容性在组织工程研究中备受关注。通过观察不同孔径丝素蛋白支架在活体Sprague-Dawley(SD)大鼠体内不同时间点降解的形态学特点,了解材料的结构特性对丝素蛋白支架降解的影响。将3种不同孔径丝素蛋白支架:SF1(平均孔径 (20±1.5) μm,平均孔隙率 86.8%±0.2%)、SF2(平均孔径(100±8) μm,平均孔隙率 92.4%±0.1%)、SF3(平均孔径(200±15) μm,平均孔隙率 96.6%±0.1%)随机植入12只SD大鼠背部皮下,分别于术后6、12、18、24周随机取材,分别进行大体观察、组织切片HE染色和Masson染色。结果显示,不同孔径丝素蛋白支架在体内的降解速率不同:SF1 24周内未见明降解,SF2 24周内降解约40%,SF3至24周时基本崩解。植入早期丝素蛋白支架主要被炎性细胞及成纤维细胞浸润,后期主要为成纤维细胞,并可见胶原纤维包绕并生长入材料。孔径较大的丝素蛋白支架比孔径较小的降解速度快,可通过改变丝素蛋白支架的孔径有效干预丝素蛋白支架在生物体内的降解速率,以适应不同组织修复的需求。
丝素蛋白;多孔支架;组织工程;降解
引言
组织工程技术包含3个关键要素:种子细胞、支架材料和细胞因子[1]。支架材料作为组织再生的框架,其特性直接影响细胞的粘附、生长和代谢。多孔丝素蛋白支架能够支持软骨细胞、骨细胞、上皮细胞、内皮细胞、胶质细胞、角质化细胞、成纤维细胞、血管、脂肪、神经等的黏附、增殖与分化,成为目前组织工程研究的热点[2-8]。我们已在多孔径丝素蛋白支架上成功培养了成纤维细胞、许旺细胞[9],初步观察了多孔丝素蛋白支架原位修复兔下
颌骨临界性骨缺损效果[10]。理想的组织工程支架材料不仅要具备良好的生物相容性,还应具有与修复区组织细胞生长速率相匹配的降解速率,这样才能为新生组织提供相应的力学支撑。由于对丝素蛋白材料体内降解的控制尚缺乏深入的了解[11-13],本研究通过对活体动物体内埋植不同孔径丝素蛋白降解行为进行观察,了解不同孔径丝素蛋白支架在体内降解速率、降解过程中材料的形态学改变以及宿主的组织学反应,为进一步研究丝素蛋白材料体内降解的可控提供参考。
1 材料与方法
1.1 多孔丝素蛋白支架的制备
由复旦大学高分子科学系制备3种不同孔径的丝素蛋白支架,3种支架的规格均为直径1.5 cm、厚0.5 cm圆柱体,圆柱体外周为薄致密层,内为多孔结构,孔径平均大小分别为20、100、200 μm,依次以SF1、SF2、SF3命名。
1.2 多孔丝素蛋白支架的基本参数检测
1.2.1 孔隙率的测定
采用密度法测量,有
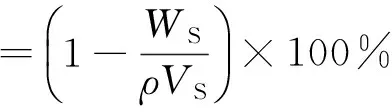
式中,WS为丝素蛋白支架的质量,VS为支架的表观体积,ρ为丝素蛋白密度。
随机取5个丝素蛋白支架样品,其中丝素蛋白密度ρ=1.355 g/cm3,计算3种丝素蛋白支架的孔隙率(n=5)。
1.2.2 孔径的测定
在3种多孔丝素蛋白支架中分别随机抽取20个样本,切成小片后冷冻干燥,然后在液氮中脆断,并用导电胶固定在样品台上,喷金后在TS 5136MM型可变真空扫描电子显微镜上(500×)对多孔支架断面的形貌进行观察,测试电压为20 kV。多孔支架的孔径大小和分布由图像处理软件随机选择50个孔测量并统计平均求得,以Mean±SD表示。
1.3 动物实验
1.3.1 实验动物的购买与饲养
健康Sprague-Dawley(SD)雄性大鼠12只,体重150~200 g,由复旦大学上海医学院实验动物部提供[许可证:SCXK(沪)2007-0 007]。在复旦大学上海医学院实验动物中心同环境下适应性饲养1周。
1.3.2 支架植入手术
术区备皮,动物用盐酸氯胺酮注射液(2 mL/0.1 g)与咪达唑仑注射液(2 mL/2 mg)按1∶2比例混合后腹腔麻醉。仰卧位,碘伏于术区及周围5 cm的皮肤常规消毒、铺巾。在其脊柱两侧共作3个长约1 cm切口,潜行分离形成3个皮下囊状间隙,分别将SF1、SF2、SF3植入左上、右上及左下3个囊状间隙,丝线分层缝合皮肤切口。
1.3.3 实验分组及取材
根据国家标准[14]《医疗器械生物学评价第六部分:植入后局部反应试验》确定观察时间为材料植入SD大鼠体内术后6、12、18、24周。每个时间点随机抽取3只动物取材,每次分别有SF1、SF2、SF3各3个标本。分别进行大体观察、HE染色、Masson染色组织切片观察。
1.3.4 术后观察及组织学染色
1)大体观察。动物麻醉后取出皮下植入材料,取材时保留周围部分组织。观察材料周围组织有无明显炎症反应,材料表面有无明显纤维组织包绕,周围组织有无反应性肉芽增生,植入材料的外观形态改变,测量植入材料的直径与厚度得出降解百分比。
2)HE染色。将植入材料标本置于10%中性福尔马林液中固定,常规石蜡包埋、切片、HE染色,光学显微镜下观察不同时间点组织纤维化反应、炎性细胞类型,及支架崩解情况,是否存在组织坏死,材料内有无组织长入。
3)Masson染色。取出材料保留部分周围组织,常规石蜡包埋、切片、Masson染色,光学显微镜下观察Masson染色结果,染色后胶原纤维、粘液、软骨呈蓝色,胞浆、肌肉、纤维素、神经胶质呈红色,胞核黑蓝色。
2 结果
2.1 多孔丝素蛋白支架孔径及孔隙率
制备3种多孔丝素蛋白支架材料SF1、SF2、SF3(见图1),平均孔径及孔隙率见表1。

图1 3种不同孔径丝素材料扫描电镜照片(500×)。 (a) SF1; (b) SF2; (c) SF3Fig.1 Scanning electron microscope images of silk fibroin scaffolds with different pore sizes (500×). (a) SF1; (b) SF2; (c) SF3

表1 3种多孔丝素蛋白支架参数(均值±标准差)Tab.1 Mean aperture and mean porosity of 3 silk fibroin scaffold materials(Mean±SD)
2.2 标本大体观察
SF1: 术后6周,SF1形态、外观与植入前无明显变化,移植物周围无明显炎症反应;术后12~24周,可见丝素蛋白支架与周围组织轻度粘连,易于分离。6周~24周内支架材料体积及外形无明显变化(见图2(a))。
SF2: 术后6周,SF2与周围组织粘连,表面组织较易分离。第12周开始发现材料体积变小约15%,部分降解,与周围新生组织难以分离。随着时间延长,材料厚度逐渐变薄,与周围组织粘连更加紧密,24周时丝素蛋白支架直径无明显变化,厚度缩小约40%(见图2(b))。
SF3: 术后6周,SF-3与周围组织难以分离,体积较植入前变小。12周时,材料与周围组织分离困难,材料直径无明显变化,体积缩小约50%。24周时,组织生长进入材料内部,很难找到成形材料存在(见图2(c))。
总体上SF1在24周内降解十分缓慢或基本不能降解;SF2降解较缓慢,24周时厚度缩小约40%;SF3降解较快,12周厚度减少约50%,24周时支架基本崩解。

图2 植入3种支架术后大体观察像(每行从左至右分别为12、18、24周时照片)。 (a) SF1; (b) SF2; (c) SF3Fig.2 Images of 3 silk fibroin scaffolds postoperative 12, 18 and 24 weeks (from left to right each line). (a) SF1; (b) SF 2; (c) SF 3
2.3 HE染色
SF1: 术后第6周取材,SF-1材料表面可见巨噬细胞及较多中性粒细胞浸润。随着时间延长,炎症细胞逐渐减少,成纤维细胞逐渐增多。在整个降解过程中丝素蛋白支架嗜伊红染色,材料与周围组织界限清楚,内部未见组织细胞长入,材料结构变化不大(见图3(a))。
SF2:术后6周可见成纤维细胞粘附在丝素蛋白材料表面生长,周围组织呈增生性改变,可见炎性细胞浸润,偶可见新生血管形成,周围组织未见坏死征象。术后12周可见组织细胞逐渐长入材料,18周后边界材料出现明显崩解现象,24周可见成熟血管长入材料(见图3(b))。
SF3:术后6周材料内部分区域嗜伊红染色消失,支架结构有崩解现象,炎症细胞明显减少,可见较多血管及成纤维细胞,成纤维细胞等组织细胞逐渐深入材料内部生长。术后12周见较多成熟血管及成纤维细胞,材料边缘支架结构崩解现象较前明显,出现较大孔隙,但材料内部变化不大,组织细胞进一步长入材料,组织增生现象仍较明显。术后18周与12周所见基本相同,组织细胞进一步长入材料。术后24周丝素支架基本崩解,组织细胞与残存材料共存,镜下界限不明确(见图3(c))。
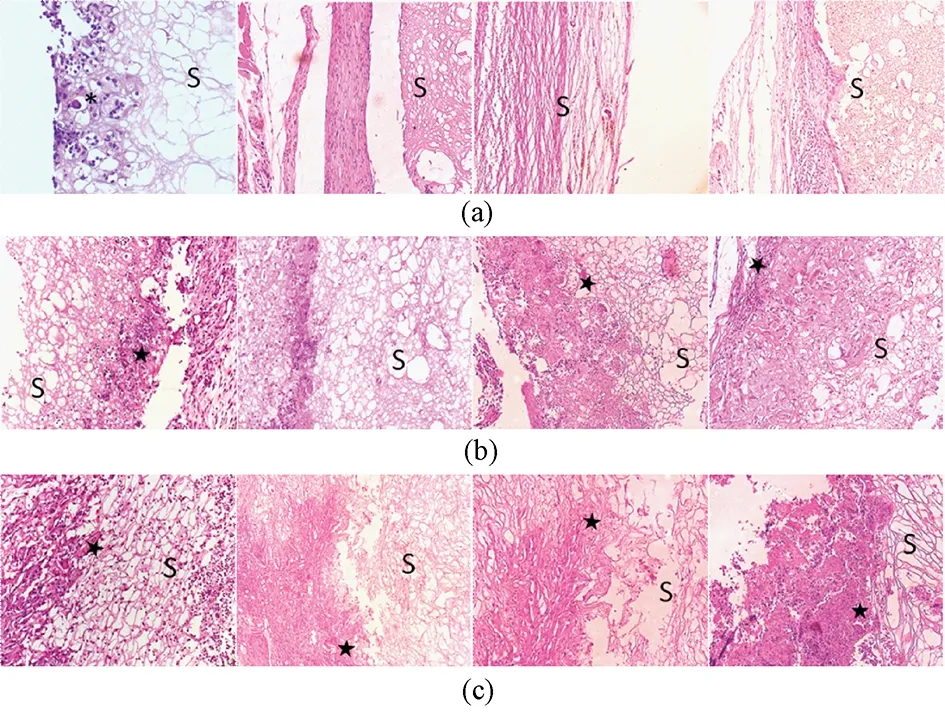
图3 植入3种支架后HE染色图像(每行从左至右分别为6、12、18、24周时照片,左起第1列400×,其余为200×; S-丝素蛋白支架, *-巨噬细胞; ★-血管)。 (a) SF1; (b) SF2; (c) SF3Fig.3 Images of HE staining for 3 silk fibroin scaffolds postoperative 6, 12, 18 and 24 weeks (From left to right each line, first column left 400×, others 200×; S- silk fibroin scaffolds, *- macrophages; ★- blood vessel). (a) SF 1; (b) SF 2; (c) SF 3
2.4 Masson染色
SF1:术后6周、12周、18周时,材料与周围组织无明显粘连,可见胶原纤维与丝素材料界限较清楚,未见明显包绕、长入。术后24周见胶原纤维包绕材料,但未长入材料(见图4(a))。
SF2:术后6周材料周围见胶原纤维包绕,未见明显长入。术后12周,胶原纤维长入材料,边界模糊。随着时间延长,血管与胶原纤维逐渐由丝素蛋白支架周围向内部生长(见图4(b))。
SF3:术后6周见较多胶原纤维、新生血管长入材料。12周时可见成熟血管及胶原纤维进一步长入。18周时见胶原纤维侵入材料深部,分区包绕材料。24周见大量胶原纤维分区包绕残余材料,正常材料结构基本消失(见图4(c))。
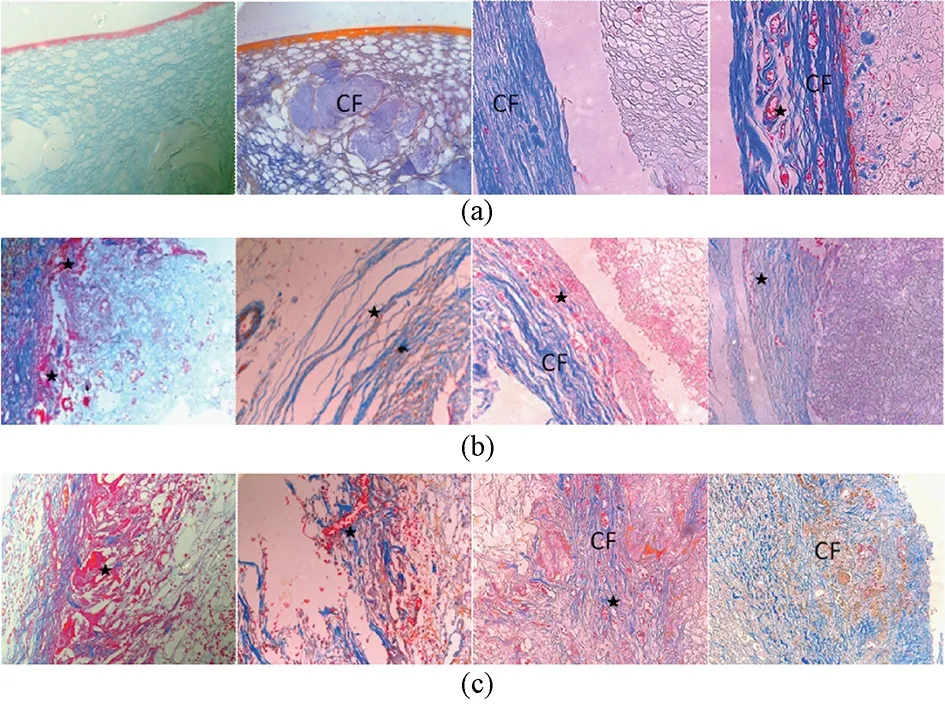
图4 植入3种支架后Masson染色图像(每行从左至右分别为6、12、18、24周时照片, 400×; CF-胶原; ★-血管)。 (a) SF1; (b) SF2; (c) SF3Fig.4 Images of Masson staining for 3 silk fibroin scaffolds postoperative 6, 12, 18 and 24 weeks(From left to right each line, 400×; CF- collagen; ★- blood vessel). (a) SF1; (b) SF2; (c) SF3
3 讨论
天然蚕丝作为手术缝线已有超过100年的历史,其主要成分丝素蛋白作为一种天然高分子材料,因其固有的低免疫原性、良好的生物相容性、缓慢的降解速度和特有的理化性质在组织工程研究中备受关注。
具备良好的生物相容性是作为组织工程或组织诱导支架的一个必要前提,生物材料的降解性能同样至关重要,材料的降解速率必须与组织的再生速率相匹配,并且满足组织的功能需求。因此,需要弄清丝素蛋白材料的生物可降解程度、降解机理及影响其降解速度的因素。
丝素蛋白在体内降解并非单一机理,而是一个复杂的生物物理、生物化学协同作用、相互促进的过程。多孔丝素的降解行为与材料制备工艺、孔径、丝素蛋白的浓度、材料表面粗糙度、结晶度,材料植入部位、周围受力情况密切相关[15-16]。体外研究显示,多种蛋白酶如弹性蛋白酶、放线菌蛋白酶、胶原蛋白酶等对丝素蛋白材料具有降解作用[17-18]。生物体内环境复杂,通过活体实验能够直接、准确地了解材料在动物体内的降解行为及机体对材料的组织学反应。本实验中3种丝素蛋白支架的差别主要是孔径不同,通过观察不同孔径丝素蛋白支架体内降解过程,为我们了解材料结构特性对丝素蛋白体内降解的影响提供帮助。
在形貌特征方面,丝素蛋白具有的疏松多孔结构有利于细胞黏附[19]。本实验制备的材料具有疏松多孔结构,3种丝素蛋白支架的平均孔径分别为20、100、200 μm,孔隙率均在85%以上。丝素蛋白属于天然可降解生物活性材料,通过观察上述3种不同孔径丝素蛋白支架在体内降解速率,孔径最小的SF1植入SD大鼠皮下24周基本没有降解,孔径较大的SF2植入24周后材料降解约40%,孔径最大的SF3植入24周后基本崩解。因此,孔径较大的SF3、SF2较孔径小的SF1降解速率明显加快,这种体内降解速率的差异是由孔径不同造成的。我们考虑大孔径、高孔隙率一方面能够降低了植入材料密度,另一方面提高了支架材料与细胞的接触面积,有利于细胞黏附生长进入支架内部,有利于营养物质进入及代谢产物排出。
我们在取材时发现,6周时植入物周围炎症反应已不明显,且材料表面有半透明纤维膜包裹。3种丝素蛋白支架降解速率明显不同,随着材料的降解,周围组织逐渐长入支架内部,难以分离。HE染色发现丝素蛋白嗜伊红染色,植入初期材料表面可见炎性细胞聚集及成纤维细胞紧贴材料的不规则表面沿腔隙向内部生长,后期炎性细胞明显减少,血管及成纤维组织逐渐向材料内部生长,大孔径材料结构逐渐崩解,形态不规整。Masson染色可见降解较快的SF2与SF3被大量胶原纤维长入、包绕,降解较慢的SF1未见胶原纤维长入。实验结果提示,丝素蛋白在体内的降解,早期主要与宿主的炎性细胞聚集有关,而后期似与成纤维细胞有关,炎性细胞中的巨噬细胞与生物材料在体内的降解有关。
4 结论
综上所述,丝素蛋白支架具有良好的组织相容性,孔径大小对丝素材料降解有明显相关性,提示可通过改变丝素蛋白支架的孔径有效干预其在生物体内的降解速率以匹配不同组织修复的要求。但是,根据不同部位组织修复的特点,除了考虑支架材料降解与局部组织修复速度相匹配这一因素外,对支架材料在不同时间点的机械强度也有相应要求,因此实现丝素蛋白的降解与其功能发挥的同步仍需进一步研究。
[1] Khademhosseini A, Vacanti JP, Langer R. Progress in tissue engineering [J]. Sci Am, 2009, 300(5): 64-71.
[2] Navone SE, Pascucci L, Dossena M, et al. Decellularized silk fibroin scaffold primed with adipose mesenchymal stromal cells improves wound healing in diabetic mice. [J]. Stem Cell Res Ther, 2014, 5(7): 2-15.
[3] Morita Y, Tomita N, Aoki H, et al. Frictional properties of regenerated cartilage in vitro [J]. J Biomech, 2006, 39(1): 103-109.
[4] Byette F, Bouchard F, Pellerin C, et al. Cell-culture com-patible silk fibroin scaffolds concomitantly patt erned by freezing conditions and salt concentration [J]. Polym Bull, 2011,67(1): 159-175.
[5] Yang Y, Chen X, Ding F, et al. Biocompatibility evaluation of silk fibroin with peripheral nerve tissues and cells in vitro [J]. Biomaterials, 2007, 28(9): 1643-1652.
[6] Mandal BB, Kundu SC. Osteogenic and adipogenic differentiation of rat bone marrow cells on non-mulberry and mulberry silk gland fibroin 3D scaffolds [J]. Biomaterials, 2009, 30(28): 5019-5030.
[7] Shangkai C, Naohide T, Koji Y, et al. Transplantation of allogeneic chondrocytes cultured in fibroin sponge and stirring chamber to promote cartilage regeneration [J]. Tissue Eng, 2007, 13(3): 483-492.
[8] Lovett M. Silk fibroin microtubes for blood vessel engineering [J]. Biomaterials, 2007, 28(35): 5271-5279.
[9] 焦微,赵霞,陆艳,等. 许旺细胞在不同孔径丝素蛋白支架上的生长[J]. 中国组织工程研究与临床康复, 2011, 15(25): 4607-4610.
[10] 唐鸣,赵霞,陈新,等 多孔丝素蛋白支架修复兔下颌骨临界性骨缺损[J]. 中国组织工程研究与临床康复, 2013, 17(8): 1337-1343.
[11] Vepari C, Kaplan DL. Silk as a biomaterial [J]. Progress in Polymer Science, 2007, 32(8-9): 991-1007.
[12] Wang Y1, Rudym DD, Walsh A, et al. In vivo degradation of three-dimensional silk fibroin scaffolds [J]. Biomaterials, 2008, 29(24-25): 3415-3428.
[13] Yumin Yang, Yahong Zhao, Yun Gu, et al. Degradation behaviors of nerve guidance conduits made up of silk fibroin in vitro and in vivo [J]. Polymer Degradation and Stability, 2009, 94(12): 2213-2220.
[14] GB/T 16886.6-1997/IS010993-6:1994, 医疗器械生物学评价 第6部分;植入后局部反应试验[S].
[15] Cao Y, Wang B. Biodegradation of silk biomaterials [J]. Int J Mol Sci, 2009, 10(4): 1514-1524.
[16] Wang Y, Rudym DD, Walsh, A. et al. In vivo degradation of three-dimensional silk fibroin scaffolds[J]. Biomaterials, 2008, 29(24-25): 3415-3428.
[17] Numata K, Cebe P, Kaplan DL.Mechanism of enzymatic degradation of beta-sheet crystals. [J]. Biomaterials, 2010,3(1): 2926-2933.
[18] Horan RL, Antle K, Collette AL, et al. In vitro degradation of silk fibroin [J]. Biomaterials, 2005, 26(17): 3385-3393.
[19] Woolfson DN, Ryadnov MG. Peptide-based fibrous biomaterials: Some things old, new and borrowed [J]. Curr Opin Chem Biol, 2006, 10(6): 559-567.
Degradation Behaviors of Silk Fibroin Scaffolds with Different Pore Sizesinvivo
Qian Jianfeng1, 3Cai Lihui1Qi Weidong1*Zhao Xia1Chen Xin2
1(DepartmentofOtolaryngologyHeadandNeckSurgery,HuashanHospitalFudanUniversity,Shanghai200040,China)2(StateKeyLaboratoryofMolecularEngineeringofPolymers,CollaborativeInnovationCenterofPolymersandPolymerCompositeMaterials,DepartmentofMacromolecularScience,LaboratoryofAdvancedMaterials,FudanUniversity,Shanghai200433,China)3(DepartmentofOtolaryngologyHeadandNeckSurgery,ZhengzhouPeople′sHospital,Zhengzhou450012,China)
silk fibroin; scaffolds; tissue engineering; degradation
10.3969/j.issn.0258-8021. 2016. 04.018
2015-06-28, 录用日期:2016-04-15
国家自然科学基金项目(81271094)
R318
D
0258-8021(2016) 04-0507-05
*通信作者(Corresponding author), E-mail:drqiweidong@126.com
