PEEK-SPEEK-HA复合材料与U2OS细胞相容性研究
2016-02-23黄苇殷吴耿锋潘田光
倪 卓,黄苇殷,王 应,吴耿锋,潘田光
深圳大学化学与环境工程学院,广东深圳518060

Received:2015-10-28;Accepted:2015-12-16
Foundation:National Natural Science Foundation of China (51378315); Science and Technology Innovation Project of Guangdong Provincial Educational Department (2013KJCX0163)
† Corresponding author:Professor Ni Zhuo.E-mail: royzhuoni@hotmail.com
Citation:Ni Zhuo, Huang Weiyin, Wang Ying, et al.Experiments on biocompatibility of PEEK-SEEK-HA composite materials with U2OS cells[J]. Journal of Shenzhen University Science and Engineering, 2016, 33(1): 1-9.(in Chinese)

【化学与化工 / Chemistry and Chemical Engineering】
PEEK-SPEEK-HA复合材料与U2OS细胞相容性研究
倪卓,黄苇殷,王应,吴耿锋,潘田光
深圳大学化学与环境工程学院,广东深圳518060
摘要:体外培养U2OS细胞,通过噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltet razolium bromide, MTT)法研究新型聚醚醚酮-羟基磷灰石(polyetheretherketone-hydroxyapatite, PEEK-HA)生物复合材料对细胞增殖的影响.研究发现,聚醚醚酮-磺化聚醚醚酮-羟基磷灰石(polyetheretherketone-sulfnated polyetheretherketone-hydroxyapatite, PEEK-SPEEK-HA)复合材料的细胞增殖作用较PEEK-HA复合材料强,且随着HA含量的增加细胞增殖作用增强,材料浸提液质量浓度为4~8 mg/mL时对细胞有较好的增殖促进作用.复合材料毒性级别为Ⅰ,对细胞无毒性.测定黏附率研究该材料对U2OS细胞的黏附特性,PEEK-SPEEK-HA复合材料随着HA含量的增大,细胞黏附率增加,高于PEEK-HA复合材料组,表明加入HA和SPEEK能改善复合材料的黏附性能.采用流式细胞术研究材料对细胞凋亡的影响,发现加入SPEEK的PEEK-HA复合材料能抑制细胞发生早期凋亡,从而降低凋亡率.激光共聚焦和流式细胞仪检测该材料对细胞活性氧的影响发现,SPEEK引入复合材料能够降低细胞活性氧水平,降低细胞毒性. 扫描电镜实验表明,U2OS细胞能够在PEEK-SPEEK-HA复合材料表面黏附、伸展和生长.
关键词:聚醚醚酮-羟基磷灰石复合材料;U2OS骨瘤细胞;细胞增殖;细胞形态;细胞黏附;细胞凋亡;活性氧
由损伤、先天畸形和疾病所导致的骨缺损在临床上十分常见,传统的治疗方法包括自体骨移植术和异体骨移植术.自体骨由于来源少且有二次手术痛苦,因此在应用上受到限制.异体骨组织可能会产生排异反应和疾病传播等问题[1].随着医疗水平的提高,对人工合成的骨和牙齿替代材料的需求不断增加.因此,从材料学和仿生学角度出发,研究人工合成硬组织材料有重要意义[2].金属材料在医学上的应用已有很长的历史,是最早被采用的生物材料,有较高的强度和韧性,适用于硬组织系统的修复.医用金属缺乏生物活性,难以与骨组织键合,其应用具有一定的局限性,且绝大多数医用金属弹性模量较高,易造成骨应力吸收,引起种植体松动[3].羟基磷灰石(hydroxyapatite,HA)是无机非金属生物材料中类最重要的磷灰石材料之一,20世纪70年代开始进入临床,以其优良的生物相容性、无毒、无刺激性、无排斥反应、不老化、不致敏、不致癌以及可与骨组织发生化学性结合等特点被广泛应用[4].然而,HA在具体应用中还存在一些缺陷,如:块状HA质硬、脆性大、韧性差、不易雕刻,与周围组织吻合不好;粒状HA用于填充牙槽嵴、填充颌骨时,存在颗粒游走、移位、凝固时间长、塑性后近期形状不稳定和易发生变形等问题[5].聚醚醚酮(polyetheretherketone, PEEK)是英国帝国化学工业集团(Imperial Chemical Industries, ICI)于1977年开发成功,并于20世纪80年代初期由英国Victrex公司实现工业化生产的一种高性能特种工程塑料,被称为塑料工业的金字塔尖[6].它具有耐热等级高、耐辐射、耐化学药品、冲击强度高、耐磨性和耐疲劳性好、阻燃和电性能优异等特点,已在航空航天、电子电气、医疗、能源、电力、机械、汽车和涂料等领域获得广泛应用[7].Bakar等[8]曾尝试将羟基磷酸钙填料加入聚醚醚酮,使聚醚醚酮表面具有生物活性.羟基磷酸钙粉体粗大且用量高,严重降低了聚醚醚酮材料的机械强度.与传统的微米级填料系统不同,均匀分散于聚合物之中的纳米填料能在单位体积内产生超大的界面积.这种超大界面积以及填料本身的纳米尺度使聚合物纳米复合材料在获得新性能的同时,其力学性能也得到显著提高[9-10].研究表明,含有磺酸基的改性材料利于细胞生长和增殖[11],因此将nHA与PEEK复合,并引入含有磺酸基类似偶联剂的磺化聚醚醚酮(sulfnated polyetheretherketone, SPEEK),克服PEEK和HA的缺陷,集中两种材料的优势,制备新型生物复合材料,提高生物相容性,以便更好地适应临床需要.目前该复合材料与U2OS细胞生物相容性未见报道,本研究采用实验室制备的新型PEEK-HA复合材料与U2OS细胞共培养,检测材料对细胞增殖、黏附、形态、凋亡和活性氧等细胞生物学特性的影响,体外评价该材料的细胞相容性,为该材料的应用和临床研究提供科学依据.
1实验
1.1实验试剂与仪器
试剂: PEEK-HA生物复合材料(本实验室制备); U2OS骨瘤细胞(上海生命科学院); RPM11640 培养基(Hyclone公司); 小牛血清(Thermo Fisher公司); 磷酸盐缓冲剂(PBS,Hyclone公司)胰蛋白酶(苏州碧云天公司); 噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltet razolium bromide, MTT,Sigma公司); 二甲基亚砜(dimethyl sulfoxide, DMSO, 美国Amresco公司); 凋亡双染试剂盒(南京凯基); 活性氧检测试剂盒(苏州碧云天), 无水乙醇(东江试剂); 戊二醛(东江试剂); 平均粒径为25~30 μm的羟基磷灰石.
仪器:酶联检测仪(Imark,美国Bio-Rad公司);高压灭菌锅(HV-50,Hirayama公司);激光共聚焦显微镜(FV1000,Olympus公司);流式细胞仪(Facscalibur,美国BD公司)SU-70热场发射扫描电子显微镜(scanning electron microscope, SEM,日本日立公司).
1.2细胞标准生长曲线测定
将对数生长期的U2OS细胞制备成7个不同浓度(0.5×104~3.5×104mL-1)细胞悬液,分别接种于96孔细胞培养板内(100 μL/孔,n=3). 置于37 ℃、CO2体积分数为5%的培养箱中,恒温培养72 h,弃上清液,加入质量浓度为5mg/L的MTT (20 μL/孔), 继续孵育4 h. 去上清, 用0.1 mmol/L 的磷酸盐缓冲剂(phosphate buffered saline, PBS)清洗,加胰蛋白酶(质量浓度为2.5 mg/mL)消化细胞,加入DMSO( 150 μL /孔) ,室温下孵育15~20 min,用酶联检测仪测其570 nm处光密度值,记作D(570),计算出各浓度组均值,作生长曲线.
1.3细胞毒性试验
将w(HA)分别为10%、20%和30%的PEEK-HA、PEEK-HA及w(HA)分别为10%、20%和30%的PEEK-SPEEK-HA共6种复合材料高压灭菌,用RPMI1640培养液按4、8、16、32和64 mg/mL配成不同质量浓度的混悬液,37 ℃恒温箱中静置浸提48 h,离心后于4 ℃冰箱保存备用.培养细胞至对数生长期,弃去原培养液,用PBS洗涤2次,质量浓度为2.5 mg/mL的胰蛋白酶消化贴壁细胞,用体积分数为10%牛血清的RPMI1640培养液配成单个细胞悬液,细胞板计数,每孔按2×104mL-1接种在96孔板(n=3), 每孔体积200 μL.24 h后细胞贴壁,吸去培养液,换成含有复合材料的浸提液,将培养板移入CO2培养箱中,在37 ℃、体积分数为5% 的CO2及饱和湿度条件下培养.通过倒置相差显微镜观察细胞形态及细胞贴壁情况.每孔加入MTT溶液(5 mg/mL)20 μL,37 ℃孵箱中继续孵育4 h,小心吸弃孔内培养上清液.每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解.选择570 nm波长,在酶联免疫检测仪上测定各孔的D(570)值,记录结果.
1.4细胞黏附率测定
将复合材料分别制备成5 mm×2 mm大小圆柱体的模压材料,经过高温高压灭菌后,置于12孔细胞培养板中,将细胞以2×104mL-1的浓度加入到细胞培养板中,每孔0.5 mL,于37 ℃、体积分数为5%的CO2及饱和湿度条件下培养48 h后,采用细胞计数板计数.具体方法为:将材料取出,培养板残余细胞消化收集、计数,所得结果为未黏附细胞数.材料的细胞黏附率计算公式为

(1)
1.5细胞凋亡实验
经灭菌的模压材料分别置于12孔板中,将处于对数生长期的U2OS细胞制成2×105mL-1的细胞悬液,滴加在材料上,培养48 h后,PBS清洗材料并消化收集细胞,待测细胞用PBS (pH=7.4) 缓冲液清洗2次,每次以2 000 r/min离心5 min,然后弃上清加入500 μL 结合缓冲液重悬细胞,移至测量管中后每管加人5 μL AnnexinV-FITC和5μL PI,室温下避光孵育15 min,流式细胞仪上样检测.CellsQuest软件进行数据分析,An-nexin-V+/PI-判断为早期凋亡,Annexin-V+/PI+判断为晚期凋亡,两种凋亡率之和为总凋亡率.观察两组细胞流式细胞仪散点图,并计算早期凋亡、晚期凋亡及总凋亡率.
1.6活性氧检测
在12孔板中分别加入经灭菌的模压材料,将处于对数生长期的U2OS细胞配制成2×105mL-1的细胞悬液,滴加在材料上,培养24 h后,取出材料,PBS清洗材料并消化收集细胞.加入终浓度为10 μmol/L的DCFH-DA(用无血清培养液稀释DCFH-DA至1∶1 000) 1 mL,37 ℃,体积分数为5% 的CO2培养箱中静置0.5 h,每隔3~5 min混匀1次,使探针和细胞充分作用.用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA.0.5 mL胰酶消化收获各组细胞,加入含血清的培养基终止消化,1 200 r/min离心5 min,再吸出上清,加入1 mL的PBS,离心2~3次.弃上清,加500 μL PBS,激发光488 nm,发射光 525 nm,采用激光共聚焦观察荧光强度,流式细胞仪进行定量检测.
1.7扫描电镜实验
经灭菌的PEEK-SPEEK-HA模压材料置于12孔板中,取对数生长期U2OS细胞配制成2×104mL-1的细胞悬液,滴加在材料上,共同培养5 d后(每天换新鲜培养液),取出材料,PBS清洗材料2次,放入EP管中,加入体积分数为2.5%的戊二醛,固定3~4 h;PBS洗涤3次,吸弃戊二醛,体积分数为30%、50%、70%、85%和90%梯度乙醇脱水各1次,每次15 min,无水乙醇脱水2~3次,把细胞中的水置换出来.然后置于真空冷冻干燥仪内干燥过夜,将样品固定在样品台上,进行喷金镀膜,上镜观察2次电子图像.
1.8统计学处理
本研究数据中,每组材料有3~6个数据,样本总体符合正态分布,适用于t检验条件,采用统计分析软件Origin 7.5进行处理,作显著性差异分析.理论值差异的显著水平为α=0.05. 数据处理得P>0.05(t<0.05), 表明差异不显著.
2结果与讨论
2.1U2OS细胞标准生长曲线
细胞标准生长曲线是细胞可反映出细胞生长的趋势,根据标准曲线选择合适的实验细胞浓度[12].一般采用MTT法测定光密度值作增殖曲线,U2OS细胞标准生长曲线,见图1.用MTT孵育细胞后要先用PBS溶液小心地洗,然后用胰酶消化,最后用DMSO裂解,混匀再测定,其结果比较准确.U2OS细胞接种量与细胞的增殖代谢率在接种细胞数为2×104~3×104mL-1范围内基本呈正相关,该区域为细胞的对数增长期.在测定时,接种细胞的密度对生长曲线的影响较大,接种密度过高或过低都不利于细胞生长,这与细胞的生长特性有关.本实验选择的接种细胞数在相关范围内.

图1 U2OS细胞的标准生长曲线Fig.1 Standard growth curve of U2OS cells

图2 PEEK-HA复合材料对细胞增殖影响Fig.2 (Color online)Influence of the composites on cell proliferation with incubation time
2.2材料对细胞增殖的影响
分别于第1、2、3和4天检测各组材料在4 mg/mL质量浓度下的细胞D(570)值,研究随时间变化材料对细胞增殖的影响.图2(a)为PEEK-HA复合材料对细胞增殖影响.随着材料与U2OS细胞培养时间的延长,D(570)值整体呈增加趋势,随着HA质量分数增加,对细胞增殖作用增加,w(HA)=30%的PEEK-HA对细胞的增殖作用最强,细胞生长到第3天时,增殖作用有减缓趋势.图2(b)显示PEEK-SPEEK-HA复合材料对细胞增殖影响,在1~3 d内,细胞增殖速度较快,各组材料曲线随时间变化趋势类似,PEEK-SPEEK-HA复合材料随HA质量分数增加,D(570)值升高,曲线向上平移.比较PEEK-HA与PEEK-SPEEK-HA复合材料,分析SPEEK对细胞增殖影响, w(HA)=20%时,PEEK-SPEEK-HA对细胞增殖影响略高于PEEK-HA,即w(HA)=20%的PEEK-SPEEK-HA材料对细胞的增殖作用比w(HA)=20%的PEEK-HA稍强,见图2(c).表明HA质量分数的增加及SPEEK引入PEEK-HA复合材料对细胞增殖有一定促进作用.
PEEK-HA复合材料随w(HA)增加,D(570)值逐渐减小,曲线缓慢下滑,4~8mg/mL内,曲线变化较为平缓,材料质量浓度变化对细胞增殖无明显作用.8~16mg/mL内,曲线下滑,质量浓度升高,材料对细胞增殖作用逐渐减小,对细胞增殖有明显抑制作用;16~64mg/mL内,曲线平缓,材料对细胞增殖作用最小,细胞增殖缓慢并即将停滞;64mg/mL时,材料对细胞增殖作用最小,表明过高的质量浓度不利于细胞增殖,见图3(a)、(b)和(c).PEEK-SPEEK-HA材料浓度对细胞增殖的影响,见图3(d)、(e)和(f),其变化趋势与PEEK-HA基本一致,主要原因是该材料主要组分为PEEK-HA,SPEEK作为类似偶联剂加入后,浓度变化对细胞影响不大.

图3 PEEK-HA复合材料质量浓度对细胞增殖影响Fig.3 (Color online) Cell proliferation at different concentrations of the composites
2.3材料毒性级别
计算相对增殖率(relative proliferation rate, RGR)及毒性级别(细胞RGR=材料组D(570)值÷阴性对照组D(570)值).细胞毒性分级标准为: RGR≥100%为0级: 75%~99%为Ⅰ级; 50%~74%为Ⅱ级; 25%~49%为Ⅲ级;1%~24%为Ⅳ级.0为Ⅴ级, 0级和Ⅰ级表示无细胞毒性;Ⅱ级表示可能有细胞毒性;Ⅲ级以上表示有细胞毒性)[13].各组材料细胞毒性级别为Ⅰ级,见表1,说明各组材料对细胞无毒性.随着HA质量分数的增加和SPEEK加入,相对增殖率增加,表明HA和SPEEK能改善复合材料生物相容性.

±s)

组 别w(HA)/%1dRGR毒性级别2dRGR毒性级别3dRGR毒性级别4dRGR毒性级别PEEK-HA1075±1.58Ⅰ92±1.59Ⅰ92±1.83Ⅰ92±2.41Ⅰ2075±3.47Ⅰ98±5.91Ⅰ89±1.67Ⅰ95±3.76Ⅰ3078±2.71Ⅰ99±4.86Ⅰ96±0.89Ⅰ96±4.82ⅠPEEK-SPEEK-HA1082±1.29Ⅰ94±2.44Ⅰ94±0.32Ⅰ96±1.15Ⅰ2097±2.49Ⅰ96±3.52Ⅰ95±0.25Ⅰ99±2.36Ⅰ3098±1.83Ⅰ98±1.73Ⅰ98±0.73Ⅰ99±1.35Ⅰ空白对照0100Ⅰ100Ⅰ100Ⅰ100Ⅰ
2.4细胞黏附率
细胞在材料表面的黏附是评价材料生物相容性的重要指标之一.细胞黏附在维持机体正常生理和生化功能中有重要的作用,是材料生物相容性的基础.随着w(HA)的增加,PEEK-HA和PEEK-SPEEK-HA复合材料的细胞黏附率均提高,且PEEK-SPEEK-HA复合材料组的黏附率高于PEEK-HA复合材料组的,说明在SPEEK中,加入HA能改善材料对细胞的黏附性能,见表2.首先,从官能团上看,羧基、羟基、磺酸基和酰胺基等官能团可以通过调节材料表面的亲水性和表面电荷促进细胞的黏附.PEEK -HA和PEEK-SPEEK-HA复合材料中的HA含有羟基,随着w(HA)在两种复合材料中的增加,羟基的量也随之增加.PEEK-SPEEK-HA复合材料中的SPEEK含有磺酸基,增加了材料中磺酸基官能团的量.羟基和磺酸基可以通过调节材料表面的亲水性和表面电荷而促进细胞的黏附,提高材料的细胞黏附率.其次,材料的表面特性和理化性质决定黏附性能[14],SPEEK引入复合材料可提高分子之间的交联,使得叉状分子增多,材料表面粗糙度增大,比表面积增大,利于细胞附着.

±s)

组别w(HA)/%未黏附细胞数×10-5黏附细胞数×10-5黏附率/%PEEK-HA103.63±0.170.61±0.0214.39±3.37203.49±0.130.75±0.0317.69±3.01303.27±0.180.97±0.0522.88±3.09PEEK-SPEEK-HA103.31±0.050.93±0.0321.93±4.39203.25±0.030.99±0.0323.35±4.54303.11±0.111.13±0.0526.65±3.29空白对照04.24±0.1000
2.5细胞凋亡率
通过流式分析,比较PEEK-HA与PEEK-SPEEK-HA复合材料对U2OS细胞凋亡的影响.各组材料凋亡率从小到大依次为,对照组、w(HA)=20%的PEEK-SPEEK-HA和w(HA)=20%的PEEK-HA,见表3.w(HA)=20%时的PEEK-SPEEK-HA与PEEK-HA相比,早期凋亡降低,晚期凋亡无明显差异,说明SPEEK加入能抑制细胞早期凋亡的发生降低凋亡率.

表3 PEEK-HA复合材料对U2OS细胞凋亡类型和
2.6材料对细胞ROS含量影响
材料的毒性与细胞活性氧(reactive oxygen species, ROS)的产生密切相关,过量的ROS会将细胞膜上的磷脂以及酶和膜受体上的多不饱和脂肪酸侧链氧化,形成过氧化脂质产物,导致细胞膜的流动性和通透性改变,继而破坏细胞的结构和功能、造成细胞凋亡、组织损伤和器官病变.因此,测试活性氧含量常常可以反映细胞氧化程度和损伤程度[15].采用激光共聚焦显微镜观察PEEK-HA复合材料对U2OS细胞ROS的影响,见图4.PEEK-HA复合材料组随着HA质量分数的增加荧光强度逐渐减弱,该结果与流式细胞仪检测结果一致,见表4,表明HA与PEEK复合后能使细胞活性氧含量减少.PEEK-SPEEK-HA复合材料组中HA质量分数的增加,活性氧降低,与PEEK-HA复合材料相比,SPEEK引入PEEK-HA复合材料能够明显降低细胞活性氧含量.其中,w(HA)=30%的PEEK-SPEEK-HA复合材料上的细胞产生活性氧最少,与对照组接近.表明加入HA和SPEEK的复合材料能够降低材料对细胞ROS水平.

图4 激光共聚焦观察U2OS细胞产生的ROSFig.4 (Color online) Cell ROS results observed by CLSM
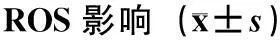
±s)

组 别w(HA)/%平均荧光强度空白对照04.26±0.14PEEK-HA106.90±0.31206.41±0.28305.14±0.29PEEK-SPEEK-HA105.20±0.18204.83±0.17304.37±0.26
2.7扫描电镜实验
扫描电镜观察U2OS细胞在PEEK-SPEEK-HA生物复合材料上的黏附生长情况,细胞在材料凹陷位置附着生长,高倍镜下显示细胞为三角形或长梭形呈扁平的形态,紧密地贴附在材料表面,且长出板层伪足及丝状伪足紧密贴附在材料表面,部分细胞板层伪足及丝状伪足深入进材料缝隙内,伪足伸展状态良好,形态正常,见图5(a).大量U2OS细胞在材料表面呈平行排列生长,细胞之间形成连接,部分细胞通过伪足连接,紧密包覆在材料表面,生长态势良好,见图5(b).大量细胞能够在该复合材料凹陷位置生长,见图5(c).图5结果表明U2OS细胞能够在PEEK-SPEEK-HA复合材料表面黏附、伸展和生长.

图5 U2OS细胞在复合材料上生长形态Fig.5 Morphology of U2OS cells on the surface of the composites
结语
采用本实验室制备的新型PEEK-HA生物复合材料,MTT法研究该材料对U2OS细胞的影响,该材料随着HA含量的增加,对细胞的增殖作用增强.随着时间推移,增殖有减缓趋势,细胞生长至第4天时,材料对细胞增殖作用达到最大,与PEEK-HA相比,PEEK-SPEEK-HA复合材料对细胞的增殖作用稍强,SPEEK加入能提高该材料的细胞相容性.比较不同浓度的PEEK-HA和PEEK-SPEEK-HA复合材料,发现质量浓度为4~8 mg/mL的材料浸提液对细胞有较好的增殖促进作用,随着浓度增大,细胞增殖减缓,过高质量浓度对细胞增殖有抑制作用.各组材料毒性级别为Ⅰ级,对细胞无毒性.HA和SPEEK的引入复合材料能改善材料对细胞的黏附性能.PEEK-SPEEK-HA (w(HA)=20%)凋亡率低于PEEK-HA (w(HA)=20%), 说明SPEEK加入能抑制细胞凋亡.活性氧检测表明,SPEEK引入PEEK-HA复合材料能够明显降低细胞活性氧含量,降低细胞毒性.U2OS细胞能够在PEEK-SPEEK-HA复合材料表面正常黏附、伸展和生长,该材料生物相容性良好.

引文:倪卓,黄苇殷,王应,等. PEEK-SPEEK-HA复合材料与U2OS细胞相容性研究[J]. 深圳大学学报理工版,2016,33(1):1-9.
参考文献/ References:
[1] Boden S D.Bone repair and enhancement clinical trial design[J]. Clinical Orthopedics and Related Research, 1998, 355(355S):S336-S346.
[2] 倪卓,王应,王双,等.PEEK/HA 生物复合材料对MG-63细胞的作用[J]. 深圳大学学报理工版,2014,31(3):258-265.
Ni Zhuo,Wang Ying,Wang Shuang,et al. Influence of PEEK/HA composites on MG-63 cells[J]. Journal of Shenzhen University Science and Engineering ,2014,31(3):258-265.(in Chinese)
[3] 倪卓,杨莎,王应,等.骨替代材料的研究方法及其进展[J].深圳大学学报理工版,2015, 32(4):331-342.
Ni Zhuo,Yang Sha,Wang Ying,et al. Research methods and advances on bone substitute materials[J]. Journal of Shenzhen University Science and Engineering,2015,32(4):331-342.(in Chinese)
[4] Ong J L, Chan D C. Hydroxyapatite and their use as coatings in dental implants[J]. Critical Reviews in Biomedical Engineering, 2000, 28(5):667-707.
[5] 倪卓,王应,华文语,等.PEEK/HA生物复合材料的热稳定性研究[J]. 深圳大学学报理工版,2012, 29(6):522-526.
Ni Zhuo,Wang Ying,Hua Wenyu, et al. Thermal stability of PEEK/HA biological composite materials[J]. Journal of Shenzhen University Science and Engineering,2012, 29(6):522-526.(in Chinese)
[6] Rigby R B. Victrex polyethersulfone (PES) and victrex polyetheretherketone (PEEK)[R]. Mississauga, Canada: Society of Plastics Engineers, Brookfield Center, CT, USA, 1984.
[7] Godara A,Raabe D, Green S,et al. The influence of sterilization processes on the micromechanical properties of carbon fiber enforced PEEK composites for bone implant applications[J]. Acta Biomaterial,2007, 3(2):209-220.
[8] 李跃文. 聚醚醚酮复合材料的研究进展[J].化工新型材料, 2009, 37(3):37-40.
Li Yuewen. Advance in poly (ether ether ketone)-based composites[J]. New Chemical Materials, 2009, 37(3):37-40.(in Chinese)
[9] Bakar M, Cheong P, Khor K. Mechanical properties of injection molded hudroxyap-tite-polyetheretherketone biomaterials[J]. Composites Science and Technology, 2003, 63(3):421-425.
[10] Goyal R K, Tiwari A N, Negi Y S, et al. Novel high performance Al2O3/poly(ether ether ketone) nanocomposites for electronics applications[J].Composites Science and Technology, 2007,67(9):1802-1812.
[11] Sayes C M, Liang Feng, Hudson J L, et al. Functionalization density dependence of single-walled carbon nanotubes cytotoxicity in vitro[J]. Toxicology Letters, 2006, 161(2): 135-142.
[12] 倪卓,刘士德,王应,等. PEEK/HA生物材料对成纤维细胞3T3的影响[J].深圳大学学报理工版,2013,30(4):392-397.
Ni Zhuo,Liu Shide,Wang Ying, et al. Influences of 3T3 cells for PEEK/HA composite[J]. Journal of Shenzhen University Science and Engineering,2013,30(4):392-397.(in Chinese)
[13] 王建营,朱治国,孙家跃,等. 聚醚醚酮人造骨关节材料研究[J].化学世界,2004,45(1):53-54.
Wang Jangying. Zhu Zhiguo, Sun Jiayue, et al. The study of PEEK artificial bone joint[J]. Chemical World,2004,45(1):53-54.(in Chinese)
[14] Zhu Xiaolong, Chen Jun, Scheideler I, et al. Effects of topography and composition of titanium surface oxides on osteoblast responses[J]. Biomaterials, 2004, 25(18): 4087-4103.
[15] Li Ning, Xia Tian, Nel A E. The role of oxidative stress in ambient particulate matter-induced lung diseases and its implications in the toxicity of engineered nanoparticles[J]. Free Radical Biology & Medicine, 2008, 44(9): 1689-1699.
【中文责编:晨兮;英文责编:新谷】
Experiments on biocompatibility of PEEK-SEEK-HA
composite materials with U2OS cells
Ni Zhuo†,Huang Weiyin,Wang Ying,Wu Gengfeng,and Pan Tianguang
College of Chemistry and Environmental Engineering, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China
Abstract:Effects of polyetheretherketone-hydroxyapatite (PEEK-HA) composites and polyetheretherketone-sulfnated polyetheretherketone-hydroxyapatite (PEEK-SPEEK-HA) composites on U2OS cells are studied by using the 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltet razolium bromide (MTT) method. It is found that cell proliferation in PEEK-SPEEK-HA composites is broader than that in PEEK-HA composites. With an increase of HA content in PEEK-HA composites, cell proliferation accelerates. The material of sulfnated polyetheretherketone promotes cell proliferation significantly at 4-8 mg/mL concentration. A cytotoxicity test shows that these bio-materials are non-toxic to U2OS cells and the U2OS cells can adapt to these materials. With an increase of HA content, the cell adhesion rate increases and is higher in PEEK-SPEEK-HA composites than in PEEK-HA composites, which indicates that adding HA and SPEEK in PEEK composite could improve the adhesion property. Cell apoptosis test by the flow cytometry (FCM) indicates that the addition of SPEEK in PEEK-HA composites can inhibit the early apoptosis thus decreasing the apoptosis rate. A test on the effect of SPEEK on the reactive oxygen species (ROS) of U2OS cells by using the flow cytometry (FCM) and the confocal laser scanning microscopy (CLSM) shows that SPEEK in PEEK-HA composites can decrease the ROS level, and reduce the cytotoxicity. Scanning electron microscope (SEM) results show that U2OS cells can adhere, stretch and grow on surfaces of PEEK-SPEEK-HA composites.
Key words:polyetheretherketone-hydroxyapatite (PEEK-HA) composite; U2OS cell; cell morphology; proliferation; cell adhesion; cell apoptosis; reactive oxygen species (ROS)
作者简介:倪卓(1965—),男,深圳大学教授、博士生导师. 研究方向:生物材料和功能材料. E-mail: royzhuoni@hotmail.com
基金项目:国家自然科学基金资助项目(51378315);广东省教育厅科技创新资助项目(2013KJCX0163)
中图分类号:R 318.08
文献标志码:A
doi:10.3724/SP.J.1249.2016.01001
