三江源区高寒草地不同生境土壤可培养纤维素分解真菌群落结构特征研究
2016-02-23芦光新李宗仁李希来王军邦吴楚李欣
芦光新,李宗仁*,李希来,王军邦,吴楚,李欣,
张更兄1,孙乾1,李峰科1,郑慧美1
(1.青海大学农牧学院,青海 西宁 810016;2.中国科学院地理科学与资源研究所,北京 100094;3.长江大学园艺园林学院,湖北 荆州 434025)
三江源区高寒草地不同生境土壤可培养纤维素分解真菌群落结构特征研究
芦光新1,李宗仁1*,李希来1,王军邦2,吴楚3,李欣1,
张更兄1,孙乾1,李峰科1,郑慧美1
(1.青海大学农牧学院,青海 西宁 810016;2.中国科学院地理科学与资源研究所,北京 100094;3.长江大学园艺园林学院,湖北 荆州 434025)
摘要:为了解三江源区不同生境土壤可培养纤维素分解真菌的群落结构特征,在黄河流域、长江流域、澜沧江流域共选取有代表性的12个样点,采集土层0~15 cm,15~30 cm的土壤样品,采用稀释平板法在羧甲基纤维素钠平板培养基上进行可培养真菌的计数和分离,利用种群优势度、Shannon-Wiener多样性指数、均匀度、生态位宽度以及群落相似度等指标对不同生境土壤中可培养纤维素分解真菌群落结构特征进行了分析。结果表明,三江源区不同生境土壤可培养纤维素分解真菌的数量和类群差异明显,数量由大到小的顺序为:灌丛草地>嵩草草地>藏嵩草草地>禾草草地;在4种生境土壤中共分离获得土壤可培养纤维素分解真菌17属,禾草草地土壤中群落的优势度指数、物种多样性指数、均匀度指数最高,除均匀度指数外,藏嵩草草地土壤中群落的优势度指数、物种多样性指数最低;物种生态位结果分析表明,毛霉属、镰孢菌属、被孢霉属、青霉属具有较宽的生态位,属于广适性物种;而亚隔孢壳属、梭孢壳属、腐质霉属等的生态位很窄,属于狭适性物种,只存在于某个生境中。禾草草地与藏嵩草草地土壤可培养纤维素分解真菌群落的相似性最低,灌丛草地和嵩草草地相似性最高。土壤纤维素分解真菌的群落结构及多样性与生境类型的特异性有着密切的关系。
关键词:三江源区;草地类型;可培养纤维素分解真菌;群落特征
近年来生态学家已经越来越强烈地认识到鲜为人知的土壤生态系统的生态功能及生物学过程已成为生态系统结构、功能与过程研究中最不确定的因素[1]。土壤微生物是土壤生物组分中最活跃的成分[2], 虽仅占土壤有机组分的一小部分, 但却是活性养分的库(在固定过程中)和源(在矿质化过程中)[3],在推动着生态系统的能量流动和物质循环,并维持生态系统的正常运转方面发挥着重要的作用[4]。
在土壤微生物的生态学过程和功能的研究中,国际上习惯以土壤微生物功能群为研究对象来探讨微生物在生态系统中的作用[5],国内一般把微生物功能群称生理类群(physiological groups)[6]。土壤微生物纤维素分解功能群是土壤中能够降解纤维素类物质的功能微生物类群的统称,包括真菌、细菌和放线菌。其中,真菌是一类种类繁多、分布广泛的真核微生物。尽管真菌数量不及细菌,甚至比放线菌还少[7-8],但其在生态系统碳素循环中发挥着重要作用[9]。另外,真菌产生的纤维素酶多是胞外酶,且纤维素酶各组分齐全,分解能力较强[10]。因此,真菌在降解纤维素类物质方面具有更广阔的应用前景。
草地土壤微生物群落通常对环境状况反应迅速,是一个地区或历史环境变迁的良好记录,环境情况及地质史对物种空间分布的影响至关重要[11]。由于地理区域的差异,土壤微生物数量、种类及组成极易受诸多生态因素的综合影响[12-14]。青藏高原高寒草地土壤环境因地质变动过程中地形隆升具有持续性低温的特征,与国内外较多研究的环境有着显著的区别。持续寒冷、季节性低温和昼夜温差大的极端环境对草地纤维素分解真菌产生了重要影响,经过长期的进化适应,可能已经形成了能够适应低温极端环境的物种和基因资源。
高寒草地土壤纤维素分解真菌是草地生态系统的重要组成部分,查明其数量及其组成情况无疑是十分必要的[15]。近年来国内外学者对青藏高原草地土壤有机碳的变化引起了高度重视[16-18],并对高寒地区草地土壤演化过程中土壤有机碳变化和土壤纤维素分解功能群的关系有了明确的认识[19-20]。因此, 研究高寒草地土壤纤维素分解真菌的数量和物种组成,可更深层次上揭示其在草地生态系统能量流动和物质循环的生态学过程和功能。迄今为止,对青藏高原高寒草地环境中主要参与有机质分解的纤维素分解真菌的群落结构和多样性方面的研究鲜有报道。本研究对三江源区不同类型草地土壤中可培养纤维素分解真菌的种类、数量组成和生态分布特征进行分析,并对不同类型草地土壤中纤维素分解真菌群落多样性及相似性进行比较, 旨在探讨该类群真菌的分布与特殊生境的关系,以期为分离和筛选高寒草地土壤环境中可培养纤维素分解真菌提供理论依据,为进一步开发和利用青藏高原高寒草地土壤可培养纤维素真菌的物种资源奠定基础。
1材料与方法
1.1样点选择和样品采集
依据草地类型图、土壤类型图以及交通路线图设计采样路线,主要选取三江源区高寒草甸类和高寒草原类典型类型的草地,根据地形、地貌、海拔、植被等生境特征,选取三江源区典型的4种生境类型确定采样点,确定以三江源地区的玛多县、甘德县、玉树县、囊谦县、曲麻莱县和治多县的12个样点(表1),组成小尺度的温度和降水梯度“样带”开展研究,采样点分布如表1所示,1~4号样点位于黄河流域, 5~8号样点位于长江流域,9~12号样点位于澜沧江流域,每个流域各有4个采样点。2011 年7-8月野外用GPS 定位,土壤样品的采集参照Geng等[21]的方法,采用土壤剖面法和混合多点取样法采取0~15 cm,15~30 cm土层,样品用灭菌自封聚乙烯袋收集,运输过程中采用便携式冰箱低温条件下带回实验室分析,在2个月内完成测试的相关指标和内容。

表1 采样点基本信息
1.24种生境类型的划分方法
将实际样点的不同草地型归并为4种生境类型。
嵩草草地:包括高山嵩草草地型、高山嵩草+矮嵩草草地型和高山嵩草+珠芽蓼草地型。
藏嵩草草地:包括藏嵩草草地型、藏嵩草+矮嵩草草地型。
禾草草地:紫花针茅草地型、紫花针茅+杂类草草地型。
灌丛草地:金露梅灌丛草地型和高山柳灌丛草地型。
1.3培养基
富集培养基:NaNO31 g,蛋白胨 1.5 g,K2HPO41 g,KCl 0.5 g,MgSO40.5 g,FeSO40.01 g,CMC-Na 5 g,蒸馏水1000 mL。用稀盐酸调pH至6.0~7.0。121℃灭菌20 min。用于富集培养。
羧甲基纤维素钠平板培养基(CMC-Na):NaNO31 g,蛋白胨 1.5 g,K2HPO41 g,KCl 0.5 g,MgSO40.5 g,FeSO40.01 g,CMC-Na 10 g,琼脂 10 g,蒸馏水1000 mL。用稀盐酸调pH至6.0~7.0。121℃灭菌20 min。用于筛选对CMC-Na纤维素具有分解能力的真菌。
马铃薯蔗糖培养基(PDA):马铃薯 200 g,葡萄糖 20 g,琼脂 15 g,蒸馏水 1000 mL,pH自然。121℃灭菌20 min。用于真菌菌株的转接和活化。
马铃薯蔗糖培养基(PS): 马铃薯 200 g,蔗糖 20 g,蒸馏水 1000 mL,pH自然。121℃灭菌20 min。用于真菌菌丝的培养。
1.4可培养土壤纤维素分解真菌的分离及纯化鉴定
将1 g土壤加入99 mL灭菌的蒸馏水中,配制10-2的土壤悬浮液,加入终浓度为30 μg/mL链霉素抑制非目标培养物,取1 mL加入富集培养基,室温下振荡培养7~10 d。可培养纤维素分解真菌的分离采用稀释平板法[22]。灭菌的羧甲基纤维素钠选择性培养基冷却至45℃左右时,倒入培养皿凝固。每皿加入100 μL稀释100倍并充分摇匀的土壤悬浮液,涂抹均匀,25℃生化培养箱培养5~7 d,在体视镜及显微镜下多次检查,根据真菌菌落形态初步统计土壤样品上、下两层中所有真菌的菌落数目。并挑取单菌落至PDA培养基上进行分离与纯化,采用rDNA-ITS序列系统发育分析[23],进行分子鉴定,在属级水平分析群落结构特征。为保证土壤样品中分离频率低的物种信息,每个土样的上层(0~15 cm)和下层(15~30 cm)各重复5皿,分3批进行,将4种不同类型草地土壤中的所有物种信息累计,再进行统计分析。
1.5群落结构特征分析
1.5.1物种丰富度即群落中的物种数,在此指各生境采集的土壤样品中分离得到的纤维素分解真菌的属级物种数,以S表示[24]。
1.5.2相对多度(Pi)Pi=Ni/N;式中,N为物种总数,Ni为第i物种个体总数(本文中以属为单位统计菌落数)[24]。

1.5.5物种均匀度采用Pielou指数,测定公式: J=H′/lnS;式中,J为均匀度指数,H ′为Shannon-Wiener多样性指数,S为物种总数[25]。
1.5.6生态位的测定采用Levins[26]提出的生态位宽度,测定公式: B=1/∑Pi2;式中,B为生态位宽度,Pi为利用资源i的个体比例。
1.5.7相似性分析采用Jaccard系数,测定公式:Cj=J/(a+b-J);式中,J为群落A与群落B共有的物种数,a为群落A含有的全部物种数,b为群落B含有的全部物种数[27]。
1.6数据统计分析方法
用Excel2003 和DPS6.55 软件[28]进行统计分析。
2结果与分析
2.1不同生境类型土壤中可培养纤维素分解真菌的菌落数和物种数
采用羧甲基纤维素钠平板培养基共分离到4种生境类型土壤的总菌落数为624个(表2),其中,禾草草地土壤中分离的菌落数最少,占总数的17.31%,藏嵩草草地土壤中的菌落数占总数的18.27%,灌丛草地土壤中菌落数占总数的36.06%,嵩草草地土壤中菌落数占总数的28.37%。由此可见,不同生境类型土壤中可培养纤维素分解真菌的数量不同,菌落数由大到小的顺序为:灌丛草地>嵩草草地>藏嵩草草地>禾草草地。
分离到的可培养纤维素分解真菌的种类共有17属(图1),经ITS-rDNA分子鉴定,可培养纤维素分解真菌的种类分别为毛霉属(Mucor)、镰孢菌属(Fusarium)、被孢霉属(Mortierella)、青霉属(Penicillium)、柔菌属(Doratomyces)、轮枝菌属(Verticillium)、亚隔孢壳属(Didymella)、木霉属(Trichoderma)、梭孢壳属(Thielavia)、链格孢属(Alternaria)、弯颈霉(Tolypocldium)、阿太菌属(Athelia)、肉座菌属(Hypocrea)、埃里砖格孢属(Embellisia)、腐质霉(Humicola)、微结节菌属(Microdochium)、小皮伞属(Marasmius)的真菌。其中,禾草草地土壤中有10属,占58.82%,藏嵩草草地中有8属,占47.06%,灌丛草地中有13属,占76.47%,嵩草草地中有11属,占64.71%。

表2 不同生境土壤中可培养纤维素分解真菌物种数和菌落数
2.24种生境类型土壤不同物种(属级)优势度比较
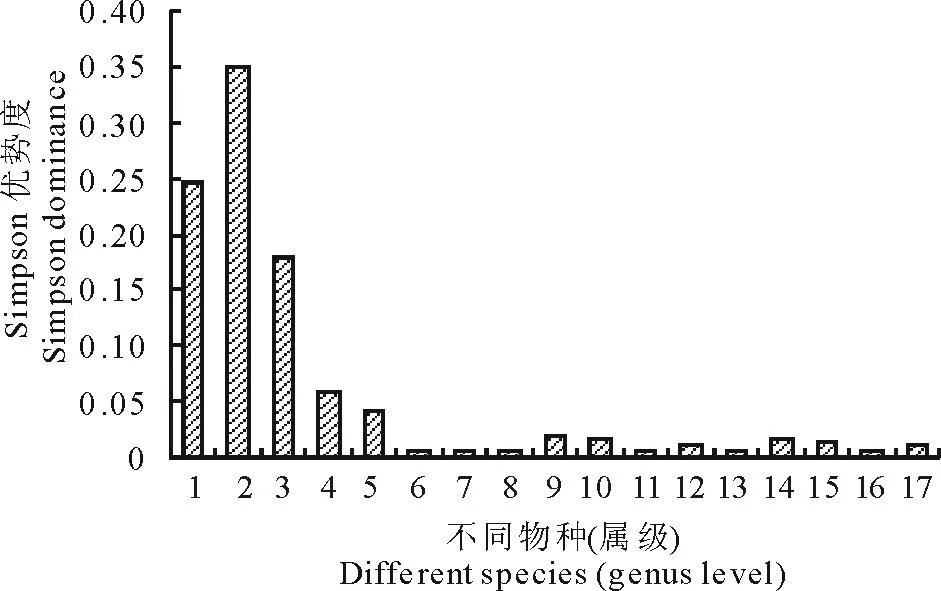
图1 不同生境类型土壤可培养纤维素分解真菌物种(属级)优势度 Fig.1 Comparison of dominance index of culturable cellulose-decomposing fungi at generic level in different ecosystemtypes soil in the Sanjiangyuan regions 1:毛霉属Mucor;2:镰孢菌属 Fusarium;3:被孢霉属 Mortierella;4:青霉属 Penicillium;5:柔菌属 Doratomyces;6:轮枝菌属 Verticillium;7:亚隔孢壳属 Didymella;8:木霉属 Trichoderma;9:梭孢壳属Thielavia;10:链格孢属Alternaria;11:弯颈霉Tolypocldium;12:阿太菌属 Athelia;13:肉座菌属 Hypocrea;14:埃里砖格孢属 Embellisia;15:腐质霉属Humicola;16:微结节菌属 Microdochium;17:小皮伞属 Marasmius.下同The same below.
参考昆虫物种优势度的划分标准[29],某物种占整体物种的比例≥0.1为优势属,0.01~0.1为常见属,≤0.01为稀有属。由图1可见,17个物种(属级)中,毛霉属、镰孢菌属、被孢霉属3个属为优势种(属级),青霉属、柔菌属、梭孢壳属、链格孢属、阿太菌属、埃里砖格孢属、腐质霉属、小皮伞属8个属为常见种(属级),轮枝菌属、亚隔孢壳属、木霉属、弯颈霉、肉座菌属、微结节菌属6个属为稀有种(属级)。
2.3不同生境类型土壤中可培养纤维素分解真菌各属的组成及比例
由表3可见,17个属级物种在不同类型草地土壤中的优势度指数存在明显差异。在禾草草地土壤中,毛霉属、镰孢菌属、柔菌属、梭孢壳属为优势属,被孢霉属、青霉属、链格孢属、阿太菌属、埃里砖格孢属为常见属。肉座菌属为稀有属。在藏嵩草草地土壤中,毛霉属、镰孢菌属、被孢霉属为优势属,青霉属、亚隔孢壳属、腐质霉属为常见属,弯颈霉、微结节菌属为稀有属。在灌丛草地土壤中,毛霉属、镰孢菌属、被孢霉属为优势属,青霉属、柔菌属、轮枝菌属、木霉属、砖格孢属、阿太菌属、小皮伞属为常见属,微结节菌属、埃里砖格孢属、弯颈霉为稀有属。在嵩草草地土壤中,毛霉属、镰孢菌属、被孢霉属为优势属,青霉属、柔菌属、肉座菌属、埃里砖格孢属、小皮伞属为常见属,轮枝菌属、木霉属、弯颈霉为稀有属。4种不同类型草地土壤中纤维素分解真菌的群落数量、种类组成和空间分布存在较大的差异, 说明土壤中该类群真菌的分布与其草地类型的特异性有着密切的关系。

表3 不同生境土壤可培养纤维素分解真菌物种(属级)的数量及所占比例
2.4不同生境类型土壤纤维素分解真菌群落多样性分析
在4种不同生境土壤中,禾草草地可培养纤维素分解真菌群落的优势度指数、多样性指数、物种均匀度指数最大(表4),指数均匀且差异显著(P<0.05),藏嵩草草地的优势度指数和多样性指数最小,灌丛草地的物种均匀度指数最小,由此可见,物种多样性与栖息的环境条件有关。
2.5不同生境类型土壤可培养纤维素分解真菌生态位分析
根据生态位宽度理论,生态位宽度值可以反映物种开发利用资源多样性的程度。由图2可以看出,17个物种(属级)在不同类型草地土壤中占据的生态位宽度不同,毛霉属、镰孢菌属、被孢霉属、青霉属的生态位宽度在2.755~3.553之间,在4种类型的草地土壤中均有分布,属于三江源区不同类型草地中的优势种和常见种,这些属在三江源地区分布范围较广,具有较强的竞争能力和生存能力,适于在大多数生境中生存,属于较广适应物种,其次是柔菌属、弯颈霉、埃里砖格孢属,生态位宽度在2.051~2.667之间,基本上在3种类型的草地土壤中分布,再次是轮枝菌属、木霉属、链格孢属、阿太菌属、肉座菌属、微结节菌属、小皮伞属,生态位宽度在1.600~1.984之间,基本上在2 种类型的土壤中有分布。生态位宽度最窄的是亚隔孢壳属、梭孢壳属、腐质霉属,生态位宽度值仅为1,这表明它们对环境的适应能力较弱,只能在极少数生境中生存,或对生存条件有某些特殊要求,属于狭适性物种。
2.6 不同生境类型土壤可培养纤维素分解真菌群落相似性分析

表4 不同类型草地土壤中可培养纤维素分解真菌的群落多样性Table4 Communitycharacteristicsofculturablecellulose-decomposingfungiindifferentgrasslandtypessoilintheSanjiangyuanregions生境类型EcosystemtypeSimpson优势度指数Simpsondominanceindex多样性指数Diversityindex物种均匀度指数Speciesevennessindex禾草草地Grasspasture0.826*0.851*0.851*藏嵩草草地Kobresiati-beticagrassland0.7130.6690.741灌丛草地Shrubgrassland0.7470.7310.656嵩草草地Alpinemeadow0.7530.7110.683 *表示差异显著(P<0.05)。 *meansignificantdifferenceatP<0.05.

图2 不同草地类型土壤中可培养纤维素分解真菌不同物种(属级)的生态位宽度Fig.2 Niche breadth of different genera of culturablecellulose-decomposing fungi in different grasslandtypes soil in the Sanjiangyuan regions
根据Jaccard相似性系数原理,当Cj值为0.00~0.25时,为极不相似;当Cj值为0.25~0.75时,为中等相似;当Cj值为0.75~1.00时,为极相似。从表5可以看出,4种不同类型草地土壤可培养纤维素分解真菌群落的相似系数在0.286~0.714之间,禾草草地和藏嵩草草地之间相似系数最低,为0.286,说明这两类生境可培养纤维素分解真菌种类组成的相似性小,共同的物种数较少,可见不同生境物种组成不同,与土壤环境关系密切,灌丛草地和嵩草草地的相似系数最高,为0.714,说明这两类生境可培养纤维素分解真菌种类组成的相似性大,有共同的物种,可见,土壤可培养纤维素分解真菌群落与草地类型有关。
3讨论
土壤真菌是陆生真菌的一部分,主要包括腐生和共生在土壤中及其有机质层或母质中的真菌区系。腐生真菌在土壤真菌中占很大的比重,是微生物区系的主要成分[30-31],具有较高的生物活性,其在土壤养分的固结、矿化中起重要的作用[32]。土壤真菌是土壤有机碳分解和周转的主要驱动力,对土壤碳的固定和释放起着重要调节作用[33]。土壤真菌与栖息的土壤环境、植被相互依存、互相影响[34]。本文基于土壤可培养纤维素分解真菌群落结构随草地类型变化而变化的假设,采用羧甲基纤维素钠平板培养基上直接分离的方法,研究了三江源区不同类型草地土壤中可培养纤维素分解真菌群落结构随草地类型变化的规律,结果发现不同类型土壤中可培养纤维素分解真菌的数量和类群差异明显,群落多样性指数也随草地类型的不同表现出分异特征,不同类型草地土壤可培养纤维素分解真菌群落变异较大。

表5 不同生境类型可培养纤维素分解真菌群落相似性Table5 Communitysimilarityofculturablecellulose-decomposingfungiindifferentecosystemtypessoilintheSanjiangyuanregions生境类型Ecosystemtype藏嵩草草地Kobresiatibeticagrassland灌丛草地Shrubgrassland嵩草草地Alpinemeadow禾草草地Grasspasture0.2860.5330.500藏嵩草草地Kobresiati-beticagrassland0.4000.354灌丛草地Shrubgrassland0.714
土壤微生物绝大部分是异养的,尤其对土壤中降解纤维素类物质的真菌而言,主要以植物分泌物或者是植物残体为食,不同类型的草地积累净初级生产力、立枯物以及凋落物的数量和种类不同,提供给土壤微生物的碳源的种类和数量也不同,因此,不同类型草地植被对土壤微生物的组成和功能有很大影响[35],刘增文等[36]、潘好芹等[37]研究表明土壤真菌分布受海拔及植被类型的影响较大。姚贤民等[38]的研究发现土壤真菌区系与植被类型密切相关。张俊忠等[39]通过东祁连山高寒草地不同类型草地土壤真菌多样性研究发现,真菌多样性与草地类型的特异性有着密切的关系,其主要原因是与丰富的地上植物种类组成、植物残体、根系分泌物、土壤物理性状和化学性质等生态因子有关。由于土壤植被类型的不同,其土壤的理化性质、养分状况也随之改变,这种改变必然会引起土壤真菌的种类和数量发生变化。本实验结果发现,不同类型草地土壤中纤维素分解真菌的数量表现为异质性,数量由大到小的顺序为:灌丛草地>嵩草草地>藏嵩草草地>禾草草地,这与丁玲玲等[40]的研究结果相一致。另外,研究发现,虽然4种草地类型土壤中都存在相似的物种组成,但不同类型草地土壤可培养纤维素分解真菌物种组成变异性大,不同类型草地土壤存在特异性的优势种,这与Costa等[41]的研究结果相同。Daniel等[42]研究认为土壤真菌具有有效利用碳源的能力,随地上植被演替,植物组成及其生理特性发生改变,造成进入土壤的有机碳(凋落物或根系分泌物)发生改变,从而导致真菌群落与地上植被更紧密,并表现出明显的优势种。除此之外,土壤中不同种类的纤维素分解真菌对碳源的利用具有选择性以及竞争力,也是表现出明显的优势种的原因。研究表明植物和土壤微生物长期协同进化导致植物可以选择那些有利于自身凋落物快速分解的分解者,即植物和分解者之间存在协同作用[43]和互相驱动的正负反馈效应[44]。土壤微生物一方面受地上植被营养的制约,同时长期的进化使微生物本身形成了一系列的适应性机制(如休眠、功能冗余等)。
纤维素分解真菌作为土壤微生物的重要组成部分,在整个草地生态系统的结构和功能上占有十分重要的地位[45],它们通过分解土壤有机质、同化无机营养、驱动土壤养分的循环,并影响地面植物的生长发育和多样性[46-48]。本实验通过分析物种生态位发现,有些物种具有较宽的生态位宽度,属于广适性物种;而有些物种生态位很窄,只存在于某种类型草地土壤中,属于狭适性物种。不同类型草地土壤中纤维素分解真菌常见种和稀有种的物种组成并不相同,由此可见,土壤纤维素分解真菌的群落结构及多样性与生境类型的特异性有着密切的关系。何寻阳等[49]研究发现植被对土壤微生物群落多样性具有显著性的影响,但其并不和地上植物多样性随演替进行发生的变化一致。
在4种不同生境土壤中,可培养纤维素分解真菌表现出不同的相似性,禾草草地和藏嵩草草地的相似性最低,其次是藏嵩草草地和嵩草草地,再次是藏嵩草草地和灌丛草地,而灌丛草地和高山嵩草草地土壤中纤维素分解真菌的相似性最高。禾草草地和藏嵩草草地土壤中可培养纤维素分解真菌表现出分异特征主要与两种类型土壤的异质性有关。禾草草地以禾本科和一年生植物群落为主,植被盖度较小,地表处于半裸露状态,草群稀疏低矮,产草量低,为土壤提供的凋落物少,而藏嵩草草地在长期渍水土壤中,使土壤中积累了大量的难分解的植物残体,土壤生态环境变得愈来愈不利于有益微生物的繁殖和活动,因此两种类型土壤中可培养纤维素分解真菌群落相似性系数低,而灌丛和嵩草草地中,植物物种相对丰富,生境条件较好,有利于微生物的繁殖和活动,因此群落相似性系数较高。研究发现,不同类型的土壤在理化性状如土壤质地、土壤含水量、pH 值、养分含量等方面存在差异,最终影响着土壤微生物的生长和活性[50]。受土壤养分、有机质含量等因素影响,微生物种类和数量也相应变化[51]。荣娟敏和孙波[52]研究发现土壤好氧性纤维素分解菌数量与土壤有机质、氮、磷、钾含量达到极显著正相关水平,其他的一些研究也发现土壤纤维素分解菌数量随土壤养分含量的增加而增加[53-55]。王启兰等[56]研究发现土壤微生物数量与土壤水分含量存在显著的相关关系,认为土壤水分是调节高寒草甸生态系统土壤微生物代谢及物质转化的关键因子。土壤微生物数量与土壤温度关系密切,一般气温较高的环境更适合土壤微生物生长[57],土壤温度与好氧性纤维素分解菌数量有极显著的正相关关系(r=0.234,P<0.01)[52]。土壤微生物的分布,不仅是对土壤养分、土壤温度以及土壤通气透水性能的反应,而且亦是土壤中生物活性的具体体现。不同类型草地土壤纤维素分解真菌群落的差异,除了和植被类型有关,土壤环境也是其中的一个影响因素。
现已证实土壤真菌群落受生物和非生物因素的影响而变化,主要的因素有地理区域[58]、植被类型[59]、土壤类型[60]、土壤的通气性、水分状况以及养分状况[61]、土壤结构[62]、土壤有机质的有效性[63]、土壤pH值[64-66]、土壤温度[67-68]、底物的组成[66]、季节[69]、凋落物质量和来源[70]。本文主要考虑可培养纤维素分解真菌群落结构与生境类型的关系,样品的采集虽然设计三江源区不同地理区域,但没有在不同区域的变异进行分析。同时也没有对不同季节、土壤环境、气候等因素进行分析,这方面有待于进一步研究。因此,在不同的季节、不同的气候条件下可培养真菌多样性研究结果可能有所出入。菌物多样性的研究方法和手段还不成熟,这样的分析只能说是一种尝试。另外,多样性研究需要多年的积累资料。在同一个地区、同一条件下不同年代之间的生物多样性比较研究更富有实际意义。
References:
[1]He J S, Wang Z Q, Fang J Y. Underground ecology under the global change: Problems and prospects. Chinese Science Bulletin, 2004, 49(13): 1226-1233.
[2]Clark F E, Pawl E A.The microflora of grassland. Advances in Agronomy, 1970, (22): 375-435.
[3]Smith J L, Paul E A. The significance of soil microbial biomass estimations. In: Bollag J M, Stotzky G. Soil Biochemistry[M]. New York: Marcel Dekker, 1990: 357-398.
[4]Clark F E, Pawl E A. The micro flora of grassland. Advance of Agronomy, 1970, 22: 375-435.
[5]Coleman D C, Whitman W B. Linking species richness, biodiversity and ecosystem function in soil systems. Pedobiologia, 2005, 49: 479-497.
[6]Yang C D, Long R J, Chen X R. Advanced research in soil microbial functional groups. Chinese Journal of Soil Science, 2008, 39(2): 421-424.
[7]Donald R Z, Willame H, David C W. Plant diversity, soil microbial communities, and ecosystem function: Are there any links. Ecology, 2003, 84(8): 2042-2050.
[8]Bardgett R D, Hobbs P J, Frostegard A. Changes in soil fungal: bacterial biomass ratios following reductions in the intensity of management of an upland grassland. Biology and Fertility of Soil, 1996, 20: 261-264.
[9]Nowak J, Nowak D, Chevallier P. Analysis of composite structure and primordial wood remains in petrified wood. Applied Spectroscopy, 2007, 61(8): 889-895.
[10]Karboune S, Geraert P A, Kermasha S. Characterization of selected cellulolytic activities of multi-enzymatic complex system fromPenicilliumfuniculosum. Journal of Agriculture Food Chemistry, 2008, 56(3): 903-909.
[11]Casey H, Alexander L, Maren N,etal. A constant flux of diverse thermophilic bacteria into the cold arctic seabed. Science, 2009, 325: 1541-1544.
[12]Diaz Ravina M, Acea M J. Seasonal changes in microbial biomass and nutrient flush in forest soils. Biology and Fertility of Soils, 1995, 19: 220-226.
[13]Grayston S J, Wang S, Campbell C D,etal. Selective influence of plant species on microbial diversity in the rhizosphere. Soil Biochemistry, 1998, 30: 369-378.
[14]Stephan A, Meyer A H, Schmid B. Plant diversity affects culturable soil bacteria in experimental grassland communities. Journal of Ecology, 2000, 22: 988-998.
[15]Yao T, Ma L P, Zhang D G. Research progress on microbiological ecology of rangeland in China. Pratacultural Science, 2005, 22(11): 1-7.
[16]Li F R, Zhao W Z, Liu J L,etal. Degraded vegetation and wind erosion influence soil carbon, nitrogen and phosphorus accumulation in sandy grasslands. Plant and Soil, 2009, 317(1/2): 79-92.
[17]Sun W Y, Shao Q Q, Liu J Y,etal. The variation characteristics of soil organic carbon of typical alpine slope grasslands and its influencing factors in the “Three-River Headwaters” region. Journal of Natural Resources, 2011, 26(12): 2072-2087.
[18]Wang J B, Huang M, Lin X H. Review on carbon budget of the grassland ecosystems on the Qinghai-Tibet Plateau. Progress in Geography, 2012, 31(1): 123-128.
[19]Wang C T, Long R J, Wang Q L,etal. Changes in soil organic carbon and microbial biomass carbon at different degradation successional stages of alpine meadows in the Headwater Region of Three Rivers in China. China Journal of Appllied Environment Biology, 2008, 14(2): 225-230.
[20]Feng R Z, Zhou W H, Long R J,etal. Characteristics of soil physical, chemical and biological properties on degraded alpine meadows in the Headwater Areas of the Yangtze and Yellow Rivers, Qinghai-Tibetan Plateau. Chinese Journal of Soil Science, 2010, 41(2): 263-269.
[21]Geng Y H, Zhang T Y, Wang H F. A preliminary report on soil dematiaceous hyphomycetes from the three river gorge regions in eastern Tibet. Mycosystema, 2008, 27(1): 39-47.
[22]Li Z H, Luo Y M, Teng Y. Soil and Environmental Microbiology Research Method[M]. Beijing: Science Press, 2008: 90-114.
[23]Lu G X, Chen X R, Yang C D,etal. Identification of cellulose decomposing fungi strain F1and decomposition activity to two kinds of lawn grass litter. Acta Prataculturae Sinica, 2011, 20(6): 170-179.
[24]Lloyd H, Zar J H, Karr J R. On the calculation of information-theoretical measures of diversity. The American Midland Naturalist, 1968, 79(2): 257-272.
[25]Pielou E C. The measurement of diversity in different types of biological collections. Journal of Theoretical Biology, 1966, 13: 131-144.
[26]Levins R. Evolution in Changing Environments[M]. Princeton, N J: Princeton University Press, 1968.
[27]Jaccard P. Étude comparative de la distribution florale dans une portion des Alpes et des Jura. Bulletin del la Société Vaudoise des Sciences Naturelles, 1901, 37: 547-579.
[28]Tang Q Y, Feng M G. Practical Statistical Analysis and DPS Data Processing System[M]. Beijing: Science Press, 2002.
[29]Pang X F, You M S. Insect Community Ecology[M]. Beijing: China Agriculture Press, 1996: 1-147.
[30]Reichle D E. The role of siol invertebrates in nutrient cycling. In: Lohm U T, Presson. Soil Organism of Ecosystems[M]. Stockholm: Ecology Bulletin, 1977: 145-156.
[31]Buée M, Reich M, Murat C,etal. 454-pyrosequencing analyses of forest soils reveals unexpectedly high fungal diversity. New Phytologist, 2009, 184: 449-456.
[32]Anderson J P E, Domsch K H. Physiological method for quantitative measurement of microbial biomass in soils. Soil Biology & Biochemistry, 1978, 10: 215-221.
[33]Jenkinson D S, Ladd J N. Microbial biomass in soil:Measurement and turnover. In: Paul E A. Soil Biochemistry[M]. New York: Marcel Dekker, 1981: 415-471.
[34]Dodd J C, Boddington C L, Rodriguez A,etal. Mycelium of arbuscular mycorrhizal fungi (AMF) from different genera: form, function and detection. Plant and Soil, 2000, 226: 131-151.
[35]Xiao H L, Zheng X J. Effects of plant diversity on soil microbes. Soil and Environmental Sciences, 2001, 10(3): 238-241.
[36]Liu Z W, Duan E J, Gao W J,etal. Effects of leaf litter replacement on soil biological and chemical characteristics in main artificial forests in Qinling Mountains. Chinese Journal of Applied Ecology, 2008, 19(4): 704-710.
[37]Pan H Q, Zhang T Y, Huang Y H,etal. Diversity and niche of soil moniliaceous hyphomycetes in Taibai Mountain. Chinese Journal of Applied Ecology, 2009, 20(2): 363-369.
[38]Yao X M, Lv G Z, Yang H,etal. Studies of fungal flora in forest soil of Changbai mountains. Journal of Fungal Research, 2007, 5(1): 43-46.
[39]Zhang J Z, Chen X R, Yang C D,etal. A study on the diversity of soil cultured fungi in the alpine grassland of Eastern Qilian Mountains. Acta Prataculturae Sinica, 2010, 19(2): 124-132.
[40]Ding L L, Qi B, Shang Z H,etal. Dynamics of different soil microbial physiological groups and their relationship to soil conditions under sub-alpine grasslands vegetation in the eastern-Qilian mountain. Acta Prataculturae Sinica, 2007, 16(2): 9-18.
[41]Costa R, Gltz M, Mrotzek N,etal. Effects of site and plant species on rhizosphere community structure as revealed by molecular analysis of microbial guilds. FEMS Microbiology Ecology, 2006, 56(2): 236-249.
[42]Daniel G F, Nilsson T, Singh A P. Degradation of lignocellulosics by unique tunnel-forming bacteria. Canadian Journal of Microbiology, 1987, 33: 943-948.
[43]Hansen R A. Red oak litter promotes amicroarthropod functional group that accelerates its decomposition. Plant and Soil, 1999, 209: 37-45.
[44]Wardle D A, Bardgett R D, Klironomos J N,etal. Ecological linkages between aboveground and belowground biota. Science, 2004, 304: 1629-1633.
[45]Rong L, Li X W, Zhu T H,etal. Varieties of soil microorganisms decomposingBetulaluminiferafine roots andHemarthriacompressaroots. Acta Prataculturae Sinica, 2009, 18(4): 117-124.
[46]Xia B C, Zhou J Z, Tiedje J M. Effect of vegetation on structure of soil microbial community. Chinese Journal of Applied Ecology, 1998, 9(3): 296-300.
[47]Hortan T R, Bruns T D. The molecular revolution in ectomycorrhizal ecology: Peeking into the black-box. Molecular Ecology, 2001, 10: 1855-1871.
[48]Loranger-Merciris G, Barthes L, Gastine A,etal. Rapid effects of plant species diversity and identity on soil microbial communities in experimental grassland ecosystems. Soil Biology & Biochemistry, 2006, 38: 2336-2343.
[49]He X Y, Wang K L, Yu Y Z,etal. There sponses of soil microbial taxonomic diversity on vegetation communities and seasons in karst area. Acta Ecologica Sinica, 2009, 29(4): 1763-1769.
[50]Garbeva P, Van Veen J A, Van Elsas J D. Microbial diversity in soil:Selection of microbial populations by plant and soil type and implications for disease suppressiveness. Annual Review of Phytopathology, 2004, 42: 243-270.
[51]Xu G H, Li Z G. Microbial Ecology[M]. Nanjing: Southeast University Press, 1991: 104-111.
[52]Rong J M, Sun B. Effects of climate conditions and soil type on aerobic cellulose degrading bacteria. Soil, 2012, 44(1): 84-89.
[53]Zhang C B, Jin Z X, Li J M. Diversity of bacterial physiological groups and microbial flora in the soil of eight forest types of Tiantai Mountain, Zhejiang. Biodiversity Science, 2001, 9(4): 382-388.
[54]Xiao J Y, Zhang L, Xie D T,etal. Study on the relationship between soil microbes and soil fertility in paddy fields of long-tern no-tillage and ridge culture. Journal of Southwest Agricultural University, 2002, 24(1): 82-85.
[55]Zhang J E, Liu W G, Hu G. The relationship between quantity index of soil microorganisms and soil fertility of different land use systems. Soil and Environmental Sciences, 2002, 11(2): 140-143.
[56]Wang Q L, Cao G M, Wang C T. Quantitative characters of soil microbes and microbial biomass under different vegetations in alpine meadow. Chinese Journal of Ecology, 2007, 26(7): 1002-1008.
[57]Ma L P, Zhang D G, Yao T. Study on the dynamics of soil cellulose decomposer in alpine grassland under disturbance in Tianzhu. Grassland and Turf, 2005, (1): 29-33.
[58]Hibbett D S, Ohman A, Glotzer D,etal. Progress in molecular and morphological taxon discovery in fungi and options for formal classification of environmental sequences. Fungal Biology Review, 2011, 25: 38-47.
[59]Waid J S. Does soil biodiversity depend upon metabiotic activity and influences. Applied Soil Ecology, 1999, 13: 151-158.
[60]Ritchie N J, Schutter M E, Dick R P,etal. Use of length heterogeneity PCR and fatty acid methyl ester profiles to characterize microbial communities in soil. Applied and Environmental Microbiology, 2000, 66: 1668-1675.
[61]Walter K D, Margaret K B, Courmey S C,etal. Biological properties of soil and subsurface sedimens under abandoned pasture and cropland. Soil Biology & Biochemistry, 1997, 2(7): 837-946.
[62]Garcia C, Hemandez T, Costa F. Microbial activity in soil under Mediterranean environmental conditions. Soil Biology & Biochemistry, 1994, 26: 1185-1191.
[63]Tiquia S M, Lloyd J, Herms D A,etal. Effects of mulching and fertilization on soil nutrients, microbial activity and rhizosphere bacterial community structure determined by analysis of TRFLPs of PCR-amplified 16S rRNA genes. Applied Soil Ecology, 2002, 21: 31-48.
[64]O’Donnell A G, Seasman M, Macrae A,etal. Plants and fertilizers as drivers of changes in microbial community structure and function in soils. Plant and Soil, 2001, 232: 135-145.
[65]Bååth E, Anderson A H. Comparison of soil fungal/bacterial ratios in a pH gradient using physiological and PLF-based techniques. Soil Biology & Biochemistry, 2003, 35: 955-963.
[66]Rousk J, Bååth E, Brookes P C,etal. Soil bacterial and fungal communities across a pH gradient in an arable soil. ISME Journal, 2010, 4: 1340-1351.
[67]Zinger L, Shahnavaz B, Baptis F,etal. Microbial diversity in alpine tundra soils correlates with snow cover dynamics. ISME Journal, 2009, 3: 850-859.
[68]Deslippe J R, Hartmann M, Simard S W,etal. Long-term warming alters the composition of Arctic soil microbial communities. FEM Microbiology Ecology, 2012, 1: 1-13.
[69]Schadt C W, Martin A P, Lipson D A,etal. Seasonal dynamics of previously unknown fungal lineages in tundra soils. Science, 2003, 301: 1359-1361.
[70]Toberman H, Freeman C, Evans C,etal. Summer drought decreases soil fungal diversity and associated phenol xidase activity in upland Calluna heathland soil. FEM Microbiology Ecology, 2008, 66: 426-436.
参考文献:
[1]贺金生, 王政权, 方精云. 全球变化下的地下生态学:问题与展望. 科学通报, 2004, 49(13): 1226-1233.
[6]杨成德, 龙瑞军, 陈秀蓉. 土壤微生物功能群及其研究进展. 土壤通报, 2008, 39(2): 421-424.
[15]姚拓, 马丽萍, 张德罡. 我国草地土壤微生物生态研究进展及浅评. 草业科学, 2005, 22(11): 1-7.
[17]孙文义, 邵全琴, 刘纪远, 等. 三江源典型高寒草地坡面土壤有机碳变化特征及其影响因素. 自然资源学报, 2011, 26(12): 2072-2087.
[18]王军邦, 黄玫, 林小惠. 青藏高原草地生态系统碳收支研究进展. 地理科学进展, 2012, 31(1): 123-128.
[19]王长庭, 龙瑞军, 王启兰, 等. 三江源区高寒草甸不同退化演替阶段土壤有机碳和微生物量碳的变化. 应用与环境生物学报, 2008, 14(2): 225-230.
[20]冯瑞章, 周万海, 龙瑞军, 等. 江河源区不同退化程度高寒草地土壤物理、化学及生物学特征研究. 土壤通报, 2010, 41(2): 263-269.
[22]李振高, 骆永明, 腾应. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008: 90-114.
[23]芦光新, 陈秀蓉, 杨成德, 等. 1株纤维素分解菌的鉴定及对两种草坪草凋落物分解活性的研究. 草业学报, 2011, 20(6): 170-179.
[28]唐启元, 冯明光. 实用统计分析及其DPS数据处理系统[M]. 北京: 科学出版社, 2002.
[29]庞雄飞, 尤民生. 昆虫群落生态学[M]. 北京: 中国农业出版社, 1996: 1-147.
[36]刘增文, 段而军, 高文俊, 等. 秦岭山区人工林地枯落叶客置对土壤生物化学性质的影响. 应用生态学报, 2008, 19(4): 704-710.
[37]潘好芹, 张天宇, 黄悦华, 等. 太白山土壤淡色丝孢真菌群落多样性及生态位. 应用生态学报, 2009, 20(2): 363-369.
[38]姚贤民, 吕国忠, 杨红, 等. 长白山森林土壤真菌区系研究. 菌物研究, 2007, 5(1): 43-46.
[39]张俊忠, 陈秀蓉, 杨成德, 等. 东祁连山高寒草地土壤可培养真菌多样性分析. 草业学报, 2010, 19(2): 124-132.
[40]丁玲玲, 祁彪, 尚占环, 等. 东祁连山亚高山草地土壤微生物功能群数量动态及其与土壤环境关系. 草业学报, 2007, 16(2): 9-18
[45]荣丽, 李贤伟, 朱天辉, 等. 光皮桦细根与扁穗牛鞭草草根分解的土壤微生物数量及优势类群. 草业学报, 2009, 18(4): 117-124.
[46]夏北成, Zhou J Z, Tiedje J M. 植被对土壤微生物群落结构的影响. 应用生态学报, 1998, 9(3): 296-300.
[49]何寻阳, 王克林, 于一尊, 等. 岩溶区植被和季节对土壤微生物遗传多样性的影响. 生态学报, 2009, 29(4): 1763-1769.
[51]许光辉, 李振高. 微生物生态学[M]. 南京: 东南大学出版社, 1991: 104-111.
[52]荣娟敏, 孙波. 水热条件和土壤类型对纤维素分解菌的影响. 土壤, 2012, 44(1): 84-89.
[53]张崇邦, 金则新, 李均敏. 浙江天台山不同林型土壤环境的微生物区系和细菌生理群的多样性. 生物多样性, 2001, 9(4): 382-388.
[54]肖剑英, 张磊, 谢德体, 等. 长期免耕稻田的土壤微生物与肥力关系研究. 西南农业大学学报, 2002, 24(1): 82-85.
[55]章家恩, 刘文高, 胡刚. 不同土地利用方式下土壤微生物数量与土壤肥力的关系. 土壤与环境, 2002, 11(2): 140-143.
[56]王启兰, 曹广民, 王长庭. 高寒草甸不同植被土壤微生物数量及微生物生物量的特征. 生态学杂志, 2007, 26(7): 1002-1008.
[57]马丽萍, 张德罡, 姚拓. 高寒草地不同扰动生境纤维素分解菌数量动态研究. 草原与草坪, 2005, (1): 29-33.
*Community structure characteristics of culturable cellulose-decomposing fungi in soils from different ecosystems in the Sanjiangyuan Regions
LU Guang-Xin1, LI Zong-Ren1*, LI Xi-Lai1, WANG Jun-Bang2, WU Chu3, LI Xin1, ZHANG Geng-Xiong1, SUN Qian1, LI Feng-Ke1, ZHENG Hui-Mei1
1.AgricultureandAnimalHusbandryCollege,QinghaiUniversity,Xining810016,China; 2.InstituteofGeographicSciencesandNatureResourcesResearch,CAS,Beijing100094,China; 3.CollegeofHorticultureandGardening,YangtzeUniversity,Jingzhou434025,China
Abstract:In order to understand the community structure characteristics of culturable cellulose-decomposing fungi in soils from different ecosystem in the Sanjiangyuan Regions, the fungi in soil from four typical grassland types were isolated by dilution plate method using a sodium carboxymethyl cellulose plate medium. The population dominance index, Shannon-Wiener index, evenness, niche breadth and community similarity were employed to analyze the community structure of the isolated fungi. The results showed that the amount and species distribution of culturable cellulose-decomposing fungi varied strongly by ecosystem. Species number decreased in the following order: shrub grassland>alpine meadow>Kobresiatibeticagrassland>grass pasture. In total 17 genera were isolated from the four grassland types. The population dominance index, species diversity index and evenness index of fungi from grass pasture were highest, whereas the population dominance and species diversity indices from alpine meadow were lowest. Analysis of community similarity between the different ecosystems showed that fungi in shrub grassland andKobresiameadow soils had the highest similarity. The similarity coefficient for fungi in grass pasture andKobresiatibeticagrassland soils was the lowest. The results of niche breadth analysis indicated that the species ofMucor,Fusarium,MortierellaandPenicilliumhad wider niche breadth and adaptability, while the species ofDidymella,ThielaviaandHumicolahad narrower niche breadth and adaptability. The study thus shows that the diversity and community structure of soil cellulose-decomposing fungi are closely related to ecosystem types.
Key words:Sanjiangyuan Regions; grassland types; community structure characteristics; culturable cellulose-decomposing fungi
*通信作者Corresponding author. E-mail:lizongrenqd@126.com
作者简介:芦光新(1974-),男,青海湟中人,教授,博士。E-mail:lugx74@qq.com
基金项目:科技部国际合作项目(2015DFG31870),国家自然科学基金项目(41261064,31460152,41161084)和青海省科学技术厅项目(2014-ZJ-924)资助。
*收稿日期:2015-02-20;改回日期:2015-05-06
DOI:10.11686/cyxb2015085
http://cyxb.lzu.edu.cn
芦光新,李宗仁,李希来,王军邦,吴楚,李欣,张更兄,孙乾,李峰科,郑慧美. 三江源区高寒草地不同生境土壤可培养纤维素分解真菌群落结构特征研究. 草业学报, 2016, 25(1): 76-87.
LU Guang-Xin, LI Zong-Ren, LI Xi-Lai, WANG Jun-Bang, WU Chu, LI Xin, ZHANG Geng-Xiong, SUN Qian, LI Feng-Ke, ZHENG Hui-Mei. Community structure characteristics of culturable cellulose-decomposing fungi in soils from different ecosystems in the Sanjiangyuan Regions. Acta Prataculturae Sinica, 2016, 25(1): 76-87.
