近百年来枝角类群落响应洱海营养水平、外来鱼类引入以及水生植被变化的特征*
2016-02-23卢慧斌,陈光杰,蔡燕凤等
近百年来枝角类群落响应洱海营养水平、外来鱼类引入以及水生植被变化的特征*
(云南师范大学旅游与地理科学学院高原湖泊生态与全球变化重点实验室,昆明650500)
摘要:近几十年来,以大型湖泊为代表的云南部分湖泊受人类活动的持续影响出现了生态环境的明显变化.洱海作为云南面积第2大淡水湖泊,经历了多重环境压力(富营养化、外来鱼类引入、水生植被退化等)的影响.在湖泊现代监测数据面临时段较短、缺乏连续记录的背景下,湖泊沉积物的连续记录可以提供湖泊生态环境变化的长期历史并可用于生态响应模式的识别.以目前处于富营养水平的洱海为研究对象,应用湖泊沉积物记录进行多指标分析,探讨多重环境压力影响下洱海枝角类群落的长期变化特征以及影响因素,并与已有研究成果和现代监测数据进行对比,探讨了枝角类群落对环境压力响应的空间差异性.通过分析沉积物枝角类记录,重建了近百年来洱海枝角类群落的变化历史,结果表明过去100年来,枝角类的生物量总体呈增加趋势,尤其从1990年左右开始,象鼻溞生物量显著增加,物种相对组成出现明显变化(如Bosmina longispina被B. longirostris取代).同时象鼻溞的生物量、壳长与触角长度在1990s初期有明显降低的趋势,与同期外来鱼类(如银鱼)引种成功的时间一致.限制性聚类分析结果表明,枝角类群落结构的变化有3个主要阶段:1990s以前,底栖枝角类为群落的主要组成;1990-2000年左右,浮游枝角类(以象鼻溞为主)在枝角类群落结构中的比例迅速增加;从2000年以后,枝角类群落组成以浮游枝角类为主.同时,枝角类数据的主成分(PCA)分析显示,仅有PCA主轴1呈现显著的变化且解释了群落结构变化的61.64%,进一步分析表明水生植被变化可能是驱动枝角类变化的主要环境梯度,如底栖枝角类生物量减少响应了湖泊水生植被的退化.与已有研究对比表明,浅水湖区沉积物记录的枝角类生物量在1970s急剧增加与1980s急剧降低等现象并没有被深水区的沉积物记录所反映,指示了洱海生态系统的变化模式存在空间差异性.同时象鼻溞个体大小的变化模式反映了外来鱼类引入导致的鱼类捕食压力的变化.总之,本文揭示了枝角类群落结构与生物量的长期变化,反映了洱海富营养化过程、水生植被的退化与外来鱼类引入的长期驱动影响,因此对洱海的生态管理与修复工作应考虑多个环境压力的影响并加强对湖泊生态系统的评价。
关键词:古湖沼学;洱海;枝角类;群落结构;富营养化
伴随人类活动的加剧和社会经济的持续发展,云南典型湖泊的生态系统结构与功能近年来发生了较大变化.作为云南省面积第2大湖泊,洱海在过去几十年里,经历了富营养化、水生植被退化、水位剧烈变化、外来鱼类引入以及土著鱼类丧失等多重环境压力的影响[1-2].不同的环境压力对湖泊生态系统产生了重要影响,而这些环境压力的长期生态效应又可以被湖泊沉积物记录下来[3].枝角类处于湖泊食物网的中间位置,对湖泊生态环境的变化十分敏感,已成为评价湖泊生态环境变化的重要指标之一[4].目前对洱海湖泊生态系统中部分重要的水生生物指标(如枝角类群落)缺乏长期、连续的监测数据和较为系统的研究,尤其是对多重环境压力驱动枝角类群落结构变化的长期效应缺乏系统研究,因此急需开展对洱海枝角类群落长期变化的历史重建与影响因子识别.古湖沼学的研究方法与技术手段可以为研究湖泊生态系统的长期变化提供重要信息.例如,湖泊食物网的一些重要组成部分(如硅质藻类、几丁质无脊椎动物)可以较好地在湖泊沉积物中保存,使得它们成为古湖沼学研究中的重要生物指标,它们在沉积物中的生物量、群落等信息可以用来重建湖泊生物群落变化的历史,并为评价不同环境压力的长期生态效应提供基础数据[5]。
Liu等在洱海中部(约20 m水深)提取了一根大约35 cm长的沉积物柱状样,通过分析沉积物中的枝角类群落,识别了近百年来多重环境压力(富营养化、水生植被退化以及外来鱼类引入等)对枝角类群落的影响[6].但是洱海水下地形复杂,且洱海北部、中部以及南部水深及营养状况、水生植被覆盖等差异显著.洱海不同区域的枝角类群落对湖泊经历的多重环境压力类型与长期响应特征是否相同,仍然知之甚少.本文拟通过利用古湖沼学的方法手段,通过提取洱海南部沉积物中的多指标信息,识别洱海近百年来枝角类群落变化的主要特征,探讨了多重环境压力对枝角类群落变化的影响,并与已有研究进行对比,揭示洱海枝角类群落对多重环境压力响应的空间差异模式,以期为今后湖泊的管理与修复工作提供参考信息与基础数据。
1 材料与方法
1.1 样品采集
洱海(25°36′~25°58′N,100°06′~100°18′E)位于云南省大理白族自治州中部,跨大理市和洱源县.长42.58 km,最大宽8.0 km,平均宽5.8 km,面积249.0 km2,最大水深20.7 m,平均水深10.17 m,为断陷陷落湖[7].目前湖泊水质总体处于富营养水平.采样点(25°40′27″N,100°13′53″E)水深6.3 m,2012年3月利用重力采样器在该点采集柱状沉积样(柱长45.4 cm),样品密封并避光保存后6 h内在野外完成分样,分样间隔为0.5 cm(图1)。
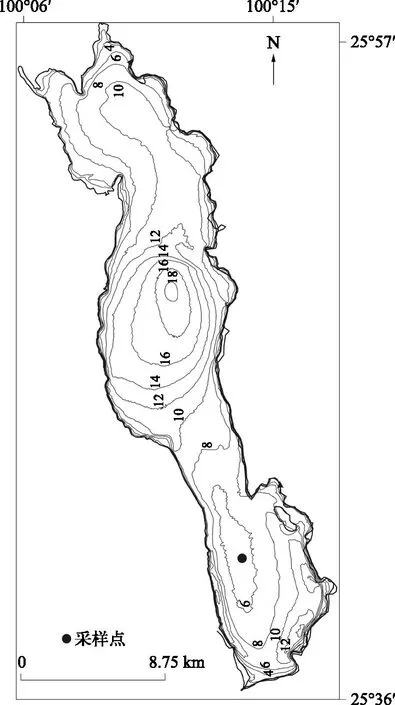
图1 洱海采样点位置Fig.1 Location and coring site of Lake Erhai
1.2 样品处理与数据分析
通过对样品放射性核素210Pb和137Cs进行测试分析,利用美国Canberra公司生产的高纯锗探测器、数字化谱仪及多通道分析系统,建立了钻孔的年代学序列.具体步骤包括:将冻干的样品研磨,称取3~5 g(干重)样品放入与标准源同一规格的塑料容器内并蜡封2周左右,使226Ra与210Pb处于衰变平衡体系,然后测定不同深度样品的210Pb和137Cs放射性强度,并应用恒定放射性通量模式建立年代学系列(图2)[8]。
沉积物枝角类样品的处理参照Korhola等的方法[4].首先将冻干的样品充分混合均匀,称取约0.1 g(干重)样品,倒入100 ml烧杯中;再加入50 ml的10%KOH溶液,并在电热板上加热到70℃左右约30 min,期间用玻璃棒轻轻搅拌,以使样品充分解絮凝;然后用38 μm的筛网过滤,再用蒸馏水将筛网上的样品清洗到带有刻度的15 ml 离心管中,加入3滴95%的乙醇用于样品的室温保存,并定容.再将样品充分摇匀,利用0.05 ml的移液枪吸取样品溶液,置于载玻片上,在电热板上以50℃加热,在样品蒸发待干前,加入两滴甘油-藏红染料,用针轻轻搅拌使其混合并均匀分布,将盖玻片置于其上,待其冷却后用指甲油密封盖玻片的边缘以便长期保存.枝角类的鉴定与计数在莱卡显微镜(Leica DM2500)下进行,依据Frey[9-11]、Goulden等[12]的鉴定标准,盘肠溞科的枝角类鉴定到种的水平,其中Alonaspp.为A.rectangula、A.guttata与A.costata的合并,基于象鼻溞的头孔将其分为Bosminalongispina与B.longirostris两个种,溞科的枝角类基于其尾爪分为Daphnialongispina与D.pulex两个群组,Daphnia为两个群组的合并.同时统计头壳、壳瓣、后腹部的个数以确定个体的数量,每个样品中枝角类的计数不少于100个,最后换算成通量(每平方厘米每年沉积的枝角类个体数量)作为生物量的指标.并测量玻片中所见象鼻溞的第一触角长度(AL)、壳长(CL)与刺长(ML)[13],每个样品中象鼻溞不同部位的测量样本个数不低于10。
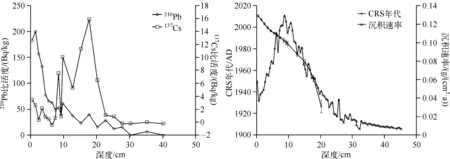
图2 210Pb和137Cs的放射性强度及沉积物年代学序列Fig.2 CRS modeled unsupported 210Pb and 137Cs profile and age versus depth
沉积物样品中氮含量采用元素分析仪、联机MAT 253型同位素比质谱仪进行测定[14]。
为探讨洱海枝角类群落变化的主要特征以及驱动因素,本文利用R软件,rioja程序包对枝角类群落结构进行CONISS聚类分析,通过Broken-Stick模型检验确认群落变化的主要阶段,应用vegan程序包对枝角类群落结构变化进行PCA分析,并通过Broken-Stick模型检验选择显著的PCA主轴.本文所采用的统计分析在R软件(版本v 2.3.0)中完成,沉积物地层图应用C2软件(版本v 1.4.3)进行处理分析。
2 结果
2.1 沉积物中枝角类生物量与个体大小变化的历史重建
过去100年来,枝角类生物量的变化总体呈现增加的趋势,但是存在波动变化的特征(图3).从1930s到1980s枝角类生物量逐渐增加,其中底栖枝角类生物量增加显著,浮游枝角类的生物量增加幅度较小;然而,枝角类总生物量在1980年达到峰值,到1985年降低到低值,其中底栖枝角类生物量大幅降低,浮游枝角类的生物量小幅增加.大约从1995年以后,浮游枝角类生物量显著波动上升,Bosminalongispina与B.longirostris都呈增加趋势,而底栖枝角类生物量仍然处于下降的趋势.约2006年以后,浮游枝角类生物量呈大幅下降的趋势,底栖枝角类生物量继续呈下降趋势。
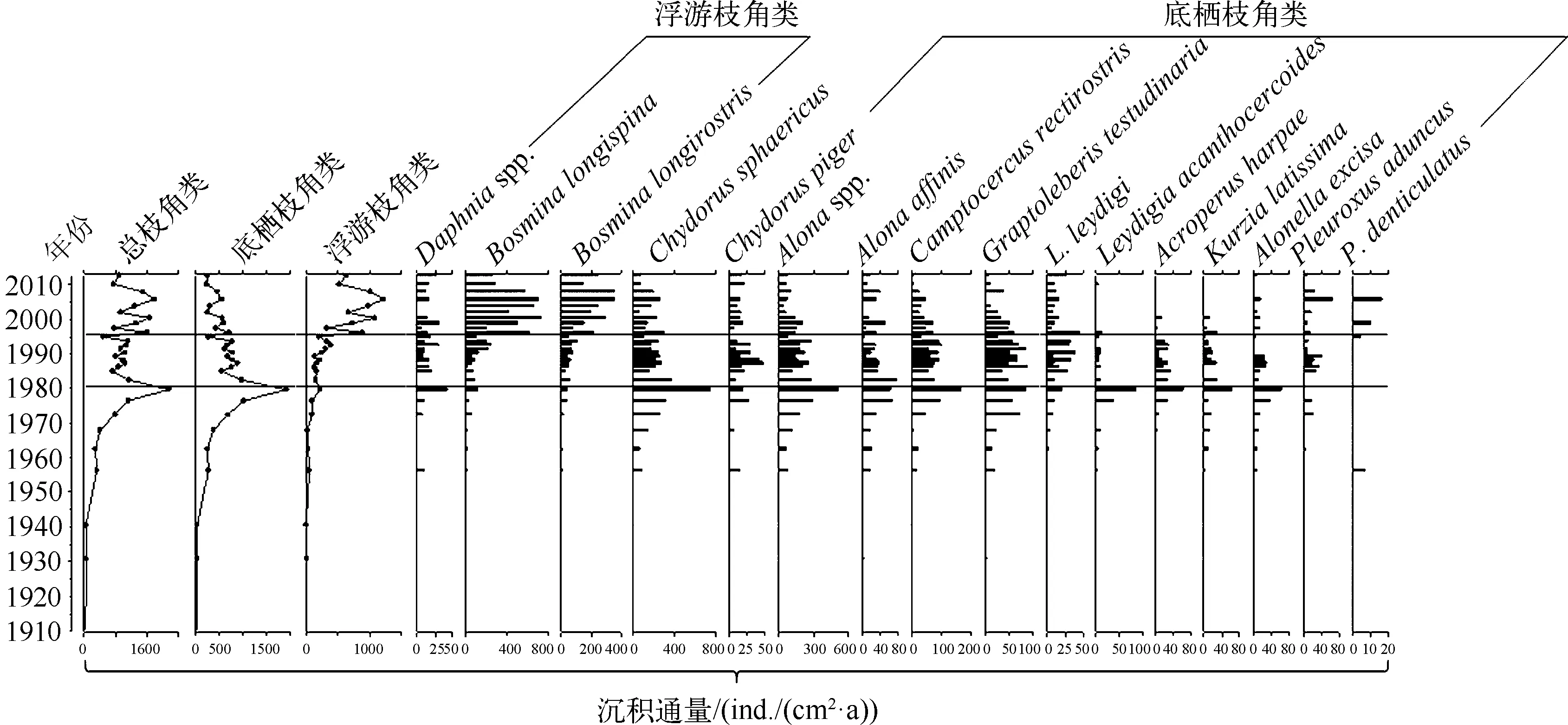
图3 洱海沉积物中枝角类生物量变化地层图Fig.3 Stratigraphic plot showing sedimentary cladoceran changes at Lake Erhai
通过测量象鼻溞的个体大小,发现象鼻溞生物量以及B.longispina第一触角长度、壳长在1990s初期显著减小与此时期太湖新银鱼在洱海引种成功这一事件相一致,可能指示了外来鱼类加剧了对湖泊中浮游动物的捕食压力,从而对象鼻溞种群及其个体大小产生抑制作用(图4).其中,指示象鼻溞总体大小的壳长与较大个体物种B.longispina第一触角长度变化的相关性为0.286(n=14,P=0.322),而与较小个体物种B.longirostris第一触角长度变化的相关性为-0.400(n=15,P=0.140).沉积物中的枝角类群落结构在1990年以前以底栖枝角类为主,象鼻溞生物量较低.从1990年以后,底栖枝角类在枝角类群落结构中所占比例逐渐减小,而象鼻溞比例迅速增加,并成为枝角类群落结构中的主要组成部分,其中B.longispina(喜好贫营养生境)的比例在近年来逐渐下降,而B.longirostris(喜好富营养生境)的比例则逐年上升(图5)。
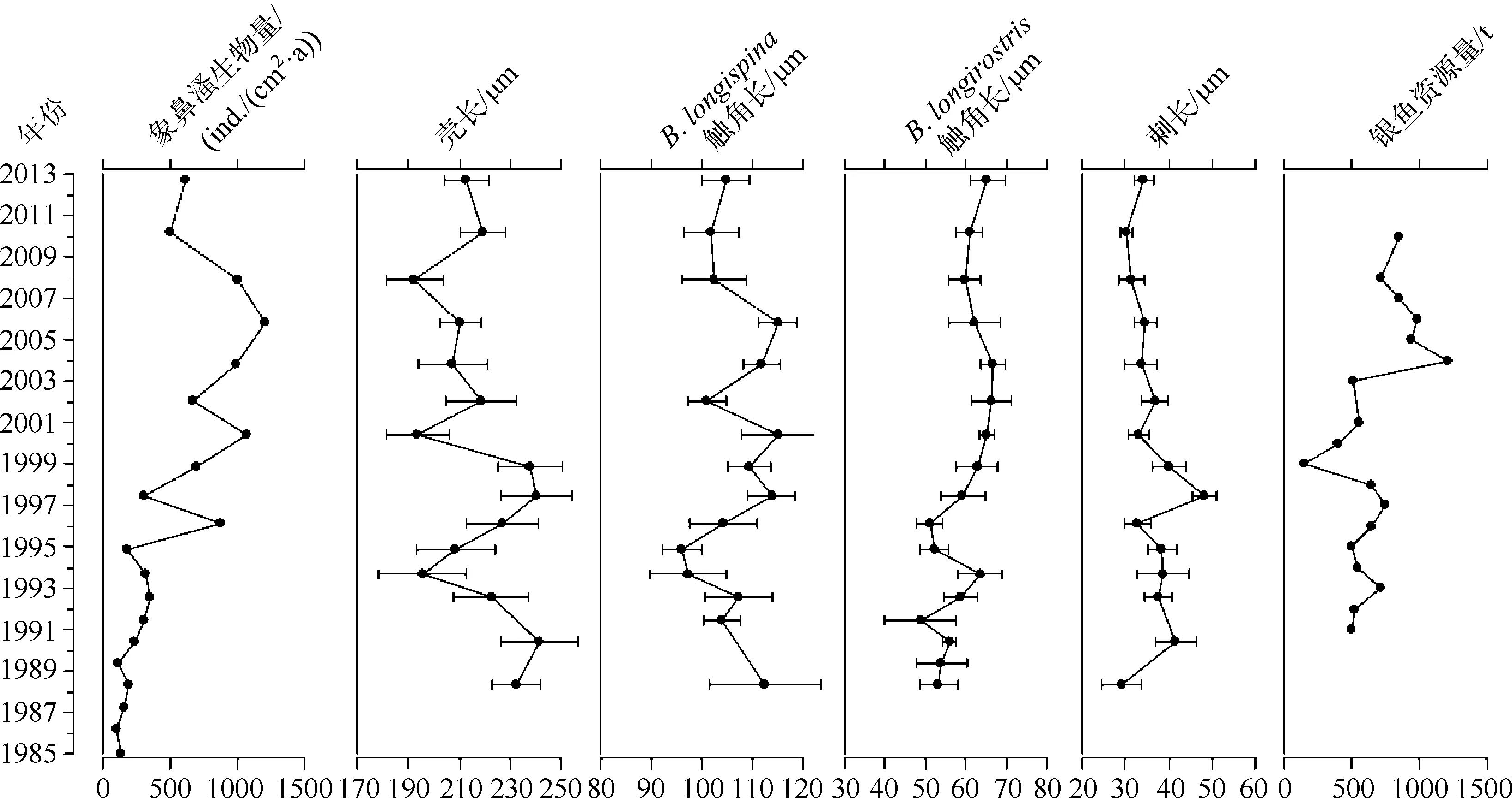
图4 象鼻溞总生物量、个体大小变化地层图与银鱼捕捞量历史记录对比Fig.4 Stratigraphic plot showing changes of bosminid production, body sizes and catch data of noodlefish
2.2 枝角类群落结构变化的特征
枝角类群落结构变化的限制性聚类分析表明,群落结构的变化主要有3个阶段,1990年以前整个枝角类群落结构以底栖枝角类为主导,浮游枝角类仅占到枝角类比例的23%左右;1990-2000年枝角类的群落结构发生急剧变化,浮游枝角类在枝角类中所占的比例快速升高,尤其是象鼻溞的增加,而底栖枝角类在枝角类中的比例呈现快速下降的趋势;从2000年以后,枝角类的群落结构基本稳定,浮游枝角类在枝角类群落结构中的比例达到70%左右,而底栖枝角类在枝角类群落结构中仅占到极小比例(图5)。
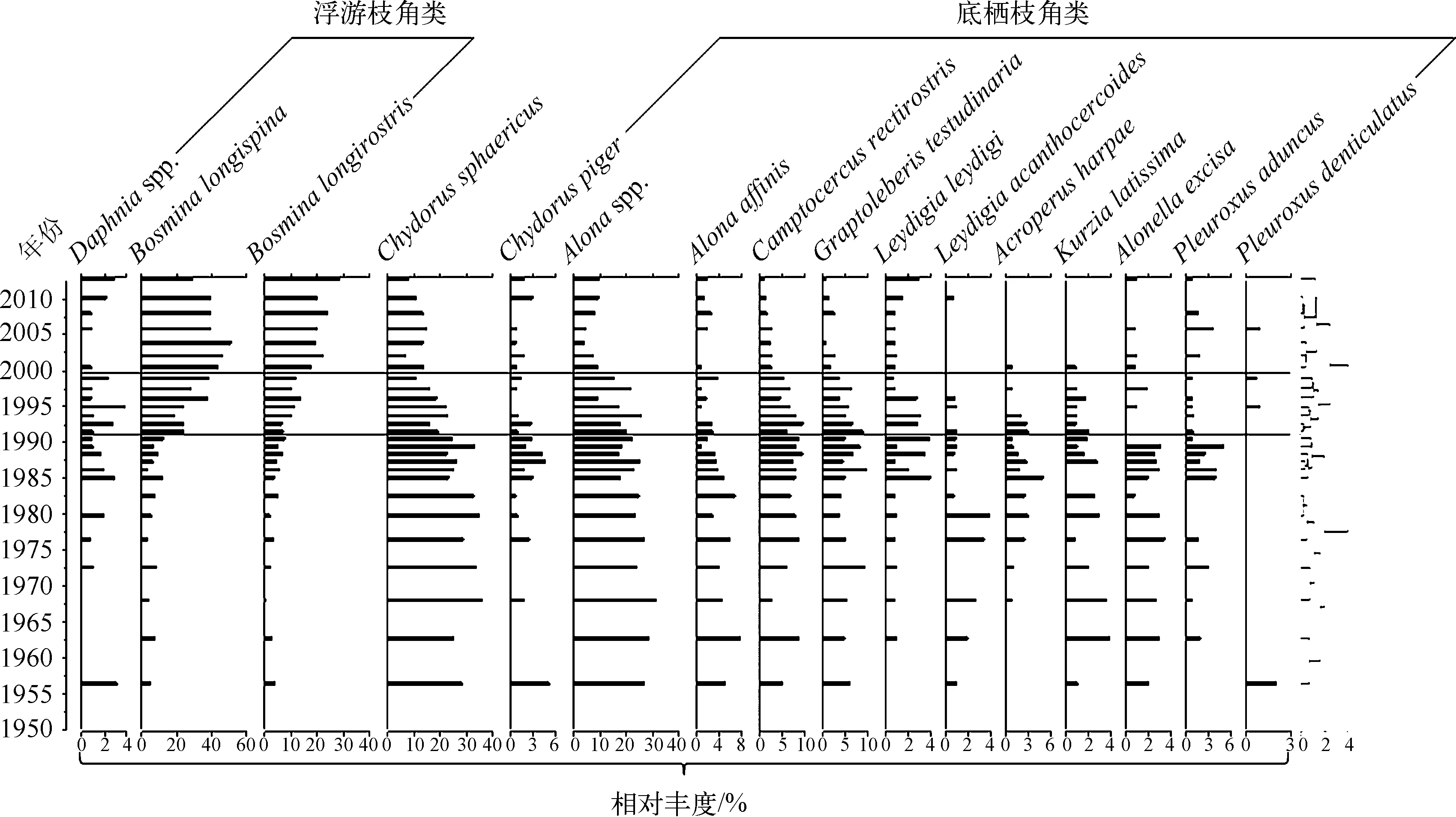
图5 枝角类群落结构变化与限制性聚类分析Fig.5 Profile of cladoceran community changes with constrained cluster analysis revealing three significant stages
在枝角类群落结构PCA分析结果基础上,运用Broken-Stick模型对PCA主轴的显著性进行检验发现,能显著解释湖区枝角类群落结构变化的仅有PCA主轴1,共解释了群落变化方差的61.64%.沿PCA轴1负方向变化的枝角类为浮游的B.longispina与B.longirostris,而沿PCA轴1正方向变化的为枝角类底栖属种,如Alonaaffinis、Acroperusharpae、Graptoleberistestudinaria等,以及半浮游物种Chydorussphaericus(图6)。
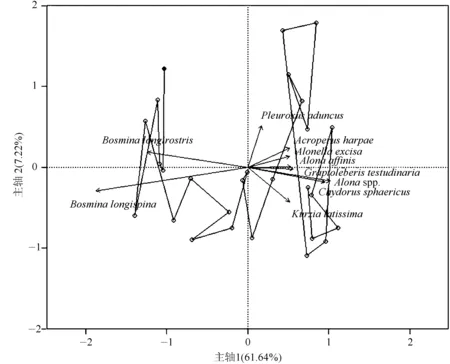
图6 枝角类群落结构变化的PCA分析Fig.6 The principal component analysis biplot of cladoceran community structure
3 讨论
沉积物记录揭示了洱海近百年枝角类群落的长期变化特征.从1930s开始,枝角类生物量总体持续增加.从1990s开始,枝角类群落结构发生迅速更替,浮游枝角类逐渐取代底栖枝角类成为主要组成部分,同时喜好贫营养生境的物种B.longispina在枝角类群落中所占比例近年来有所减小,而喜好富营养生境的B.longirostris的比例则逐渐增加[15].象鼻溞在这一时期个体大小总体减小,与太湖新银鱼在洱海引种成功的时间一致.1980年以后,枝角类群落结构出现底栖物种丰度持续偏低,对应了此阶段洱海水生植物覆盖度的大幅度降低[2]。
3.1 枝角类生物量变化特征及驱动因素
洱海沉积物氮含量的变化(图7)反映了洱海缓慢的富营养化过程,枝角类生物量总体增加的趋势与这一过程相对应[5],但是存在较大波动,可能反映了不同时期人类活动类型与强度的变化.例如,1970s枝角类生物量的急剧增加与西洱河水电站的修建使得洱海水位下降这一事件相一致.湖泊水位的下降促进水草空间分布的变化,南部湖底平坦的湖区水深相对较浅,水草生长茂盛,有利于底栖枝角类生境的增加[2].然而,1980s以后枝角类生物量的显著降低,与吴庆龙等调查发现的洱海水生高等植被在1980s以后的衰退相一致[2].特别是洱海网箱养鱼的大力开展,对水草资源的破坏性开发[16],使得底栖枝角类赖以生存的环境遭到破坏,对枝角类生物量产生抑制作用.从1990s以后,底栖枝角类逐渐衰退,浮游的象鼻溞成为枝角类的重要组成部分.而Liu等对洱海中部沉积物中的枝角类群落的研究并没有发现枝角类生物量在1970s急剧增加与1980s急剧降低的事件[6],可能反映了浅水区生物群落对湖泊水位下降的响应比深水区更为敏感,指示了生物群落在湖泊不同水深出现的差异性响应现象.本文的研究结果与Liu等识别的1990s以后枝角类生物量的增加,特别是象鼻溞相对丰度的急剧增加是一致的[6].然而,Chydorussphaericus在Liu的研究中作为湖泊富营养化的指示物种,在1990s以后生物量显著增加[6],这与我们的研究结果是不同的.Duigan在对Chydorussphaericus的研究中发现,该种不仅出现在贫营养的水体中,也经常在湖泊与池塘沿岸区的大型植被床中被发现,还在蓝绿藻水华出现的地点以及高水位水体的沉水植被中被发现[17].这说明Chydorussphaericus生活的生境广泛,其在洱海南部的变化特征与水生植被的退化趋势相一致,同时也可能受到水体营养水平、水位变化的协同影响。
洱海从1984年开始移植太湖新银鱼,到1990s初形成稳定产量,成为洱海渔业生产中的重要组成部分.太湖新银鱼引入后,现代调查显示洱海浮游动物中的枝角类、桡足类和轮虫的数量呈下降趋势,总生物量锐减[2].我们的沉积物记录也反映出枝角类群落响应太湖新银鱼引入这一事件.特别是象鼻溞在1990s初期生物量、个体大小(壳长以及B.longispina第一触角长度)的显著减小,与太湖新银鱼在洱海引种成功的时间相一致.这与我们对滇池及抚仙湖沉积物中象鼻溞的研究结果一致[18].Liu等也识别了抚仙湖象鼻溞个体变小响应太湖新银鱼的引入[19].然而Liu等研究发现Daphnia休眠卵长度的减小响应洱海太湖新银鱼引入这一事实,但是没有发现Bosmina个体大小有明显的变化,本文结果表明洱海象鼻溞也响应了太湖新银鱼引入;Liu等还识别了1999年Daphnia休眠卵长度的增加与太湖新银鱼的低产量相对应[6].象鼻溞在1999年较大的壳长与B.longispina第一触角的长度也对应了洱海这一时段太湖新银鱼的低产量.2006年以来,象鼻溞生物量及其个体大小的显著减小可能反映了湖泊中增强的鱼类捕食压力作用(图4).而洱海于2004年开始实行季节性休渔以及投放鱼苗等活动对浮游动物的群落结构产生了显著的调节作用[20]。
3.2 枝角类群落结构变化特征及驱动因素
本文的研究结果表明洱海在近百年来经历了多重环境压力的胁迫.特别是1970s以来,富营养化趋势增强、水质恶化、水位剧烈波动、水生植被退化、鱼类群落组成变动大等,这些因素都会对枝角类群落结构产生重要影响[1-2].现代调查数据显示洱海的水生植被在过去几十年出现了明显变化.水生高等植物在1950s-1980s呈扩展趋势,而从1980s开始趋于衰退,不仅种类组成与群落类型减少,分布面积更是大为缩减[2].导致水生植被退化的原因有多种,无论是水体中氮、磷营养盐对水生植物的胁迫,还是透明度、气温、水位变化以及食物网消费者结构改变等因素都会对水生植物生长产生直接或间接的影响,水生植被在洱海呈现长期退化的趋势(图7)[21].而我们发现水生植被的退化所造成的底栖枝角类群落生境的丧失,可能导致了枝角类群落结构的改变.从对枝角类群落PCA分析的结果来看,只有第一个主轴显著且解释了枝角类群落结构变化的61.64%.从沿PCA主轴1两个方向变化的物种来看,呈现底栖枝角类逐渐被象鼻溞等浮游类型取代的趋势.样品点在PCA主轴1上的得分与底栖枝角类比例的变化显著相关(r=0.9957,n=27,P<0.001),其在1980年以后的急剧变化(图7)与同期底栖枝角类生物量的迅速下降(图3)同步,可以看出枝角类群落结构的长期变化主要是由底栖枝角类群落的变化导致的.水生植被覆盖面积在这一时期的显著减小[22],表明底栖枝角类赖以生存的环境的丧失.生境的丧失导致底栖枝角类群落的生物量以及比例急剧下降.而这一时期指示湖泊营养水平的沉积物总氮含量增加的趋势并不明显,浮游枝角类生物量在这一时期增加幅度也较小,所以不可能是增加的浮游枝角类生物量对底栖枝角类生物量的稀释作用造成的底栖枝角类比例相对减小.从1995年以后,沉积物总氮含量显著增加,水体中总磷的监测值也同步增加(图7)[6],同时浮游枝角类的生物量大幅增加(图3),可能造成了枝角类群落结构的改变.因此,枝角类群落结构的显著变化主要反映了水生植被的快速变化,而富营养化的过程也可能影响枝角类群落结构的变化。
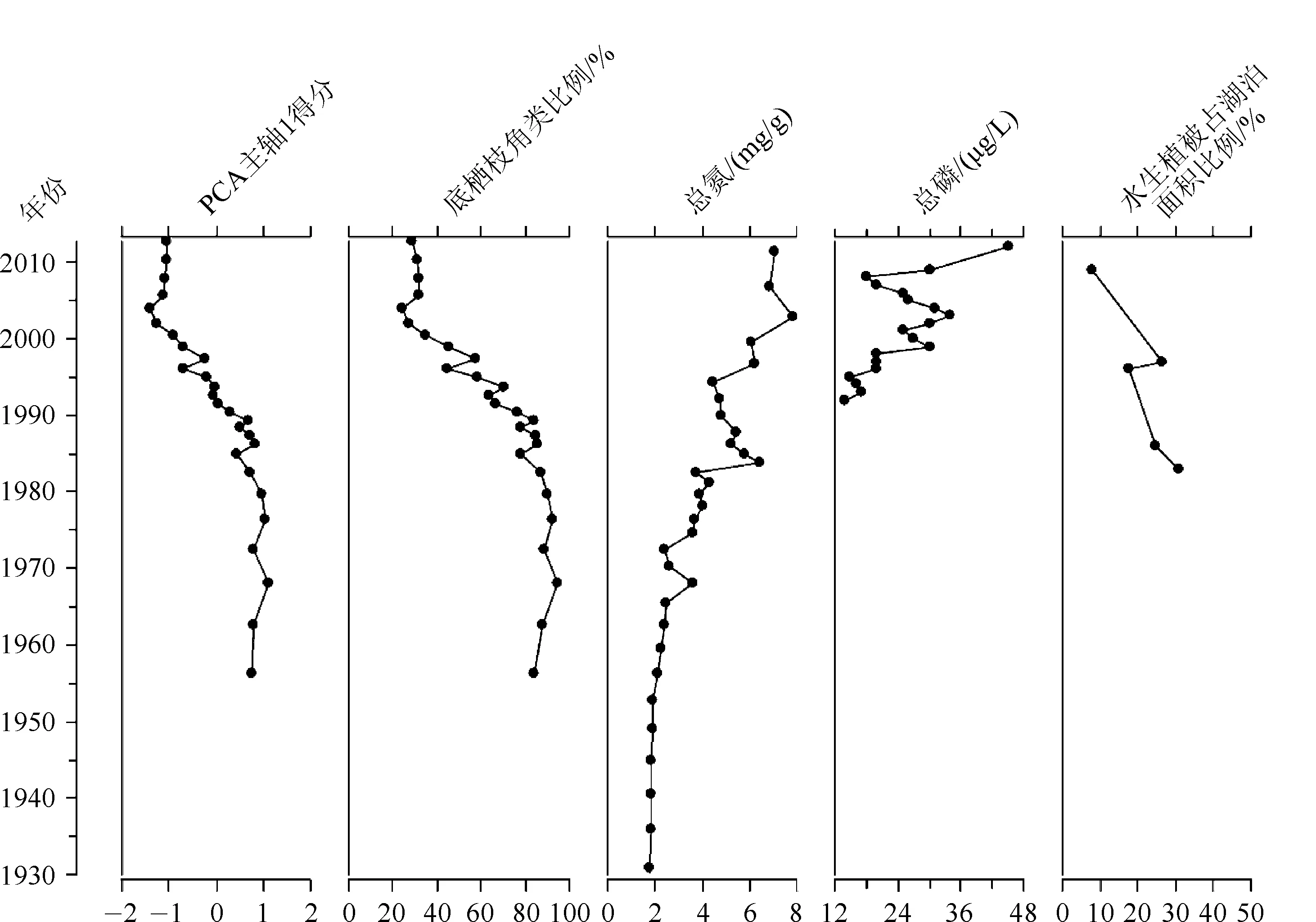
图7 PCA主轴1样品点得分、底栖枝角类比例、沉积物总氮含量、水体总磷的现代监测数据以及水生植被覆盖面积变化Fig.7 Stratigraphic plot showing changes of cladoceran PCA axis1 scores, relative abundance of littoral cladocerans,the sedimentary total nitrogen, the monitoring TP data, and macrophyte coverage
3.3 枝角类群落的变化与洱海生态系统的稳态转变
在湖泊生态系统中,清水态(草型)和浊水态(藻型)是最常见的两种稳态.当湖泊生态系统从一种稳态(如草型湖泊)转变到另一种稳态(如藻型湖泊)时,指示湖泊生态系统稳定性发生突变,即稳态转变[23].Wang等结合洱海的现代监测数据,提取沉积物中记录的硅藻信息,识别了在洱海发生稳态转变的时间为2001年左右并分析了湖泊生态系统转变的预警信号[24].本文的枝角类群落结构分析发现,从2000年左右以后枝角类群落结构稳定,浮游枝角类成为枝角类群落结构的主要组成部分,这一结果与洱海发生稳态转变的时间基本一致.同时,枝角类群落在1990-2000年期间出现的显著变化也可能作为指示湖泊稳态转变预警信号的重要指标.同时也可能由于不同湖区在水深等方面存在的空间差异性,从而出现浅水湖区比深水区更早出现稳态转变的时间差异性;因此,进一步开展不同湖区的对比研究将有助于揭示生态系统稳态转变的时空异质性是否存在。
4 结论
本文通过对洱海沉积物多指标记录的对比研究,在重建近百年来湖泊枝角类群落长期变化历史的基础上,识别了水生植被退化对枝角类群落结构转变可能起到主要的驱动作用,同时外来鱼类引入与富营养化过程也对枝角类群落产生重要影响.结合已有研究,本文对比并识别了洱海不同区域的枝角类群落响应环境压力存在一定的空间差异性,同时枝角类群落作为指示生态系统健康的重要指标也反映了与硅藻群落指示的洱海生态系统稳态转变的时相基本一致的特征.总之,本文的结果表明沉积物记录的枝角类群落信息,可以为了解湖泊生态系统的变化提供长期数据与一定的科学依据,同时为洱海的有效管理与生态修复提供基础资料。
致谢:对在本研究中给予野外采样、室内分析等帮助的云南师范大学高原湖泊生态与全球变化重点实验室各位老师和同学表示感谢。
参考文献5
[1]王云飞, 潘红玺, 吴庆龙等. 人类活动对洱海的影响及对策分析. 湖泊科学, 1999, 11(2): 123-128. DOI 10. 18307/1999. 0206。
[2]吴庆龙, 王云飞. 洱海生物群落的历史演变分析. 湖泊科学, 1999, 11(3): 267-272. DOI 10. 18307/1999. 0312。
[3]Smol JP. Pollution of lakes and rivers: a paleoenvironmental perspective. New Jersey: John Wiley & Sons, 2008。
[4]Korhola A, Rautio M. Cladoceran and other branchiopod crustaceans. Dordrecht: Springer Netherlands, 2001: 5-41。
[5]Smol JP. The power of the past: using sediments to track the effects of multiple stressors on lake ecosystems.FreshwaterBiology, 2010, 55(s1): 43-59。
[6]Liu G, Liu Z, Gu Betal. How important are trophic state, macrophyte and fish population effects on cladoceran community? A study in Lake Erhai.Hydrobiologia, 2014, 736: 189-204。
[7]王苏民, 窦鸿身. 中国湖泊志. 北京: 科学出版社, 1998: 371-374。
[8]王小雷, 杨浩, 丁兆运等. 云南抚仙湖近现代沉积速率变化研究. 地理学报, 2011, 66(11): 1551-1561。
[9]Frey DG. The late-glacial cladoceran fauna of a small lake.ArchivfürHydrobiologie, 1958, 54: 209-275。
[10] Frey DG. Cladoceran from the Eemian Interglacial of Denmark.JournalofPaleontology, 1962, 36: 1133-1154。
[11]Frey DG. Supplement to the taxonomic and phylogenetic significance of the head pores of the Chydoridae(Cladoceran).IssueInternationaleRevuedergesamtenHydrobiologieundHydrographie, 1962, 47: 603-609。
[12]Goulden CE, Frey DG. The occurrence and significance of lateral head pores in the genusBosmina(Cladoceran).IssueInternationaleRevuedergesamtenHydrobiologieundHydrographie, 1963, 48(3): 513-522。
[13]Sweetman JN, Finney BP. Differential responses of zooplankton populations (Bosminalongirostris) to fish predation and nutrient-loading in an introduced and a natural sockeye salmon nursery lake on Kodiak Island, Alaska, USA.JournalofPaleolimnology, 2003, 30(2): 183-193。
[14]朱芸, 雷国良, 林燕语等. 元素分析仪-同位素质谱测定全氮含量的方法研究. 福建师范大学: 自然科学版, 2013, 29(1): 58-62。
[15]Boucherle MM, Züllig H. Cladoceran remains as evidence of change in trophic state in three Swiss lakes.Hydrobiologia, 1983, 103: 141-146。
[16]董云仙, 谢建平, 董云生等. 洱海水生植被资源及其可持续利用途径. 生态经济, 1996, (5): 15-19。
[17] Duigan AC. The ecology and distribution of the littoral freshwater Chydoridae (Branchiopoda, Anomopoda) of Ireland, with taxonomic comments on some species.Hydrobiologia, 1992, 241: 1-70。
[18] 卢慧斌, 陈光杰, 陈小林等. 上行与下行效应对浮游动物的长期影响评价——以滇池与抚仙湖沉积物象鼻溞为例. 湖泊科学, 2015, 27(1): 67-75. DOI 10. 18307/2015. 0109。
[19]Liu G, Liu Z, Li Yetal. Effects of fish introduction and eutrophication on the cladoceran community in Lake Fuxian, a deep oligotrophic lake in southwest China.JournalofPaleolimnology, 2009, 42(3): 427-435。
[20] 吴秋婷, 卫志宏, 朱江等. 一座季节性休渔湖泊——洱海轮虫的季节动态特征. 湖泊科学, 2012, 24(4): 586-592. DOI 10. 18307/2012. 0412。
[21] 吴功果, 倪乐意, 曹特等. 洱海水生植物与浮游植物的历史变化及影响因素. 水生生物学报, 2013, 37(5): 912-918。
[22] 厉恩华, 王学雷, 蔡晓斌等. 洱海湖滨带植被特征及其影响因素分析. 湖泊科学, 2011, 23(5): 738-746. DOI 10. 18307/2011. 0511。
[23]Scheffer M, Hosper SH, Meijer MLetal. Alternative equilibria in shallow lakes.TrendsinEcologyandEvolution, 1993, 8(8): 275-279。
[24]Wang R, John AD, Peter GLetal. Flickering gives early warning signals of a critical transition to a eutrophic lake state.Nature, 2012, 492: 419-422。
J.LakeSci.(湖泊科学), 2016, 28(1): 132-140
©2016 byJournalofLakeSciences
Cladoceran community responses to eutrophication, fish introduction and macrophyte degradation over the past century in Lake Erhai
LU Huibin, CHEN Guangjie**, CAI Yanfeng, WANG Jiaoyuan, CHEN Xiaolin, DUAN Lizeng & ZHANG Hucai
(KeyLaboratoryofPlateauLakeEcologyandGlobalChange,SchoolofTourism&Geography,YunnanNormalUniversity,Kunming650500,P.R.China)
Abstract:Obvious environment changes have occurred in some lakes of Yunnan Province due to intensifying human impacts over the past decades, especially in large lakes. Lake Erhai is the second largest lake in the Yunnan by surface area, which experienced the pressures of multiple environmental stressors (e.g. eutrophication, fish invasion and macrophyte degradation). The application of lake sediment records enables us to reconstruct the long-term changes of lake environment and ecosystem dynamics in situation of less monitoring data. Here multi-proxy analyses of lake sediments were conducted from a short sediment core in the south and shallow basin of Lake Erhai, which are currently eutrophic. We aimed to recognize the long-term variations and driving factors of cladoceran community, and to test for whether spatial heterogeneity exists in community responses through a comparison with monitoring data and previous results from the deep basin of Lake Erhai. Our results showed that cladoceran production showed an overall increasing trend in the past century, and since 1990s bosminid production increased significantly with a general trend of the oligotrophic taxon of Bosmina longispina replaced by B. longirostris. In addition, bosminid production and the body size (i.e. carapace and antennule length) displayed a decrease during early 1990s, were in good correspondence with the period when the population of the exotic noodlefish was well established. Based on the constrained cluster analysis, the historical changes of cladoceran community were characterized by three distinct phases: littoral cladocerans were dominant before the 1990s and the relative abundance of pelagic cladocerans increased rapidly from the 1990s before the pelagic cladocerans became predominant during early 2000s. The principal component analysis showed that the environmental gradient associated with macrophyte coverage accounted for 61.64% of the total variance in the cladoceran community. Compared with previous studies, we observed that the increased production of cladocerans during the 1970s and an abrupt decrease during the 1980s recorded in shallow basin of Lake Erhai were not reflected in the core from the deep basin, indicating that spatial heterogeneity exists in ecosystem changes of Lake Erhai. We also found the obvious shift of bosminid body sizes in response to fish introduction. Overall, our results revealed the long-term changes of cladoceran production and community structure mainly as a consequence of lake eutrophication and macrophyte degradation, while fish introduction also played a role in structuring zooplankton community through changing predation pressure. Therefore the environmental stressors which could be identified through sedimentary records should be taken into account for sustainable management and ecological restoration of Lake Erhai through facilitating lake ecosystem assessment。
Keywords:Paleolimnology;Lake Erhai;cladoceran;community structure;eutrophication
通信作者卢慧斌,陈光杰*;E-mail: guangjiechen@gmail.com.,蔡燕凤,王教元,陈小林,段立曾,张虎才
基金项目收修改稿.卢慧斌(1990~),男,硕士;E-mail: luhuibin611@163.com。
DOI10.18307/2016.0115
