紫杉醇脂质体药代动力学参数与胃癌干预中不良反应的关系研究
2016-02-23陈珊珊李华敏陈建寿
陈珊珊 李华敏 陈建寿
紫杉醇脂质体药代动力学参数与胃癌干预中不良反应的关系研究
陈珊珊1李华敏2陈建寿1
目的探究紫杉醇脂质体药代动力学参数与胃癌干预中不良反应的关系。方法选取在2015年5月至2016年6月期间在海南省农垦那大医院接受治疗的胃癌患者58例作为该研究的对象,对所有的患者进行随机分组,分为观察组和对照组,观察组的患者选择紫杉醇脂质体进行干预治疗,对照组选择常规紫杉醇进行干预治疗,两组患者均联合S-1进行治疗。治疗结束后对患者的近期疗效、不良反应以及药代动力学参数进行比较和分析。结果两组血药浓度和Tc>0.05(临床血药浓度c>0.05 μmol/L的暴露时间)的组间比较无显著差异(P>0.05);治疗结束后观察组的有效率和疾病控制率分别是46.67%和86.67%,对照组的有效率和疾病控制率分别是35.71%和89.29%,两组间比较差异无统计学意义(P>0.05);治疗结束后观察组的不良反应中骨髓抑制、肌肉关节疼痛以及头发均轻于对照组,组间比较具有显著的差异(P<0.05)。结论常规紫杉醇与紫杉醇脂质体在治疗胃癌方面均具有良好的有效性,但是紫杉醇脂质体的有效性与常规紫杉醇相比较明显较高;根据Tc>0.05的观测值,可以对下一阶段的给药量做出调整,进一步提高临床的有效性并最大可能的改善患者的生活质量。
胃癌;药代动力学;紫杉醇脂质体
化疗在胃癌的治疗中占有非常重要的地位,但是,临床上胃癌化疗方案还没有形成共识[1]。在临床上应用最为广泛的治疗胃癌的化疗药物有:铂类、紫杉烷类及氟尿嘧啶类[2]。S-1是一种最新研发的药物,其单药治疗胃癌具有较高的有效率,患者的生存时间被延长,该药物属于一种氟尿嘧啶的衍生物[3]。本文对紫杉醇脂质体药代动力学参数与胃癌干预中不良反应的关系进行了研究并进行相应的报道。
材料与方法
一、一般资料
选取2015年5月至2016年6月我院收治的胃癌患者58例作为研究对象,对所有患者进行随机分组,分为观察组和对照组,观察组30例,其中男23例,女7例,中位年龄68岁,选择紫杉醇脂质体进行干预治疗;对照组28例,其中男18例,女10例,中位年龄68岁,选择常规紫杉醇进行干预治疗,两组患者均联合S-1进行治疗。患者入选的标准:①临床分期以及病理诊断明确;②KPS功能状态评分大于60分;③生存时间需大于3个月;④没有接受过正规的或者是系统的化疗;⑤心脏、肝脏以及肾脏等重要器官没有严重疾病;⑥血生化指标以及血常规等指标无异常。两组在性别组成、原发病变类型、病理分化、年龄、疾病类型等方面无统计学差异(P>0.05),具有可比性,见表1。
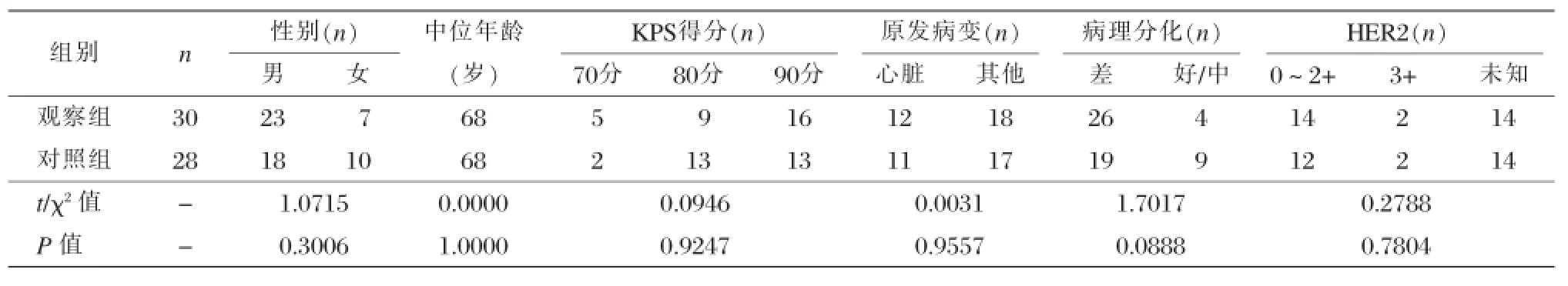
表1 不同组患者的基本资料的比较与分析
二、方法
观察组患者注射用紫杉醇脂质体,选自思科药业(南京)有限公司,1次/d,用量为160 mg/m2;对照组的患者注射用的紫杉醇,选自双鹭药业(北京)股份有限公司,1次/d,用量为160 mg/m2;同时,两组患者均口服S-1胶囊,选自恒瑞医药(江苏)股份有限公司,用量为2次/d,用量为160 mg/m2,连用两周;两组患者的化疗周期均为3周,每周为1个疗程。
三、观察指标
观察的指标包括:①药代动力学参数;②近期的疗效(包括影像学的检查以及体格的检查),按照肿瘤疗效评价表[4],分四个等级进行评价,分别是疾病进展、疾病稳定、部分缓解以及完全缓解;③对患者出现的不良反应进行时时观察,评价的标准参照常见不良反应(美国国立癌症研究所)术语标准4.0版[5]。
四、统计学分析
调查资料、数据的整理与统计学分析分别选择EXEL软件和SPSS 18.0进行,计量资料和计数资料的比较分析分别选择t检验和χ2检验,等级分类资料采用Ridit分析,数据的表示方法以方便为准。P<0.05为差异有统计学的意义。
结果
一、不同组患者药代动力学参数的比较与分析
两组患者的血药浓度和Tc>0.05的组间比较无显著差异,不具有统计学的意义(P>0.05),见表2。
表2 两组患者的血药浓度和Tc>0.05的比较与分析()
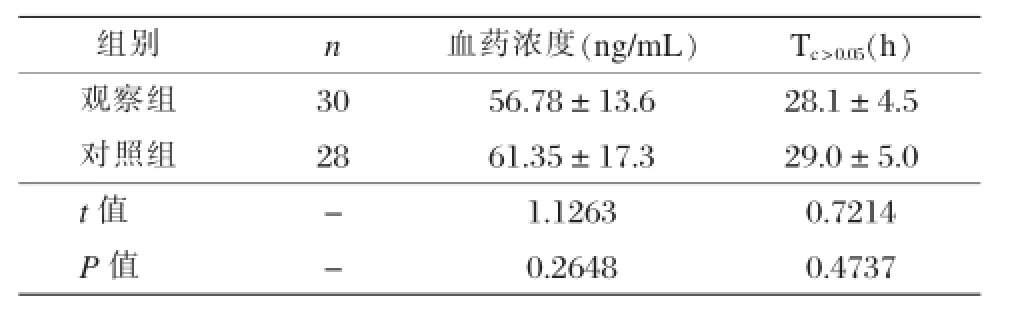
表2 两组患者的血药浓度和Tc>0.05的比较与分析()
组别n血药浓度(n g / m L)Tc>0.05(h)观察组3 0 5 6 . 7 8 ± 1 3 . 6 2 8 . 1 ± 4 . 5对照组2 8 6 1 . 3 5 ± 1 7 . 3 2 9 . 0 ± 5 . 0 t值-1 . 1 2 6 3 0 . 7 2 1 4 P值-0 . 2 6 4 8 0 . 4 7 3 7
二、不同组患者治疗完成后的近期疗效比较分析
治疗结束后观察组患者的有效率和疾病控制率分别是46.67%和86.67%,对照组患者的有效率和疾病控制率分别是35.71%和89.29%,两组患者相组间比较无显著差异,不具有统计学的意义(P>0.05),见表3。
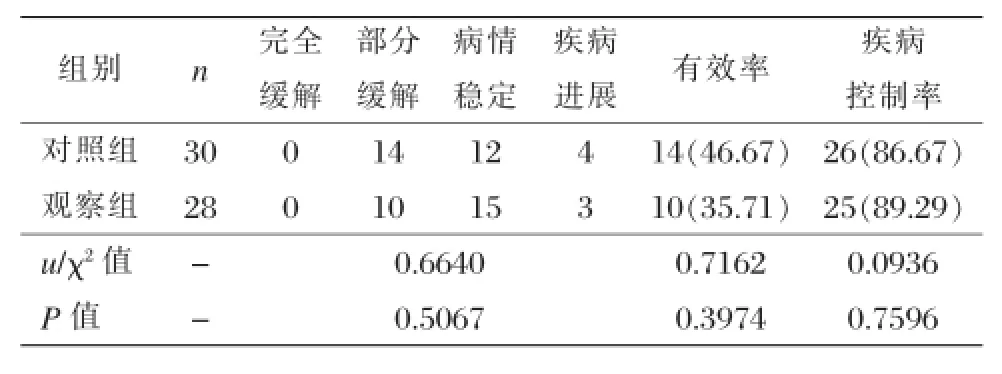
表3 不同组患者治疗完成后的近期疗效比较[n(%)]
三、治疗结束后不同组患者不良反应的比较分析
治疗结束后观察组患者的不良反应,骨髓抑制、肌肉关节疼痛以及头发与对照组的患者相比较均较轻,组间比较具有显著的差异,有统计学的意义(P<0.05),见表4。

表4 治疗结束后不同组患者不良反应的比较分析(n)
讨论
在胃癌的临床化疗中,两种药物相联合治疗与3种药物联合治疗相比,具有不良反应少但疗效相当的效果[6]。有关的研究人员指出,在胃癌的治疗中,紫杉醇联合S-1具有较高的生存时间(11.6~13.6个月)和临床的总有效率(39%~65%),常见的不良反应是中性粒细胞的减少[7]。多项研究表明,与常规的紫杉醇相比,紫杉醇脂质体在临床的治疗中呈现出较多的优势,特别是在药物的耐受方面效果明显[8-9]。其原因可能是,紫杉醇脂质体包裹在被卵磷脂等之内,因而具有更加良好的稳定性,由于药物引发的溶媒介导的过敏反应以及不良反应的发生率均比较低[10]。同时,多项其他肿瘤的临床研究也表明,与常规的紫杉醇相比较,紫杉醇脂质体在引发心脏以及骨髓抑制等不良反应方面,反应明显较轻[11]。
紫杉醇在人体中的代谢过程是,首先经过肝脏的代谢,之后又胆汁排从出体外[12]。所以,如果患者有恶性肿瘤肝转移或者是肝功不全,均会出现非血液学或者是血液学的不良反应增加[13]。在紫杉醇的临床应用中,常见的由于计量限制引起的不良反应有胃肠反应、神经不良反应、骨髓抑制以及脱发等[14]。有关的研究表明,药物中的相关中性粒子细胞的减少程度可以通过Tc>0.05进行有效的预测。在相同的药物剂量下,该组研究结果发现,两组患者的血药浓度和Tc>0.05的组间比较无显著差异,不具有统计学的意义。
本研究结果显示,治疗结束后选择紫杉醇脂质体的患者的有效率和疾病控制率分别是46.67%和86.67%,选择常规紫杉醇的患者有效率和疾病控制率分别是35.71%和89.29%,两组患者相组间比较无显著差异,不具有统计学的意义。但是在不良反应方面,选择紫杉醇脂质体的患者骨髓抑制、肌肉关节疼痛以及头发与选择常规紫杉醇的患者相比较均较轻,组间比较具有显著的差异,说明紫杉醇脂质体具有更高的安全性。同时,提示在具有良好的血药浓度检测的环境下,可以适当的对紫杉醇脂质体的用药量有所增加,以达到最佳的临床效果[15-17]。
综上所述,常规紫杉醇与紫杉醇脂质体在治疗胃癌方面均具有良好的有效性,但是紫杉醇脂质体的有效性与常规紫杉醇相比较明显较高;根据Tc>0.05的观测值,可以对下一阶段的给药量做出调整,进一步提高临床的有效性并最大可能地改善患者的生活质量。
[1]晏淼,刘小青,卞保祥,等.替吉奥胶囊联合紫杉醇治疗进展期胃癌的临床研究[J].中国全科医学,2012,15(9):990-992.
[2]郭晓冬,韩克起,方盛泉,等.紫杉醇、顺铂和替吉奥联合化疗方案治疗晚期胃癌的疗效和安全性[J].肿瘤,2012,32(6):453-457.
[3]李尚富,韩述岭,潘春球,等.XELOX方案与DF方案治疗老年患者晚期胃癌的比较[J].现代消化及介入诊疗,2011,16(2):112-114.
[4]Morgagni P,Gardini A,Marrelli D,et al.Gastric stump carcinoma after distal subtotal gastrectomy for early gastric cancer:experience of 541patients with long-term follow-up[J].Am J Surg,2015,209 (6):1063-1068.
[5]Li CS,Wu W,Xie KK,et al.HMGCR is up-regulated in gastric cancer and promotes the growth and migration of the cancer cells [J].Gene,2016,587(01):42-47.
[6]徐旭,徐寰骞,黄新恩.紫杉醇脂质体或紫杉醇联合替加氟和奥沙利铂治疗晚期胃癌的比较[J].中国新药与临床杂志,2011,30 (6):467-470.
[7]刘国龙,吴红瑛,毛海波,等.紫杉醇联合希罗达治疗晚期胃癌的初步观察[J].现代消化及介入诊疗,2006,11(2):66-67.
[8]马晴晴,曲颜丽,唐勇.替吉奥或奥沙利铂联合紫杉醇脂质体治疗进展期胃癌的临床分析[J].中国肿瘤临床,2014,41(3):200-203.
[9]Li Y,Tian X,Sui CG,et al.Interference of lysine-specific demethylase 1 inhibits cellular invasion and proliferation in vivo in gastric cancer MKN-28 cells[J].iomed Pharmacother,2016,82: 498-508.
[10]朱鸿武,江丹,周梅花,等.siRNA沉默STMN1对胃癌AGS细胞紫杉醇敏感性的影响[J].中国现代医学杂志,2014,24(26):27-31. [11]刘在亮,蔡剑雄,张瑚.紫杉醇脂质体注射液与普通紫杉醇治疗胃癌疗效与安全性的Meta分析[J].中国实验方剂学杂志,2016, 22(5):221-225.
[12]武梦娇,王峰,宋丽杰,等.紫杉醇脂质体或常规紫杉醇联合S-1治疗进展期胃癌:药代动力学、疗效及安全性的比较[J].肿瘤, 2016,36(3):303-309.
[13]王宏,郭广洋.经导管动脉栓塞化疗为基础的多烯紫杉醇联合方案治疗结直肠癌肝转移效果分析[J].现代消化及介入诊疗, 2016,21(1):35-37,42.
[14]邹春华,黄涛金,谢勇久,等.奥沙利铂或替吉奥联合紫杉醇治疗进展期胃癌的临床疗效及安全性评价[J].中国临床药理学杂志, 2015,31(8):609-611.
[15]戚麟,高天慧,刘明月,等.紫杉醇脂质体与普通紫杉醇治疗胃癌疗效比较[J].山东医药,2011,51(16):66-67.
[16]何雯婷,陆明洁,喻存俊,等.Ⅲ型β-微管蛋白、微管相关蛋白tau及凋亡抑制蛋白survivin的mRNA水平与胃癌对紫杉醇敏感性的研究[J].南京医科大学学报(自然科学版),2011,31(6): 867-871.
[17]周然,王峰,曹蕾,等.紫杉醇联合卡培他滨一线治疗晚期胃癌后卡培他滨维持治疗的疗效和安全性[J].世界华人消化杂志, 2014,22(17):2456-2462.
2016-09-19)
(本文编辑:朱薇)
10.3969/j.issn.1672-2159.2016.06.011
1 571700海南省农垦那大医院;2 571700海南省儋州市第一人民医院
