放疗联合不同同步化疗方案治疗局部晚期鼻咽癌的毒副反应及远期疗效比较
2016-02-23梁忠国曾凡艳陈晓倩朱小东
黄 丽, 梁忠国, 曾凡艳, 李 龄, 曲 颂, 苏 芳, 陈晓倩, 朱小东△
(1. 广西医科大学附属肿瘤医院放疗科, 南宁 530021; 2.广西医科大学研究生学院, 南宁 530021)
放疗联合不同同步化疗方案治疗局部晚期鼻咽癌的毒副反应及远期疗效比较
黄 丽1,2, 梁忠国1, 曾凡艳1, 李 龄1, 曲 颂1, 苏 芳1, 陈晓倩1, 朱小东1△
(1. 广西医科大学附属肿瘤医院放疗科, 南宁 530021; 2.广西医科大学研究生学院, 南宁 530021)
目的:对比单药顺铂及顺铂联合5-Fu同步放化疗治疗局部晚期鼻咽癌患者的毒副反应及远期疗效。方法: 选取2005年1月至2011年12月共140例局部晚期鼻咽癌患者参与本研究,临床分期均为Ⅲ~Ⅳb期。单药顺铂组(DDP组)70例、顺铂联合5-Fu组(PF组)70例,两组均采用根治性常规分割放疗,DDP组同步化疗方案:顺铂80~100mg/m2静滴,分3天用,每3周1次,共1~3个周期;PF组为:顺铂80 mg/m2,静滴,分3天用,5-Fu 750 mg/m2/d,静滴,d1~d4,每3周1次,共1~3个周期。比较两组的远期疗效及毒副反应。结果: 中位随访时间55个月,DDP组和PF组5年总生存率、无局部区域复发生存率、无远处转移生存率及无病生存率分别为71.7% vs. 64.0% (P=0.62)、91.8% vs. 85.7%(P=0.13)、86.7% vs. 85.2%(P=0.95)及80.6% vs. 78.8%(P=0.65)。多因素统计分析显示,年龄、N分期是影响5年总生存率的独立预后因素(HR,1.99;95% CI,1.15~3.46;P=0.01)、(HR,2.01;95% CI,1.06~4.15;P=0.03)。两组毒副反应以口腔黏膜炎、恶心呕吐及白细胞减少为主,但PF组出现口腔黏膜炎的患者较DDP组多,差异有统计学意义(P<0.05)DDP组的顺应性优于PF组,两组均未出现治疗相关性死亡,但化疗周期完成数≥2周期的患者DDP组有52例(74.3%),PF组仅25例(35.7%)。结论: 对局部晚期鼻咽癌患者,单药顺铂与顺铂联合5-Fu两种同步化疗方案远期疗效相近,患者大都可耐受,但口腔黏膜炎PF组较DDP组重。
局部晚期鼻咽癌; 同步放化疗; 顺铂; 5-Fu; 毒副反应
NCCN临床实践指南将顺铂(DDP)100mg/m2,d1,22,43作为局部晚期鼻咽癌放疗同步化疗的标准治疗方案,尽管总生存受益,但远处转移仍是治疗失败的主要原因[1]。因此,通过增加化疗的强度或寻找更有效的化疗方案来降低远处转移成为目前研究的热点。一些研究在同步放化疗的基础上加上诱导化疗/辅助化疗[2]或采用联合方案[3]代替单药DDP同步化疗,但均未能有效降低治疗后的远处转移率。到目前为止,关于局部晚期鼻咽癌同步化疗的最优方案、最佳剂量也尚未确定。为此,笔者回顾性对比本院同期放化疗不同化疗方案治疗局部晚期鼻咽癌的毒副反应及远期疗效,为局部晚期鼻咽癌放化综合治疗提供借鉴。
1 资料与方法
1.1 病例选择
1.1.1 纳入标准 (1)病理确诊为鼻咽癌的初诊患者;(2)病理类型为非角化型或未分化型癌(WHO病理分型Ⅱ型或Ⅲ型);(3)临床分期为T3~4N0~1或TxN2~3及M0(AJCC分期第七版);(4)一般情况较好(Kamofsky Performance Status,KPS≥70);(5)骨髓功能:WBC≥4×109/L,HGB≥80.0g×109/L且PLT≥100×109/L;(6)肝功能:ALT、AST≤正常值上限×2.5倍;(7)肾功能:肌酐清除率≥60ml/min;(8)接受同步放化疗,化疗方案为单药DDP或DDP联合5-Fu。
1.1.2 排除标准 (1)伴有其它恶性肿瘤病史;(2)怀孕或哺乳期;(3)既往接受过化学治疗或放射治疗;(4)接受了诱导化疗或辅助化疗。
1.1.3 病例资料 2005年1月~2011年12月符合纳入以及排除标准的鼻咽癌患者共260例,其中DDP组(118人),顺铂+5-Fu(PF)组(142人)。DDP组常规放疗77人(65.2%)、调强放疗41人(34.8%);PF组常规放疗130人(91.5%),调强放疗12人(8.5%)。由于DDP组调强放疗患者明显多于PF组,导致两组在放疗方式上具有差异性(P<0.05),遂根据患者的T分期、N分期、临床分期、性别、年龄及放疗方式采用1 ∶1配对方法进一步将符合纳入条件的患者分为2组,最终纳入分析的共有140例,DDP组和PF组各70人,均采用常规放疗,其中DDP组男51例(72.9%),女19例(27.1%),年龄28~72岁,PF组男49例(70.0%),女21例(30.0%),年龄23~68岁,两组患者性别、年龄、T分期、N分期及临床分期等具有可比性(表1)。
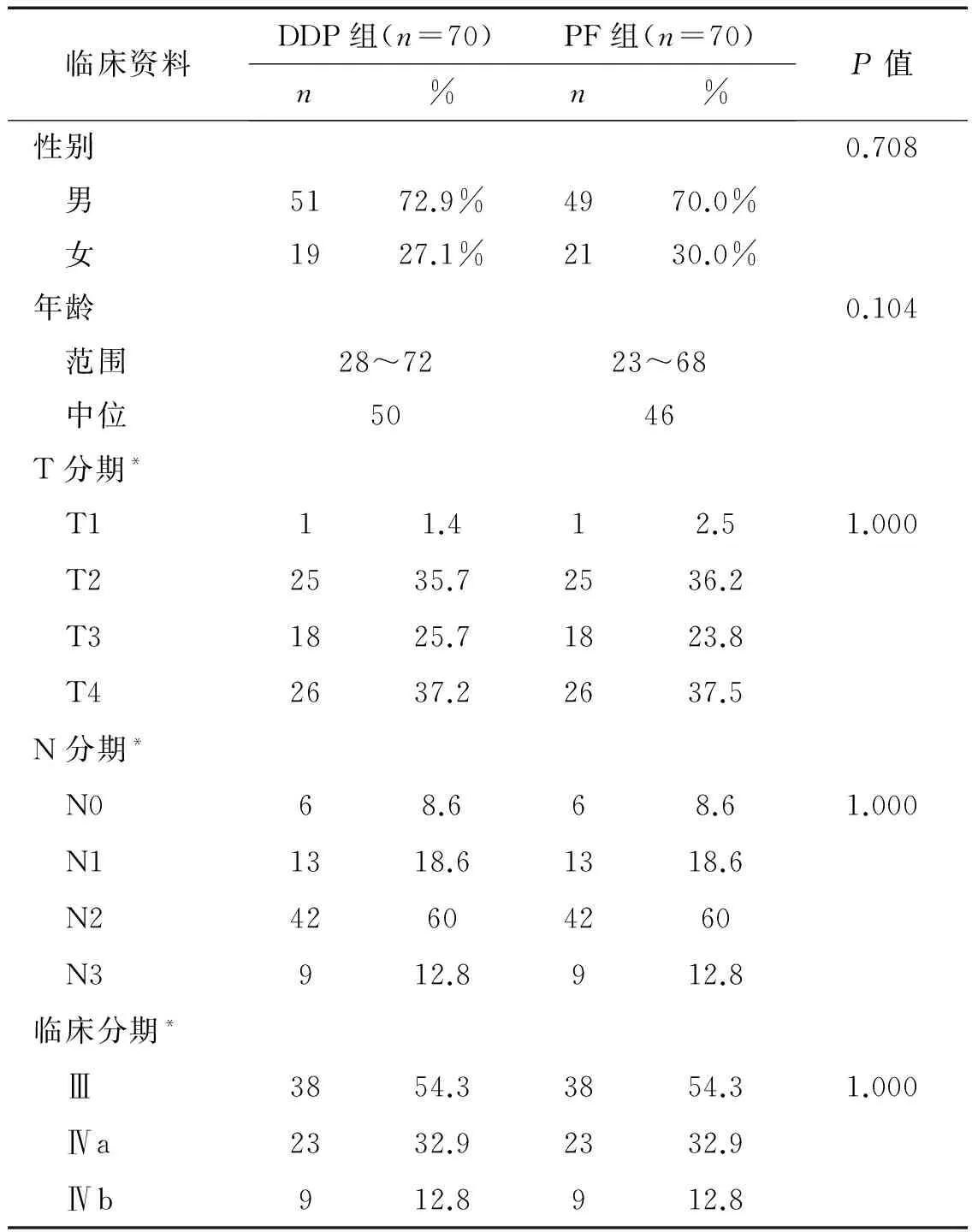
表1 两组病例一般资料比较140例(%)
*根据AJCC分期第七版
1.2 治疗方法
1.2.1 放射治疗 常规放疗:采用直线加速器6MV-X线照射,放疗剂量2Gy/次,1次/天,5次/周,第一段:先设双侧面颈联合野+颈前切线野对穿照射鼻咽部至36~40Gy;第二段:面颈联合野缩野+下颈前切线野继续放疗;第三段:耳前野继续照射。有颅底侵犯者予颅底野补充照射、伴有鼻腔或筛窦侵犯者加用电子线筛窦野照射,如有淋巴结阳性者,在第二段加用双侧耳后电子线野。放疗总量:鼻咽部68~78Gy,颈部阳性淋巴结区域:60~74Gy,颈部预防照射量:50~54Gy。
1.2.2 化疗 从放疗第1天开始同步化疗。化疗方案:DDP组: 顺铂80~100mg/m2,静滴,分3天用,每3周1次,共1~3个周期。PF组:顺铂80 mg/m2,静滴,分3天用,联合5-Fu 750 mg/m2·d-1,静滴d1~d4,每3周1次,共1~3个周期。
1.3 观察指标
总生存、无局部区域复发生存、无远处转移生存时间分别指从治疗结束日期至死亡、鼻咽复发或区域淋巴结复发、远处转移时间间隔,无病生存指从治疗结束至复发、转移或任何原因造成的死亡的时间间隔。毒性反应评价,放射性毒副反应采用美国放射治疗肿瘤组(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准,系统毒性采用抗癌药物常见不良反应评价标准(Common Terminology Criteria for Adverse Events,CTCAE)V3.0版本。
1.4 随访
治疗结束后,第1~2年,每隔3个月随访一次,第3~5年,每隔6个月随访一次,第6年及以后每隔1年随访1次。随访信息记录内容:初次复发部位与时间、初次转移部位与时间、死亡时间及原因。随访方式:门诊、电话。相关检查项目:鼻咽喉镜、骨ECT、腹部B超、胸片或CT、鼻咽及颈部MRI等。中位随访时间55个月(2~106个月),140例患者(100%)完成随访。
1.5 统计学分析
采用SPSS 17.0统计软件进行分析,两组病例的一般资料如年龄、性别等的比较采用如下方法:连续性变量t检验,离散型或有序变量用χ2检验;采用Kaplan-Meier生存曲线分析两组的5年总生存率(OS)、无局部区域复发生存率(LRFS)、无远处转移生存率(DMFS)及无病生存率(DFS);采用Log-rank检验比较两组间生存率差异;采用χ2检验、确切概率法对比两组治疗毒性反应发生率,以P<0.05为差异有统计学意义;多因素分析采用Cox风险比模型。
2 结 果
2.1 治疗顺应性及毒性反应
2.1.1 治疗顺应性 140名患者中DDP组1例、PF组2例因个人原因未按计划完成预定放疗量,在治疗过程中共有10人(DDP组4例、PF组6例)中断放疗超过1周,口腔黏膜炎为放疗中断的主要原因,其次是骨髓抑制及恶心、呕吐等胃肠道反应。DDP组25.7%(18/70)的患者完成了1个周期同期化疗,52.9%(37/70)的患者完成了2个周期同期化疗,21.4%(15/70)的患者完成了3个周期同期化疗;PF组64.3%(45/70)的患者按计划完成了1个周期同期化疗,35.7%(25/70)的患者完成了2个周期同期化疗,PF组没有患者完成了3个周期同期化疗。 PF组未能按计划完成主要原因是口腔黏膜炎(30例)、胃肠道反应(12例),其次是骨髓抑制(8例),而DDP组未能按计划完成同步化疗的主要原因是胃肠道反应(17例)、骨髓抑制(14例)及口腔黏膜炎(9例);DDP组和PF组分别有5例因经济原因未按计划完成化疗;此外,DDP组8例、PF组15例患者因对化疗毒副反应的恐惧心理和对化疗疗效的不确定性未能按计划完成化疗(表2)。
2.1.2 毒性反应 两组急性毒性反应以白细胞减少、恶心呕吐及口腔黏膜炎为主,DDP组及PF组各有3例(4.3%)出现了3~4级胃肠道反应;分别有10例(14.3%)及5例(7.1%)出现了3~4级白细胞减少,差异均无统计学意义;2级急性口腔黏膜炎DDP组及PF组分别有35例(50%)、36例(51.4%);但3级分别有5例(7.1%)、16例(22.9%),差异有统计学意义(P=0.01),但两组均未发生治疗相关性死亡。放疗期间两组的急性毒副反应的发生率及对比情况,见表3。而放疗远期不良反应方面有口干、味觉改变、张口困难、皮下组织纤维化、放射性脑损伤及视力、听力下降,以口干、听力下降及皮下组织纤维化为主,其中DDP组及PF组分别有11例(15.7%)及12例(17.1%)出现了口干、4例(5.7%)及5例(7.1%)出现了听力下降、6例(8.6%)及7例(10.0%)出现了皮下组织纤维化,张口困难DDP组及PF组分别有1例(1.4%)及2例(2.9%),视力下降DDP组及PF组分别有1例(1.4%)及3例(4.3%),DDP组及PF组分别出现了2例(2.9%)、1例(1.4%)放射性脑损伤,另外,DDP组还有1例(1.4%)患者出现了味觉改变,详见表4。
2.2 生存情况
随访日期截止至2015年1月12日,随访率100%,中位随访时间55个月(2~106个月),DDP组和PF组分别有5.7%(4/70)、11.4%(8/70)患者出现复发;11.4%(8/70)、14.3%(10/70)的患者出现远处转移,DDP组和PF组的5年总生存率、无局部区域复发生存率、无远处转移生存率及无病生存率分别为71.7% vs. 64.0% (P=0.62)、91.8% vs. 85.7%(P=0.13)、86.7% vs. 85.2%(P=0.95)及80.6% vs. 78.8%(P=0.65),差异无统计学意义(图1~图4)。
2.3 多因素统计分析
Cox多因素统计分析显示年龄、N分期是影响5年总生存率的独立预后因素(HR,1.99;95% CI,1.15~3.46;P=0.01)、(HR,2.01;95% CI,1.06~4.15;P=0.03)。(表5)
表2 两组同步化疗完成情况对比
Table 2 Comparison of maximum number of cycles of concurrent chemothrapy between the two groups

周期数DDP组(70人)PF组(70人)1周期18(25.7%)45(64.3%)2周期37(52.9%)25(35.7%)3周期15(21.4%)0
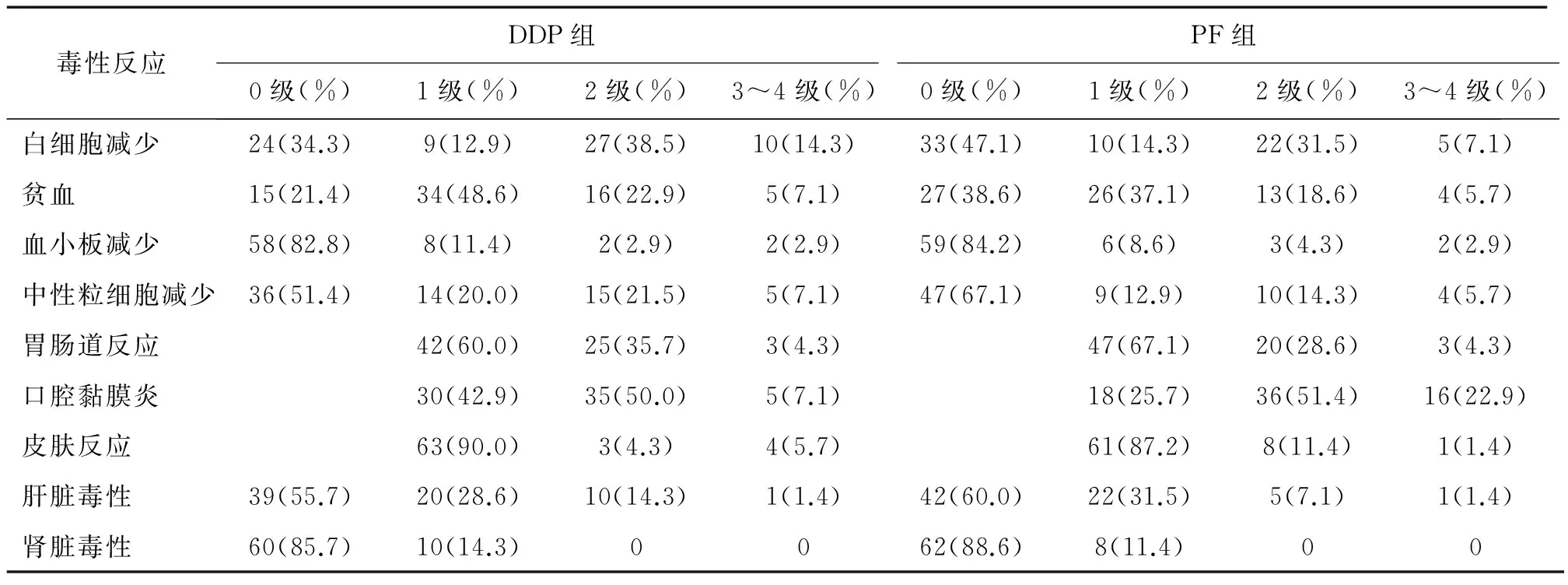
表3 两组病例治疗毒性反应的比较 例(%)

表4 两组病例远期不良反应的比较 例(%)
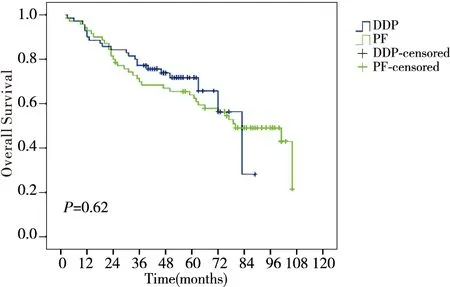
图1 DDP组与PF组总生存率比较Figure 1 Comparison of OS between DDP group and PF group
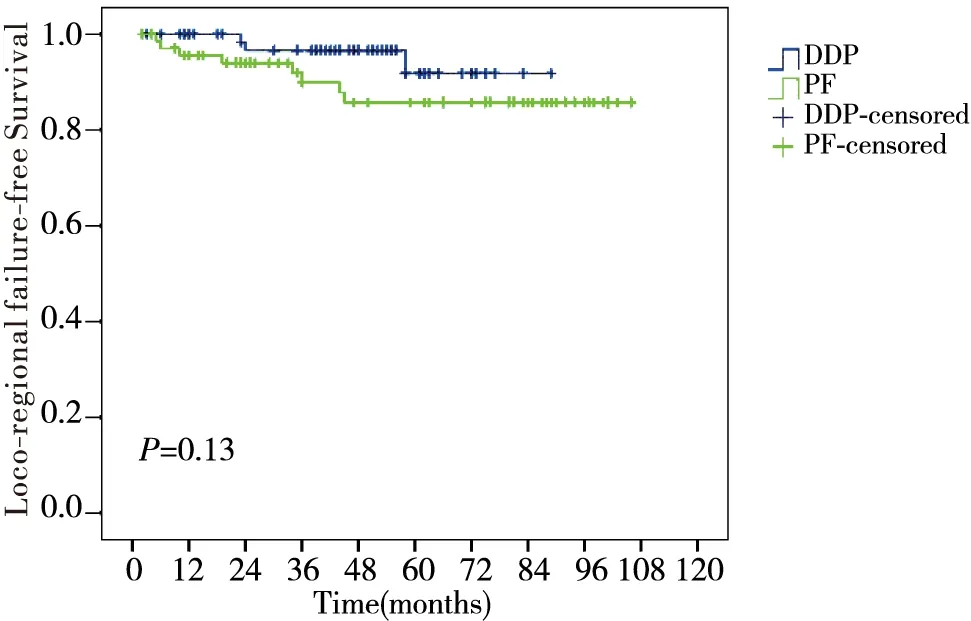
图2 DDP组与PF组无局部区域复发生存率比较Figure 2 Comparison of LRFS between DDP group and PF group
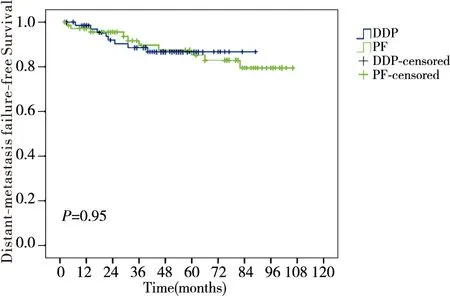
图3 DDP组与PF组无远处转移生存率比较Figure 3 Comparison of DMFS between DDP group and PF group
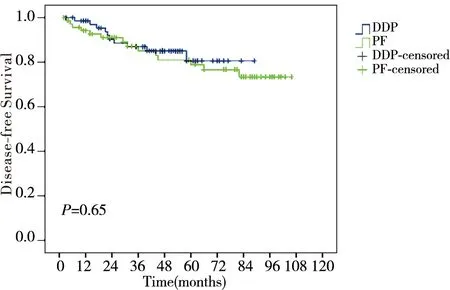
图4 DDP组与PF组无病生存率比较Figure 4 Comparison of DFS between DDP group and PF group
表5 140例患者多因素统计分析的预后因素
Table 5 Summary of multivariate analysis of prognostic factors (N=140)
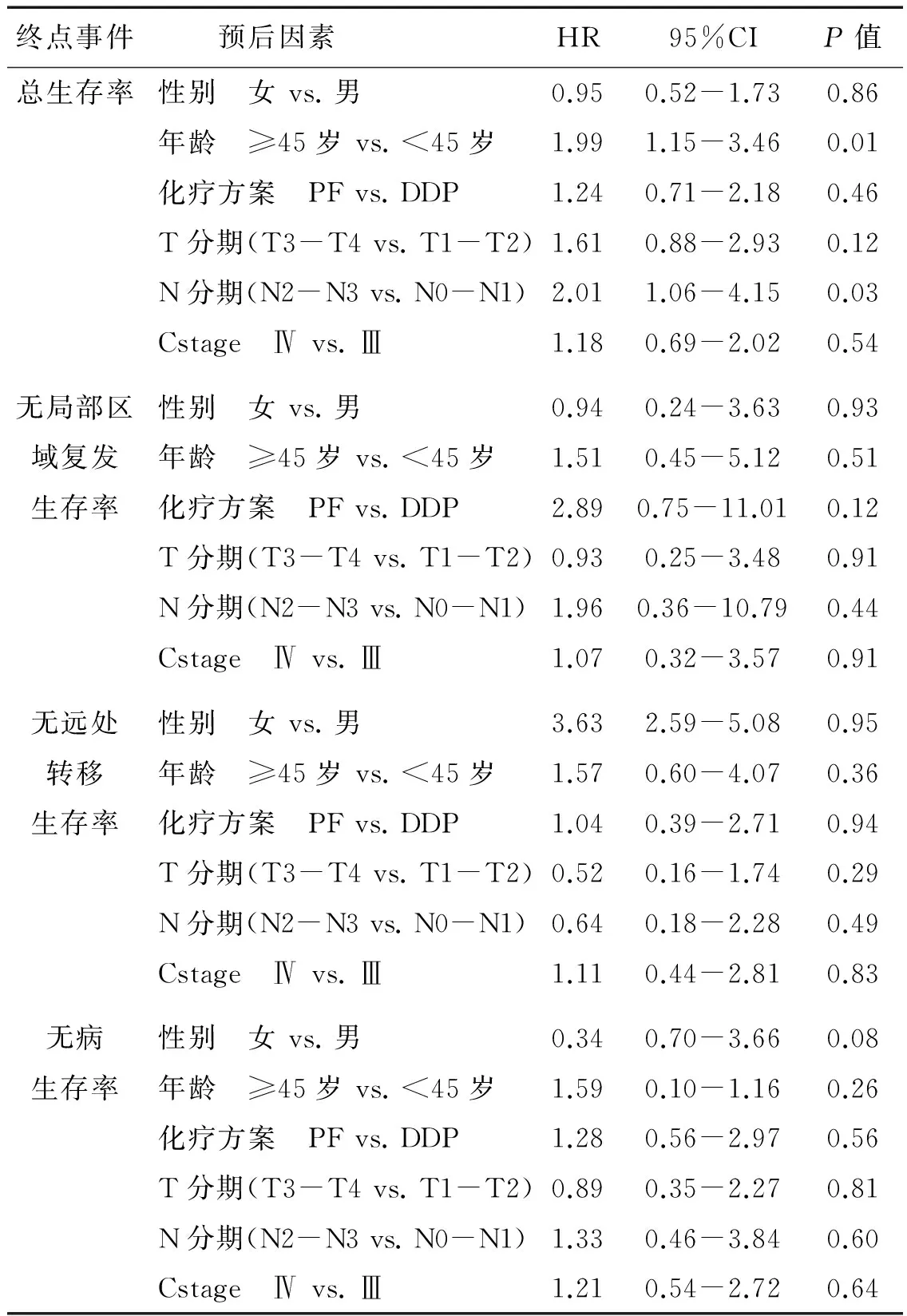
终点事件 预后因素HR95%CIP值总生存率性别 女vs.男0.950.52-1.730.86年龄 ≥45岁vs.<45岁1.991.15-3.460.01化疗方案 PFvs.DDP1.240.71-2.180.46T分期(T3-T4vs.T1-T2)1.610.88-2.930.12N分期(N2-N3vs.N0-N1)2.011.06-4.150.03Cstage Ⅳvs.Ⅲ1.180.69-2.020.54无局部区性别 女vs.男0.940.24-3.630.93域复发年龄 ≥45岁vs.<45岁1.510.45-5.120.51生存率化疗方案 PFvs.DDP2.890.75-11.010.12T分期(T3-T4vs.T1-T2)0.930.25-3.480.91N分期(N2-N3vs.N0-N1)1.960.36-10.790.44Cstage Ⅳvs.Ⅲ1.070.32-3.570.91无远处性别 女vs.男3.632.59-5.080.95转移年龄 ≥45岁vs.<45岁1.570.60-4.070.36生存率化疗方案 PFvs.DDP1.040.39-2.710.94T分期(T3-T4vs.T1-T2)0.520.16-1.740.29N分期(N2-N3vs.N0-N1)0.640.18-2.280.49Cstage Ⅳvs.Ⅲ1.110.44-2.810.83无病性别 女vs.男0.340.70-3.660.08生存率年龄 ≥45岁vs.<45岁1.590.10-1.160.26化疗方案 PFvs.DDP1.280.56-2.970.56T分期(T3-T4vs.T1-T2)0.890.35-2.270.81N分期(N2-N3vs.N0-N1)1.330.46-3.840.60Cstage Ⅳvs.Ⅲ1.210.54-2.720.64
HR:hazard ratio; CI,confidence interval; DDP:顺铂组;PF:顺铂+5-Fu组
3 讨 论
美国0099试验[4]报道局部晚期鼻咽癌同期放化疗联合辅助化疗的Ⅲ期临床试验实验组3年总生存率、无进展生存率分别提高了31%和45%,但Lee[5]及Chow[6]对该试验提出了质疑:(1)试验中的研究对象均来自鼻咽癌低危区的北美,而鼻咽癌的高危地区为东南亚及中国华南地区;(2)病理分型方面,试验中WHO Ⅲ型的患者只有45%,与鼻咽癌高危区的近90%相比相距甚远;(3)单纯放疗组47%的3年总生存率较同类实验[5]的62%偏低。近二十年来,鼻咽癌的高危区的多项研究[3, 7-10]及大宗病例的Meta分析[11-12]均证实了同步放化疗与单纯放疗对比可提高局部晚期鼻咽癌的总生存率,而单药DDP同步放化疗也已经成为了局部晚期鼻咽癌的标准治疗模式[13-15],目前临床同步化疗应用最多的是大剂量每3周疗法[4]及中等剂量每周化疗[8],化疗的急性毒副反应使患者的耐受性及生活质量受到较大影响,且远处转移仍是局部晚期鼻咽癌治疗失败的主要原因[1, 16],因此,越来越多的临床试验开始研究应用非顺铂或顺铂与其他药物联合方案同步放化疗治疗局部中晚期鼻咽癌以提高疗效及减少毒副反应。
黄海欣[17]等对比了奥沙利铂与顺铂同步放化疗治疗局部晚期鼻咽癌的疗效与不良反应,两组化疗均采用每周方案,两组2年无转移生存率、无复发生存率均无显著差异,奥沙利铂组的外周神经毒性虽发生率较高(P<0.05),但血液毒性发生率较低,耐受性较DDP组好;认为奥沙利铂同步放化疗治疗局部晚期鼻咽癌疗效与顺铂相似, 但骨髓抑制及胃肠道反应发生率较低,患者更易耐受。曹卡加等[18]的研究则比较了奈达铂+5-Fu(NF组)和顺铂+5-Fu(PF组)同步放化疗治疗局部晚期鼻咽癌患者的疗效及不良反应,认为奈达铂用于同步化疗治疗局部晚期鼻咽癌患者时耐受性好,不良反应较顺铂少,但该研究并未进一步对比两组的远期疗效。Yau等[19]的研究认为卡铂不能代替顺铂同步化疗治疗局部晚期鼻咽癌。
从以上几个研究报道显示,局部晚期鼻咽癌同步放化疗中使用非顺铂类药物并未显示出明显优于顺铂的结果。因此,我们回顾性分析本院使用单药顺铂及顺铂联合5-Fu同步放化疗治疗局部晚期鼻咽癌的远期疗效及毒性反应,结果示两组在5年总生存率、无局部区域复发生存率、无远处转移生存率及无病生存率上疗效近似,差异无统计学意义(P>0.05),毒副反应方面,两组主要不良反应为白细胞下降、恶心呕吐、口腔黏膜炎,但PF组出现口腔黏膜炎的患者较DDP组多,差异有统计学意义(P<0.05)。孙志华等[20]对比单药DDP与PF方案,结果显示:二组3 年生存率、3年无进展生存率均无显著性差异 (P>0.05);但DDP单药组毒副反应较轻。该研究的结论与我们的结果一致。
Wei等[21]的一项关于多西他赛对比顺铂同步放化疗治疗局部晚期鼻咽癌的临床研究显示,两组均采用每周方案同步化疗,结果在5年总生存率、无进展生存率、无局部区域复发生存率及无远处转移生存率均无显著差异,进一步研究对比显示,相对顺铂累积剂量<200mg/m2的患者,顺铂累积剂量>200mg/m2的患者无局部区域复发生存及无远处转移均有明显获益(P<0.05),此外,在Ou等[22]的一项关于869例鼻咽癌患者远期疗效分析的回顾性研究中,多因素统计分析结果也显示顺铂累积剂量是影响5年总生存及无远处转移生存的独立预后因素。本研究结果中DDP组及PF组5年总生存率为71.7% vs. 64.0%(P=0.62),虽然差异无统计学意义,但PF组较DDP组相差近8%,考虑与DDP组的顺铂累积剂量较PF组中顺铂累积剂量高有关,此外,PF组患者口腔黏膜炎不良反应较DDP组重,导致PF组顺应性相对较差也是原因之一。在本研究中,两组患者因胃肠道及骨髓抑制未能按计划完成化疗的人数相近,而造成PF组未能按计划完成主要原因是口腔黏膜炎,同步化疗周期完成数≥2周期的患者DDP组有52例(74.3%),而PF组仅25例(35.7%),PF组顺应性较差,与两种药物联合方案有关。
此外,本研究的多因素分析提示年龄、N分期是影响5年总生存率的独立预后因素(表4),有多项研究的多因素统计分析结果显示年龄、性别是影响总生存的独立预后因素,且女性鼻咽癌患者比男性鼻咽癌患者具有优势;尤其是在无局部复发转移生存率及无远处转移生存率方面[23-24],Xiao等[25]最新研究以45岁为分水岭,发现<45岁的男性患者更容易出现远处转移,总生存率及无局部复发生存率较其他患者明显降低(P<0.05),而Ou等[22]的研究中多因素统计分析显示,对于局部晚期鼻咽癌,年龄、N分期是影响5年总生存的独立预后因素。
总之,放疗同步顺铂与同步顺铂联合顺铂5-Fu化疗治疗局部晚期鼻咽癌,两种化疗方案在远期疗效对比上无统计学差异,单药顺铂的毒副反应稍轻,但是,在调强放疗时代,本研究纳入的患者均采用常规放疗技术,而且为回顾性分析,纳入样本量较小,只有符合纳入标准的病例被纳入,可能存在一定的选择性偏倚。因此,该结论仍需进一步开展多中心大样本前瞻性随机对照试验。此外,调强放疗已广泛开展,调强放疗模式下同步顺铂与同步顺铂联合5-Fu化疗方案比较仍需进一步研究。
[1] Wang J, Shi M, Hsia Y, et al. Failure patterns and survival in patients with nasopharyngeal carcinoma treated with intensity modulated radiation in Northwest China: a pilot study[J].Radiat Oncol, 2012, 7(1): 2.
[2] Liang ZG, Zhu XD, Tan AH, et al. Induction chemotherapy followed by concurrent chemoradiotherapy versus concurrent chemoradiotherapy with or without adjuvant chemotherapy for locoregionally advanced nasopharyngeal carcinoma: meta-analysis of 1,096 patients from 11 randomized controlled trials[J].Asian Pac J Cancer Prev, 2013,14(1): 515-521.
[3] Lin JC, Jan JS, Hsu CY, et al. Phase Ⅲ study of concurrent chemoradiotherapy versus radiotherapy alone for advanced nasopharyngeal carcinoma: positive effect on overall and progression-free survival[J].Clin Oncol, 2003, 21(4):631-637.
[4] Al-Sarraf M, LeBlanc M,Giri PG, et al.Chemoradiotherapy versus radiotherapy in patients with advanced nasopharyngeal cancer: phase Ⅲ randomized intergroup study 0099[J]. Clin Oncol, 1998, 16(4): 1310-1317.
[5] Lee AW, Lau WH,Tung SY, et al.Preliminary results of a randomized study on therapeutic gain by concurrent chemotherapy for regionally-advanced nasopharyngeal carcinoma: NPC-9901 Trial by the Hong Kong Nasopharyngeal Cancer Study Group[J]. Clin Oncol, 2005, 23(28): 6966-6975.
[6] Chow ED,Payne B,Sullivan O, et al.Radiotherapy alone in patients with advanced nasopharyngeal cancer: comparison with an intergroup study. Is combined modality treatment really necessary? [J].Radiother Oncol, 2002, 63(3):269-274.
[7] Chan AT, Teo PM, Ngan RK., et al. Concurrent chemotherapy-radiotherapy compared with radiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: progression-free survival analysis of a phase Ⅲ randomized trial[J]. Clin Oncol, 2002, 20(8): 2038-2044.
[8] Chan AT, Leung SF, Ngan RK, et al.Overall survival after concurrent cisplatin-radiotherapy compared with radiotherapy alone in locoregionally advanced nasopharyngeal carcinoma[J]. Natl Cancer Inst, 2005,97(7):536-539.
[9] Zhang L, Zhao C , Peng PJ, et al. Phase Ⅲ study comparing standard radiotherapy with or without weekly oxaliplatin in treatment of locoregionally advanced nasopharyngeal carcinoma: preliminary results[J]. Clin Oncol, 2005, 23(33): 8461-8468.
[10]Lin JC, Liang WM, Jan JS, et al. Another way to estimate outcome of advanced nasopharyngeal carcinoma-is concurrent chemoradiotherapy adequate? [J]. Int J Radiat Oncol Biol Phys, 2004, 60(1): 156-164.
[11]Baujat B, Audry H, Bourhis J, et al. Chemotherapy in locally advanced nasopharyngeal carcinoma: an individual patient data meta-analysis of eight randomized trials and 1753 patients[J]. Int J Radiat Oncol Biol Phys, 2006, 64(1): 47-56.
[12]Blanchard P, Lee A, Marguet S, et al. Chemotherapy and radiotherapy in nasopharyngeal carcinoma: an update of the MAC-NPC meta-analysis[J].Lancet Oncol, 2015, 16(6): 645-655.
[13]Chan AT, Teo PM , Leung TW, et al. A prospective randomized study of chemotherapy adjunctive to definitive radiotherapy in advanced nasopharyngeal carcinoma[J].Int J Radiat Oncol Biol Phys, 1995, 33(3): 569-577.
[14]Rossi A, Molinari R, Boracchi P, et al. Adjuvant chemotherapy with vincristine, cyclophosphamide, and doxorubicin after radiotherapy in local-regional nasopharyngeal cancer: results of a 4-year multicenter randomized study[J]. Clin Oncol, 1988, 6(9): 1401-1410.
[15]Chua DT, Sham JS, Choy D, et al. Preliminary report of the Asian-Oceanian Clinical Oncology Association randomized trial comparing cisplatin and epirubicin followed by radiotherapy versus radiotherapy alone in the treatment of patients with locoregionally advanced nasopharyngeal carcinoma. Asian-Oceanian Clinical Oncology Association Nasopharynx Cancer Study Group[J].Cancer, 1998, 83(11): 2270-2283.
[16]Huang PY, Zeng Q, Cao K.J, et al. Ten-year outcomes of a randomised trial for locoregionally advanced nasopharyngeal carcinoma: A single-institution experience from an endemic area[J].Eur J Cancer, 2015, 51(13): 1760-1770.
[17]黄海欣,黄东宁,陈绍俊,等.每周奥沙利铂或顺铂同期放化疗治疗局部晚期鼻咽癌的随机对照研究[J]. 徐州医学院学报,2009, 29(6):366-368.
[18]曹卡加,张爱兰,马文娟,等.奈达铂或顺铂联合5-氟尿嘧啶治疗鼻咽癌的随机对照研究[J].中华肿瘤杂志,2011,33(1):50-52.
[19]Yau TK, Lee AW, Wong DH , et al. Treatment of Stage Ⅳ(A-B) nasopharyngeal carcinoma by induction-concurrent chemoradiotherapy and accelerated fractionation: impact of chemotherapy schemes.[J].Int J Radiat Oncol Biol Phys, 2006, 66(4): 1004-1010.
[20]孙志华,李振宇,陈叶珊,等.局部晚期鼻咽癌放疗同步PF方案或顺铂单药的临床对照研究[J]. 临床肿瘤学杂志,2012,17 (3):229-232.
[21]Wei W, Huang Z, Li S, et al. Pretreatment Epstein-Barr virus DNA load and cumulative cisplatin dose intensity affect long-term outcome of nasopharyngeal carcinoma treated with concurrent chemotherapy: experience of an institute in an endemic area[J]. Oncol Res Treat, 2014, 37(3):88-95.
[22]Ou X, Zhou X, Shi Q, et al. Treatment outcomes and late toxicities of 869 patients with nasopharyngeal carcinoma treated with definitive intensity modulated radiation therapy: new insight into the value of total dose of cisplatin and radiation boost[J]. Oncotarget, 2015, 6(35):38381-38397.
[23]Yeh SA, Tang Y, Lui CC, et al. Treatment outcomes and late complications of 849 patients with nasopharyngeal carcinoma treated with radiotherapy alone[J].Int J Radiat Oncol Biol Phys, 2005, 62(3): 672-679.
[24]Muller CP, Treiber D, Steinke B, et al. Enhanced antigenicity of autologous leukemia cells enriched with cholesterylhemisuccinate[J].Anticancer Res, 1991, 11(2): 925-930.
[25]Xiao G, Cao Y, Qiu X, et al. Influence of gender and age on the survival of patients with nasopharyngeal carcinoma[J].BMC Cancer, 2013, 13(19): 226.
Comparision of Effectiveness and Toxicity of Different Chemotherapy Regimens Combined with Radiotherapy for Locoregionally Advanced Nasopharyngeal Carcinoma
Huang Li1,2, Liang Zhongguo1, Zeng Fanyan1, et al
(1.DepartmentofRadiationOncology,TheAffiliatedTumorHospitalofGuangxiMedicalUniversity,Nanning530021,Guangxi,China; 2.GuangxiMedicalUniversityGraduateSchool,Nanning530021,Guangxi,China)
Objective: To compare the efficacy and toxicity of different concurrent chemoradiotherapy with cisplatin or cisplatin plus fluorouracil regimen in patients with locoregionally advanced nasopharyngeal carcinoma. Methods: A total of 140 patients with locoregionally advanced NPC (classified as stage Ⅲ~Ⅳb) in our institution between January 2005 and December 2011 were included in this study. The patients were treated with concurrent chemoradiotherapy with cisplatin(DDP group,n=70) or cisplatin plus fluorouracil(PF group,n=70). All patients were treated by definitive-intent radiation therapy. Patients in DDP group received concurrent cisplatin (80~100mg/m2iv d1~d3) every 3 weeks for 1~3 cycles, patients in PF group received cisplatin (80mg/m2iv d1~d3) plus fluorouracil (750 mg/m2·d-1iv 96h) every 3 weeks for 1~3 cycles. Treatment efficacy and toxicity reaction were compared. Results: After a median follow-up time of 55 months,the 5-year overall survival rates(OS)was 71.7% in DDP group,and 64.0% in PF group (P=0.62). The locoregional relapse-free survival rates (LRFS)was 91.8% in DDP group,and 85.7% in PF group (P=0.13). The distant metastasis-free survival rates(DMFS)was 86.7% in DDP group,and 85.2% in PF group (P=0.95),while the disease free survival rates (DFS)of DDP group was 80.6%,compared with 78.8% of PF group (P=0.65). In multivariate analysis, age and N stage were independent prognosis factors of 5-year OS (hazard ratio,1.99;95% CI,1.15~3.46;P=0.01),(hazard ratio,2.01;95% CI,1.06~4.15;P=0.03).The main toxicities were oral mucositis,nausea /vomiting and leucopenia, The incidence of oral mucositis in PF group was significantly higher than that in DDP group (P<0.05) . Compliance of the DDP group was better than the PF group, In the DDP group, 52(74.3%) patients completed 2 or more cycles of concurrent chemotherapy compares to the 25(35.7%) in the PF group. Conclusion: The efficacy of DDP and PF concurrent chemoradiotherapy regimens are found similar in patients with locoregionally advanced NPC. In addition , both regimens have acceptable toxicity reactions except relatively higher incidence of oral mucositis in PF group.
Locally Advanced Nasopharyngeal Carcinoma; Concurrent Chemoradiotherapy; Cisplatin; Fluorouracil; Toxicity Reaction
2016- 01- 05
2016- 02- 15
黄 丽(1985-),女,江西南昌人,在读硕士研究生,主要从事肿瘤放射治疗工作。
△朱小东,教授,Email:zhuxdonggxmu@126.com
R739.63;R730.55;R730.53
A
10.3969/j.issn.1674- 0904.2016.01.005
