检测硝基苯的类石墨氮化碳修饰电化学传感器研究
2016-02-23黄素珍康天放鲁理平
黄素珍,康天放,鲁理平
(北京工业大学 区域大气复合污染防治北京市重点实验室,环境与能源工程学院,北京 100124)
检测硝基苯的类石墨氮化碳修饰电化学传感器研究
黄素珍,康天放*,鲁理平
(北京工业大学区域大气复合污染防治北京市重点实验室,环境与能源工程学院,北京100124)
摘要:以三聚氰胺为原料,利用热缩聚法制备了类石墨氮化碳(g-C3N4),并采用X射线衍射(XRD)、扫描电镜(SEM )、红外光谱等方法对其进行表征。然后将g-C3N4超声分散于Nafion溶液中,将所得悬浊液修饰到玻碳电极上,制备用于检测硝基苯的电化学传感器(g-C3N4/Nafion/GCE)。采用循环伏安法、方波伏安法研究了硝基苯在该电极上的电化学行为。在优化实验条件下,硝基苯在该电极上的方波伏安还原峰电流与其浓度在4.0×10-6~6.0×10-4mol/L范围内呈良好的线性关系,相关系数(r)为0.999 8,检出限为4.0×10-7mol/L。按照国家标准方法对实际水样进行检测,未检测出硝基苯。配制两个浓度水平硝基苯的模拟水样进行加标回收实验,其回收率分别为102.1%和99.9%。用气相色谱法做对照实验,结果表明本方法与气相色谱法的测定结果无显著性差异。
关键词:氮化碳;硝基苯;方波伏安法;电化学传感器
硝基苯是有机合成的重要原料,被广泛应用于香料、染料、塑料、炸药等的合成[1],具有较强的生物毒性和稳定性,不仅会造成严重的水体污染,而且对人类健康构成威胁。近年来,低浓度硝基苯的检测方法研究引起了广泛关注。常用的方法有荧光法、气相色谱法、高效液相色谱法、荧光猝灭法等。以上方法通常需对样品进行复杂的前处理,而电化学传感器法具有操作简单、成本低、灵敏度高、选择性好等优点,已有一些关于检测硝基苯的电化学传感器的文献报道[2],例如,碳纳米管修饰石墨电极[3]、铋膜修饰碳糊电极[4]、介孔碳修饰玻碳电极[5]、Pt纳米颗粒与多孔碳复合材料修饰电极[6]、有序介孔碳/双十二烷基二甲基溴化铵修饰电极[7]、氮掺杂介孔碳修饰电极[8]等。所以,采用新材料构建检测硝基苯的高灵敏电化学传感器具有重要意义。
类石墨氮化碳(g-C3N4)具有类似石墨的片层结构,由于其结构中碳氮之间存在很强的共价键,所以g-C3N4的化学性质稳定,具有耐热、耐酸碱腐蚀的特性。g-C3N4具有较窄的半导体禁带宽度,目前已被广泛应用于光催化[9-11]及电化学发光领域[12-13],例如,g-C3N4及其复合物作为光催化材料用于染料的降解[14]和水的分解制氢[15],以及作为光敏材料被用于太阳能的转换[16]等。
类石墨氮化碳在电分析化学领域应用较少,Zhang等[17]利用类石墨氮化物掺杂氧化石墨烯同时测定了抗坏血酸、多巴胺和尿素;唐跃等[18]利用类石墨氮化碳检测了重金属Cd(Ⅱ)离子。本文将g-C3N4超声分散于Nafion溶液中,所得悬浊液修饰到玻碳电极上,制备了检测硝基苯的电化学传感器。
1实验部分
1.1仪器与试剂
CHI 842b 电化学工作站(上海辰华仪器有限公司);P-2A 型金相试样抛光机(上海日用电机厂);KQ218 型超声波清洗仪(昆山市超声仪器有限公司);BS124S型电子天平(赛多利斯科学仪器有限公司);PHS-3C 型精密pH计(上海雷磁仪器厂);DHG-9070A 型电热恒温鼓风干燥箱(上海-恒科学仪器有限公司);三电极系统:玻碳电极(d=3 mm)为工作电极;饱和甘汞电极为参比电极;铂片电极为辅助电极。D8 ADVANCE型X射线衍射仪(德国Bruker公司);SU-8010型扫描电镜仪(日本日立公司);IR Prestige-21型红外光谱仪(日本岛津公司);三聚氰胺(天津市光复精细化工研究所,99.5%);硝基苯(分析纯,天津市福晨化学试剂厂);Nafion(5%,乙醇溶液,Sigma公司),其它试剂均为分析纯,实验用水为超纯水(Milli-Q Advantage A10超纯水系统制备,法国Millipore公司)。
1.2氮化碳的制备
采用热缩聚法[16],以三聚氰胺为原料制备氮化碳。称取5.00 g三聚氰胺粉末于陶瓷坩埚中,加盖,置于马弗炉中,在无保护气的条件下于550 ℃煅烧4 h,冷却至室温,得到淡黄色的g-C3N4固体,研磨,待用。
1.3工作电极的制备
将玻碳电极用0.5 μm氧化铝粉末抛光成镜面,依次用无水乙醇和水超声洗涤5 min,N2吹干。取1.6 mg g-C3N4置于小烧杯中,加入4 mL 1.0%的Nafion溶液(乙醇稀释),超声分散2 h,得到g-C3N4/Nafion悬浮液。然后用移液枪取6.0 μL悬浮液滴于破碳电极(GCE)表面,自然晾干,得到修饰电极g-C3N4/Nafion/GCE。
1.4实验方法
移取10 mL磷酸盐缓冲溶液于25 mL电解池中,插入三电极,通入高纯N210 min,除去溶液中的溶解氧,氮气氛保护,在+0.4~-1.2 V(vs.SEC)电位范围进行循环伏安或方波伏安电位扫描(频率:15 Hz;振幅0.025 V),记录峰电流。
2结果与讨论
2.1g-C3N4的表征
图1A为g-C3N4的红外吸收光谱图,3 200 cm-1处的宽吸收峰对应于N—H 的伸缩振动,在1 240~1 643 cm-1范围内出现的吸收峰对应C—N杂环化合物的结构特征峰;810 cm-1处对应三嗪结构的特征峰( s-三嗪环的面外弯曲振动 )。图1B为g-C3N4/Nafion/GCE的扫描电镜图(SEM),图中显示g-C3N4与Nafion的悬浊液较均匀地分散在玻碳电极上,g-C3N4呈片层状结构。 图1C为g-C3N4的X射线能谱图(EDAX),C∶N ≈ 3∶4(原子数量比)。图1D 为g-C3N4的X射线衍射谱图(XRD),在 27.5°最强衍射峰是g-C3N4片层堆积结构(002)晶面的特征峰,由布拉格方程2dsinθ=nλ(λ=0.154 nm,n=2)可得其对应层间距为 0.334 nm;13.1°衍射峰对应3-s-三嗪结构的特征峰[19],对应平面内氮孔间距为 0.679 nm。因此可证实所制得的产物为 g-C3N4。
2.2硝基苯在g-C3N4/Nafion/GCE上的电化学行为
将g-C3N4/Nafion/GCE修饰电极浸入含有1.00×10-4mol/L 硝基苯的0.1 mol/L磷酸盐缓冲溶液(PBS)中,开路富集30 s,于+0.4 V~-1.2 V范围内循环伏安扫描2圈。图2A为g-C3N4/Nafion/GCE修饰电极在硝基苯溶液中的循环伏安扫描图,在第1圈阴极扫描过程中(从+0.4 V到-1.2 V),硝基苯在-0.78 V处出现1个不可逆还原峰Ⅰ,这是硝基苯被还原成苯胲(C6H5NHOH)所产生,回扫时在-0.1 V处出现了1个氧化峰Ⅱ,这是由于苯胲被氧化为亚硝基苯(C5H6NO)所产生;进行第2圈扫描时在-0.2 V处又出现1个新的还原峰Ⅲ,这是亚硝基苯被还原为苯胲所产生,其中峰Ⅱ和峰Ⅲ是1对准可逆峰,且峰Ⅲ在第2圈扫描才会出现。其机理如下[20]:
(1)
-NHOH↔-NO+2H++2e
(2)
为进一步证明g-C3N4/Nafion/GCE电极对硝基苯的电催化特性,在含有1.0×10-4mol/L硝基苯的0.1 mol/L PBS(pH 7.2)中,分别以裸玻碳电极(GCE)和Nafion溶液修饰电极(Nafion/GCE)为工作电极循环伏安扫描1圈,结果如图2B所示。与裸玻碳电极(GCE)产生的还原峰a和Nafion修饰的玻碳电极(Nafion/GCE)产生的还原峰b相比,氮化碳修饰电极(g-C3N4/Nafion/GCE)产生的还原峰c的电流信号明显增大,说明g-C3N4/Nafion/GCE修饰电极对硝基苯有较好的吸附和电催化作用。这是由于g-C3N4含氮量较高,其中N原子作为电子供体与C原子形成大π键,从而提高了其稳定性、电子传递速率和催化活性[21]。
采用方波伏安法对硝基苯进行检测,图3曲线a为g-C3N4/Nafion/GCE电极在0.1 mol/L PBS(pH 7.2)中的方波伏安曲线,图3曲线b为g-C3N4/Nafion/GCE电极在含有1.0×10-4mol/L硝基苯的0.1 mol/L PBS(pH 7.2)中的方波伏安曲线。由图可见,硝基苯在g-C3N4/Nafion/GCE电极上可产生灵敏的还原峰电流。
2.3实验条件的优化
氮化碳(g-C3N4)浓度对硝基苯测定有非常重要的影响。配制浓度为0.2,0.4,0.6,0.8,1.0 mg/mL 的g-C3N4/Nafion溶液,分别吸取等体积的g-C3N4/Nafion溶液制备一系列电极,考察了用不同浓度氮化碳制备的修饰电极对1.0×10-4mol/L硝基苯还原峰电流的影响(图4A)。当g-C3N4/Nafion溶液的浓度为0.4 mg/mL时,硝基苯的方波伏安峰电流响应最大,随着g-C3N4/Nafion溶液浓度的增大,峰电流反而减小。对g-C3N4/Nafion溶液的体积进行了优化,分别吸取2.0,4.0,6.0,8.0,10.0,12.0 μL的g-C3N4/Nafion溶液制备一系列电极,用修饰电极在1.00×10-4mol/L 硝基苯溶液中进行方波伏安扫描,结果显示,当g-C3N4/Nafion溶液用量为6.0 μL 时,硝基苯的还原峰电流最大(图4B)。这可归因于高浓度的g-C3N4/Nafion溶液中粒子之间更易团聚,而大体积的用量则增加了修饰电极修饰层的厚度,这两种情况都增大了电化学反应过程中电子转移的阻力,而g-C3N4/Nafion溶液浓度太小或用量太少时不能充分发挥其吸附富集性能,所以溶出峰电流不大。因此,本研究选择浓度为0.4 mg/L,用量为6.0 μL的g-C3N4/Nafion溶液制备电极,即:每支电极修饰2.4 ng g-C3N4。
溶液pH值对硝基苯的吸附过程有很大影响。本文采用0.1 mol/L NaOH 和HCl对磷酸盐缓冲溶液的pH值进行调节,考察了pH 4.0~10.0范围内,于1.0×10-4mol/L硝基苯溶液中开路富集30 s后,g-C3N4/Nafion/GCE电极的峰电流响应情况。如图4C所示,pH 7.2条件下修饰电极对硝基苯的吸附情况最好,溶出峰电流最大。因此本文采用pH 7.2的磷酸盐缓冲溶液为电解质溶液。
富集时间直接影响吸附过程中修饰电极上硝基苯的富集量,进而影响峰电流值。研究了富集时间分别为5,10,20,30,40,50 s 时对1.0×10-4mol/L硝基苯的还原峰电流的影响。如图4D所示,在前30 s,硝基苯的方波伏安峰电流随着富集时间的增加而快速增大,当富集时间超过30 s后,峰电流变化不大,说明30 s后硝基苯在g-C3N4/Nafion上的吸附逐渐趋于饱和。因此,实验选用30 s作为最佳富集时间。
2.4工作曲线
在优化条件下,g-C3N4/Nafion/GCE在含有不同浓度硝基苯的电解质溶液中富集后的方波溶出伏安图如图5所示。随着硝基苯浓度的增大,响应电流相应增大,且硝基苯的不可逆还原峰电流值与其浓度(c,μmol/L)在4.0×10-6~6.0×10-4mol/L范围内呈良好的线性关系,回归方程为Ip(μA)=0.090 94c+0.080 6,相关系数(r)为0.999 8,根据信噪比(S/N)为3确定检出限为4.0×10-7mol/L。
2.5电极的重现性与稳定性
将7根g-C3N4/Nafion/GCE电极在含有1.0×10-4mol/L硝基苯的0.1 mol/L PBS溶液中富集30 s后,记录方波伏安曲线,峰电流的相对标准偏差(RSD)为3.6%。电极在不使用时存放于4 ℃冰箱,7 d后再次测定,响应电流为最初响应电流的85%以上。这表明,该方法制备的传感器具有良好的重现性和稳定性。
2.6干扰实验
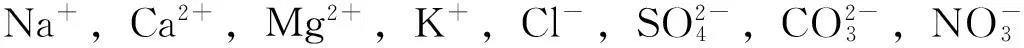
2.7实际水样的检测
实际水样于2015年6月20日采自北京市门城湖,过滤去除水样中的悬浮物质,然后按照本实验方法和国家标准方法对实际水样进行检测。由于实际水样中硝基苯的浓度过低,未能检测其浓度,配制模拟水样,做2个浓度水平的加标回收实验,得其回收率分别为102.1%和99.9%,说明此方法可用于实际样品中硝基苯的测定。同时用气相色谱法做对照实验(表1),实验结果表明,本方法的测定结果与气相色谱法的测定结果之间无显著性差异。

表1 实际水样中硝基苯的测定(n=3)
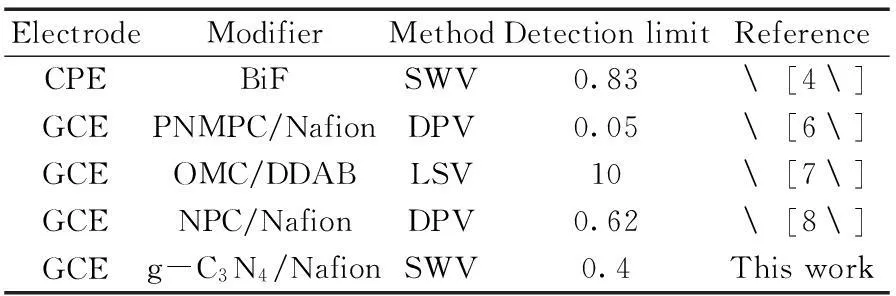
表2 本方法与其他测定硝基苯方法的比较*
*PNMPC:composites of Pt nanoparticles and macroporous carbon(Pt
纳米颗粒与多孔碳的复合材料);OMC:ordered mesoporous carbon(有
序介孔碳); DDAB: didodecyldimethylammonium bromide(双十二烷基二
甲基溴化铵); NPC:nitrogen-doped porous carbon(氮掺杂多孔碳)
2.8与其他方法的比较
用本文提出的方法与文献报道的检测硝基苯的电化学传感器法进行比较,从表2可以看出,与合成铋膜[4]、有序介孔碳[7]、氮掺杂介孔碳[8]修饰电极相比,本文提出的传感器对硝基苯具有更低的检出限,而且本文的电极修饰物质由三聚氰胺热聚法直接合成,制备方法简单,所用材料经济。
3结论
本文基于合成g-C3N4制备了用于硝基苯检测的电化学传感器。由于g-C3N4优异的物理化学性质,此传感器对硝基苯表现出良好的吸附富集作用。结果表明,硝基苯的不可逆还原峰电流值与其浓度在4.0×10-6~6.0×10-4mol/L范围内呈良好的线性关系,检出限为4.0×10-7mol/L。与检测硝基苯的同类方法相比,该传感器制备和检测方法简单,选择性与重现性优异,稳定性好,成本低,电极使用寿命较长,可用于硝基苯的快速检测。
参考文献:
[1]Zhao L,Ma J,Sun Z Z.Appl.Catal.B,2008,79:244-253.
[2]Wang J.Electroanalysis,2007,19:415-423.
[3]Li Y P,Cao H B,Liu C M,Zhang Y.J.Hazard.Mater.,2007,148:158-163.
[4]Luo L Q,Wang X,Ding Y P,Li Q X,Jia J B,Deng D M.Anal.Methods,2010,2:1095-1100.
[5]Ma J Y,Zhang Y S,Zhang X H,Zhu G B,Liu B,Chen J H.Talanta,2012,88:696- 700.
[6]Zhang Y F,Zeng L J,Bo X J,Wang H,Guo L P.Anal.Chim.Acta,2012,752:45- 52.
[7]Qi B,Lin F Y,Bai J,Liu L,Guo L P.Mater.Lett.,2008,62:3670-3672.
[8]Yan L J,Bo X J,Zhang Y F,Guo L P.Electrochim.Acta,2014,137:693-699.
[9]Wang X,Chen X,Thomas A,Fu X Z,Antonietti M.Adv.Mater.,2009,21:1609-1612.
[10]Wang H,Yuan X Z,Wu Y,Zeng G M,Chen X H,Leng L J,Li H.Appl.Catal.B,2015,174:445-454.
[11]Wang Y,Zhang J,Wang X,Antonietti M,Li H R.Angew.Chem.Int.Ed.,2010,49:3356-3359.
[12]Liu Y T,Wang Q B,Lei J P,Hao Q,Wang W,Ju H X.Talanta,2014,122:130-134.
[13]Cheng C M,Huang Y,Tian X Q,Zheng B Z,Li Y,Yuan H Y,Xiao D,Xie S P,Martin M,Choi F.Anal.Chem.,2012,84:4754-4759.
[14]Yan S,Li C,Zou Z G.Langmuir,2010,26:3894-3901.
[15]Yan H J,Huang Y.Chem.Commun.,2011,47:4168-4170.
[16]Zhang Y J,Mori T,Ye J H.Antonietti M.J.Am.Chem.Soc.,2010,132:6294-6295.
[17]Zhang H Q,Huang Q T,Huang Y H,Lia F M,Zhang W X,Wei C,Chen J H,Dai P W,Huang L Z,Huang Z Y,Kang L P,Hu S R,Hao A Y.Electrochim.Acta,2014,142:125-131.
[18]Tang Y,Zhang W D.J.Instrum.Anal.(唐跃,张伟德.分析测试学报),2013,32(12):1143-1147.
[19]Yan S C,Li Z S,Zou Z G.Langmuir,2009,25:10397-10401.
[20]Singh S,Devi P,Singh D D,Jain V S,Singla M L.GoldBull,2012,45:75-81.
[21]Zhang Y F,Bo X J,Nsabimana A,Luhana C,Wang G,Wang H,Mian L.Guo L P.Biosens.Bioelectron.,2014,53:250-256.
Study on Graphitic Carbon Nitride Modified Electrochemical Sensors for Determination of NitrobenzeneHUANG Su-zhen,KANG Tian-fang*,LU Li-ping
(College of Environmental and Energy Engineering,Key Laboratory of Beijing on Regional Air Pollution Control,
Beijing University of Technology,Beijing100124,China)
Abstract:In this study,graphitic carbon nitride(g-C3N4) was synthesized by thermal condensation with melamine,and characterized by X-ray diffraction(XRD),scanning electron microscopy(SEM) and infrared spectroscopy.Graphitic carbon nitride was dispersed in Nafion solution by ultrasound to prepare suspension liquid which was modified onto the surface of a glassy carbon electrode(GCE) to prepare an electrochemical sensor(g-C3N4/ Nafion /GCE) for nitrobenzene.The voltammetric behaviours of nitrobenzene at the g-C3N4/ Nafion /GCE were studied by cyclic voltammetry and square-wave voltammetry(SWV).Under the optimal conditions,the cathodic peak current of nitrobenzene showed a highly linear increase with nitrobenzene concentrations over the range of 4.0×10-6-6.0×10-4mol/L with a correlation coefficient(r) of 0.999 8.The detection limit was 4.0×10-7mol/L.The concentration values in real water samples were determined by the national standard method.No SWV response corresponding to nitrobenzene was observed when the real water samples were analysed.Simulated water samples therefore were prepared,and standard-additions method was adopted to estimate the recorvery.The recoveries at two spiked concentration levels were 102.1%and 99.9%,respectively.No obvious differences were found between the proposed method and the gas chromatographic method.
Key words:carbon nitride;nitrobenzene;square-wave voltammetry;electrochemical sensor
中图分类号:O657.1;O625.11
文献标识码:A
文章编号:1004-4957(2016)01-0048-06
doi:10.3969/j.issn.1004-4957.2016.01.008
通讯作者:*康天放,博士,教授,研究方向:化学与生物传感技术及化学污染物快速检测应用,Tel:010-67391659,E-mail:kangtf@bjut.edu.cn,kangtf@sina.cn
基金项目:北京市自然科学基金重点项目(B类)(KZ201110005006);教育部博士点基金资助项目(20131103110011)
收稿日期:2015-06-25;修回日期:2015-07-22
