梁氏异蝎毒素促进KYSE-510细胞凋亡的作用机制研究
2016-02-16王娟李秦晋符文卉魏宝阳王智
王娟, 李秦晋, 符文卉, 魏宝阳, 王智*
(1. 湖南农业大学生物科学技术学院,长沙410128; 2. 湖南体育职业学院,长沙410019)
梁氏异蝎毒素促进KYSE-510细胞凋亡的作用机制研究
王娟1#, 李秦晋1, 2#, 符文卉1, 魏宝阳1, 王智1*
(1. 湖南农业大学生物科学技术学院,长沙410128; 2. 湖南体育职业学院,长沙410019)
为了研究蝎毒抑制肿瘤细胞生长的机理,提取梁氏异蝎Heterometrusliangi蝎毒干预人食管癌细胞(KYSE-510细胞),运用流式细胞术、电镜技术、逆转录PCR和Western blot方法分别检测蝎毒对KYSE-510细胞凋亡的影响以及对caspase-3基因表达。结果表明:经蝎毒处理的实验组KYSE-510活细胞数量显著减少,其原因是蝎毒引起细胞大量凋亡和坏死。经不同浓度(50 μg·mL-1,100 μg·mL-1,200 μg·mL-1)蝎毒处理的KYSE-510细胞与对照组的caspase-3基因在mRNA水平表达相近,而在蛋白表达水平上,实验组细胞与对照组细胞相比,蝎毒促进了caspase-3的剪切活化,且以200 μg·mL-1蝎毒处理的KYSE-510细胞caspase-3的剪切活化最强,由此证明蝎毒导致KYSE-510细胞凋亡的机理之一可能是其促进了caspase-3的剪切活化。
梁氏异蝎毒素;KYSE-510细胞;caspase-3;基因表达
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用(Krajewskaetal.,1997,Stefanakietal.,1998;许世伟等,2014),其中caspase-3为关键的执行分子,它在凋亡信号传导的许多途径中发挥作用。作为细胞凋亡的调控因子,caspase-3可能在癌的发生发展过程中起重要作用(Liuetal.,1996;Qietal.,2002)。蝎毒作为一种动物毒素,对肿瘤细胞有直接杀伤作用,能有效导致癌细胞的凋亡(贾莉等,2001),对肝癌、肺癌等有确切的疗效(孙立东等,1996;杨春旭等,2002,2005;王兆朋等,2006a),对一些移植性动物肿瘤也有显著的抑制和预防作用(李桂生等,2004)。不同的学者应用不同的方法证明了蝎毒广泛的抗肿瘤活性(董伟华等,1999;孔天翰等,2004;付士波,2005;杨春旭等,2005;王兆朋等,2006b;朱灵等,2008),并且其在抗肿瘤的同时具有明显的增强机体免疫力的作用(张维东等,2007),与放疗药和化疗合用可降低放疗和化疗的毒副作用,具有成为新型抗癌药的良好前景(Krajewskaetal.,1997;杨志华等,2000;王兆朋等,2006a,2006b;许世伟等,2014)。
已有统计数据表明,食道癌的发生率占所有恶性肿瘤的2%(Parkinetal.,1999;Enzinger & Mayer,2003)。全世界每年约有22万人死于食道癌,我国是食道癌高发区,因食道癌死亡者仅次于胃癌,居第二位。因此,本实验以人食管癌KYSE-510细胞为代表,以梁氏异蝎Heterometrusliangi为材料提取蝎毒,运用电镜以及流式细胞仪检测,采用逆转录PCR(RT-PCR)和Western blot方法分别检测蝎毒对KYSE-510细胞caspase-3基因的mRNA和蛋白表达,分别在mRNA和蛋白水平上研究了蝎毒对KYSE-510细胞中caspase-3基因表达的影响,以揭示蝎毒抗肿瘤的分子机理。
1 材料与方法
1.1 细胞株
KYSE-510细胞株由中南大学湘雅二医院遗传学国家重点实验室提供。
1.2 培养基
RPMI1640培养基购自美国GIBCO公司。
1.3 蝎毒制备
蝎毒(提取自梁氏异蝎):用电激法取毒液,溶于磷酸盐缓冲液中,离心去不溶物质,然后在RPMI1640培养基中溶解,分别配制成50 μg·mL-1、100 μg·mL-1、200 μg·mL-1,-20 ℃保存备用。
1.4 主要试剂
新生牛血清、牛血清蛋白、Triton X-100(聚乙二醇辛基苯基醚)、RT-PCR通用试剂盒(美国PROMEGA公司)、TRIZOL Reagent(美国GIBCO公司)、DEPC(德国GREINER公司)、PVDF膜(美国MILLIPORE公司),羊抗小鼠抗体 #05-665(美国MERK MILLIPORE公司),PCR引物由上海生工生物工程技术服务有限公司合成,其他试剂均为国产分析纯。
1.5 实验方法
1.5.1 流式细胞仪检测细胞凋亡——Annexin V/PI双染色法 悬浮细胞直接收集到10 mL的离心管中,用孵育缓冲液洗涤1次,500~1 000 r·min-1离心5 min。用100 μL的标记溶液重悬细胞,室温下避光孵育10~15 min,500~1 000 r·min-1离心5 min沉淀细胞孵育缓冲液洗1次,加入荧光(SA-FLOUS)溶液,4 ℃下孵育20 min,避光并不时振动,用流式细胞仪分析,然后判断结果:凋亡细胞对所有用于细胞活性鉴定的染料如PI有抗染性,坏死细胞则不能。
1.5.2 电镜标本的制备 扫描电镜以及透射电镜实验标本均分为对照组和实验组。实验组加含最终浓度为100 μg·mL-1的蝎毒处理,不加毒素的为对照组,培养24 h后常规扫描电镜和透射电镜制样。
1.5.3 RT-PCR方法检测caspase-3基因的mRNA表达水平 引物设计:内参GAPDH扩增的片段长度为443 bp,引物序列为:
Upper Primer1: 5’-TCCCTCAAGATTGTCAGCAA-3’, Lower Primer2: 5’-AGATCCACAACGGATACATT-3’。
根据GenBank提供的序列,设计用于扩增caspase-3基因引物,扩增的片段长度为250 bp,引物序列为:
Upper Primer1: 5’-CTCTCAACGACAGCAGCCCG-3’, Lower Primer2: 5’-AGGTGATCCAGACTCTGACC-3’。
凝胶图像分析:用电泳图像分析仪的分析软件系统进行琼脂糖凝胶的扫描和扩增条带光密度分析。
1.5.4 Western blot方法检测caspase-3基因的蛋白表达 用10%分离胶,4%的浓缩胶灌胶,电泳至溴酚兰刚跑出即可终止电泳,转膜,转完后将膜用1×丽春红染液染5 min,然后用水冲洗掉多余染液并将膜晾干准备免疫反应,通过显影和定影完成凝胶图像分析。
2 结果与分析
2.1 流式细胞仪检测结果
Annexin V/PI双染色法后,用50 μg·mL-1和100 μg·mL-1蝎毒处理KYSE-510细胞,48 h内观察到细胞凋亡的产生。从图1可知,活细胞的减少与蝎毒浓度是密切相关的,随着蝎毒浓度的增加,活细胞的数量显著减少:从98.68%减少到42.58%再到38.28%。细胞凋亡数(包括损伤和凋亡)从0.93%增加到47.97%再到49.49%,细胞坏死率从0.40%到9.46%再到12.22%。结果表明,该蝎毒能有效促进KYSE-510细胞的凋亡和坏死。
2.2 电镜检测结果
对照组的细胞(图2:A,B)在扫描电镜下生长活跃,细胞之间紧密相连。正常的KYSE-510细胞是一个中间有突起的不规则多边形,它的游动靠其表面延伸到周围环境的微绒毛。经蝎毒处理24 h,实验组(图2:C,D)的KYSE-510细胞在扫描电镜下的形态学特征表现为细胞凋亡的出现:细胞表面粗糙,细胞膜出现皱缩甚至部分出现穿孔。
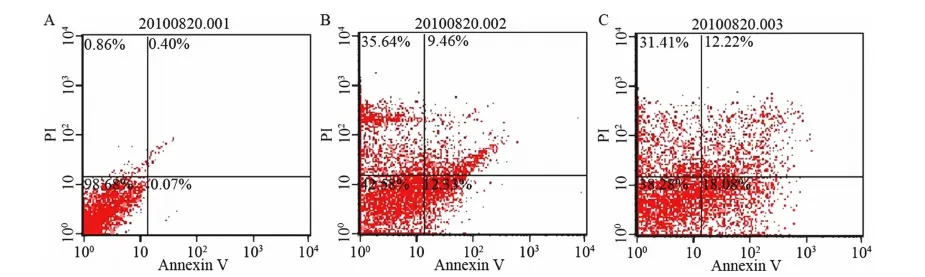
图1 50 μg·mL-1以及100 μg·mL-1蝎毒处理(48 h)KYSE-510细胞密度坐标(百分含量)
Fig. 1 Density plots showing the percentage distribution of KYSE-510 control and 50 μg·mL-1and 100 μg·mL-1scorpion venom treated cells
A. 对照组, B. 50 μg·mL-1蝎毒处理组, C. 100 μg·mL-1蝎毒处理组; 左上方: 损伤细胞, 右上方: 晚期凋亡细胞或者坏死细胞, 左下方: 活细胞, 右下方: 早期凋亡细胞。A. Control group, B. Scorpion venom-treated group (50 μg·mL-1), C. Scorpion venom-treated group (100 μg·mL-1); upper left: injured cell, upper right: non-viable apoptotic cell or non-viable non-apoptotic cell, bottom left: living cell, bottom right: viable apoptotic cell.

图2 扫描电镜下的形态学观察Fig. 2 Morphological observations using scanning electron microscopy
A. 对照组细胞 (×2 000), B. 100 μg·mL-1蝎毒处理细胞 (24 h, ×2 000), C. 对照组细胞(×5 000), D. 100 μg·mL-1蝎毒处理细胞 (24 h, ×5 000)。
A. Control group cell (×2 000), B. Scorpion venom-treated cell (100 μg·mL-1, 24 h, ×2 000), C. Control group cell (×5 000), D. Scorpion venom-treated cell (100 μg·mL-1, 24 h, ×5 000).
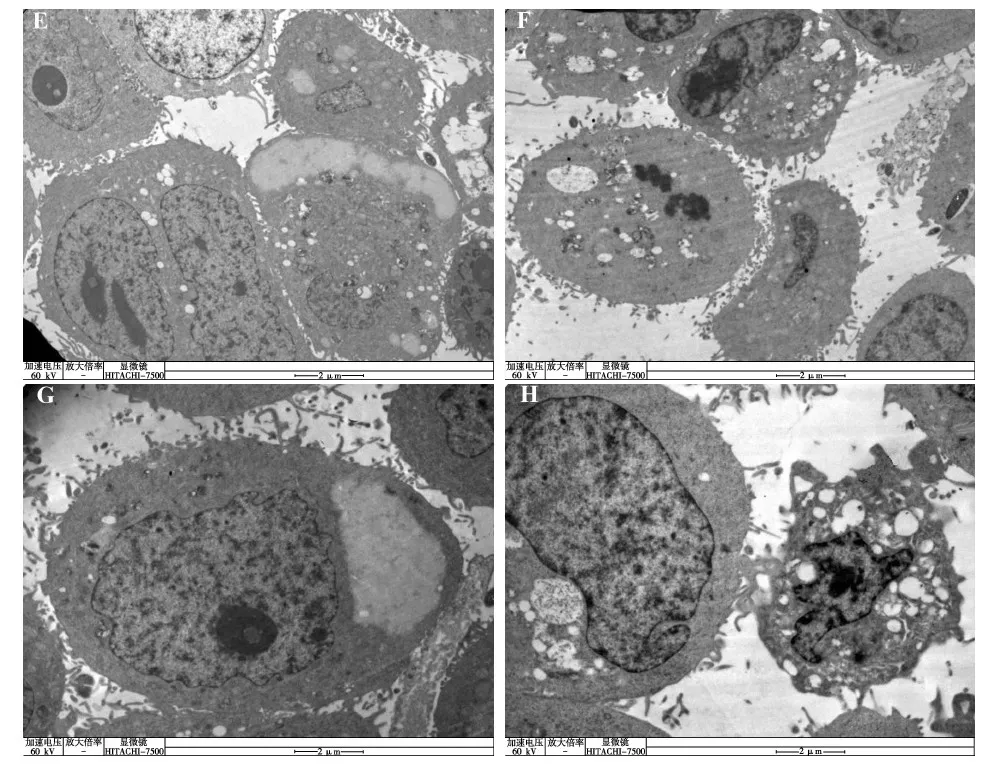
图3 透射电镜下的超微结构观察
Fig. 3 Morphological observations using transmission electron microscopy
E. 对照组细胞 (×10 000), F. 100 μg·mL-1蝎毒处理细胞 (24 h, ×10 000), G. 对照组细胞 (×15 000), H. 100 μg·mL-1蝎毒处理细胞 (24 h, ×15 000)。 E. Control group cell (×10 000), F. Scorpion venom-treated cell (100 μg·mL-1, 24 h, ×10 000), G. Control group cell (×15 000), H. Scorpion venom-treated cell (100 μg·mL-1, 24 h, ×15 000).
用透射电镜进一步观察它的超微结构,可以看出对照组的细胞(图3:E,G)拥有完整的细胞膜及细胞器,没有出现核物质的聚集。而实验组的组织水肿,细胞内空泡数量增多;细胞核内常染色体减少,程序性死亡的细胞增多(图3:F,H)。
2.3 RT-PCR方法检测caspase-3基因mRNA表达水平结果分析
caspase-3基因RT-PCR产物经1.8%琼脂糖凝胶电泳后凝胶成像,结果显示(图4),3组不同浓度(50 μg·mL-1、100 μg·mL-1、200 μg·mL-1)蝎毒处理的KYSE-510细胞与对照组相比,caspase-3基因的mRNA表达量相近,证明蝎毒对caspase-3基因在mRNA水平表达上无明显影响。
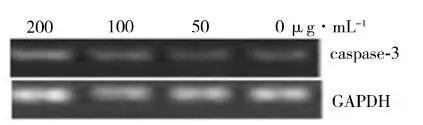
图4 不同浓度蝎毒处理的KYSE-510细胞 caspase-3基因mRNA表达水平Fig.4 Expression of caspase-3 gene in KYSE-510 cells that treated with different concentrations of scorpion venom as determined by RT-PCR
2.4 Western blot方法检测caspase-3基因蛋白表达水平结果分析
用Western blot方法检测了不同浓度(50 μg·mL-1、100 μg·mL-1、200 μg·mL-1)蝎毒处理的KYSE-510细胞与对照组的caspase-3基因在蛋白质水平上的表达,结果显示(图5),经蝎毒处理的KYSE-510细胞caspase-3基因的蛋白表达明显强于对照组,并且经200 μg·mL-1蝎毒处理的KYSE-510细胞caspase-3基因的蛋白表达增强最为明显,箭头所指的部位是亚基(17 kDa),细胞开始早期凋亡,证明蝎毒可以明显促进KYSE-510细胞caspase-3蛋白的剪切活化,并在浓度为200 μg·mL-1时最为有效。

图5 不同浓度蝎毒处理的KYSE-510细胞 caspase-3基因蛋白表达水平Fig. 5 Expression of caspase-3 gene in KYSE-510 cells that treated with different concentrations of scorpion venom as determined by Western blot
3 讨论
许多研究表明,caspase-3与肿瘤的分化、增生、转移有关,caspase-3在正常情况下充当肿瘤抑制基因,在肿瘤组织中高表达则是机体对肿瘤的一种抵抗措施(EI-Deiryetal.,1993;Leppleetal.,1996;Ikeguchietal.,1998)。本实验以KYSE-510细胞为代表,以梁氏异蝎为材料提取蝎毒,在扫描电镜与透射电镜下对比观察实验组(经蝎毒处理24 h)与对照组细胞形态学的改变与超微结构的变化,发现对照组的细胞正常而实验组的细胞出现凋亡。用流式细胞仪检测细胞凋亡的程度,随着毒素浓度的增大,正常活细胞的数量显著减少或百分比显著降低,凋亡坏死的细胞明显增加,表明蝎毒影响KYSR-510细胞的生长与死亡,抑制细胞的生长增殖而促进其凋亡和坏死,这也是蝎毒的抗肿瘤机制。
实验中蝎毒在mRNA水平上对caspase-3基因表达无明显影响,而在蛋白水平上则大大增强了caspase-3蛋白的剪切活化,并以经200 μg·mL-1蝎毒处理的KYSE-510细胞caspase-3蛋白的剪切活化最强,由此说明了蝎毒抑制癌细胞增殖的其中一种机制是通过增强癌细胞内caspase-3蛋白的剪切活化来阻止细胞进入细胞周期。另外,蝎毒是否还有其他机制可以促进癌细胞凋亡,还有待进一步研究。
董伟华, 孔天翰, 韩雪飞, 等. 1999. 蝎毒抗癌多肽对4种人肿瘤细胞系的作用[J]. 河南医科大学学报, 34(1): 52-55.
付士波. 2005. 蝎毒体外抗肿瘤作用的实验研究及机制探讨[D]. 吉林: 吉林大学.
贾莉, 孙宏丹, 孟秀香, 等. 2001. 蝎毒对白血病Raji细胞株的生长抑制和诱导凋亡作用的研究[J]. 白血病淋巴瘤, 10(4): 205-207.
孔天翰, 林山, 韩雪飞, 等. 2004. 蝎毒多肽对肿瘤细胞的抑制作用研究[J]. 中国病理生理杂志, 20(6): 968-972.
李桂生, 杨春旭, 韦晓谋, 等. 2004. 蝎毒对人肝癌Bel-7404细胞端粒酶活性的影响[J]. 东南大学学报(医学版), 23(3): 166-169.
孙立东, 侯长安, 邓春禧, 等. 1996. 蝎素抗癌因子介入性治疗晚期肝癌疗效观察[J]. 郑州大学学报(医学版), (3): 36-38.
王兆朋, 张维东, 张捷, 等. 2006a. 蝎毒多肽提取物对前列腺癌细胞增殖的影响[J]. 实用癌症杂志, 21(1): 1-3, 10.
王兆朋, 张维东, 张捷, 等. 2006b. 蝎毒多肽提取物对非激素依赖性前列腺癌细胞增殖抑制作用的实验研究[J]. 中国药理学通报, 22(8): 938-942.
许世伟, 丰雪琴, 孙学国. 2014. 参附注射液对心肌缺血再灌注损伤患者Bcl-2、Bax与Caspase-3蛋白水平的影响[J]. 中医学报, 29(2): 267-268.
杨春旭, 戴盛明, 朱灵. 2002. 东亚钳蝎毒生物提取物对人肝癌细胞体外增殖及凋亡的影响[J]. 肿瘤防治研究, 29(3): 184-186.
杨春旭, 韦晓谋, 朱灵. 2005. 蝎毒与丝裂霉素联合应用对人肝癌细胞生长的影响[J]. 东南大学学报(医学版), 24(4): 263-264.
杨志华, 肖桂元, 杨卓平, 等. 2000. 蝎毒复合胶囊合并放疗治疗中晚期肿瘤患者的临床研究[J]. 郑州大学学报(医学版), 35(4): 294-296.
张维东, 张月英, 王朝霞, 等. 2007. 蝎毒多肽提取物对肿瘤生长和细胞免疫功能的影响[J]. 山东大学学报(医学版), 45(3): 286-289.
朱灵, 韦晓谋, 杨春旭. 2008. 蝎毒对人肝癌细胞Bel-7404凋亡及端粒酶逆转录酶基因的作用[J]. 广西医学, 30(2): 158-160.
EI-Deiry WS, Tokino T, Veleculescu VE,etal. 1993. WAFI, a potential mediator of p53 tumor suppression[J]. Cell, 75: 817-825.
Enzinger PC, Mayer RJ. 2003. Esophageal cancer[J].The New England Journal of Medicine, 394(23): 2241-2252.
Ikeguchi M, Saito H, Katano K,etal. 1998. Expression of caspase-3 and P21 independent prognositic factors in patients with serosal invasion by gastric carcinoma[J]. Digestive Diseases and Science, 43: 964-967.
Krajewska M, Wang HG, Krajewski S,etal. 1997. Immunohistochemical analysis ofinvivopatterns of expression of CPP32 (Caspase-3), a cell death protease[J]. Cancer Research, 57: 1605-1613.
Lepple WA, Berweck S, Bohmig M,etal. 1996. K+channels and the Jnhtraealluar calcium signal in human melanoma cell proliferation[J]. The Journal of Membrane Biology, 15(2): 149-153.
Liu X, Kim CN, Yang J,etal. 1996. Induction of apoptosis program in cell-free extracts, requirement for Datp and cytochrome[J]. Cell, 86(1): 147-157.
Parkin DM, Pisani P, Ferlay J. 1999. Global cancer statistics[J].A Cancer Journal of Clinicians, 49(1): 33-64.
Qi H, Chen HZ, Jin ZJ. 2002.Caspase 3 gene expression and Ca2+homeostasis underlying desipramine-induced C6 glioma cell apoptosis[J]. Acta Pharmacologica Sinica, 23: 803-807.
Stefanaki K, Rontogiannis D, Vamvouka C,etal. 1998. Immunohistochemical detection of bcl2, P53, mdm2 and caspase-3 proteins in small-cell lung carcinomas[J]. Anticancer, 18: 1689-1696.
Mechanism of the Enhancement of Scorpion Venom fromHeterometrusliangion Apoptosis and Necrosis of KYSE-510 Cell
WANG Juan1#, LI Qinjin1, 2#, FU Wenhui1, WEI Baoyang1, WANG Zhi1*
(1. College of Bioscience & Biotechnology, Hunan Agriculture University, Changsha 410128, China;2. Hunan Sports Vocational College, Changsha 410019, China)
Scorpion venom was extracted fromHeterometrusliangito study the mechanism of inhibition of venom on tumor grow. The effect of scorpion venom on apoptosis and necrosis of KYSE-510 cell and expression levels of caspase-3 were investigated by electron microscopy, Annexin V-FITC, and propidiumiodide double staining analysis by flowcytometry as well as reverse transcription PCR and Western blot. The results indicated that the mRNA expression levels of caspase-3 in KYSE-510 cells that treated with different concentrations of scorpion venom (50 μg·mL-1, 100 μg·mL-1, 200 μg·mL-1) were similar to these of control. However, the expressions of caspase-3 in KYSE-510 cells were obviously up-regulated by scorpion venom as determined by Western blot, especially when the cells were treated with 200 μg·mL-1scorpion venom. These results suggested that the possible mechanism of the scorpion venom was accelerated protein splicing activity of caspase-3.
venom ofHeterometrusliangi; KYSE-510 cells; caspase-3; gene expression
2016-06-03 接受日期:2016-08-17
湖南省科技厅重点项目(2014FJ2003)
王娟(1990—), 女, 硕士研究生, 研究方向为发育生态学, E-mail:240647109@qq.com; 李秦晋(1975—), 男, 博士研究生, 讲师, 主要从事农业生态学研究, E-mail:18157099@qq.com#同等贡献作者
*通信作者Corresponding author, 博士, 教授, 博士研究生导师, 主要从事生态学和害虫生态调控研究, E-mail:wangzspider@sina.com.cn
10.11984/j.issn.1000-7083.20160152
Q78
A
1000-7083(2016)05-0660-06
