民勤荒漠区子午沙鼠的配偶偏好行为研究
2016-02-16张世虎何芳杨旭升陈向阳
张世虎, 何芳, 杨旭升, 陈向阳
(西北师范大学生命科学学院,兰州730070)
民勤荒漠区子午沙鼠的配偶偏好行为研究
张世虎*, 何芳, 杨旭升, 陈向阳
(西北师范大学生命科学学院,兰州730070)
配偶偏好是单配制物种在配偶选择实验中偏好配偶而不是陌生异性个体的行为,配偶选择行为是检验物种婚配体系的重要行为学指标。子午沙鼠Merionesmeridianus是我国西北荒漠草原地区的优势鼠种,其种群的迁徙与扩散对环境变化有良好的指示作用,但其婚配体系还不清楚。本实验系统观察了室内繁殖的F1代子午沙鼠的配偶偏好行为,结果表明雌性子午沙鼠在配对3 d后与配偶鼠的接触时间和探究频次均显著高于陌生鼠(P<0.05);配对10 d后与配偶鼠的接触时间和探究频次均极显著高于陌生鼠(P<0.01);与配偶鼠的接触时间在配对10 d后极显著高于配对3 d后(P<0.01),而探究频次降低(P<0.01);与陌生鼠的接触时间刚好相反,配对10 d后显著低于配对3 d后(P<0.01)。雄性子午沙鼠在配对3 d后对配偶鼠和陌生鼠的接触时间和探究频次均没有差异,然而在配对10 d后对配偶鼠的接触时间和探究频次均极显著高于陌生鼠(P<0.01);配对10 d后对配偶鼠的接触时间极显著高于配对3 d后(P<0.01),配对10 d后对陌生鼠的接触时间极显著低于配对3 d后(P<0.01);配对10 d后对配偶鼠和陌生鼠的探究频次均极显著低于配对3 d后(P<0.01)。通过上述实验分析推断,雌雄子午沙鼠均可形成稳定的配偶偏好,具有单配制物种的行为特征。
子午沙鼠;配偶偏好;婚配制度;行为
子午沙鼠Merionesmeridianus隶属于啮齿目Rodentia仓鼠科Cricetidae沙鼠亚科Gerbillinae沙鼠属Meriones,是欧亚大陆中部荒漠和半荒漠地区的鼠种,适应多种生境。该鼠通常分布在荒漠中的固定、半固定灌丛沙丘、沙梁低地、水渠堤岸,土堆坟地等地区,是我国西北荒漠草原地区的优势鼠种,从海拔-103 m到3 205 m以上均有分布(Zhaoetal.,2013),其种群的迁徙与扩散对当地环境变化起良好的指示作用(罗泽珣等,2000;鄂晋等,2009)。子午沙鼠主要食物为当年新生植物嫩茎、叶和部分灌木韧皮部分,植物花、浆果等,其中茎、叶取食频次最高,花和浆果类次之,种子最少(李俊生等,2003)。尽管该鼠没有颊袋,但采食范围仍旧很大(Shuai & Song,2011)。因此该鼠的繁殖生物学研究对该物种的种群控制,进而对荒漠区植被保护和管理具有重要意义。
子午沙鼠繁殖能力较强,每年2月开始繁殖,直到10月仍可见繁殖雌鼠,各地的繁殖时间略有差异,每年繁殖2~3次;妊娠率低,6月下旬的妊娠率为33.3%,且逐月下降;每胎产仔2~11只,多为4~6只(王香亭,1990,1991;林纪春等,2006)。室内研究表明,子午沙鼠性情温和,不会主动咬人,白天常集聚休息,夜晚活动频繁,多觅食(宋恺,刘荣堂,1984;蒋卫等,1995)。在实验室繁殖过程中,曾选择1雄2雌的交配繁殖方式,但结果表明2只雌鼠中总有1只不参加繁殖,而以一雄一雌配对繁殖效果最好(蒋卫等,1995)。在本实验室的繁殖过程中,也观察到同样的现象,这种严格的一雄一雌配对关系恰好是单配制物种的典型特征之一。研究还报道有一只雌鼠产后3 d即死亡,雄鼠每天长时间地趴在幼仔身上,给它们取暖,使其幼仔在没有母乳的情况下,仍存活了3 d(蒋卫等,1995)。本实验室在饲养过程中,也观察到雌、雄亲本的共同育幼行为。雄性子午沙鼠有高水平的父本行为,而父本行为是单配制物种的又一典型特征。因此从室内研究结果推断子午沙鼠很可能属于单配制动物,然而有关该鼠婚配制度的系统研究未见报道。本研究以民勤地区捕获的F1代子午沙鼠为研究对象,系统研究了室内条件下该鼠在繁殖季节里配偶偏好行为的形成,为该鼠婚配制度的研究提供基础资料。
1 材料与方法
1.1 实验动物
子午沙鼠捕自甘肃省民勤县(位于腾格里沙漠
和巴丹吉林沙漠之间,103°05′E,38°38′N),于西北师范大学生命科学学院动物室分笼饲养,以锯末铺垫,用棉花做巢材,水和食物供应充足,室温(23±2)℃,相对湿度(35±10)%,自然采光。2014年5月将捕获的雌、雄成年子午沙鼠配对,新出生幼仔即为F1代。F1代个体与亲本同窝饲养至30 d后分窝,雌、雄分开单笼饲养,越冬后来年开始实验。2015年5月选取F1代健康成年雌、雄个体各10只,日龄均为180 d以上的性成熟个体,分别将无亲缘关系的个体配对,观察记录其配对3 d后和10 d后的配偶偏好行为。
1.2 配偶偏好实验
配偶偏好行为观察箱为T形,由2个选择箱(长40 cm×宽20 cm×高16 cm)和1个中立箱(长40 cm×宽20 cm×高16 cm)组成,中立箱设置一个活动隔板,可将中立箱与2个选择箱同时隔离。实验开始后,将配偶鼠和陌生鼠分别关在捕鼠笼中,然后将捕鼠笼分别随机放入2个选择箱中,选择箱之间没有通道。配偶鼠和陌生鼠只能在各自的捕鼠笼内活动,而不能进入中立箱。而实验鼠可以在中立箱和选择箱中自由活动。选择箱和中立箱中均以锯末为垫料。每次捕捉子午沙鼠均用一次性手套,以排除气味对子午沙鼠配偶偏好行为产生的影响,每次实验后清理底物并清洗3个观察箱以排除气味对下次实验产生的影响。实验开始时,在无配偶鼠和陌生鼠的情况下,实验鼠在3个观察箱中自由活动适应20 min;然后把其放在中立箱内将活动隔板放下,将配偶鼠和陌生鼠随机放置于2个选择箱中,适应20 min后打开活动隔板,用摄像机记录行为。30 min后实验结束。在计算机上用行为记录分析软件包Jwacher记录动物的行为,以行为的发生频次和持续时间为数据指标,行为实验在Jwacher系统下进行分析。
1.3 数据分析
用SPSS作统计处理,对行为的持续时间和发生频次进行单样本K-S检验,均符合正态分布。对配偶鼠和陌生鼠之间接触时间及探究频次的比较选用配对样本t检验,对配对3 d后和配对10 d后的接触时间及探究频次的比较选用独立样本t检验,显著水平为P≤0.05,所得数据以平均值±标准误(Mean±SE)表示。
2 结果
2.1 雌性子午沙鼠对配偶鼠和陌生鼠的偏好时间比较
雌性子午沙鼠在配对3 d后与配偶鼠的接触时间显著高于陌生鼠(t=2.633,P=0.023);配对10 d后与配偶鼠的接触时间极显著高于陌生鼠(t=6.256,P<0.001)。而且与配偶鼠的接触时间在配对10 d后极显著高于配对3 d后(t=2.779,P=0.001),与陌生鼠的接触时间刚好相反,配对10 d后极显著低于配对3 d后(t=-2.054,P=0.002)(图1)。
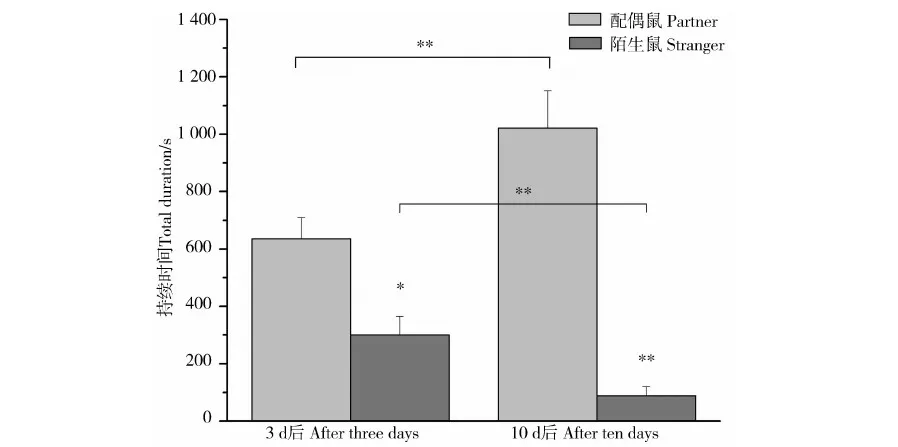
图1 雌性子午沙鼠配偶偏好行为的持续时间Fig.1 The total duration of female Meriones meridianus in partner preference
*P<0.05,**P<0.01; 下同, the same below.
2.2 雌性子午沙鼠对配偶鼠和陌生鼠的偏好频次比较
雌性子午沙鼠在配对3 d后(t=3.787,P=0.003)和10 d后(t=5.755,P=0.001)对配偶鼠的探究频次均极显著高于对陌生鼠。而且配对10 d后对配偶鼠的探究频次极显著低于配对3 d后(t=-1.526,P=0.001)(图2)。对陌生鼠的探究频次差异无统计学意义(t=-0.496,P=0.626)(图2)。
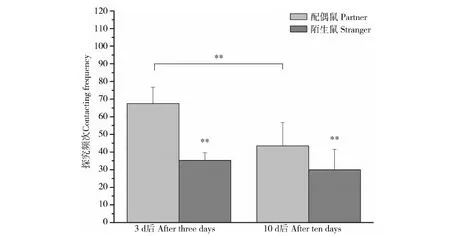
图2 雌性子午沙鼠配偶偏好行为的探究频次Fig.2 The contacting frequency of female Meriones meridianus in the partner preference
2.3 雄性子午沙鼠对配偶鼠和陌生鼠的偏好时间比较
雄性子午沙鼠在配对3 d后对配偶鼠和陌生鼠的接触时间差异无统计学意义(t=-0.188,P=0.855),然而在配对10 d后对配偶鼠的接触时间极显著高于对陌生鼠(t=8.571,P<0.001)。而且配对10 d后对配偶鼠的接触时间极显著高于配对3 d后(t=4.436,P<0.001),配对10 d后对陌生鼠的接触时间极显著低于配对3 d后(t=-2.516,P<0.001)(图3)。
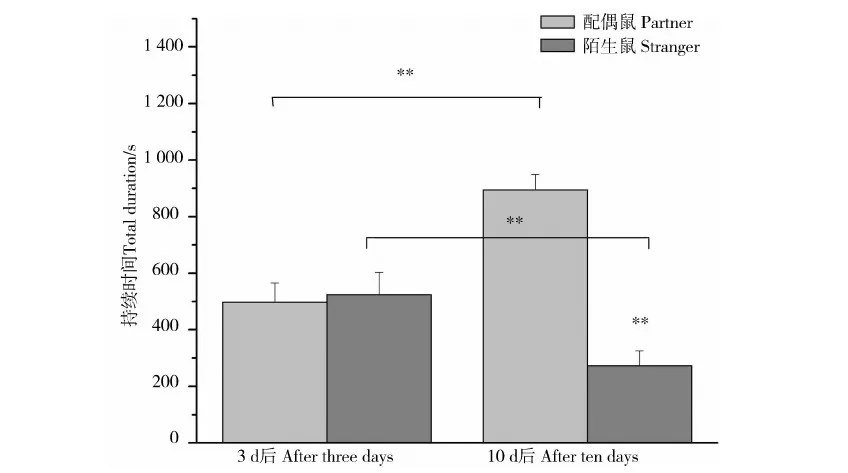
图3 雄性子午沙鼠配偶偏好行为的持续时间Fig.3 The total duration of male Meriones meridianus in the partner preference
2.4 雄性子午沙鼠对配偶鼠和陌生鼠的偏好频次比较
雄性子午沙鼠在配对3 d后对配偶鼠和陌生鼠的探究频次差异无统计学意义(t=1.529,P=0.161),然而在配对10 d后对配偶鼠的探究频次极显著高于对陌生鼠(t=10.370,P<0.001)。而且配对10 d后对配偶鼠(t=-1.716,P=<0.001)和陌生鼠(t=-2.923,P<0.001)的探究频次均极显著低于配对3 d后(图4)。
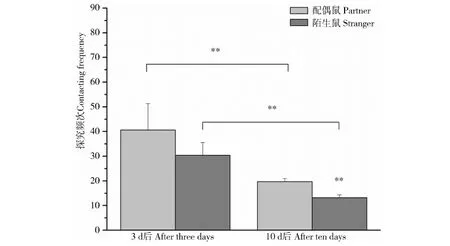
图4 雄性子午沙鼠配偶偏好行为的探究频次Fig.4 The contacting frequency of male Meriones meridianus in the partner preference
3 讨论
结果表明,雌性子午沙鼠在配对3 d后表现出明显的配偶偏好行为和大量亲密行为,而雄性没有形成配偶偏好。然而在配对10 d后,雌性子午沙鼠对配偶鼠的偏好仍旧维持,雄性子午沙鼠对配偶鼠也表现出偏好行为。可见雌、雄子午沙鼠均可形成配偶偏好,只是雄性子午沙鼠形成偏好的时间晚于雌性。在一个繁殖季节里,只拥有一个配偶,且配偶关系亲密、维持时间长是单配制动物的典型行为特征(Emlen & Oring,1977;Wang & Novak,1994;赵亚军等,2000)。室内研究表明单配制物种——草原田鼠Microtusochrogaster和松田鼠M.pinetorum在雌雄共居一段时间后,表现出对交配后熟悉异性的喜好(Carter & Getz,1993;Getz & Carter,1996);单配制物种——长爪沙鼠Merionesunguiculataus和子午沙鼠属于同一亚科,野外研究表明雌雄长爪沙鼠可以形成长期稳定的配偶关系,表现出明显的配偶偏好(Hendrie & Starkey,1998;Starkey & Hendrie,1998;Wangetal.,2011)。而多配制物种——山地田鼠Microtusmontanus和草甸田鼠M.pennsylvanicus并无对熟悉异性明显的选择倾向(Shapiro & Insel,1990),这与野外观察对以上田鼠婚配制度的预测一致(Dewsbury,1987)。因此动物的配偶偏好可以作为婚配制度的一个重要行为学特征。子午沙鼠很可能为单配制物种,但是仍需要大量室内研究和野外实验证明。
子午沙鼠性情温和,不会主动咬人,社会行为丰富;每年2—10月都可发情妊娠,每胎产仔数为1~7只,平均产仔3.92只(蒋卫等,1995;廖力夫,黎唯,1999);雌、雄亲本均参与育幼,且有较高的父本行为(蒋卫等,1995)。长爪沙鼠为子午沙鼠的伴生鼠种,繁殖期亚成体的性行为受到抑制,只有一对雌、雄个体具有繁殖能力(Agren,1984);该鼠一年可繁殖4窝,每窝3~7只幼仔居多(刘伟等,2013);雌、雄共同参与领地防御(Agren,1984),共同参与幼仔抚育,雄性有很强的父本行为(夏武平等,1982)。而同样为伴生鼠种的多配制物种——大沙鼠Rhombomysopimus,繁殖期呈明显聚集型分布,每年的3月初、5月初和9月间,繁殖3次,每窝仔鼠6~8只;繁殖期群体通常由1只雄鼠和1~3只成年雌鼠,以及一些幼体和亚成体组成,雄性很少参与育幼(乔洪海等,2011)。由此可见,与长爪沙鼠和大沙鼠相比,子午沙鼠一年当中的繁殖次数和胎仔数与两者相似,然而育幼方式更接近长爪沙鼠,具有单配制动物中雌雄共同抚育幼仔的行为学特征。
婚配制度的形成受多种因素的影响,资源分布是一个重要的方面。如果资源集中分布,但又不是高度集中,那么一个雄性足以占有丰富资源获得多个配偶,即资源保卫型的一雄多雌制;如果资源平均分布,小型动物就难以绝对占有该资源,无法形成一雄多雌的社会策略,而更容易形成一雄一雌的单配制。子午沙鼠的主要食物为当年生植物的嫩茎、叶和部分灌木韧皮部分、植物花、浆果等,其中茎、叶取食频次最高,花和浆果次之,种子最少(李俊生等,2003)。子午沙鼠可食用的植物类型主要有数量可观的沙蓬Agriophyllumsquarrosum(Linn.) Moq.、绳虫实Corispermumdeclinatum、星状角果藜CeratocarpusarenariusL.、猪毛菜SalsolacollinaPall等夏雨型植物,这类植物为其提供了丰富的食源,而灌木丛又是它们躲避敌害、隐蔽活动的良好环境,子午沙鼠在这类生境分布密度较高(宋恺,刘荣堂,1984;徐敏,2009)。子午沙鼠的取食范围有限,局限于巢区周围(Shilova & Orlenev,2004)。因此食物资源分布相对平均,且竞争激烈,因此很难形成一雄多雌的社会策略,而容易形成单配制,这与我们的研究结果一致。
婚配制度的形成还受到资源丰富度的影响。如果食物足够丰富,则双亲中的一员(通常是雌性)就可以保证子代健康存活,那么雄性个体就可以从中解放出来,形成一雄多雌制。如果食物不丰富,或者食物难以获取和处理,则双亲必需同时参与抚育幼仔,有时还需要助亲者的帮助,容易形成单配制。子午沙鼠广泛分布于复杂多样的荒漠,加之扩散能力弱,对栖息地环境有很强的依赖性(Nicolasetal.,2008)。而荒漠的生态结构简单、食物资源贫瘠,食物资源丰富度具有空间上斑块性和时间上波动性的不确定特点(Brown,1986),因此容易形成单配制的行为策略。
配偶分布和可利用程度也会影响婚配制度的形成。如果有效性比不平衡(如雌性少),则雄性不能占有多于一个的雌性,容易形成单配制。如果配偶集群,易形成雌性保卫型的一雄多雌制;如果雌性均匀分布,则雄性只能保护一个雌性,容易形成单配制。野外实验表明,0~5月龄的子午沙鼠性比为1.939 6∶1,5~12月龄的性比为1.455∶1,12~24月龄的性比0.656∶1,24~36月龄的性比为1∶1。而且其中0~5月龄的182只雌性子午沙鼠均没有怀孕现象,5~12月龄的88只雌性子午沙鼠中有39只怀孕,12~24月龄的66只雌性子午沙鼠中有56只怀孕,24~36月龄的4只雌性子午沙鼠均怀孕(林纪春等,2006)。可见有生殖能力的雌性沙鼠主要集中在5~24月龄,此时性比接近1∶1。周延林等(1999)对内蒙古鄂尔多斯沙地草场1991—1996年所采集子午沙鼠的研究表明,6年总的性比为1.44∶1。内蒙古北部荒漠草原和宁夏灵武县2个地区子午沙鼠的性比分别为1∶1和0.94∶1(董媛,2007)。 因此从性比和配偶可利用程度上分析,子午沙鼠更易形成单配制策略。
综上所述,雌、雄子午沙鼠在室内共居一段时间后可以形成稳定的配偶偏好,且存在两性差异,表现出了单配制动物的行为特征,但是确定其婚配制度仍需要大量的野外和室内实验证明。
致谢:感谢程昉老师在实验过程中的大量帮助;感谢于鹏老师和李西波老师对文章提出宝贵意见;感谢实验室欧锐、南旭梅等在实验过程中的鼎力协助!
董媛. 2007. 子午沙鼠形态地理变异[D]. 兰州: 兰州大学.
鄂晋, 张福顺, 余奕东, 等. 2009. 荒漠区开垦干扰下子午沙鼠种群数量动态与繁殖特征[J]. 内蒙古农业大学学报(自然科学版), 30(2): 140-144.
蒋卫, 郑强, 张兰英. 1995. 人工饲养条件下子午沙鼠的繁殖特征[J]. 兽类学报, 15(1): 75-76.
李俊生, 宋延龄, 曾治高. 2003. 7种荒漠啮齿动物食物组成与消化道长度的比较[J]. 动物学报, 49(2): 171-178.
廖力夫, 黎唯. 1999. 室温与光照对子午沙鼠和灰仓鼠繁殖的影响[J]. 上海实验动物科学, 19(2): 87-89.
林纪春, 张晓雪, 王诚, 等. 2006. 子午沙鼠生命表和繁殖的研究[J]. 地方病通报, 21(2): 5-7.
刘伟, 宛新荣, 钟文勤, 等. 2013. 长爪沙鼠种群繁殖的季节性特征[J]. 兽类学报, 33(1): 35-46.
罗泽珣, 陈卫, 高武. 2000. 中国动物志: 仓鼠科(China fauna: Cricetidae)[M]. 北京: 科学出版社.
乔洪海, 刘伟, 杨维康. 2011. 大沙鼠行为生态学研究现状[J]. 生态学杂志, 30(1): 603-610.
宋恺, 刘荣堂. 1984. 子午沙鼠(Merionesmeridianus)的生态研究[J]. 兽类学报, 4(4): 291-300.
王香亭. 1990. 宁夏脊椎动物志[M]. 银川: 宁夏人民出版社.
王香亭. 1991. 甘肃脊椎动物志[M]. 兰州: 甘肃科学技术出版社.
夏武平, 廖崇惠, 钟文勤, 等. 1982. 内蒙古阴山北部农业区长爪沙鼠的种群动态及其调节研究[J]. 兽类学报, 2(1): 51-69.
徐敏. 2009. 子午沙鼠空间分布特点的初探[J]. 医学动物防制, 25(12): 931-933.
赵亚军, 房继明, 孙儒泳. 2000. 田鼠属动物婚配制度的研究范式[J]. 兽类学报, 20(1): 67-75.
周延林, 王利民, 鲍伟东, 等. 1999. 子午沙鼠种群繁殖特征分析[J]. 兽类学报, 19(l): 62-67.
Agren G. 1984.Pair bond formation in the Mongolian gerbil[J]. Animal Behavior, 32(2): 528-535.
Brown JS. 1986. Coexistence on a resource whose abundance varies: a test with desert rodents[M].Arizona, USA: University of Arizona Tucson.
Carter CS, Getz LL. 1993. Monogamy and the prairie vole[J]. Scientific American, 268: 100-106.
Dewsbury DA.1987. The comparative psychology of monogamy[J]. Nebraska Symposium on Motivation Nebraska Symposium on Motivation, 35: 1-50.
Emlen T, Oring LW. 1977. Ecology, sexual selection and the evolution of mating systems[J]. Science, 197(4278): 215-223.
Getz LL, Carter CS. 1996. Prairie-vole partnerships[J]. American scientist, 84: 56-62.
Hendrie CA, Starkey NJ. 1998. Pair-bond disruption in mongolian gerbils: effects on subsequent social behaviour[J]. Physiology & Behavior, 63(5): 895-901.
Nicolas V, Bryja J, Akpatou B,etal. 2008. Comparative phylogeography of two sibling species of forest-dwelling rodent (PraomysrostratusandP.tullbergi) in west Africa: different reactions to past forest fragmentation[J]. Molecular Ecology, 17(23): 5118-5134.
Shapiro LE, Insel TR. 1990. Infant’s response to social separation reflects adult differences in affiliative behavior: a comparative developmental study in prairie and montane voles[J]. Developmental Psychobiology, 23: 375-393.
Shilova SA, Orlenev DP. 2004. Certain behavioral traits of small mammals in abnormal social environment[J]. Biology Bulletin, 31: 358-366.
Shuai LY, Song YL. 2011. Foraging behavior of the midday gerbil (Merionesmeridianus): combined effects of distance and microhabitat[J]. Behavioural Processes, 86: 143-148.
Starkey NJ, Hendrie CA. 1998. Importance of gender for the display of social impairment in pairbond disrupted gerbils[J]. Neuroscience and Biobehavioral Reviews, 23: 273-277.
Wang W, Liu G, Wang X,etal. 2011. Home-range sizes of social groups of Mongolian gerbilsMerionesunguiculatus[J]. Journal of Arid Environments, 75(2): 132-137.
Wang ZX, Novak MA. 1994. Alloparental care and the influence of father presence on juvenile prairie voles (Microtusochrogaster)[J]. Animal Behaviour, 47: 281-288.
Zhao LM, Wang Y, Liu NF,etal. 2013. Effects of change in altitude on the auditory bulla of midday gerbil,Merionesmeridianus[J]. Pakistan Journal of Zoology, 45(3): 581-588.
Partner Preference ofMerionesmeridianusin Minqin Desert Area
ZHANG Shihu*, HE Fang, YANG Xusheng, CHEN Xiangyang
(College of Life Sciences, Northwest Normal University, Lanzhou 730070, China)
Monogamous species prefer to their partners rather than the unfamiliar ones in partner preference test. Partner preference is an important parameter to determine mating system. The midday gerbil (Merionesmeridianus) is widespread and commonly encountered in the desert steppe of northwest China. The migration and diffusion of this population have a good habitat-indicative value. However, the mating system ofM.meridianusis still unclear. We investigated the partner preference in F1generation ofM.meridianusin this study. The results showed that the duration and frequency of contacting (including sniff, licking, crouching and friendly contacting behavior) for partner in femaleM.meridianuswere significantly higher than those for stranger after 3 days (P<0.05) and 10 days (P<0.01) of pairing, and the duration of contacting partner after 10 days of pairing was extremely longer than that after 3 days (P<0.01), the contacting frequency for partner after 10 days of pairing was extremely less than that after 3 days (P<0.01), the duration of contacting for stranger after 10 days of pairing was extremely shorter than that after 3 days(P<0.01). The duration and frequency of contacting for partner in maleM.meridianusafter 3 days of pairing had no significant difference with those for stranger, however, the duration and frequency of contacting for partner after 10 days of pairing were extremely longer than those for stranger (P<0.01). The duration of contacting for partner after 10 days of pairing was extremely longer than that after 3 days (P<0.01), and the frequency of contacting for partner and stranger after 10 days of pairing were extremely less than that after 3 days (P<0.01). In conclusion, both female and maleM.meridianushad stable pair bonding and behavioral characteristic of monogamous species.
Merionesmeridianus; partner preference; mating system; behavior
2016-03-23 接受日期:2016-07-20
西北师范大学青年教师科研能力提升计划项目(NWNU-LKQN-14-12); 甘肃省自然科学基金项目(1506RJZA128)
张世虎(1980—), 男, 博士, 讲师, 主要从事草地生态学教学与研究
*通信作者Corresponding author, E-mail:zhangshh05@163.com
10.11984/j.issn.1000-7083.20160064
Q959.837
A
1000-7083(2016)05-0648-06
