草珊瑚叶片总RNA提取方法及效果的比较研究
2016-02-16沈少炎谢德金吴玉香荣俊冬何天友陈礼光郑郁善
沈少炎,谢德金,吴玉香,荣俊冬,何天友,陈礼光,郑郁善,*
(1.福建农林大学 园林学院,福建 福州 350002;2.福建农林大学 林学院,福建 福州 350002)
草珊瑚叶片总RNA提取方法及效果的比较研究
沈少炎1,谢德金2,吴玉香1,荣俊冬2,何天友1,陈礼光2,郑郁善1,2*
(1.福建农林大学 园林学院,福建 福州 350002;2.福建农林大学 林学院,福建 福州 350002)
采用CTAB法、CTAB-LiCl法、CTAB-Trizol法、Trizol法、天根RNA提取试剂盒及百泰克RNA提取试剂盒提取草珊瑚(Sarcandra glabra)叶片总RNA,并通过微量紫外分光光度计、电泳检测等对提取的结果进行了分析比较。结果表明:CTAB-LiCl法和天根RNA提取试剂盒比较适合提取草珊瑚叶片的总RNA。这两种方法提取的总RNA的完整性和纯度较高,无明显的蛋白质及其他杂质污染,OD260/OD280的值在1.9~2.1,OD260/OD230在2.0~2.4。获得质量高、完整性好、纯度高的总RNA,为后续构建cDNA文库以及相关基因的克隆提供了试验基础。
草珊瑚;RNA提取;CTAB-LiCl法;天根RNA提取试剂盒
草珊瑚(Sarcandra glabra) 是金粟兰科(Chloranthaceae)草珊瑚属(Sarcandra)[1],多年生常绿草本或亚灌木,又名观音茶、接骨木等[2],是我国传统的中药材。草珊瑚全株可入药。现代药理学研究发现草珊瑚具有抗菌消炎、抑制流感病毒、促进骨折愈合以及抗肿瘤等药效和生物活性[3~5]。利用分子生物学研究我国传统中草药已经成为当今科研工作的趋势。但是,关于草珊瑚分子生物学方面的探索才刚刚开始,包括如cDNA文库的构建、RNA印迹表达、基因克隆和基因表达分析等都是草珊瑚分子生物学研究的重要课题,开展这些研究的关键是提取高质量的总RNA。关于植物总RNA提取方法及其改良方法已多有报道,但是由于不同植物及其不同部位都有各自的特点,这些特点又会反映在自身的结构和组成上,没有一种适合于所有植物总RNA的提取方法,必须针对不同植物的特点,对总RNA的提取方法进行相应的改良,才能提高总RNA的质量[6~7]。目前关于草珊瑚叶片的总RNA的提取方法尚未见报道。本试验尝试用6种方法从草珊瑚叶片中提取总RNA,并进行系统的分析和比较,以期找到一种理想的提取方法,现将结果报道如下。
1 材料与方法
1.1 试验材料及试剂仪器
以移植于福建农林大学的5年生草珊瑚植株幼嫩叶片为材料,剪取叶片后用蒸馏水洗净晾干后储存至-80℃超低温冰箱,备于后期进行液氮研磨提取。将研磨好的样品分成6份,采用不同方法提取总RNA前称量不同质量的样品。
试验试剂药品包括:CTAB提取缓冲液[2% CTAB,100 mmol·L-1Tris-HCl(pH=8.0),25 mmol·L-1EDTA( pH = 8.0),2 mol·L-1NaCl,0.5 g·L-1亚精胺,2% PVP,2% β-巯基乙醇];50×TAE缓冲液(2 M Tris-醋酸, 100 mM EDTA,使用前稀释为1×TAE缓冲液);0.1% DEPC处理水(1 ml DEPC,1 L超纯水);75%酒精;RNase-free水;10 mol·L-1LiCl;百泰克RNA提取试剂盒(RP3301,北京百泰克科技);天根RNA提取试剂盒(DP441,北京天根生物);Trizol(Thermo Fisher Scientific,USA);DEPC(Amresco,USA);无水乙醇、氯仿、酚/氯仿/异戊醇、异丙醇、β-巯基乙醇、PVP等均为国产国药分析纯。研钵于200℃烘烤2 h后直接放于-20℃预冷备用。一些未提及的溶液配制方法参见《分子克隆》[8]。
主要实验仪器包括:电子天平、超净工作台、压力蒸汽灭菌锅、凝胶成像系统、制冰机、恒温水浴锅、北京六一电泳仪、Thermo公司的微量紫外分光光度计、超低温冰箱。
1.2 试验方法
1.2.1 总RNA提取
1.2.1.1 CTAB法 参照Jamalnasir等方法[9]并做修改,具体步骤:(1)取新鲜叶片加入少许PVP,在液氮中快速研磨成粉末,将研磨好的叶片粉末0.1 g迅速转移到预热的1 ml CTAB缓冲液中,涡旋震荡混匀后,65℃水浴20 min,每隔5 min涡旋混匀1次,使RNA充分析出,于4℃、12 000 r·min-1离心15 min,转移上清液至新的1.5 mL离心管中,加入等体积的酚/氯仿/异戊醇(25:24:1),上下颠倒混匀5 min;(2)同样参数离心后,转移上清液至新的离心管中,加入等体积的氯仿抽提混匀,冰浴5 min;同样参数离心后转移上清液至新的离心管中,加入2倍体积预冷的无水乙醇,上下颠倒混匀,-20℃沉淀2 h;(3)4℃下,12 000 r·min-1离心15 min后弃上清,用75%乙醇洗涤,将沉淀弹起,充分颠倒,4℃下,12 000 r·min-1离心15 min,弃上清,并用枪小心吸去残留液体并吹干沉淀至无色透明;(4)用RNase-free水溶解沉淀,取出少量用于后续检测,其余-70℃贮存。
1.2.1.2 CTAB-LiCl法 参照赵锦等方法[10]并做修改,具体步骤如下:(1)取新鲜叶片加入少许PVP,在液氮中快速研磨成粉末,将研磨好的叶片粉末0.15 g迅速转移到预热的1 ml CTAB缓冲液中,涡旋震荡混匀后,65℃水浴20 min,每隔2 min混匀1次,使RNA充分析出,加入600 µL氯仿,上下颠倒混匀10 min,于4℃,12 000 r·min-1离心10 min,转移上清液至新的1.5 mL离心管中,并重复操作;(2)加入1/4体积的10 mol·L-1LiCl溶液,4℃静置过夜,同样参数离心后,弃上清,以250 µL DEPC水溶解沉淀;(3)加等体积氯仿抽提2次,取上清并加入2倍体积的无水乙醇,-20℃沉淀2 h,相同参数离心后弃上清,用75%乙醇洗涤,将沉淀弹起,充分颠倒,于4℃,7 500 r·min-1离心10 min, 弃上清并小心弃除残留的液体,风干沉淀至无色透明;(4)用RNase-free水溶解沉淀,取出少量用于后续检测,其余-70℃贮存。
1.2.1.3 Trizol法 参照Chow等方法[11]并做修改,具体步骤:(1)取新鲜叶片用液氮在研钵中快速研磨成粉末,将研磨好的叶片粉末0.1 g转入1 mL Trizol提取液中,涡旋震荡2 min,室温静置5 min于4℃,12 000 r·min-1离心10 min;(2)转移上清液至新的离心管中,加入0.2 mL氯仿,震荡15 s后,室温静置2~3 min;(3)相同参数离心后取上层水相至新的离心管中并加入0.5 mL异丙醇,颠倒混匀,室温静置10 min;(4)4℃,12 000 r·min-1离心10 min,弃上清液并用1 mL 75%乙醇漂洗沉淀,使其从底部弹起悬浮;(5)相同参数离心后弃上清并风干沉淀;(6)用20 ~ 50 µL RNase-free水溶解沉淀,取出2~5 µL用于后续检测,其余-70℃贮存。
1.2.1.4 CTAB-Trizol法 参照宋蓓等方法[12]并做修改,具体步骤:(1)第一步骤与CTAB法相同,将0.1 g粉末转移到预热的1 mL CTAB缓冲液中,涡旋震荡混匀后,65℃水浴20 min,每隔5 min涡旋混匀1次,使RNA充分析出,于4℃,12 000 r·min-1离心10 min后取上清液加入0.7倍的异丙醇,混匀后室温静置10 min;(2)相同参数离心后弃上清,用RNase-free水溶解沉淀,加入1 mL Trizol提取液,200 µL氯仿,剧烈震荡30 s;(3)相同参数离心后取上清液,加水至400 µL并加入300 µL 5 mol·L-1NaCl和300 µL异丙醇,充分混匀后冰浴20 min;(4)4 ℃、12 000 r·min-1离心15 min,去上清液,加入预冷的75%乙醇使其从底部弹起悬浮;(5)于4℃下,7 500 r·min-1离心5 min, 弃除上清液并风干10~15 min;(6)用20~50 µL RNase-free水溶解沉淀,取出2~5 µL用于后续检测,其余-80℃贮存。
1.2.1.5 百泰克试剂盒法 参照百泰克公司植物总RNA提取试剂盒(RP3301)指导说明书进行,以30 µL RNase-free水溶解沉淀,取出2~5 µL用于后续检测,其余-70℃贮存。
1.2.1.6 天根试剂盒法 参照天根公司RNAprep Pure植物总RNA提取试剂盒(DP441)指导说明书进行,以30 µL RNase-free水溶解沉淀,取出2~5 µL用于后续检测,其余-70℃贮存。
1.2.2 总RNA检测
1.2.2.1 总RNA的纯度检测 用NanoDrop2000c 微量紫外分光光度计测定样品OD260/OD280,OD260/OD230的比值和总RNA的浓度。通常,OD260/OD280以及OD260/OD230的比值的范围在1.8~2.1,说明核酸的杂质较少、纯度较高。1.2.2.2 总RNA完整性的检测 取6种方法提取总RNA样品,在1.2%的非变性琼脂糖凝胶上进行电泳检测,测定总RNA的完整性。RNA的完整性可以通过28S、18S以及5S的完整度及明亮度进行检测。但是,由于植物叶片中含有大量叶绿体RNA,凝胶显像中可见4条或更多rRNA。通常较完整的RNA的28S亮度是18S亮度的1.5~2.0倍,5S末端较锐利,不弥散,否则表示RNA样品产生了降解,出现弥散片状或条带消失即表明样品RNA严重降解[6~8]。
2 结果与分析
2.1 6种总RNA提取方法的比较
用NanoDrop2000c测定不同提取方法的总RNA的OD260/OD280、OD260/OD230的比值以及总RNA的浓度结果(表1),通过琼脂糖凝胶电泳检测RNA的完整性(图1)。
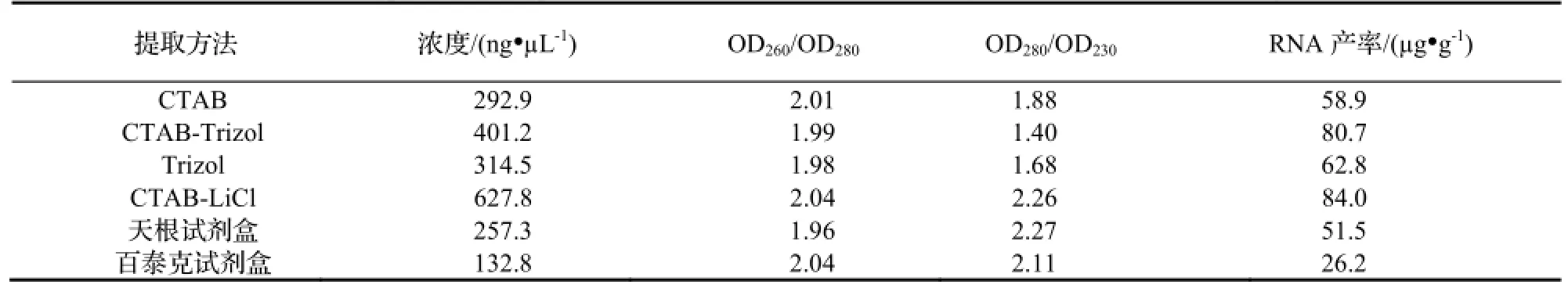
表1 6种不同方法提取的草珊瑚叶片总RNA纯度、浓度检测比较Table 1 Comparison of the purity and yield of total RNA extracted by six methods in leaves of S. glabra
由图1、表1可知,电泳图CTAB-LiCl法和天根总RNA提取试剂盒法提取出的总RNA在28S、18S条带清晰、完整、无弥散,加样孔内较干净,OD260/OD280的比值范围在1.9~2.1,说明没有蛋白质的污染,而OD260/OD230的比值大于2.0,说明RNA没有盐类等杂质的干扰。但是CTAB-LiCl法在点样孔附近有些微弱条带,有轻微DNA污染。天根总RNA提取试剂盒法由于在实验步骤中加入了DNA酶,消除了DNA存在的可能。从28S和18S条带的亮度和完整度可知,CTAB-LiCl法得到的总RNA含量比较高,而天根试剂盒法得到的总RNA含量比较低;CTAB法得到的总RNA的完整性低,含量低,且有轻微DNA污染,但其纯度较高;CTAB-Trizol法在点样孔附近有蛋白残留,且总RNA完整性低;Trizol法得到的总RNA有大量的DNA污染出现,且其完整性和纯度不高,CTAB-Trizol法和Trizol法的试剂成分可能会影响提取结果,OD260/OD230含量较低,胍类等盐分残留较多;百泰克RNA提取试剂盒法提取出的总RNA完整性不高,含量低,有轻微DNA污染。
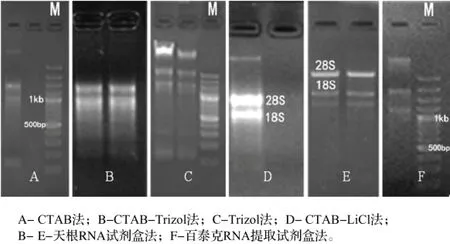
图1 6种不同方法提取的草珊瑚叶片总RNA电泳检测结果Figure 1 Electrophoretograms of total RNA extracted from leaves of S. glabra. by six different methods
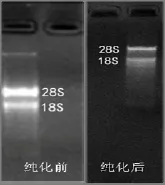
图2 CTAB-LiCl法提取的RNA纯化前后电泳图对比Figure 2 Comparison of electrophoretogram of RNA extracted
综上所述,CTAB法、CTAB-Trizol法、Trizol法以及百泰克试剂盒都不适合提取草珊瑚的总RNA;CTAB-LiCl法提取草珊瑚叶片总RNA时需用DNA酶处理完后,再浓缩纯化;天根总RNA提取试剂盒法可以直接用来快速、简洁的提取草珊瑚叶片总RNA,但是得到的总RNA含量及成功率较低。试验表明,采用CTAB-LiCl法以及天根试剂盒法提取草珊瑚总RNA较为合适,但需要进一步消除DNA的污染。
2.2 总RNA中的DNA去除及纯化
把两管CTAB-LiCl法所得的RNA合并,用DNase-I,RNase-free酶处理后,经NaCl等纯化浓缩处理后用20 µL体积的RNase-free水溶解沉淀,所得的RNA的完整性、纯度、浓度均可达到要求,见图2、表2。
采用CTAB-LiCl法提取后,再经过纯化,能够看到清晰的条带,28S与18S的荧光亮度接近2:1。条带之间十分清晰并且没有弥散发生,表明纯化的RNA结构完整,没有产生降解。用此方法提取的RNA已经达到了构建了cDNA文库的条件。

表2 总RNA去除DNA及纯化前后的浓度及纯度对比Table 2 Comparison of purity and yield of total RNA extracted by CTAB-LiCl before and after purification
3 讨论与结论
提取高质量、结构完整的总RNA是植物分子生物学研究的基础,现今已有较多的植物RNA分离提取的报道[13~15]。草珊瑚含有丰富的黄酮类物质,目前从草珊瑚中分离到的黄酮类化合物有24种[16~17],黄酮类又被称为多酚类化合物。此外,草珊瑚粗多糖的提取率为7.7%,其中多糖含量为13.2%[18]。草珊瑚是多年生草本或亚灌木,其组织富含多酚、多糖及其它次级代谢产物[16,19~20]。植物总RNA的提取方法有多种,对于特定植物选择一种简便、经济、快速的方法对于该种类植物的分子生物学研究十分的必要。
本试验结合草珊瑚叶片中富含多酚、多糖及其它次级代谢产物较多的特点,利用CTAB,CTAB-LiCl,CTAB-Trizol,Trizol,天根试剂盒以及百泰克试剂盒6种方法来提取总RNA。其中CTAB-LiCl法以及天根试剂盒法比较适合提取草珊瑚叶片的总RNA。草珊瑚叶片中含有较多的多酚类和多糖类物质,而酚类化合物在匀浆时容易被氧化成醌类物质,能与RNA产生不可逆的结合,从而影响总RNA的提取质量。目前,一般采用在提取的初始阶段防止其被氧化,然后再将其与RNA分开[20~21]的方法来去除酚类物质。采用CTAB-LiCl提取草珊瑚总RNA时,在初始阶段加入聚乙烯吡咯烷酮(PVP)和β-巯基乙醇来去除酚类化合物,而LiCl能选择性地沉淀高分子量的RNA,这样就可以去除DNA的干扰。同时,天根试剂盒在实验初始阶段中也加入了β-巯基乙醇,在实验进程中加入了DNA酶去除了DNA的干扰。多糖的许多理化性质与RNA相似,在提取过程中能与RNA共沉淀,很难将它们分开,在实验中加入KAC(醋酸钾)及无水乙醇可以去除大部分多糖。
本研究选择的CTAB-LiCl法以及天根试剂盒法能够有效的防止多酚及多糖物质的干扰,获得质量高、完整性好、纯度高的总RNA,能够满足草珊瑚后续cDNA文库构建、相关持家基因的克隆及相关基因功能的验证提供了试验基础,并为其它植物RNA提取提供了试参考依据。
[1] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:化学工业出版社,2005:154-155.
[2] 中国科学院中国植物志编辑委员会. 中国植物志(第二十卷 第一分册)[M]. 北京:科学出版社,1982:79.
[3] 倪开诚,闵芳,郭卫东,等. 采用ISSR分子标记进行草珊瑚8个种源的遗传多样性分析[J]. 中草药,2008,9:1 392-1 396.
[4] He X F,Yin S,Ji Y C,et al. Sesquiterpenes and dimeric sesquiterpenoids from Sarcandra glabra[J]. J Nat Prod,2010,73(1):45-50.
[5] Zhou H,Liang J,Lu D,et al. Characterization of phenolics of Sarcandra glabra by non-targeted high-performance liquid chromatography fingerprinting and following targeted electrospray ionisation tandem mass spectrometry/time-of-flight mass spectrometry analyses [J]. Food Chem, 2013,138(4):2 390-2 398.
[6] 吴林,薛建平,徐有明,等. 半夏叶片总RNA四种提取方法及效果的比较[J]. 中草药,2008,06:901-905.
[7] 王玉成,杨传平,姜静. 木本植物组织总RNA提取的要点与原理[J]. 东北林业大学学报,2002,2:1-4.
[8] 薛艺敏. 雷公藤叶片cDNA文库的构建与EST分析[D].福州:福建农林大学,2013.
[9] Jamalnasir H,Wagiran A,Shaharuddin N A,et al. Isolation of high quality RNA from plant rich in flavonoids, Melastoma decemfidum Roxb ex. Jack[J]. Aust J Crop Sci,2013,7(7):911-916.
[10] 赵锦,刘中成,代丽等. 枣不同器官和组织RNA提取方法的研究[J]. 植物遗传资源学报,2009,10(1):111-117.
[11] Chow K L,Tsang W H,Lee J T Y. Simple Modifications to Standard TRIzol® Protocol Allow High-Yield RNA Extraction from Cells on Resorbable Materials[J]. J Biomater Nanobiotechnol,2011,02(01):41-48.
[12] 宋蓓,赵锦,刘孟军,等. 改良CTAB-LiCl法提取枣总RNA体系的建立[J]. 中国农学通报,2007,7(23):79-83.
[13] 谭丽丽,燕正民,徐亚英,等. 番茄叶片总RNA提取方法的比较[J]. 东北农业学报,2010,4(4):29-32
[14] 王梦娜,武艳,程国山,等. 茶树叶片总RNA提取方法的比较研究[J]. 植物生理学报,2013,49(1):95-99.
[15] 白云凤,郭志华,白冬梅,等. 马铃薯总RNA提取和鉴定方法的改进[J]. 园艺学报,2007,34(4):1 059-1 062.
[16] 徐艳琴,刘小丽,黄小方,等. 草珊瑚的研究现状与展望[J]. 中草药,2011,12:2 552-2 559.
[17] 胡晓茹. 草珊瑚的化学成分研究[D]. 北京:北京协和医学院中国医学科学院药用植物研究所,2009.
[18] 邵佳,郁建平,胡美忠. 草珊瑚水溶性粗多糖提取及抗氧化性能研究[J]. 食品科学,2007,11:283-286.
[19] 陈瑾,迪丽拜尔·托乎提,郭卫东. 五种提取草珊瑚叶片总DNA方法的比较研究[J]. 新疆师范大学学报(自然科学版),2008,01:87-89.
[20] 李宏. 植物组织RNA提取的难点及对策[J]. 生物技术通报,1999,1:38-41.
[21] Loomis W D. Overcoming problems of phenolics and quinines in the isolation of plant enzymes and organelles[J]. Method Enzymol,1974,31: 528-545.
Comparison on Methods of Total RNA Extraction from Sarcandra glabra Leaves
SHEN Shao-yan1,XIE De-jin2,WU Yu-xiang1,RONG Jun-dong2,HE Tian-you1,CHEN Li-guang2,ZHENG Yu-shan1,2*
(1.Department of Landscape,Fujian Agriculture and Forestry University,Fuzhou 350002,China;2.Department of forestry, Fujian Agriculture and Forestry University, Fuzhou, 350002,China)
Experiments were conducted on total RNA extraction from Sarcandra glabra leaves by CTAB, CTAB-LiCl, CTAB-Trizol, Trizol, TIANGEN RNAprep Pure Plant Kit and Bio Teke RNApure Total RNA Plant kit. Comparisons were made on the extraction efficiencies by UV spectrophotometer detection and electrophoresis. The result showed that extraction by CTAB-LiCl and TIANGEN RNAprep Pure Plant Kit was better for total RNA in leaves of S. glabra, because the total RNA extracted by above two methods had better integrity and purity without obvious contamination like proteins and other impurities. The ratio of OD260/OD280was among 1.9-2.1, OD260/OD230among 2.0-2.4.
Sarcandra glabra; RNA extraction; CTAB-LiCl; TIANGEN RNAprep Pure Plant Kit
S567.9
A
1001-3776(2016)05-0040-05
2016-05-09;
2016-07-23
福建省科技重大专项(2004YZ02-05)资助;福建省科技创新平台(2008Y2001)资助
沈少炎(1992-),男,硕士研究生,从事园林植物与观赏园艺研究;*通讯作者。
