低温条件下ABA和钨酸钠对茶树叶片中渗透调节物质含量及抗氧化酶活性的影响
2016-02-16李庆会朱旭君房婉萍
李 磊, 周 琳, 李庆会, 徐 辉, 朱旭君, 房婉萍
(南京农业大学园艺学院 茶叶科学研究所, 江苏 南京 210095)
低温条件下ABA和钨酸钠对茶树叶片中渗透调节物质含量及抗氧化酶活性的影响
李 磊, 周 琳, 李庆会, 徐 辉, 朱旭君, 房婉萍①
(南京农业大学园艺学院 茶叶科学研究所, 江苏 南京 210095)
为探讨外源脱落酸(ABA)及其抑制剂钨酸钠对茶树〔Camelliasinensis(Linn.) O. Ktze.〕耐寒性的影响效应,以茶树品种‘龙井43’(‘Longjing 43’)的2年生幼苗为实验材料,在低温(4 ℃)条件下分别设置50 mg·L-1ABA和20 mmol·L-1钨酸钠单一及复合处理共6个处理组(T1:仅喷施蒸馏水,对照;T2:仅喷施ABA;T3:仅喷施钨酸钠;T4:同时喷施ABA和钨酸钠; T5:0 h时喷施ABA,24 h时喷施钨酸钠; T6:0 h时喷施钨酸钠, 24 h时喷施ABA),对处理0~72 h叶片中渗透调节物质含量和抗氧化酶活性的变化进行了比较分析。结果显示:低温条件下,各处理组幼苗叶片中可溶性糖、游离脯氨酸和可溶性蛋白质含量以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性均在处理初期逐渐升高,之后各指标的变化趋势存在差异。在处理的中后期,除T4处理组的游离脯氨酸含量低于对照组外,各处理组的可溶性糖、游离脯氨酸和可溶性蛋白质含量总体上显著高于对照组;T2处理组的SOD、CAT和POD活性均显著高于对照组,而T3处理组仅SOD活性明显高于对照组,其CAT和POD活性则低于或略高于对照组。对各单一与复合处理组的比较结果显示:T4处理组的SOD和POD活性总体上低于T2处理组,但高于T3处理组;而其CAT活性总体上低于T2和T3处理组。在处理24 h后,T5处理组的可溶性糖、游离脯氨酸和可溶性蛋白质含量以及SOD和POD活性的变化趋势与T2处理组一致;T6处理组的可溶性糖和游离脯氨酸含量及POD活性变化趋势与T3处理组一致,而其可溶性蛋白质含量以及SOD和CAT活性的变化趋势却与T3处理组有一定差异。上述研究结果表明:低温条件下喷施适量的ABA或钨酸钠均可以提升茶树叶片中渗透调节物质含量及抗氧化酶活性,但同时喷施ABA和钨酸钠对茶树叶片中渗透调节物质含量及抗氧化酶活性的影响却不显著。
茶树; 脱落酸(ABA); 钨酸钠; 耐寒性; 渗透调节物质; 抗氧化酶
茶树〔Camelliasinensis(Linn.) O. Ktze.〕为山茶科(Theaceae)山茶属(CamelliaLinn.)多年生常绿木本植物,是一种喜暖喜湿的叶用经济植物。茶树的生长和分布受品种、光照、土壤条件、水分和温度等因素的影响,其中,温度和水分是影响茶树自然分布和产量的重要限制因素。近年来全球气候变化异常,使春茶频繁的遭遇“霜冻”和“倒春寒”等低温灾害,造成茶叶产量减少、品质下降和上市时间推迟等问题,严重影响了茶叶的生产和经济效益。目前,在茶树低温胁迫研究方面虽然已取得一定的研究成果[1],但较水稻(OryzasativaLinn.)[2]、玉米(ZeamaysLinn.)[3]和小麦(TriticumaestivumLinn.)[4]等作物而言,茶树的耐低温胁迫研究相对滞后。
脱落酸(abscisic acid,ABA)是调控植物生长发育的激素之一。在高等植物体内,ABA以间接途径合成为主,即以类胡萝卜素合成途径为主,在类胡萝卜素合成途径中生成的ABA醛是合成ABA的前体物质[5]。ABA合成抑制剂钨酸钠能抑制ABA合成过程中的ABA醛氧化酶(ABA-aldehyde oxidase)活性,使ABA醛不能转化为ABA[6]。逆境胁迫下,植物体内的可溶性糖、游离脯氨酸和可溶性蛋白质等渗透调节物质的含量均不同程度升高[7],且植物体经过长期进化形成了完善的抗氧化系统清除活性氧,以应对低温胁迫的伤害[8]。外源ABA可提高植物抗冷性或抗寒性,这一特性在水稻[9]、甜椒(CapsicumannuumLinn.)[10]、小麦[4]和玉米[11]等多种植物中已经得到研究证实,但目前研究者们对低温胁迫下外源ABA及钨酸钠对茶树抗寒性的影响尚未知。
作者以茶树品种‘龙井43’(‘Longjing 43’)的2年生幼苗为实验材料,通过单一或混合喷施50 mg·L-1ABA和20 mmol·L-1钨酸钠,研究了低温(4 ℃)条件下外源ABA及钨酸钠对茶树幼苗叶片中渗透调节物质含量和抗氧化酶活性的影响,旨在初步探讨外源ABA及钨酸钠对茶树低温生理特性的作用机制,为茶树抗寒性的人工调控提供基础实验数据。
1 材料和方法
1.1 材料
供试材料为茶树品种‘龙井43’的2年生幼苗,由南京农业大学茶叶科学研究所提供。供试幼苗培养在装有pH 5.5营养液(配方由中国科学院南京土壤研究所提供)的聚乙烯盆(容积为20 L)中,用海绵与硬质泡沫板固定幼苗, 每盆20株, 充分供氧, 每7天更换1次营养液。培养条件为昼温25 ℃,夜温20 ℃, 光照强度120 μmol·m-2·s-1, 光照时间12 h·d-1,空气相对湿度75%~80%。
1.2 方法
1.2.1 处理方法 将茶树幼苗置于温度4 ℃、光照强度120 μmol·m-2·s-1人工气候箱中进行培养,采用完全随机试验设计进行处理,共设置6个处理组,均重复3次。 T1处理组: 仅喷施蒸馏水, 对照; T2处理组: 仅喷施50 mg·L-1ABA; T3处理组: 仅喷施20 mmol·L-1钨酸钠; T4处理组:同时喷施50 mg·L-1ABA和20 mmol·L-1钨酸钠;T5处理组:0 h时喷施50 mg·L-1ABA,24 h时喷施20 mmol·L-1钨酸钠; T6处理组: 0 h时喷施20 mmol·L-1钨酸钠, 24 h时喷施50 mg·L-1ABA。对幼苗嫩叶进行喷施处理,各处理组喷施溶液的体积相同;从喷施处理开始时计算时间,并于处理0、4、8、12、24、48和72 h时采集叶片用于相关指标测定,采样部位为植株顶部从上往下第2至第3位叶。
1.2.2 指标测定方法 采用蒽酮比色法[12]测定可溶性糖含量;采用酸性茚三酮显色法[13]测定游离脯氨酸含量;采用考马斯亮蓝法[14]测定可溶性蛋白质含量;采用NBT(氮蓝四唑)法[15]测定超氧化物歧化酶(SOD)活性;采用紫外吸收法[16]测定过氧化氢酶(CAT)活性;采用愈创木酚法[17-18]测定过氧化物酶(POD)活性。所有指标均重复测定3次。
1.3 数据处理和统计分析
实验数据用EXCEL 2003与SPSS 20.0统计分析软件进行统计分析,采用Duncan’s新复极差法进行多重比较[19]。
2 结果和分析
2.1 低温条件下喷施ABA和钨酸钠对茶树幼苗叶片中渗透调节物质含量的影响
低温(4 ℃)条件下单一或混合喷施ABA和钨酸钠后茶树幼苗叶片中可溶性糖、游离脯氨酸和可溶性蛋白质含量的动态变化见表1。
2.1.1 对可溶性糖含量的影响 由表1可以看出:低温条件下处理0~72 h,随处理时间的延长,T1(仅喷施蒸馏水,对照)、T4(同时喷施50 mg·L-1ABA和20 mmol·L-1钨酸钠)和T5(0 h时喷施50 mg·L-1ABA,24 h时喷施20 mmol·L-1钨酸钠)处理组茶树叶片中可溶性糖含量总体呈逐渐升高的趋势;T2(仅喷施50 mg·L-1ABA)和T3(仅喷施20 mmol·L-1钨酸钠)处理组的可溶性糖含量呈先显著升高后显著降低的趋势, 且均在处理48 h达到峰值; T6(0 h时喷施20 mmol·L-1钨酸钠,24 h时喷施50 mg·L-1ABA)处理组的可溶性糖含量则呈先显著升高后略有下降的趋势。
在处理的8~48 h,T2处理组的可溶性糖含量较对照显著升高;在处理的4~24 h,T3和T6处理组的可溶性糖含量显著高于其他处理组,可能与钨酸钠抑制茶树内源ABA合成有关,茶树为适应低温环境,诱导可溶性糖含量升高;在处理的0~24 h,T2和T5处理组的可溶性糖含量无显著差异,但在处理的48~72 h,T5处理组的可溶性糖含量显著高于T2处理组,这2个处理组的差别在于T5处理组在处理24 h时喷施了20 mmol·L-1钨酸钠,推测T5处理组的可溶性糖含量在实验中后期急剧升高也与钨酸钠抑制了茶树内源ABA的合成有关;在处理的8~72 h,T5处理组的可溶性糖含量显著高于T4处理组和对照组,表明外源ABA可通过提高可溶性糖含量来提高植物的抗冷性,而喷施钨酸钠后,虽然内源ABA合成途径受阻,但由于前期喷施外源ABA,可溶性糖含量仍能维持在一个较高的水平。
2.1.2 对游离脯氨酸含量的影响 由表1还可以看出:低温条件下,在处理的0~48 h,对照组茶树叶片中的游离脯氨酸含量呈显著上升的趋势,在处理48 h之后游离脯氨酸含量趋于稳定;在处理的0~72 h,T2和T5处理组的游离脯氨酸含量呈先显著升高后显著降低的趋势,且均在处理48 h达到峰值;T3、T4和T6处理组的游离脯氨酸含量则总体上呈显著升高的趋势。
在处理的4~72 h,T3处理组的游离脯氨酸含量显著高于其他处理组,而T4处理组的游离脯氨酸含量总体上显著低于其他处理组。T4处理组和对照组的游离脯氨酸含量均较低,可能是由于喷施外源ABA提高了游离脯氨酸的合成,而喷施钨酸钠导致内源ABA合成受阻,最终导致同时喷施ABA和钨酸钠对游离脯氨酸含量的影响不显著。
2.1.3 对可溶性蛋白质含量的影响 由表1还可以看出:低温条件下,在处理的0~72 h,对照组茶树叶片中的可溶性蛋白质含量呈先显著升高后略有降低的趋势;T2、T5和T6处理组的可溶性蛋白质含量呈先升高后降低的趋势,且均在处理24 h达到峰值;T3处理组的可溶性蛋白质含量呈显著升高的趋势,说明喷施钨酸钠后,内源ABA合成受阻,降低了茶树的抗冷性,但为了应对低温环境,导致其可溶性蛋白质含量升高;T4处理组的可溶性蛋白质含量的变化趋势与对照组类似,但总体上显著高于对照组。
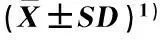
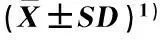

处理2)Treatment2)不同处理时间叶片的可溶性糖含量/% Solublesugarcontentinleafatdifferenttreatmenttimes0h4h8h12h24h48h72hT110.56±0.14fA11.19±0.55efC11.76±0.30eD13.35±0.49dE16.18±0.63cE20.03±1.67bD21.45±0.79aDT29.83±1.00fB11.13±1.14eC14.81±0.43dC17.70±0.45cC20.14±0.90bC22.50±1.05aC21.12±0.52bDT310.46±0.18fAB14.72±0.70eB18.23±0.31dB22.12±1.49cB24.19±0.53bB26.74±0.68aB24.62±0.58bCT410.36±0.21eAB11.66±0.27dC12.01±0.26dD13.94±0.50cD17.52±1.02bD21.65±1.59aC21.82±0.72aDT59.91±1.01fAB11.17±1.15eC14.75±0.33dC17.73±0.38cC20.05±0.82bC26.00±0.73aB25.45±0.75aBT610.52±0.28eAB22.91±0.97dA25.57±1.67cA27.64±0.36bA29.16±0.32aA28.55±0.46abA28.95±0.25aA
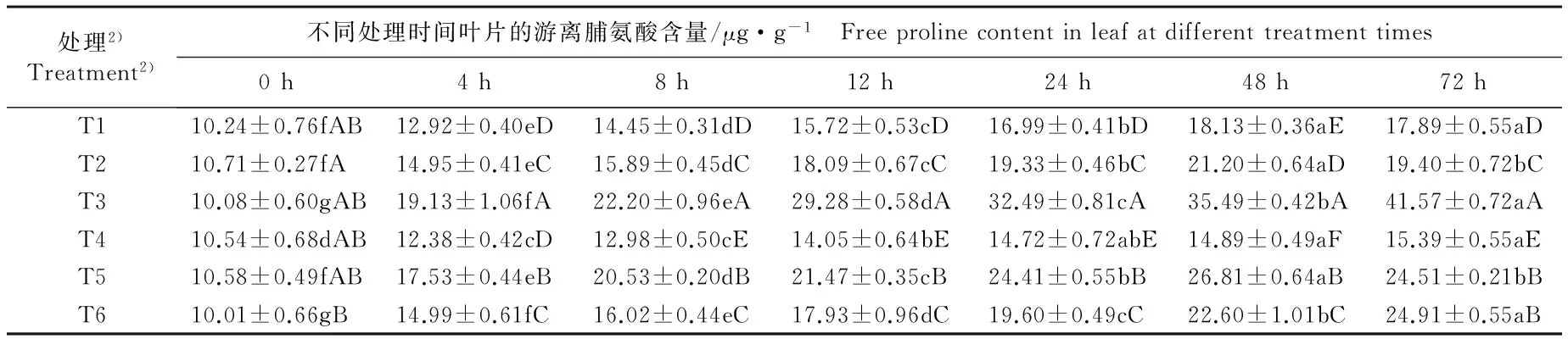
处理2)Treatment2)不同处理时间叶片的游离脯氨酸含量/μg·g-1 Freeprolinecontentinleafatdifferenttreatmenttimes0h4h8h12h24h48h72hT110.24±0.76fAB12.92±0.40eD14.45±0.31dD15.72±0.53cD16.99±0.41bD18.13±0.36aE17.89±0.55aDT210.71±0.27fA14.95±0.41eC15.89±0.45dC18.09±0.67cC19.33±0.46bC21.20±0.64aD19.40±0.72bCT310.08±0.60gAB19.13±1.06fA22.20±0.96eA29.28±0.58dA32.49±0.81cA35.49±0.42bA41.57±0.72aAT410.54±0.68dAB12.38±0.42cD12.98±0.50cE14.05±0.64bE14.72±0.72abE14.89±0.49aF15.39±0.55aET510.58±0.49fAB17.53±0.44eB20.53±0.20dB21.47±0.35cB24.41±0.55bB26.81±0.64aB24.51±0.21bBT610.01±0.66gB14.99±0.61fC16.02±0.44eC17.93±0.96dC19.60±0.49cC22.60±1.01bC24.91±0.55aB

处理2)Treatment2)不同处理时间叶片的可溶性蛋白质含量/μg·g-1 Solubleproteincontentinleafatdifferenttreatmenttimes0h4h8h12h24h48h72hT112.46±0.16cAB15.99±0.14bF17.19±2.13aD16.36±0.70abE16.10±0.32bF16.40±0.14abF16.59±0.14abFT212.58±0.69eAB17.34±0.47dD17.68±0.43cdD19.36±0.67bD28.66±0.84aD19.57±0.85bE18.58±1.08bcET312.56±0.21gAB18.74±0.29fC20.82±0.52eB21.98±0.68dC30.88±0.55cB42.20±0.84bA53.63±0.65aAT411.92±0.42dB16.44±0.24cE19.50±0.80bC19.34±0.10bD19.83±0.70bE20.60±0.35aD20.49±0.40aDT512.66±0.46fA20.23±0.34eB21.81±0.41dB23.45±0.54bB29.75±0.18aC22.36±0.48cC21.63±0.38dCT612.68±0.26gA21.13±0.36fA23.43±0.33eA24.51±0.87dA33.21±0.36aA26.21±0.62cB28.98±0.38bB
1)同行中不同的小写字母表示差异显著(P=0.05) Different small letters in the same row indicate the significant difference (P=0.05); 同列中不同的大写字母表示差异显著(P=0.05) Different capitals in the same column indicate the significant difference (P=0.05).
2)T1: 仅喷施蒸馏水,对照 Only spraying distilled water, the control; T2: 仅喷施50 mg·L-1ABA Only spraying 50 mg·L-1ABA; T3: 仅喷施20 mmol·L-1钨酸钠Only spraying 20 mmol·L-1sodium tungstate; T4: 同时喷施50 mg·L-1ABA和20 mmol·L-1钨酸钠Spraying 50 mg·L-1ABAand20mmol·L-1sodiumtungstateatthesametime; T5: 0 h时喷施50 mg·L-1ABA, 24 h时喷施20 mmol·L-1钨酸钠Spraying 50 mg·L-1ABA at 0 h, and spraying 20 mmol·L-1sodium tungstate at 24 h; T6: 0 h时喷施20 mmol·L-1钨酸钠,24 h时喷施50 mg·L-1ABA Spraying 20 mmol·L-1sodium tungstate at 0 h, and spraying 50 mg·L-1ABA at 24 h.
在处理的4~72 h,对照组的可溶性蛋白质含量总体上显著低于其他处理组。在处理的0~24 h,T5和T6处理组的可溶性蛋白质含量总体上显著高于其他处理组;在处理的48~72 h,T3处理组的可溶性蛋白质含量显著高于其他处理组。
T2处理组的可溶性蛋白质含量在低温胁迫初期和中期总体上显著高于对照组,与同时期T4处理组相近,但与其他处理组相比较其可溶性蛋白质含量偏低,推测可能是茶树的抗寒途径并不单一,虽然ABA在植物抗寒过程中起着非常重要的作用,但并不是惟一途径,茶树可能通过非ABA依赖的低温应答途径提高其他抗寒基因表达从而增加对应蛋白的合成,最终提高其抗寒性。
2.2 低温条件下喷施ABA和钨酸钠对茶树幼苗叶片中抗氧化酶活性的影响
低温(4 ℃)条件下单一或混合喷施ABA和钨酸钠后茶树幼苗叶片中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性的动态变化见表2。
2.2.1 对SOD活性的影响 由表2可以看出:低温条件下,T1(仅喷施蒸馏水,对照)处理组茶树叶片中的SOD活性在处理的0~48 h逐渐升高,随后在处理的72 h又显著降低。在处理的0~72 h,T2(仅喷施50 mg·L-1ABA)、 T5(0 h时喷施50 mg·L-1ABA, 24 h时喷施20 mmol·L-1钨酸钠)和T6(0 h时喷施20 mmol·L-1钨酸钠,24 h时喷施50 mg·L-1ABA)处理组的SOD活性总体上呈显著升高的趋势,其中,T5处理组在喷施钨酸钠后SOD活性的变幅较小;T6处理组在喷施钨酸钠后SOD活性显著升高,但在处理12 h后差异不显著,24 h时喷施ABA后其SOD活性显著升高。T3(仅喷施20 mmol·L-1钨酸钠)和T4(同时喷施50 mg·L-1ABA和20 mmol·L-1钨酸钠)处理组的SOD活性在处理的0~24 h间显著升高,随后显著降低。
在处理的4~72 h,T2处理组的SOD活性显著高于其他处理组;对照组和T3处理组的SOD活性均较低,且总体上显著低于其他处理组。
2.2.2 对CAT活性的影响 由表2还可以看出:低温条件下, 对照组茶树叶片中的CAT活性在处理的0~8 h显著升高,在处理的8~48 h变幅较小,但在处理的48~72 h显著降低。在处理的0~72 h,T2和T4处理组的CAT活性总体上呈显著升高的趋势;T3和T5处理组的CAT活性在处理的0~48 h总体上显著升高,之后降低;T6处理组的CAT活性则呈波动的变化趋势,在处理的0~24 h显著升高,在处理的48 h显著降低,但在处理的72 h又显著升高。
在处理的0~72 h,T3处理组茶树叶片中的CAT活性总体上显著低于T2处理组,说明钨酸钠对CAT活性的影响程度小于外源ABA。在处理的4~48 h,T4处理组的CAT活性显著低于对照组。 在处理的0~72 h,T6处理组的CAT活性总体上较高。
2.2.3 对POD活性的影响 由表2还可以看出:低温条件下, 对照组茶树叶片中的POD活性在处理的0~12 h显著升高,之后逐渐下降;而其他处理组的POD活性则总体上在处理的0~24 h显著升高,之后显著降低。
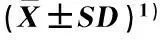
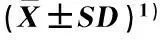
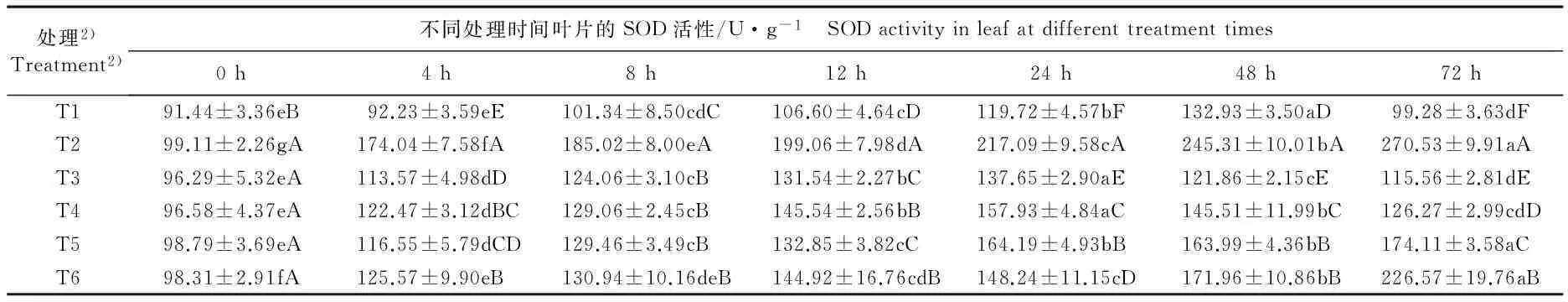
处理2)Treatment2)不同处理时间叶片的SOD活性/U·g-1 SODactivityinleafatdifferenttreatmenttimes0h4h8h12h24h48h72hT191.44±3.36eB92.23±3.59eE101.34±8.50cdC106.60±4.64cD119.72±4.57bF132.93±3.50aD99.28±3.63dFT299.11±2.26gA174.04±7.58fA185.02±8.00eA199.06±7.98dA217.09±9.58cA245.31±10.01bA270.53±9.91aAT396.29±5.32eA113.57±4.98dD124.06±3.10cB131.54±2.27bC137.65±2.90aE121.86±2.15cE115.56±2.81dET496.58±4.37eA122.47±3.12dBC129.06±2.45cB145.54±2.56bB157.93±4.84aC145.51±11.99bC126.27±2.99cdDT598.79±3.69eA116.55±5.79dCD129.46±3.49cB132.85±3.82cC164.19±4.93bB163.99±4.36bB174.11±3.58aCT698.31±2.91fA125.57±9.90eB130.94±10.16deB144.92±16.76cdB148.24±11.15cD171.96±10.86bB226.57±19.76aB
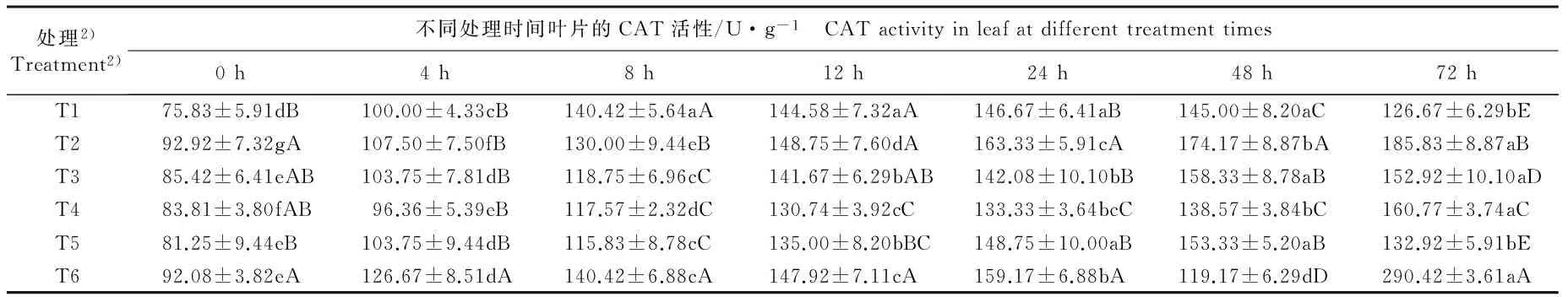
处理2)Treatment2)不同处理时间叶片的CAT活性/U·g-1 CATactivityinleafatdifferenttreatmenttimes0h4h8h12h24h48h72hT175.83±5.91dB100.00±4.33cB140.42±5.64aA144.58±7.32aA146.67±6.41aB145.00±8.20aC126.67±6.29bET292.92±7.32gA107.50±7.50fB130.00±9.44eB148.75±7.60dA163.33±5.91cA174.17±8.87bA185.83±8.87aBT385.42±6.41eAB103.75±7.81dB118.75±6.96cC141.67±6.29bAB142.08±10.10bB158.33±8.78aB152.92±10.10aDT483.81±3.80fAB96.36±5.39eB117.57±2.32dC130.74±3.92cC133.33±3.64bcC138.57±3.84bC160.77±3.74aCT581.25±9.44eB103.75±9.44dB115.83±8.78cC135.00±8.20bBC148.75±10.00aB153.33±5.20aB132.92±5.91bET692.08±3.82eA126.67±8.51dA140.42±6.88cA147.92±7.11cA159.17±6.88bA119.17±6.29dD290.42±3.61aA
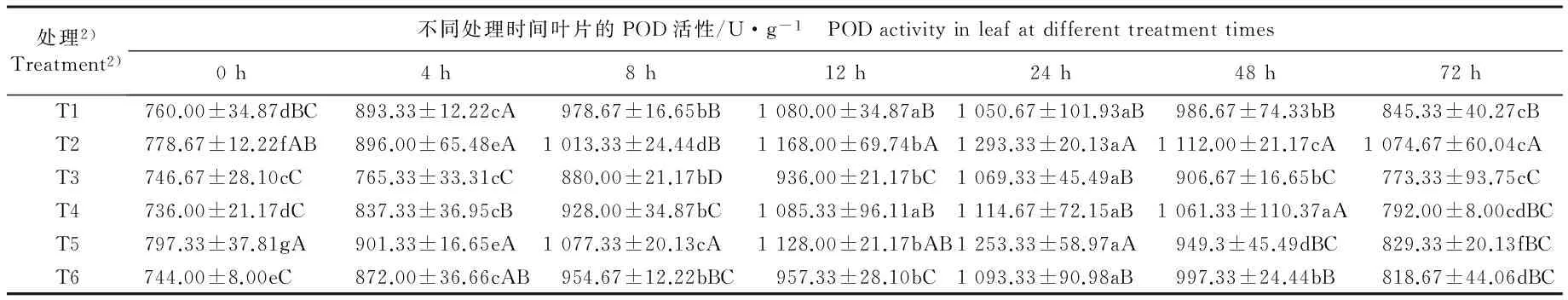
处理2)Treatment2)不同处理时间叶片的POD活性/U·g-1 PODactivityinleafatdifferenttreatmenttimes0h4h8h12h24h48h72hT1760.00±34.87dBC893.33±12.22cA978.67±16.65bB1080.00±34.87aB1050.67±101.93aB986.67±74.33bB845.33±40.27cBT2778.67±12.22fAB896.00±65.48eA1013.33±24.44dB1168.00±69.74bA1293.33±20.13aA1112.00±21.17cA1074.67±60.04cAT3746.67±28.10cC765.33±33.31cC880.00±21.17bD936.00±21.17bC1069.33±45.49aB906.67±16.65bC773.33±93.75cCT4736.00±21.17dC837.33±36.95cB928.00±34.87bC1085.33±96.11aB1114.67±72.15aB1061.33±110.37aA792.00±8.00cdBCT5797.33±37.81gA901.33±16.65eA1077.33±20.13cA1128.00±21.17bAB1253.33±58.97aA949.3±45.49dBC829.33±20.13fBCT6744.00±8.00eC872.00±36.66cAB954.67±12.22bBC957.33±28.10bC1093.33±90.98aB997.33±24.44bB818.67±44.06dBC
1)同行中不同的小写字母表示差异显著(P=0.05) Different small letters in the same row indicate the significant difference (P=0.05); 同列中不同的大写字母表示差异显著(P=0.05) Different capitals in the same column indicate the significant difference (P=0.05).
2)T1: 仅喷施蒸馏水,对照 Only spraying distilled water, the control; T2: 仅喷施50 mg·L-1ABA Only spraying 50 mg·L-1ABA; T3: 仅喷施20 mmol·L-1钨酸钠Only spraying 20 mmol·L-1sodium tungstate; T4: 同时喷施50 mg·L-1ABA和20 mmol·L-1钨酸钠Spraying 50 mg·L-1ABAand20mmol·L-1sodiumtungstateatthesametime; T5: 0 h时喷施50 mg·L-1ABA, 24 h时喷施20 mmol·L-1钨酸钠Spraying 50 mg·L-1ABA at 0 h, and spraying 20 mmol·L-1sodium tungstate at 24 h; T6: 0 h时喷施20 mmol·L-1钨酸钠,24 h时喷施50 mg·L-1ABA Spraying 20 mmol·L-1sodium tungstate at 0 h, and spraying 50 mg·L-1ABA at 24 h.
在处理的72 h,T2处理组的POD活性较对照组显著升高,增幅达到27.1%,而T3、T4、T5和T6处理组的POD活性无显著差异,但均低于T2处理组和对照组,且差异显著。处理的0~72 h,T2处理组的POD活性总体上显著高于T3处理组和对照组。推测喷施外源ABA或钨酸钠能够提高茶树叶片中的POD活性,并且喷施外源ABA对POD活性的影响大于钨酸钠。
3 讨论和结论
本研究结果显示, 低温(4 ℃)条件下, 在处理的0~72 h,T1(仅喷施蒸馏水,对照)处理组茶树叶片中的可溶性糖和游离脯氨酸含量总体上随处理时间延长呈显著升高的趋势,而可溶性蛋白质含量则呈先显著升高后略降低的趋势,并保持在较高水平,这可能是由于低温胁迫诱导了茶树体内响应蛋白的产生及渗透调节物质合成酶活性的提高,使得各类渗透调节物质含量上升,保持细胞渗透压平衡,达到维持细胞正常功能的目的。低温胁迫条件下,植物细胞内活性氧(ROS)浓度急剧升高,并超过植物本身ROS清除系统的能力,对植物体产生氧化损伤[20]。本研究中,在一定的处理时间内,对照组茶树叶片中的SOD、CAT和POD活性均升高,以清除因低温胁迫而产生的过量ROS,之后3种酶活性则不同程度降低。造成这一变化趋势的原因可能是随低温胁迫时间的延长,植物细胞的保护系统损伤加剧,抗氧化酶的合成也受到抑制,导致酶活性降低。朱政等[1]对茶树和冯建灿等[21]对喜树(CamptothecaacuminataDecne.)的研究也获得了类似的结果。
ABA也称为胁迫激素(stress hormone),外源ABA通过维持植物体内的水分平衡、诱导抗氧化系统、维持膜稳定性以及提高渗透调节物质水平等多种途径以提高植物的耐寒性,表现为可溶性糖、可溶性蛋白质和脯氨酸含量升高[22-23]等。本研究中,除处理初期外,T2(仅喷施50 mg·L-1ABA)处理组茶树叶片中渗透调节物质含量及抗氧化酶活性均显著高于对照组,同时,T5(0 h时喷施50 mg·L-1ABA,24 h时喷施20 mmol·L-1钨酸钠)处理组在处理0~24 h的变化趋势与T2处理组相似。低温条件下用ABA处理黄瓜(CucumissativusLinn.)幼苗后也有类似的现象[24]。在外源ABA作用下,植物相关基因被诱导表达,诱导合成逆境蛋白,同时ABA通过影响细胞内pH值,提高了茶树的内源ABA含量,从而提高了脯氨酸含量[25]。喷施钨酸钠会抑制植物体内源ABA的合成[8]。本研究中,喷施20 mmol·L-1钨酸钠后,茶树叶片中可溶性糖、游离脯氨酸和可溶性蛋白质的含量急剧升高,并且显著高于对照组,这可能由钨酸钠抑制ABA合成造成茶树耐寒性的降低,茶树产生的应激保护反应使茶树叶片中渗透调节物质含量升高以减轻伤害[26];而T4(同时喷施50 mg·L-1ABA和20 mmol·L-1钨酸钠)处理组的渗透调节物质含量变化总体上明显低于T2和T3处理组,与对照组趋势相近,而T5和T6处理组24 h时分别喷施钨酸钠和ABA后,与T2和T3处理组24 h后产生了显著差异。外源ABA提高了植物的抗冷性,但喷施钨酸钠抑制了茶树叶片内源ABA的形成,同时喷施ABA和钨酸钠对茶树渗透调节物质影响减小。
目前,植物响应低温胁迫主要分为依赖ABA途径和非依赖ABA途径[27]。ABA可以诱导抗氧化酶基因如Mn-SOD、过氧化物酶基因以及过氧化氢酶基因的表达[28]。本研究中,在低温条件下,对照组茶树叶片中SOD、CAT和POD活性均增强以适应低温环境;喷施50 mg·L-1外源ABA则能显著提高茶树叶片中SOD、CAT和POD的活性;而喷施20 mmol·L-1钨酸钠,仅SOD活性明显升高,CAT和POD的活性则较对照组降低或略有升高。这一现象的产生可能与茶树响应低温胁迫的不同途径有关。在低温条件下,外源喷施ABA促进了依赖ABA途径的信号转导;喷施钨酸钠阻断了ABA信号的转导,而茶树非依赖ABA途径的信号转导及时启动,通过调节茶树的渗透物质含量和抗氧化酶活性适应低温胁迫。
寒害是茶树常见的自然灾害之一,关于茶树抗寒性机制及其抗寒性育种的研究已经取得了一定的进展。在极低温度下,茶树并不能保持其抗寒性,导致受冻害严重,制约茶叶的质量和产量。近年来外源物质提高植物抗性的研究备受关注,本文初步验证了外源ABA和钨酸钠在低温条件下对茶树的影响,以期通过外源物质在短期内提高茶树抗寒性。
[1] 朱 政, 蒋家月, 江昌俊, 等. 低温胁迫对茶树叶片SOD、可溶性蛋白和可溶性糖含量的影响[J]. 安徽农业大学学报, 2011, 38(1): 24-26.
[2] 邓化冰, 车芳璐, 肖应辉, 等. 开花期低温胁迫对水稻花粉性状及剑叶理化特性的影响[J]. 应用生态学报, 2011, 22(1): 66-72.
[3] 徐田军, 董志强, 兰宏亮, 等. 低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J]. 作物学报, 2012, 38(2): 352-359.
[4] 刘丽杰. 低温下ABA调控冬小麦糖代谢及抗寒基因表达的研究[D]. 哈尔滨: 东北农业大学生命科学学院, 2013: 126-127.
[5] MILBORROW B V. The pathway of biosynthesis of abscisic acid in vascular plants: a review of the present state of knowledge of ABA biosynthesis[J]. Journal of Experimental Botany, 2001, 52: 1145-1164.
[6] HANSENH, GROSSMANNK. Auxin-inducedethylenetriggers abscisic acid biosynthesis and growth inhibition[J]. Plant Physiology, 2002, 124: 1437-1448.
[7] 邓雪柯, 乔代蓉, 李 良, 等. 低温胁迫对紫花苜蓿生理特性影响的研究[J]. 四川大学学报(自然科学版), 2005, 42(1): 190-194.
[8] 刘家忠, 龚 明. 植物抗氧化系统研究进展[J]. 云南师范大学学报(自然科学版), 1999, 19(6): 1-11.
[9] 朱素琴. 高盐/低温胁迫下水稻叶细胞内ASC的氧化还原状态和外源ABA的作用研究[D]. 扬州: 扬州大学生物科学与技术学院, 2011: 115-118.
[10] 罗立津, 徐福乐, 翁华钦, 等. 脱落酸对甜椒幼苗抗寒性的诱导效应及其机理研究[J]. 西北植物学报, 2011, 31(1): 94-100.
[11] ANDERSON M D, PRASAD T K, MARTIN B A, et al. Differen-tial gene expression in chilling acclimated maize seedlings and evidence for the involvement of abscisic acid in chilling tolerance[J]. Plant Physiology, 1994, 105: 331-339.
[12] YEMM E W, WILLIS A J. The estimation of carbohydrates in plant extracts by anthrone[J]. Biochemical Journal, 1954, 57: 508-514.
[13] 王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京: 高等教育出版社, 2008: 278-279.
[14] BRADFORD M M. A rapid and sensitive method for the quantita-tion of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[15] GIANNOPOLITIS CN,RIESSK.Superoxide dismutase: Ⅰ. Occurrenceinhigherplants[J]. Plant Physiology, 1977, 59: 309-314.
[16] AEBI H. Catalaseinvitro[J]. Methods in Enzymology, 1984, 105: 121-126.
[17] BERGMEYER H U. Methods of Enzymatic Analysis[M]. 2nd ed. New York: Academic Press, 1974: 1205-1214.
[18] KONG F X, HU W, CHAO S Y, et al. Physiological responses of the lichenXanthoparmeliamexicanato oxidative stress of SO2[J]. Environmental and Experimental Botany, 1999, 42: 201-209.
[19] 张文彤. SPSS统计分析基础教程[M]. 北京: 高等教育出版社, 2011: 266-270.
[20] 杜秀敏, 殷文璇, 赵彦修, 等. 植物中活性氧的产生及清除机制[J]. 生物工程学报, 2001, 17(2): 121-125.
[21] 冯建灿, 张玉洁, 杨天柱. 低温胁迫对喜树幼苗SOD活性、MDA和脯氨酸含量的影响[J]. 林业科学研究, 2002, 15(2): 197-202.
[22] GRAHAM D, PATTERSON B D. Responses of plants to low, nonfreezing temperatures: proteins, metabolism, and acclimation[J]. Annual Reviews of Plant Physiology, 2003, 33: 347-372.
[23] SAVOURÉ A, HUA X J, BERTAUCHE N, et al. Abscisic acid-independent and abscisic acid-dependent regulation of proline biosynthesis following cold and osmotic stress inArabidopsisthaliana[J]. Molecular and General Genetics, 1997, 254: 104-109.
[24] 贾庆虎. ABA对黄瓜幼苗抗冷性的影响[D]. 泰安: 山东农业大学园艺学院, 2007: 15-21.
[25] 周 琳, 徐 辉, 朱旭君, 等. 脱落酸对干旱胁迫下茶树生理特性的影响[J]. 茶业科学, 2014, 34(5): 473-480.
[26] 周碧燕, 郭振飞. ABA及其合成抑制剂对柱花草抗冷性及抗氧化酶活性的影响[J]. 草业学报, 2005, 14(6): 94-99.
[27] 陈 暄, 房婉萍, 邹中伟, 等. 茶树冷胁迫诱导抗寒基因CBF的克隆与表达分析[J]. 茶叶科学, 2009, 29(1): 53-59.
[28] GUO L W, CHEN R G, GONG Z H, et al. Exogenous abscisic acid increases antioxidant enzymes and related gene expression in pepper (Capsicumannuum) leaves subjected to chilling stress[J]. Genetics and Molecular Research, 2012, 11: 4063-4080.
(责任编辑: 张明霞)
Effects of ABA and sodium tungstate on osmoregulation substance content and antioxidant enzyme activity in leaf of Camellia sinensis under low temperature
LI Lei, ZHOU Lin, LI Qinghui, XU Hui, ZHU Xujun, FANG Wanping①
(Tea Research Institute, College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China),J.PlantResour. &Environ., 2016, 25(4): 18-24
In order to study effects of exogenous abscisic acid (ABA) and its inhibitor sodium tungstate on cold tolerance ofCamelliasinensis(Linn.) O. Ktze., taking two-year-old seedling ofC.sinensis‘Longjing 43’asexperimentalmaterial,sixtreatmentgroupsofsingleandmixed treatments of 50 mg·L-1ABA and 20 mmol·L-1sodium tungstate (T1: only spraying distilled water, the control; T2: only spraying ABA; T3: only spraying sodium tungstate; T4: spraying ABA and sodium tungstate at the same time; T5: spraying ABA at 0 h, and spraying sodium tungstate at 24 h; T6: spraying sodium tungstate at 0 h, and spraying ABA at 24 h) were set up under low temperature (4 ℃), changes in osmoregulation substance content and antioxidant enzyme activity in leaf treating for 0-72 h were compared and analyzed. The results show that contents of soluble sugar, free proline and soluble protein and activities of superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD) in leaf of seedling in each treatment group increase gradually at the early stage of treatment, and afterwards, changing trends of each index are different. At the middle and later stages of treatment, except free proline content in T4 treatment group is lower than that in the control group, contents of soluble sugar, free proline and soluble protein in each treatment group are generally significantly higher than those in the control group; activities of SOD, CAT and POD in T2 treatment group are significantly higher than those in the control group, while in T3 treatment group, only SOD activity is obviously higher than that in the control group, and activities of CAT and POD are lower or slightly higher than those in the control group. The results of comparison on single and mixed treatment groups show that activities of SOD and POD in T4 treatment group are generally lower than those in T2 treatment group, but are higher than those in T3 treatment group, while its CAT activity is generally lower than that in T2 and T3 treatment groups. After treated for 24 h, changing trends of contents of soluble sugar, free proline and soluble protein and activities of SOD and POD in T5 treatment group are consistent with those in T2 treatment group; changing trends of contents of soluble sugar and free proline and POD activity in T6 treatment group are consistent with those in T3 treatment group, but there are a certain differences in changing trends of soluble protein content and activities of SOD and CAT between T6 treatment group and T3 treatment group. It is suggested that spraying proper amount of ABA or sodium tungstate can enhance osmoregulation substance content and antioxidant enzyme activity in leaf ofC.sinensisunder low temperature, but effect of spraying ABA and sodium tungstate at the same time on osmoregulation substance content and antioxidant enzyme activity in leaf ofC.sinensisis not significant.
Camelliasinensis(Linn.) O. Ktze.; abscisic acid (ABA); sodium tungstate; cold tolerance; osmoregulation substance; antioxidant enzyme
2015-07-06
国家自然科学基金资助项目(31370688; 31400584); 南京市科技计划项目(2013创基066)
李 磊(1993—),男,浙江嘉兴人,硕士研究生,主要从事茶树栽培育种方面的研究。
①通信作者E-mail: fangwp@njau.edu.cn
Q945.78; S571.1
A
1674-7895(2016)04-0018-07
10.3969/j.issn.1674-7895.2016.04.03
