参附注射液对脓毒症大鼠心肌组织Bcl-2、Bax表达的影响
2016-02-16胡丹丹徐慧连楼黎明
胡丹丹 徐慧连 楼黎明
参附注射液对脓毒症大鼠心肌组织Bcl-2、Bax表达的影响
胡丹丹 徐慧连 楼黎明
目的研究参附注射对脓毒症大鼠心肌细胞凋亡及Bcl-2、Bax蛋白表达的影响,阐明参附注射液抗脓毒症心肌损伤的相关机制。方法雄性SD大鼠随机分为假手术组、模型组和参附组,每组8只。以盲肠结扎穿孔(cecal ligation and puncture,CLP)法建立脓毒症大鼠动物模型,观察各组大鼠心肌酶谱变化;凋亡原位末端标记法(TUNEL)检测心肌细胞凋亡指数,RT-PCR法检测心肌细胞Bcl-2 mRNA、Bax mRNA表达。结果与假手术组比较,模型组、参附组心肌肌酸激酶同工酶(CK-MB)、肌酸激酶(CK)均明显升高,差异有统计学意义[CK-MB:(4208.51±382.57)U/L、(3584.59±347.06)U/L比(2187.41±556.63)U/L,P<0.05;CK:(3216.75±565.42)U/L、(1986.21± 366.73)U/L比(1189.40±245.87)U/L,P<0.05];与参附组比较,模型组心肌酶明显升高,差异有统计学意义(P<0.05)。三组均可见大鼠心肌细胞凋亡,与假手术组比较,模型组、参附组TUNEL平均光密度(MOD)升高,差异有统计学意义(0.24±0.11、0.18±0.09比0.09±0.05,P<0.05);模型组升高最明显,与参附组比较差异有统计学意义(P<0.05)。模型组、参附组大鼠心肌细胞Bcl-2 mRNA表达均较假手术组降低,差异有统计学意义 [(3.83±0.07)×10-3、(4.86±0.08)×10-3比(5.75±0.09)×10-3,P<0.05];参附组Bcl-2 mRNA表达高于模型组(P<0.05)。模型组、参附组Bax mRNA表达均较假手术组升高[(7.12±0.08)×10-3、(6.26±0.06)×10-3比(4.61±0.05)×10-3,P<0.05];参附组Bax mRNA表达低于模型组(P<0.05)。结论参附注射液能减轻脓毒症大鼠的心肌损伤,其作用机制与上调Bcl-2 mRNA的表达,下调Bax mRNA表达,减少心肌细胞凋亡相关。
大鼠;脓毒症;心肌;Bcl-2;Bax;参附注射液
脓毒症是严重创伤、重症感染等多种危重疾病应激状态下的常见并发症,具有高发病率,高死亡率的特点,其高死亡率与它易致多脏器功能损伤直接相关。40%~50%的脓毒症可导致心功能不全,其特征为左右心室扩大、收缩功能下降及舒张功能障碍[1]。心肌细胞损伤是脓毒症心功能不全发生的主要原因,细胞凋亡在脓毒症的发生、发展中起着重要作用,已有的试验已证明抗凋亡治疗有逆转脓毒症心肌损伤的作用[2]。中医认为,心功能不全多责之于邪气损伤心阳、心阳不足,参附注射液具有温阳祛邪的作用。本研究通过观察参附注射液对大鼠脓毒症模型心肌损伤标记物、心肌细胞凋亡指数及Bcl-2、Bax mRNA表达的影响,探讨参附注射液对脓毒症大鼠心肌损伤的保护作用及其机制。
1 实验材料
1.1 实验动物 雄性SD大鼠,清洁级,体质量(200±20)g,由浙江中医药大学实验动物中心提供和饲养,许可证号:SYXK(浙)2013-0184。造模前适应性喂养7天。
1.2 仪器与试剂 低温离心机(Eppendorf Centrifuge 5804德国);紫外分光光度计(BECKMAN DU-600,美国);电泳转膜装置(Bio-RAD,美国);数显恒温水浴锅(泰州市华普达教学仪器有限公司);Model 550酶标仪(Bio-Rad,美国);BioSenSC300凝胶图象分析系统(上海山富科学仪器有限公司);PTC-225 Peltier Thermal Cycler(MJ Research Inc,Waltham,Massachusetts);Rotor-Gene RG-3000 Real-Time Thermal Cycler(Corbett Reseach,Sydney,Aus-tralia)等。参附注射液(雅安三九药业有限公司);戊巴比妥钠(上海西塘生物科技有限公司)。
2 实验方法
2.1 脓毒症模型的制备 参照相关文献[3]以盲肠结扎穿孔(CLP)法制备脓毒症模型。
2.2 分组及给药 雄性SD大鼠共分为假手术组、模型组、参附组,每组8只。模型组行CLP术后,分别于0、6h、12h尾静脉注射生理盐水5mL/kg,参附组于CLP术后分别于上述时间点行尾静脉注射参附注射液5mL/kg;假手术组麻醉后开腹翻动肠道,关腹。各组于术后24h麻醉腹主动脉采血处死,留取心肌组织行相关指标检测。
2.3 指标检测方法
2.3.1 心肌酶检测 自动生化分析仪测定心肌肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)水平变化。
2.3.2 TUNEL法检测心肌细胞凋亡 取心肌组织,制备石蜡切片。以末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)法按试剂盒说明进行肺组织切片细胞凋亡的原位检测。具体方法如下:(1)石蜡包埋的切片常规脱蜡脱水。(2)用蛋白酶K (20μg/mL溶于Tris/HCl中,Ph7.4~8.0)室温孵育15~30min。37℃度孵育15min。PBS洗2次。(3)标记:PBS冲洗2次,擦干样品周围水分,滴加50μL的TUNEL反应混合溶液,在湿盒中37℃孵育60min(为防止蒸发和保证TUNEL反应混合物均匀分布,在孵育过程中加盖盖玻片)。PBS冲洗3次。(4)信号转化和分析:擦干样品周围水分,加入50μL转化剂-POD,在湿盒中37℃孵育30min(为防止蒸发和保证转化剂-POD均匀分布,在孵育过程中加盖盖玻片)。PBS冲洗3次,加入50~100μL DAB底物溶液,室温孵育10min,PBS冲洗3次。(5)苏木素复染细胞核,封片,以多功能真彩色细胞图象分析管理系统在光镜下行图象分析:选择有意义的组织相,经登录、编号、采集、分析、读取数据。
2.3.3 荧光定量PCR法检测心肌组织Bcl-2、Bax mRNA表达 Trizol常规法抽提各组心肌组织总RNA,具体方法如下:(1)约100mg组织于冰浴匀浆器中,冰上迅速研磨成匀浆液,加入1mL Trizol,剧烈震荡,室温放置5min。(2)加入0.2mL的氯仿,盖好后漩涡剧烈震荡15s,室温放置2~3min,然后离心12 000 rpm,15min,4°C。离心后分成三层,下面的红色为酚-氯仿相、中间层、上面是无色的水相。RNA只存在于水相中。(3)将上层水相转移到另一干净的EP管中,加入等体积的异丙醇,静置30min,-20℃,然后离心12 000rpm,15min,4°C。(4)去上清,加入1mL75%乙醇洗涤RNA沉淀,振荡器混匀,离心7 500×g,5min,4℃。(5)去上清,置真空或空气中5~10min,干燥RNA沉淀(不能在真空中离心干燥)。根据沉淀的量加入适量的RNase free水溶解RNA,去除基因组DNA;RNA定量后逆转录为cDNA;引物:Bcl-2 (110bp):F:5’-AGTACCTGAACCGGCATCTG-3;R:5’-CAGCCAGGAGAAATCAACAG-3′。Bax(133bp):F:5’-ACACCTGAGCTGACCTTGGA-3′;R:5’-CCGT GTCCACGTCAGCAATC-3′。GAPDH(130bp):F:5’-TGCACCACCAACTGCTTAGC-3;R:5’-GGCATGGA CTGTGGTCATGAG-3′。取样本总cDNA 1μL、上游和下游引物各0.5μL,加入试剂盒其他成分,样品Bcl-2、Bax GAPDH循环条件为:94℃预变性5min;接着进行45个循环,95°C变性30s,58℃退火30s,72℃延伸40s;最后72℃延伸5min。以GAPDH作为内参,分析Bcl-2的表达。基因扩增的Ct值:采用相对定量方法分析各样本的ΔCt值(ΔCt=母的基因Ct 值-内参基因Ct值),再依据ΔΔCt值=实验组ΔCt值-对照组ΔCt值计算2-ΔΔCt的值。当目的基因与内参基因的扩增效率接近时,2-ΔΔCt的值表示目的基因在实验组样本中相对于对照组样本的表达倍数。
2.4 统计学方法 所有数据使用SPSS18.0统计软件处理,计量资料以均数±标准差(±s) 表示。采用单因素方差分析;方差齐性选用LSD检验,方差不齐采用Dunnett’s T3法检验,P<0.05为差异有统计学差异。
3 实验结果
3.1 各组大鼠心肌酶谱变化 与假手术组比较,模型组、参附组大鼠血清CK-MB、CK较假手术组明显升高,差异有统计学意义(P<0.05);与模型组比较,参附组大鼠血清CK-MB、CK较模型组明显降低,差异有统计学意义(P<0.05),见表1。
3.2 各组大鼠心肌细胞凋亡情况 三组均可见凋亡细胞,模型组、参附组大鼠心肌细胞TUNEL平均光密度(MOD)均高于假手术组,差异有统计学意义(P< 0.05);参附组MOD较模型组明显降低(P<0.05),见表2,图1。

表1 各组大鼠心肌酶谱比较(x±s)

表2 各组大鼠心肌细胞TUNEL光密度值比较(x±s)
3.3 各组大鼠心肌组织Bcl-2 mRNA、Bax mRNA表达水平变化 与假手术组比较,模型组、参附组大鼠心肌Bcl-2 mRNA较假手术组明显降低,Bax mRNA较假手术组明显升高,差异有统计学意义(P<0.05);与模型组比较,参附组大鼠心肌Bcl-2 mRNA明显升高,Bax mRNA明显降低,差异均有统计学意义(P<0.05),见表3。
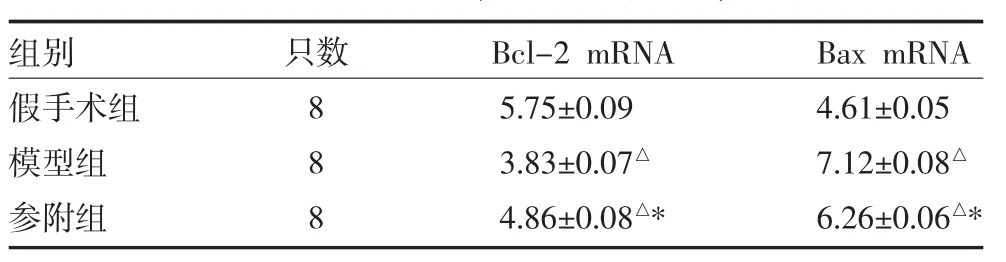
表3 各组大鼠心肌组织Bcl-2 mRNA 和Bax mRNA表达比较(×10-3,x±s)

图1 各组大鼠心肌细胞凋亡情况(荧光定量,×200)
4讨 论
脓毒症可导致多器官损伤,心脏是其损伤的重要靶器官之一。本研究显示,模型组及参附组大鼠CK-MB、CK均出现不同程度升高,心肌细胞TUNEL平均光密度(MOD)均高于假手术组(P<0.05),表明CLP大鼠存在心肌损伤。参附组与模型组比较,CKMB、CK、MOD降低(P<0.05),表明参附注射液对脓毒症心肌损伤有一定的保护作用。
研究发现脓毒症心肌损伤除与心肌细胞低氧、线粒体损伤能量代谢障碍有关,还与心肌细胞凋亡有关[3]。脓毒症心肌细胞凋亡存在多条信号通路,线粒体途径是其中最重要的通路之一[4]。Bcl-2家族控制着线粒体外膜和内膜的通透性,它们通过激活一系列下游基因发挥调节凋亡作用,因此是线粒体凋亡途径的主要调控者[5]。Bcl-2家族蛋白按功能可分为抗凋亡蛋白和促凋亡蛋白两大类,抗凋亡蛋白以Bcl-2、Bcl-xl为代表,具有抑制细胞凋亡作用,主要分布于线粒体;促凋亡蛋白以Bax、Bad、Bid为代表的,可以促进或诱导线粒体凋亡因子的释放,主要分布于细胞质中。Bcl-2家族蛋白通过二聚体的形式相互作用,调控细胞的凋亡,不同二聚体间的精细平衡决定了细胞是继续存活还是走向死亡。Bcl-2是此途径中的关键调节因子,有抑制凋亡作用。Bcl-2表达占优势时可阻止细胞凋亡[6]。在小鼠CLP模型,抗凋亡蛋白Bcl-2的过表达可抑制巨噬细胞和树突状细胞的细胞凋亡[7],肠道特异Bcl-2过表达的转基因小鼠脓毒症死亡率较其他小鼠低[8]。本研究显示,模型组及参附组大鼠心肌Bax mRNA表达均高于假手术组,Bcl-2 mRNA表达低于假手术组(P<0.05),心肌细胞凋亡增加,与文献报道相一致。
《内经》有“少火生气,壮火食气”的论述,脓毒症邪气伤人,先伤脏腑之功能,后则损及形质,重症脓毒症的高热阶段必然耗损正气,甚则阳气耗散,脓毒症心脏损伤,也表现为先伤及心阳而后心之形质受损。“阳化气、阴成形”,脓毒症时邪气损伤心阳,心阳受损、气化失司,阴血不生,脏腑失养进一步加剧心脏功能障碍。因此温阳益气是治疗脓毒症心脏损伤的关键,心阳恢复、气化得行则阴血自生,从而恢复正常的脏腑功能。参附注射液由红参、附子组成,主要有效成分为人参皂苷和乌头碱,具有温阳益气养心、回阳救逆之效。临床常用于脓毒症而症见胸闷、气促、悸动不安、动则尤甚等心阳不足证候者。已有的研究发现参附注射液具有抗缺血再灌注损伤、改善心脏功能、抗休克、增强心肌收缩力等作用。江荣林等[9]临床研究表明,参附注射液可改善脓毒症患者的组织氧代谢。邱泽亮等[10]则发现参附注射液可以降低严重脓毒症患者急性生理和慢性健康状况评分(acute physiology and chronic health evaluation,APACHE)II、Marshall评分及IL-6和CRP水平,明显升高CD3+、CD4+、CD8+T淋巴细胞和单核细胞HLA-DR,提示参附注射液具有维持促炎/抗炎平衡,双向调节严重脓毒症免疫紊乱作用。本研究显示,与模型组比较,参附组大鼠心肌Bcl-2 mRNA表达较模型组上调,细胞凋亡明显减少,心肌损伤酶学指标较模型组降低。认为参附注射液可以通过上调心肌细胞Bcl-2 mRNA表达,下调Bax mRNA表达,减少脓毒症大鼠心肌细胞凋亡的机制,改善脓毒症相关的心肌损伤。
[1]Paoli G,Valente S,Ardissino D,et al.Myocardial dysfunction during sepsis:epidemiology,prognosis and treatment [J].G Ital Cardiol(Rome),2011,12(12):804-814.
[2]Flierl MR,Rittirsch D,Huber-Lang MS,et al.Molecular events in the cardiomyopathy of sepsis[J].Mol Med,2008,14(5-6):327-336.
[3]Bauer I,Bauer M,Raddatz A,et al.In fluence of gender on stimulated cytokine response in patients of severe sepsis[J]. Anaesthesist,2006,55(5):515-527.
[4]Buerke U,Carter JM,Schlitt A,et al.Apoptosis contributes to septic cardiomyopathy and is improved by simvastatin therapy[J].Shock,2007,29(4):497-503.
[5]Tsukahara S,Yamamoto S,Tin-Tin-Win-Shwe,et al.Inhalation of low-level formaldehyde increases the Bcl-2/Bax expression ratio in the hippocampus of immunologically sensitized mice[J].Neuroimmunomodulation,2006,13(2):63-68.
[6]Chopra M,Reuben JS,Sharma AC.Acute lung injury:apoptosis and signaling mechanisms[J].Exp Biol Med(Maywood),2009,234(4):361-371.
[7]Peck-Palmer OM,Unsinger J,Chang KC,et al.Modulation of the Bcl-2 family blocks sepsis-induced depletion of dendritic cells and macrophages[J].Shock,2009,31(4):359-366.
[8]Stromberg PE,Woolsey CA,Clark AT,et al.CD4+lymphocytes control gut epithelial apoptosis and mediate survival in sepsis[J].FASEB J,2009,23(6):1817-1825.
[9]江荣林,雷澍,王灵聪,等.参附注射液对重度脓毒症患者组织氧代谢的影响[J].中华中医药杂志,2009(7):965-967.
[10]邱泽亮,叶一萍,张宁,等.参附注射液对严重脓毒症免疫调节的前瞻性研究[J].中华中医药学刊,2012(2):363-366.
(收稿:2015-04-08 修回:2015-07-07)
Effect of Shenfu Injection on the Expression of Bcl-2 and Bax in Rats with Sepsis
HU Dandan,XU Huil-ian,LOU Liming. Department of Respiratory Diseases,Third Affilated Hospital of Zhejiang Traditional Chinese Medical University,Hangzhou(310005),China
ObjectiveTo investigate the effect of Shenfu injection on the expression of BCL-2 and Bax and myocardial cellapoptosis in rat models with sepsis,in order to elucidate the anti-myocardial injurymechanism of Shengfu Injection.MethodsTwenty-fourmale SD rats were randomly divided 3 groups:sham-operated group(n=8), model group(n=8)and Shenfu group(n=8).Rat sepsis models were established through cecal ligation and puncture. Myocardial creatine kinase(CK)and itsisozyme(CK-MB)levels in plasma were detected in 24 h after sepsis,myocardial apoptosis were detected by TUNEL(TdT dUTP nick and labelling)technique,and the expression of Bcl-2 mRNA and Bax mRNA in myocardial cells were detected by RT-PCR.ResultsCompared with sham-operated group,CK and CK-MB levels in model group and Shenfu group were higher with a significant difference(CK-MB: 4208.51±382.57U/L,3584.59±347.06U/L vs 2187.41±556.63U/L;CK:3216.75±565.42U/L,1986.21±366.73U/L vs 1189.40±245.87U/L;all P<0.05);CK and CK-MB in model group were higher than those in Shenfu group(P<0.05).Myocardial cellapoptosis was observed in 3 groups;the mean optical density in model group and Shengfu group was higher than that in sham-operated group(0.24±0.11,0.18±0.09 vs 0.09±0.05,P<0.05)and that in Shenfu group was lower than that in model group(P<0.05).The expression of Bcl-2 mRNA in myocardial cells in model group and Shenfu group was lower than that in sham-operated group[(3.83±0.07)×10-3,(4.86±0.08)×10-3vs(5.75± 0.09)×10-3,P<0.05];that in Shenfu group was higher than that in model group(P<0.05).The expressionof Bax mR-NA in myocardial cells in model groupand Shenfu group was higher than that in sham-operated group[(7.12±0.08)×10-3,(6.26±0.06)×10-3vs(4.61±0.05)×10-3,P<0.05];that in Shenfu group was lower than that in model group (P<0.05).ConclusionShengfu injection canalleviatesepsis-induced myocardial injury in rats through increasing Bcl-2 mRNA and decreasing Bax mRNAand reducing myocardialapoptosis.
rats;sepsis;myocardium;Bcl-2;Bax;Shenfu injection
浙江省中医药科技计划项目(No.2009CA041);浙江省自然科学基金(No.LY12H15004)
浙江中医药大学附属第三医院呼吸科(杭州 310005)
楼黎明,Tel:0571-88393529
