我国睡眠药理学研究现状与展望
2016-02-15崔翔宇张永鹤
崔翔宇,张永鹤
(北京大学基础医学院药理学系,北京 100191)
我国睡眠药理学研究现状与展望
崔翔宇,张永鹤
(北京大学基础医学院药理学系,北京 100191)

张永鹤,药理学博士,教授,博士生导师,北京大学基础医学院药理学系副主任。长期从事睡眠及其共病机制和催眠新药研发等工作。在国内外杂志发表论文80余篇,其中SCI收录论文60余篇。先后主持了科技部“十一五”国家重大新药创制项目、国家自然科学基金、教育部博士学科点专项基金-博导类、留学回国人员启动基金、美国中华医学基金-专项人才基金和北京大学“十五”211工程等科研项目。参编出版著作8部,包括八年制《药理学》教材、《神经精神药理学进展》、《神经药理学研究方法》、《神经精神药理学》和《新药药理学研究方法》等。已授权国际专利7项,国内专利1项。担任中国药理学会副秘书长等学术兼职。
睡眠异常与多种精神和躯体疾病有关,如抑郁症、焦虑症、记忆减退和高血压等。经过几代人的努力,我国睡眠药理学研究在学术领域已经与国际接轨,在国际学术界具有了一定的影响力,尤其是在睡眠机制研究方面取得了进展,并开始参与到本领域热点的研究,如睡眠障碍及其共病(包括创伤后应激障碍、抑郁症、高血压、糖尿病及神经退行性疾病)之间相关性的研究,同时还积极参与催眠药的研究。尽管我国的睡眠研究水平与世界先进水平之间还存在一定的差距,但通过我国研究人员的共同努力,随着对睡眠健康重视度的提高,我国的睡眠研究事业也必将迎来发展黄金期,并为更多的患者尽早带来健康的睡眠。
睡眠药理学;睡眠障碍;催眠药
睡眠是人类和高等动物普遍的生理现象。在整个生命过程中,不同动物睡眠所占据的时间各不相同,对于人类约占生命的1/3时间。人类需要通过睡眠得到体力和精力的恢复。如果睡眠的质或量发生异常,如入睡困难、频繁觉醒、睡眠减少或睡眠过多、睡行症和不能恢复疲劳的睡眠等,将会影响到在生活和工作中的表现,甚至引发各种精神和躯体疾病,如抑郁症、焦虑症、记忆减退和高血压等。据中国睡眠研究会调查问卷统计显示,高达38.2%的中国城市居民存在着不同程度的失眠。根据中国睡眠研究会《2016中国中产阶层睡眠指数白皮书》披露,睡眠不佳对人们身心健康造成不同程度的伤害,被调查人群中有失眠症状的比例达46.58%,其中4.79%的人群需要长期服用安眠药才能入睡。
虽然经过多年的研究,对睡眠的机制以及与疾病的关系等有了初步的认识,但是对于睡眠这一现象的理解还远远不够。在2005年美国Science专刊提出的125个科学前沿问题中,“我们为什么睡眠?(Why do we sleep?)”和“为什么做梦(Why do we dream?)”赫然在列,与“宇宙起源”、“时间维度”和“外星生命”等问题并列,足见对睡眠问题的重视。在10余年间,国内研究人员进行了大量的工作,取得了很多重要的成果,但是对于这2个问题的解答还远远不够。由于笔者常年从事睡眠机制及睡眠干预药物的基础研究,故本文对我国睡眠药理学的研究历史及现状进行简要介绍。
1 我国睡眠研究历史和现状
1.1 睡眠研究方法变迁
我国的睡眠研究发展史相当于世界睡眠研究发展的一个缩影。在睡眠研究方法的选择上,最初主要是以大体观察为主,采用的实验方法是观察给药后动物的自主活动是否减少,以此判断镇静和睡眠的程度,或者观察能否增强苯巴比妥或戊巴比妥等药物的麻醉作用,以动物发生翻正反射消失的比例和消失的时间作为评价标准。该方法在研究催眠机制时常常受限于麻醉作用的干扰,但目前仍在使用。其优点在于实验条件要求低,操作简单,节省时间和空间,适合进行镇静催眠药物的快速筛选。
现今能够查到的最早采用与巴比妥钠协同作用评价催眠效应的文献,当属1957年胡崇家[1]发表在《武汉医学院学报》的“酸枣仁与茯神的镇静作用”一文。这篇文章也是国内首篇在动物实验中验证中药酸枣仁和芙神镇静催眠作用的研究论文。而中国科学院上海药物研究所金国章和邹冈等[2]于1959年在《药学学报》发表的“萝芙甲素与蛇根碱中枢作用的比较研究”论文,则是新中国第一篇有关天然产物单体药物催眠药效考察的研究报告。研究比较了萝芙甲素与蛇根碱对腹腔注射环己烯巴比妥钠睡眠时间的影响,发现蛇根碱的作用比萝芙甲素强10余倍。而1962年金国章等[3]发表“四氢小檗碱和延胡索乙素对家兔自发脑电波的影响”论文,在国内开启了采用脑电记录睡眠波的研究历史。自此,中国催眠药物研究,尤其是中药与天然产物催眠药理学的研究历史步入了新的阶段。
而新中国成立后最初的30年间,由于众所周知的原因,有关睡眠生理和药理学研究报告甚少。但所幸的是,当时国内的睡眠药理学研究已经达到了国际先进水平。在此值得一提的是,20世纪60年代,中国科学院上海药物研究所邹冈等发现的γ-氨基丁酸(gamma aminobutyricacid,GABA)A受体拮抗剂荷包牡丹碱。GABAA受体是临床上所使用的催眠药的作用靶点。当时由于缺乏可以调控该受体的拮抗剂,致使GABA受体相关生理和药理学的研究陷于停顿状态。而当时,邹冈先生向中国生理学会报告了研究发现,同时向《中国生理学杂志》投寄了一篇论文。遗憾的是,由于1966年所有的科学出版物停止发行,这篇论文没有公开发表。5年后,在堪培拉Curtis实验室工作的Johnston重复并延伸了邹冈教授的研究,得到类似的结果[4]。
自改革开发以来,睡眠生理与药理学研究也和其他领域的研究一样,开始了新的征程。20世纪80年代,国内研究人员开始用采集的动物脑电波,进行睡眠时相的初步分析。在之后的30多年中,从最初的记录纸描记、格尺测量及目测法,把睡眠简单分为慢波睡眠和快波睡眠[5],到如今的脑电记录、摄像与电脑连接一体化技术平台,以脑电不同频谱段功能谱为依据的、以不同时相睡眠潜伏期、总时长、发生次数、每次发生时长、各时相所占百分率等作为指标进行分析。睡眠研究技术手段,也伴随着国家经济实力的增强,逐步得到了改善,使得这一研究领域步入了与世界接轨的良性发展阶段,目前已达到了国际先进水平。
在实验动物的选择方面,也与国外的研究类似,早期限于设备条件和技术,主要选择比较大型的动物进行研究,如犬、猫和兔等[6]。目前,随着脑电记录设备的微型化和手术技术的提高,睡眠研究主流的实验动物已经变成体积更小的啮齿类,如大鼠和小鼠等[7],也便于后期的药物干预、化学遗传和光遗传等操作。另外,除了常用的啮齿类动物,还有果蝇和斑马鱼等用于睡眠的遗传学研究。由于果蝇在遗传和基因研究方面的便利性,对睡眠和昼夜节律调节基因以及睡眠功能的研究得到了快速发展。
1.2 睡眠机制研究现状
多种致炎细胞因子具有促进睡眠的特性,促使人们对免疫系统与睡眠调节之间的关系进行了研究。从20世纪90年代开始,北京医科大学(现北京大学医学部)库宝善教授研究组[8-9]就已经报道了免疫细胞因子对睡眠有一定的调控作用。研究发现,许多免疫增强剂及免疫调节剂具有调节睡眠时相,改善睡眠质量的效应,异丙肌苷、转移因子和胞壁酰二肽等免疫增强剂在使脑内白细胞介素1(inter⁃leukin-1,IL-1)和肿瘤坏死因子(tumor necrosis factor,TNF)增加的同时,也延长了家兔的睡眠时间[8]。IL-1的水平与睡眠相关,在慢波睡眠(slow wave sleep,SWS)期间活性达峰值,在睡眠剥夺期间增多[10]。静脉注射或者脑室内注射IL-1,均可延长家兔睡眠时间,其中以SWS为主。另一项研究发现TNF的催眠作用与中枢5-羟色胺(serotonin,5-HT)有关,可以促进脑内5-HT的合成,提高5-HT及其代谢产物5-羟吲哚乙酸(5-hydroxyindoleace⁃tic acid,5-HIAA)的含量[11]。同时有国外报道了IL-1的催眠作用,发现当IL-1灌流至前列腺素D2的睡眠促进脑区(prostaglandin D2 sleep promoting zone,PGD2-SPZ)的蛛网膜下腔中时,SWS增加最为显著,而环氧化酶2(cycloxygenase-2,COX-2)抑制剂可阻断此作用,提示IL-1促进SWS的作用可能是通过PGD2介导的[12]。然而,近来复旦大学黄志力教授研究组利用PGD2受体敲除小鼠研究发现,高选择性COX-2抑制剂NS398并不能阻断PGD2-SPZ或腹腔注射IL-1β的催眠作用,提示IL-1诱导的非快动眼(non-rapid eye movement,NREM)睡眠可能与PGD2系统无关,同时IL-1β与PGD2诱导的睡眠模式也不相同,可能有着不同的机制[13]。
5-HT作为脑内重要的神经递质,与情绪、昼夜节律、疼痛和睡眠功能相关。北京大学靳照宇等[14]报道,脑内5-HT1A受体和5-HT2受体与睡眠有密切关系,轻度激动5-HT1A受体或拮抗5-HT2受体均可增加深睡眠,同时激动和拮抗这两种亚型受体在减少REM睡眠和增加深睡眠方面具有协同作用。同时期很多睡眠机制研究均与5-HT系统有关,安徽医科大学张景行教授实验室研究了脑干5-HT能核团中缝背核(dorsal raphe nucleus,DRN)对睡眠的影响[15],还研究了杏仁核[16]、海马[17]、腹外侧视前区[18]以及外侧缰核[19]等部位对睡眠的调节作用,主要关注了脑中5-HT能系统对睡眠的调控作用。吉林大学赵华研究组多年来关注缰核对睡眠的调控作用,报道了缰核通过5-HT和腺苷途径对促睡眠的视前区-下丘脑前部发挥调节作用[20]。同时,通过睡眠剥夺研究发现,损毁外侧缰核减弱睡眠剥夺后的反跳效应,并且与外侧缰核中的时钟基因(per2)表达变化有关[21]。
腺苷是一种中枢神经系统的抑制性神经调质,具有睡眠促进作用,但是对其调节睡眠的机制尚不清楚。复旦大学黄志力教授等[22]在留学归国之前就开始了这方面的研究,利用选择性敲除腺苷A1受体或者A2A受体的小鼠,最先报道了腺苷A1和A2A受体拮抗剂咖啡因发挥作用的机制是特异性的通过腺苷A2A受体介导的,而与A1受体的关系不大。随后,利用局部RNA干扰技术选择性沉默特定脑区的腺苷A2A受体基因,发现咖啡因的促觉醒作用与脑中伏核壳部的A2A受体最相关,而与基底节其他部位的A2A受体以及伏核核心部的A2A受体均无关[23]。最近又发现,大鼠嗅球处的腺苷A2A受体参与对REM睡眠的抑制[24]。
钙离子(Ca2+)作为第二信使参与中枢神经系统多种功能的调控,如信号传导、递质释放和基因调控等,其对睡眠的调节作用也受到了关注。在21世纪初,北京大学张永鹤教授研究组就开始对Ca2+通道在睡眠中的作用进行了研究,发现L-型钙通道阻断剂如地尔硫、硝苯地平和维拉帕米,均能促进戊巴比妥钠诱导的催眠作用[25],并且此作用与5-HT系统有关,作用涉及睡眠中枢下丘脑腹外侧视前区和促觉醒核团结节乳头核[26],其中脑干的5-HT能核团中缝背核(DRN)中的Ca2+水平[27]以及5-HT1A和5-HT2A/2C受体[28]起重要作用。进一步研究发现,L-型钙通道阻断剂对戊巴比妥钠诱导催眠的促进作用与DRN神经元Ca2+信号通路中的下游分子蛋白激酶C[29]和钙调蛋白II[30]均有关系。最新的研究发现,DRN中的Ca2+可以通过内源性的睡眠-觉醒调控机制促进觉醒[31],进一步为特定脑区的Ca2+信号可以作为内源性睡眠觉醒调节物质提供了证据(图1)。

图1 中缝背核中钙离子对睡眠时相的影响机制.中缝背核中Ca2+浓度减少,抑制觉醒,促进睡眠,主要是慢波睡眠及非快动眼睡眠增加,快动眼睡眠不变;而当中缝背核中Ca2+浓度增加,促进觉醒,抑制睡眠,主要是浅睡眠及快动眼睡眠减少,慢波睡眠不变.
1.3 睡眠障碍与共病之间关系的研究
有多种原因可能导致失眠,包括一些睡眠障碍和精神障碍。失眠也可能是许多疾病产生、恶化或者复发的诱因。因此,有必要研究建立与临床症状特征相近或相类似的伴发睡眠障碍的共病模型,如抑郁症/睡眠障碍、创伤后应激障碍/睡眠障碍、痴呆/睡眠障碍、帕金森病/睡眠障碍和糖尿病/睡眠障碍、高血压/睡眠障碍、癌症/睡眠障碍等。
创伤后应激障碍(post-traumatic stress disorder,PTSD)是指个体在经历强烈的精神创伤性事件后出现的一种严重精神疾病,给健康和事件发生后的生活重建造成很大困难与阻碍,是严重损害劳动能力的精神疾病。PTSD患者常常伴发夜间睡眠中的“噩梦”惊醒,目前被认为是PTSD的核心症状之一,反映了创伤记忆病理性提取和再现,甚至参与疾病的发展和维持。目前,对于PTSD的研究更多关注的是精神创伤事件的经历者,而对于创伤事件的目击者所发生的PTSD的研究很少。
北京大学张永鹤教授课题组采用“交流箱”,首次探索了创伤应激的经历者(躯体应激)和目击者(心理应激)所发生的PTSD睡眠中惊醒症状的发生机制,发现:①两种应激所致的脑内觉醒相关核团活性变化不是完全相同的,比如蓝斑核(去甲肾上腺素能)和穹窿周核(食欲素orexin能)神经元活性均升高,而中缝背核(5-HT能)神经元活性在躯体应激组降低,在心理应激组升高;②两种应激产生的创伤记忆在脑中的存储部位不同,躯体应激动物的创伤记忆主要储存在次级躯体感觉皮质和初级听觉皮质,而心理应激动物的创伤记忆主要储存在颞叶联合皮质;而造成动物惊醒的创伤记忆提取环路变化相同,均涉及到杏仁核的激活和下边缘前额叶皮质和腹侧前扣带回皮质的失活。该研究深化了对PTSD伴发的睡眠惊醒机制的理解,同时提示对于不同类型创伤所致的PTSD,应采用不同的临床治疗方案[32-33](图2)。
北京大学第六医院何佳等[34]报道,可以在睡眠过程中无痛苦地消除恐惧记忆,在监测受试者睡眠时相的同时,对其痛苦记忆的巩固过程进行干预,在SWS状态下进行伤害性记忆相关线索的暴露,可以显著降低受试者清醒后的恐惧反应,从而消除痛苦的记忆,整个操作过程并不影响受试者的睡眠结构与质量,使得对PTSD的无创伤、无痛苦治疗成为可能。
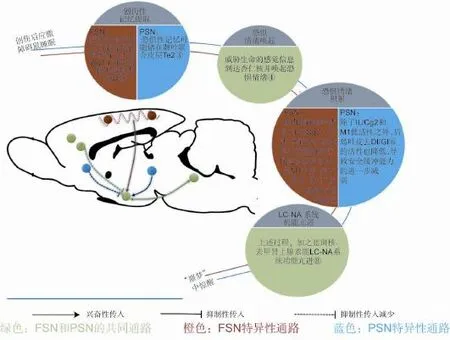
图2 推测的躯体应激(FS)和心理应激(PS)大鼠惊醒的神经解剖学环路[32].FSN:生理性应激创伤惊醒;PSN:心里性应激创伤惊醒;Au1:初级听觉皮质;S2:此机制体感觉皮质;Te:颞叶联合皮质;amygdala:杏仁核;Cg2:前扣带回腹侧区;M1:初级运动皮质;IL:前额叶皮质腹侧区;DI:少颗粒岛叶皮质;GI:颗粒岛叶皮质.
流行病学研究已证实睡眠障碍和抑郁症关系密切,失眠主诉患者最常见的初步诊断是精神疾病,特别是抑郁症。而抑郁症也常伴有睡眠异常,如失眠和多梦等等。抑郁症等情绪障碍与睡眠之间的关系也是一个研究的热点,国内的基础研究还比较少。近来北京大学王子君等[35]报道了在皮质酮慢性给药所致的抑郁症动物模型中,一些睡眠参数(如SWS和REM睡眠百分比等)早于动物明显抑郁行为的出现,并且与动物抑郁行为之间存在相关性,提示在此模型中,睡眠障碍是抑郁症的预测因子,抑郁症的某些症状可能与特定的睡眠参数改变有关。进一步研究发现,此动物模型的睡眠障碍与脑干蓝斑核(locus coeruleus,LC)中的糖皮质激素受体有关[36]。
阿尔茨海默病(Alzheimer disease,AD)也常伴有睡眠模式改变,但是造成这种睡眠紊乱的机制尚不清楚。上海交通大学平勇研究组报道,果蝇Aβ42AD模型可出现睡眠减少,这与JNK激酶信号通路有关,抑制JNK活性可以恢复睡眠,减少Aβ42蓄积,减轻神经退行性变[37]。中国农业大学的赵章武研究组在果蝇模型中发现,果蝇类胰岛素样肽(Drosophilia insulin-like peptides,DILP)可以调节睡眠,这些肽在突变缺失后使得睡眠减少,上调DILP及其受体DInR均可增加睡眠;还发现在果蝇禁食时DILP2水平会降低,提示饥饿引起的睡眠抑制可能与DILP系统有关[38]。此外,该研究组首次报道了神经肽Y系统(在果蝇为神经肽F)在果蝇中的睡眠调节作用,并且发现该系统对于果蝇睡眠的调节存在性别依赖性,即仅在雄性中有上述效果[39]。该研究组还报道了短神经肽F(short neuro⁃peptide F,sNPF)对果蝇睡眠的调节作用,并且是通过调节环磷酸腺苷-磷酸激酶A-环磷酸腺苷反应元件结合蛋白(cyclic adenosine monophosphateprotein kinase A-cyclic adenosine monophos⁃phate response element binding protein,cAMPPKA-CREB)信号通路发挥作用的[40]。兰州大学侯一平等[41]还报道了神经肽S可以促进觉醒,而其受体NPSR的单核苷酸多态性与人类的生理性睡眠调节密切相关,进一步研究发现这些作用与下丘脑结节乳头核的促觉醒组胺能系统有关。
除了中枢系统疾病之外,睡眠紊乱与高血压和过度肥胖关系密切。高血压和过度肥胖患者可能会伴有睡眠障碍,而睡眠障碍也会加重病情[42]。华西医院睡眠医学中心唐向东教授团队与美国宾夕法尼亚州立大学医学院合作,发现部分有生理性高觉醒特征的慢性失眠病人,如果入睡潜伏期>14 min,患高血压的几率是正常人的300%;>17 min,可达正常人的400%[43]。在基础研究方面,北京大学张娟等[44]报道了高血压模型自发性高血压大鼠(spontaneous hypertensive rat,SHR)的睡眠障碍特征,并且发现非选择性钙通道拮抗剂粉防己碱可以改善SHR的睡眠并降低血压。后续研究发现,粉防己碱改善睡眠和降低血压作用分别是通过不同的机制发挥的[45]。
还有一些研究表明,现代社会的快节奏和光污染会造成睡眠紊乱,除了与一些精神障碍有关之外,还与一些神经疾病有关。我国研究者对睡眠与脑内能量代谢以及记忆巩固之间的关系进行了研究,从分子和基因层面揭示了睡眠障碍与一些神经退行病变等衰老性疾病如帕金森病、亨廷顿病和AD之间的联系[46-47]。
1.4 催眠药物药效学研究
北京大学库宝善教授[48]在1992年提出“催眠药物开发新构想”,主张开发既能够选择性增加SWS、同时能够保证REM睡眠比例的药物。而现有的催眠药的特点是使失眠者入睡快,浅睡眠时间明显延长,中间不易醒,但是都会程度不同地缩短SWS和REM睡眠,导致患者主观睡眠质量不佳。
我国的天然药物资源丰富,在传统医药的宝库中发现新型的、作用更好、副作用更少的催眠药物是一条最合理的发展方向。我国的催眠药物研究者们在研究睡眠功能、机制以及调控环路的同时,也研究了中草药成分或者复方制剂对睡眠的调节作用。
安徽医科大学张景行教授课题组对酸枣仁有效成分的催眠作用进行了研究[49]。北京大学药理系张永鹤教授课题组进一步研究了酸枣仁中的黄酮类物质斯皮诺素(spinosin)和总皂苷的催眠作用及其机制,发现酸枣仁黄酮和皂苷均具有催眠作用,作用机制与5-HT系统有关,并且这种5-HT系统的作用与突触后膜的5-HT1A受体关系更为密切[50-52]。另外,在对传统免疫调节剂灵芝的安神和睡眠调节作用研究过程中,发现灵芝提取物的促眠作用与中枢TNFα有关,不仅延长NREM持续时间,还增加NREM睡眠的深度[53],而最终对睡眠的调节作用与中枢GABA系统有关[54]。近年来,还对中药远志科植物远志中的主要皂苷成分tenuifolin的催眠作用及其机制进行了探讨,首次发现该化合物的催眠作用,其作用特征在于可以诱导近似生理性的睡眠,机制可能与激活中枢内源性的GABA系统和抑制中枢的去甲肾上腺素(norepinephrine,NE)能系统有关[55]。
尽管睡眠研究开展得如火如荼,但在新药开发方面,我国从新靶点和新型催眠药物的发现,到临床前药效学评价都缺乏创新性成果。而我国批准上市的可改善睡眠的“创新”药物只有安神类中成药,与发达国家相比还有较大差距。近年来的新型药物绝大多数都是国外的研究成果,拥有我国自主知识产权、获得国际公认的成果仍是空白。而临床上正在使用的可以改善睡眠的中药的药效学资料,也多停留在与戊巴比妥钠的协同作用的实验依据水平上,极少见到对睡眠时相的作用特征及其作用机制深入研究的实验数据。如此,则极大地阻碍了这些药物的正确使用。
2 展望
2.1 睡眠对人体健康的重要性将越来越受到关注
睡眠医学是一门交叉学科,睡眠与人们的生活息息相关,睡眠障碍不但会严重影响生活质量,降低工作效率,还与各种神经精神疾病的发生和加重有关,造成巨大的社会和健康负担,睡眠卫生作为最基本的健康指标之一,已经越来越受到人们所关注。
随着科学技术的发展和智能设备的普及,多种带有睡眠监测功能的随身设备和可穿戴设备应运而生,可以对每夜的入睡时间、总睡眠时间甚至睡眠深度等参数进行记录。在对所记录的睡眠参数进行解读并给出相应建议的过程中,睡眠基础研究的作用不可或缺。比如,可以根据已有的研究结果来设置合理的作息时间,最大限度的保证记忆的巩固、生长激素的分泌和突触联系的优化,以更好的应对竞争日益激烈的环境。
可以期待的是,未来将可以通过某种睡眠成分或者脑电波能谱的变化,预测神经精神疾病可能的加重或复发,例如对于学生和士兵,通过对其睡眠的监测,可以检测出情绪的波动以及意志是否坚定等等。此外,通过对睡眠与记忆巩固机制的研究,期待不远的将来,学习将不再成为痛苦的事情,枯燥的公式和原理可以在睡梦中进行学习。通过对睡眠机制和功能的研究,终究会帮助我们更好的理解人类大脑的工作方式,为人工智能的开发提供帮助,也会使得未来的人机交互和人机对话成为可能。
2.2 我国睡眠科学研究能力亟待加强
未来的睡眠医学基础研究,依然需要解决我们为什么睡眠、为什么做梦等问题,相关研究已经有了很大进展,感兴趣的读者可以阅读被誉为睡眠医学“圣经”的《睡眠医学——理论与实践》[56](第4版已有中文版)。在已有研究的基础上,我们亟需对经典睡眠调节环路、神经递质和脑区进行补充,比如陆俊课题组对脑桥臂旁核向视前区基底前脑以及外侧下丘脑的投射对睡眠调节的研究[57]等。
按照已掌握的睡眠调控机制,开发的新型催眠药有中枢组胺受体拮抗剂和orexin受体拮抗剂等。然而,作用于GABA系统的药物如唑吡坦和佐匹克隆等,还是最常用的催眠药,虽然与传统苯二氮类催眠药相比,已经将记忆损害、REM睡眠抑制和停药反跳等副作用大大减少,但是对于某些患者,特别是伴发精神障碍,如抑郁症、焦虑症、PTSD等患者的疗效仍然不理想。未来更加需要根据患者睡眠障碍特点个体化用药,发现新的作用靶点,并且开发出可以同时作用于多个靶点,可同时治疗睡眠障碍及其伴随疾病的药物,以达到更好的治疗效果。比如新型抗抑郁药阿戈美拉汀[58],可激动褪黑素1和2受体,同时拮抗5-HT2C受体,对抑郁症及其伴发的睡眠障碍均有治疗作用。
因此,在睡眠研究新技术的认识和普及上,我们还有很长一段路要走。由于研究深度不够,大部分研究很难涉及到神经环路和蛋白质分子层面,导致整个研究的意义受限。
2.3 新技术的应用
进入21世纪以来,随着一些新技术的引入,比如化学遗传学(chemogenetics)和光遗传学(opto⁃genetics)等,极大地推动了神经科学包括睡眠科学的研究。化学遗传学是指对一些大分子实行改造,如特定药物专一性地激活特定受体(designer recep⁃tors exclusively activated by designer drugs,DREADD),使其能和先前无法识别的小分子进行相互作用的过程,其作用是可控和可逆的,可以通过加入或去除化合物如n-氧化氯氮平(clozapine n-oxide),从而选择性的作用于不同的GPCR级联反应(如Gq-DREADD和Gi-DREADD)[59]。
光遗传学是通过将遗传学技术与光学相结合,使受体细胞产生视蛋白,再对细胞进行光学控制的技术,通过不同波长或频率的光刺激激活或沉默特定的神经元,曾被Nature Method评为2010年年度技术,具有低损伤性和高时空分辨率等特点,适合研究自由活动的实验动物,可以在活体动物中对特定神经元的活性进行精确的调控,非常适用于睡眠这种动态变化生命现象的研究。
近年来,国内采用化学遗传学[60]和光遗传学[61]进行的睡眠研究还不是很多,二者相比,后者具有时间精度更高(可精准到ms)及刺激强度可控性强的优点,而缺点是设备和配件昂贵,在国内还未普及。近年来,国外研究者利用光遗传学技术对睡眠调控环路进行了大量研究,涉及下丘脑外侧orexin(又称下丘脑食欲素,hypocretin)能神经元[62]、基底前脑[63]、脑干脑桥脚核和背外侧被盖核[64]、延髓腹侧[65]、下丘脑[66]以及腹侧被盖区[67]等。
可喜的是,我国的研究人员也已开始利用这些新技术进行研究,比如浙江大学李晓明研究组在eLife报道了利用光遗传学方法选择性激动从基底前脑和脑干投射至丘脑网状核的胆碱能神经纤维可以促进睡眠,缩短入睡潜伏期,延长NREM睡眠,此作用经研究是通过调节丘脑网状核中的GABA能神经元实现的[68],重新探讨了基底前脑胆碱能神经元对觉醒、NREM睡眠和REM睡眠调节的机制,为睡眠的机制研究做出了贡献。
2.4 国家的重视和学术界的努力
我国的睡眠研究起步较晚,真正专业的睡眠研究学术组织成立也不过30余年。相比较而言,美国、日本和欧洲等西方国家都早已提出了包括睡眠研究在内的脑科学计划。以美国为例,美国睡眠协会于1987年成立,并于1999年在此基础上成立了美国睡眠科学院,负责制定相应的认证标准和执业规范。1993年美国国立卫生院在心肺血液病研究所下设了国家睡眠障碍研究中心,负责睡眠医学领域的研究、教育、临床事务以及与其他相关部门关系的协调。尤其是在1996年、2003年和2015年3次发布国家睡眠研究计划(Sleep Research Plan),阐述了睡眠医学的基础和临床领域亟待解决的问题并提出了研究建议。
而目前我国不论是在国家重视程度还是学术界的交流方面都还远远不够。近年来,在中国睡眠研究会和相关专家的努力下,随着每年“世界睡眠日”的宣传和教育及整个社会对健康要求的提高,对睡眠问题越来越重视。比如我国的多家医院已经成立了睡眠医学中心,可以为患者进行睡眠监测,并诊断一些睡眠疾病等。尽管这些睡眠中心存在水平不一、专业人员不足等问题,但也是睡眠医学的重大进步。另一方面,我国的睡眠医学发展主要体现在临床方面,对基础研究的关注程度仍然不足,虽然总体上我国睡眠医学的基础研究水平逐年提高,但还处于比较初级的水平。从中文文献数据库中可见,每年有大量的重复工作,难以将工作做深做细,原创性的睡眠调控机制和环路研究成果少,只能引用国外的研究结论,大量的睡眠相关研究难在国外高水平期刊发表。
另外,专门从事睡眠医学基础研究的人员比较短缺,大部分课题组也没有以睡眠作为主要的研究方向,只是以睡眠作为一个药效学的评价指标,没有长远规划和长期目标。对于这种局面,政府部门的号召与相应资助当然是一个重要的“指挥棒”,我国的睡眠研究专业团体和机构也必须肩负起振兴中国睡眠研究的任务,要团结起来,进行更多的科普宣传和经验分享,让更多的人认识到睡眠医学基础研究的重要性,让我们的睡眠研究团体能发出更大的声音,在国内和国外有更大的影响力。希望有一天,睡眠问题与其他躯体疾病,如高血压、脑卒中和肿瘤等重大疾病一样,也得到应有的重视,能得到更大的支持力度,让更多的科研人员愿意投身到这项与人类身心健康密切相关的睡眠医学领域中来。
3 结语
根据美国国立卫生研究院2011年发布的睡眠障碍研究计划,睡眠研究将集中在以下4个方向:①探索睡眠及昼夜节律的功能和机制;②阐明遗传、病理生理、环境、文化、生活方式、年龄和性别等方面的差异引起睡眠障碍的风险,以及这些风险因素在形成共病过程中的作用;③寻找预防、诊断和治疗睡眠节律障碍和慢性失眠的更有效方法,并评估这些疾病对身心健康的影响;④加强研究成果从实验台到临床的转化。我国的睡眠研究历时数十载,然而睡眠仍是一道未解之谜,面向这一谜团的研究充满机会和挑战,需要我们创新思维模式,改变固有观念,为带给人们健康的睡眠付出不懈的努力。
[1]Hu CJ.Hypnotic effects of SemenZizyphi SpinozaeandPachyma Cocos[J].Acta Med Univ Wuhan(武汉医学院学报).1957,(1):125-133.
[2]Kin KC,Tsou K,Hsu KL,Tang XC,Hsu B.The comparative study on central action of Rauwolfia a and reserpine[J].Acta Pharm Sin(中国药学学报),1959,7(9):346-354.
[3]Kin KC,Tsoch SY,Tang XC,Hsu B.Pharmaco⁃logic actions of tetrahydroberberine on the central nervous system[J].Acta Physiol Sin(中国生理学报),1962,25(3):183-190.
[4]Curtis DR,Duggan AW,Felix D,Johnston GA. GABA, bicuculline and centralinhibition[J].Nature,1970,226(5252):1222-1224.
[5]Zhu GQ,Zhang JX,Wang M,Shen JH,Zhang HX,Kong XS,et al.Effects of decoction of fried Semen Ziziphi Jujubae on sleep[J].Acta Univ Med Anhui(安徽医科大学学报),1990,25(1):1-5.
[6]Li SX.Li ZH,Ku BS.Establishment of an automat⁃ic sleep phase analysis method in rabbit[J].Chin Pharmacol Bull(中国药理学通报),1996,12(5):429.
[7]Jin ZY,Ku BS,Yao HY,Li ZH,Rao Y,Wang XQ. A new automatic sleep analysis system in rats[J].Chin Pharmacol Bull(中国药理学通报),1999,15(5):411-414.
[8]Li SX.Ku BS,Lin ZB.Study on the relationship of immunoenhancers and sleep[J].Chin J Neuroim⁃munol Neurol(中国神经免疫学和精神病学杂志),1997,4(3):168-170.
[9]Li SX,Ku BS,Lin ZB.Effect of Muramyl dipeptide on sleep and its relationship to TNF[J].J B Med Univ(北京医科大学学报),1996,28(4):259-261.
[10]Li SX.Ku BS and Lin ZB.Effect of interleukin-1 on the regulation of sleep[J].Chin Pharmacol Bull(中国药理学通报),1995,11(3):179-182.
[11]Li SX,Ku BS,Li ZH,Lin ZB.Effects and mecha⁃nism of tumor necrosis factor on animal′s sleep[J].Chin J Neurosci(神经科学),1997,4(4):157-160.
[12] Terao A, Matsumura H, Saito M.Interleukin-1 induces slow-wave sleep at the prostaglandin D2-sensitive sleep-promoting zone in the rat brain[J].J Neurosci,1998,18(16):6599-6607.
[13]Zhang BJ,Shao SR,Aritake K,Takeuchi A,Urade Y,Huang ZL,et al.Interleukin-1β induces sleep independent of prostaglandin D2 in rats and mice[J/OL].Neuroscience,2017,340:258-267. http://dx.doi.org/10.1016/j.neuroscience.2016.09.053[Epub ahead of print]
[14] Jin ZY,Ku BS,Yao HY,Li ZH,Rao Y.Relation⁃ship between the function of 5-HT1A,2 receptors and waking-sleeping stages[J].Chin Pharmacol Bull(中国药理学通报),2000,16(2):208-211.
[15]Zhang GL,Zhao LZ,Gao J,Zhang JX,Liu QQ,Fan YF.Effects of microinjection of PCPA into dorsal raphe nuclei on sleep and serotonergic neurons[J].Acta Univ Med Anhui(安徽医科大学学报),2002,37(3):175-177.
[16]Zhao LZ,Gao J,Zhang JX,Zhang GL,Zhong MK,Zhang J.Role of serotonergic projection from dorsal raphe nuclei to basolateral amygadaloid in regula⁃tion of sleep[J].Chin Pharmacol Bull(中国药理学通报),2003,19(1):77-79.
[17]Li CH,Zhang J,Zhao LZ,Gu GQ,Zhong MK,Gui L,et al.Effect of serotonin in the hippocampus on slow wave sleep[J].Chin J Bas Med Trad ChinMed(中国中医基础医学杂志),2006,12(11):844-845.
[18]Zhang GL,He YL,Wang LC,Zhao LZ,Zhang J,Zhong MK,et al.The role of serotonin in ventrolateral preoptic area on sleep-wakefulness cycle of rat[J].Chin Pharmacol Bull(中国药理学通报),2003,19(8):931-934.
[19]Gui L,Zhang GL,Zhang JX,He YL,Zhao LZ. Effects of microinjection of L-glutamate into lateral habenula and lateral lesion of habenula on sleepwake cycle[J].Acta Univ Med Anhui(安徽医科大学学报),2006,41(5):511-512.
[20]Mu L,Zeng LL,Zhang XH,Huang M,Zhao H. Regulatory effect of habenular nucleus on sleeppromoting preoptic anterior hypothalamus[J].J Jilin Univ(Med Ed.)〔吉林大学学报(医学版)〕,2009,35(5):765-768.
[21]Zhang BL,Gao YX,Li Y,Yang J,Zhao H.Sleep deprivation influences circadian gene expression in the lateral habenula[J].Behav Neurol,2016,2016:7919534.
[22]HuangZL,QuWM,EguchiN,ChenJF,Schwarzschild MA,Fredholm BB,et al.Adenosine A2A,but not A1,receptors mediate the arousal effect of caffeine[J].Nat Neurosci,2005,8(7):858-859.
[23]Lazarus M,Shen HY,Cherasse Y,Qu WM,Huang ZL,Bass CE,et al.Arousal effect of caf⁃feine depends on adenosine A2A receptors in the shell of the nucleus accumbens[J].J Neurosci,2011,31(27):10067-10075.
[24]Lavielle O,McEown K,Schiffmann SN,de Ker⁃chove d′Exaerde A,Qu WM,Lazarus M,et al. Adenosine A2A receptors in the olfactory bulb suppress rapid eye movement sleep in rodents[J/OL].Brain Struct Funct,2016.http://link.springer.com/ article/10.1007%2Fs00429-016-1281-2[Epub ahead of print]
[25]Zhao X,Cui XY,Chu QP,Chen BQ,Wang XM,Lin ZB,et al.Potentiating effects of L-type Ca2+channel blockers on pentobarbital-induced hypnosis are influenced by serotonergic system[J].J Neural Transm(Vienna),2006,113(10):1395-1402.
[26]Zhao X,Cui XY,Wang LE,Zhang YH.Potentiating effect of diltiazem on pentobarbital-induced hypnosis is augmented by serotonergic system:the TMN and VLPO as key elements in the pathway[J].Neuro⁃pharmacology,2009,56(6-7):937-943.
[27]Cui SY,Cui XY,Zhang J,Wang ZJ,Yu B,Sheng ZF,et al.Ca2+modulation in dorsal raphe plays an important role in NREM and REM sleep regulation during pentobarbital hypnosis[J].Brain Res,2011,1403:12-18.
[28]Cui SY,Cui XY,Zhang J,Wang ZJ,Yu B,Sheng ZF,et al.Diltiazem potentiates pentobar⁃bital-induced hypnosis via 5-HT1A and 5-HT2A/2C receptors:role for dorsal raphe nucleus[J].Phar⁃macol Biochem Behav,2011,99(4):566-572.
[29]Li SJ,Cui SY,Zhang XQ,Yu B,Sheng ZF,Huang YL,et al.PKC in rat dorsal raphe nucleus plays a key role in sleep-wake regulation[J].Prog Neuropsychopharmacol Biol Psychiatry,2015,63:47-53.
[30]Cui SY,Li SJ,Cui XY,Zhang XQ,Yu B,Sheng ZF,et al.Phosphorylation of CaMKII in the rat dorsal raphe nucleus plays an important role in sleep-wake regulation[J].J Neurochem,2016,136(3):609-619.
[31]Cui SY,Li SY,Cui XY,Zhang XQ,Yu B,Huang YL,et al.Ca2+in the dorsal raphe nucleus promotes wakefulness via endogenous sleepwake regulating pathway in the rats[J].Mol Brain,2016,9:71.
[32]Yu B,Cui SY,Zhang XQ,Cui XY,Li SJ,Sheng ZF.et al.Mechanisms underlying footshock and psycho⁃logical stress-induced abrupt awakening from post⁃traumatic″Nightmares″[J].Int J Neuropsychophar⁃macol,2016,19(4):1-6.
[33]Yu B,Cui SY,Zhang XQ,Cui XY,Li SJ,Sheng ZF,et al.Different neural circuitry is involved in physiological and psychological stress-induced PTSD-like″nightmares″in rats[J].Sci Rep,2015,5:15976.
[34]He J,Sun HQ,Li SX,Zhang WH,Shi J,Ai SZ,et al.Effect of conditioned stimulus exposure during slow wave sleep on fear memory extinction in humans[J].Sleep,2015,38(3):423-431.
[35]Wang ZJ,Yu B,Zhang XQ,Sheng ZF,Li SJ,Huang YL,et al.Correlations between depression behaviors and sleep parameters after repeated corticosterone injections in rats[J].Acta Pharma⁃col Sin,2014,35(7):879-888.
[36]Wang ZJ,Zhang XQ,Cui XY,Cui SY,Yu B,Sheng ZF,et al.Glucocorticoid receptors in the locus coeruleus mediate sleep disorders caused by repeated corticosterone treatment[J].Sci Rep,2015,5:9442.
[37]Song Q,Feng G,Huang Z,Chen X,Chen Z, Ping Y.Aberrant axonal arborization of PDF neurons Induced by Aβ42-mediated JNK activation underlies sleep disturbance in an alzheimer′s model[J/OL].Mol Neurobiol,2016.http://link.springer.com/article/ 10.1007%2Fs12035-016-0165-z[Epub ahead of print].
[38]Cong XN,Wang HL,Liu ZX,He CX,An CJ,Zhao ZW.Regulation of sleep by insulin-like peptide system in drosophila melanogaster[J].Sleep,2015,38(7):1075-1083.
[39]He CX,Yang YY,Zhang MM,Price L,Zhao ZW. Regulation of sleep by neuropeptide Y-like system in Drosophila melanogaster[J].PLoS One,2013,8(9):e74237.
[40]Chen WF,Shi W,Li LZ,Zheng Z,Li TJ,Bai WW,et al.Regulation of sleep by the short neuro⁃peptide F(sNPF)in Drosophila melanogaster[J].Insect Biochem Mol Biol,2013,43(9):809-819.
[41]Hou YP,Wang C,Xie YP,Xie JF,Hui PL,Hong JP,et al.The role of neuropeptide S in sleep-wake regulation[J].J Lanzhou Univ(Med Sci)〔兰州大学学报〔(医学版)〕,2014,40(4):79-92.
[42]Song QF,Liu XX,Zhou WH,Wang XZ,Wu SL. Short-term changes in sleep duration and risk of type 2 diabetes:Kailuan prospective study[J].Medicine(Baltimore),2016,95(45):e5363.
[43]Li Y,Vgontzas AN,Fernandez-Mendoza JA,Sun YF,Zhou JY,Ren RA,et al.Insomnia with physiological hyperarousal is associated with hypertension[J].Hypertension,2015,65(3):644-U317.
[44]Zhang J,Yu B,Zhang XQ,Sheng ZF,Li SJ,Wang ZJ,et al.Tetrandrine,an antihypertensive alkaloid,improves the sleep state of spontaneously hypertensive rats(SHRs)[J].J Ethnopharmacol,2014,151(1):729-732.
[45]Huang YL,Cui SY,Cui XY,Cao Q,Ding H,Song JZ,et al.Tetrandrine,an alkaloid from S. tetrandra exhibits anti-hypertensive and sleep-enhanc⁃ing effects in SHR via different mechanisms[J].Phytomedicine,2016,23(14):1821-1829.
[46]Ren J,Zhang MJ,Li TM,Zhang E,Lin R,Chen S,et al.Quantitative proteomics of sleep-deprived mouse brains reveals global changes in mitochon⁃drial proteins[J].PLoS One,2016,11(9):e0163500.
[47]Li XJ,Yu F,Guo AK.Sleep deprivation specifically impairs short-term olfactory memory in drosophila[J].Sleep,2009,32(11):1417-1424.
[48]Ku BS.New ideas in the development of hypnotics[J].Prog Physiol Sci(生理科学进展),1992,23(2):107-109.
[49]Zhu GQ,Wang M,Zhai J,Zhang JX,Xu JC,Shen WZ,et al.Effects of effective components of semen ziziphi jujubae on polysomnogram of rats[J].Acta Univ Med Anhui(安徽医科大学学报),1991,26(3):165-167.
[50]Wang LE,Bai YJ, Shi XR,Cui XY,Cui SY,Zhang F,et al.Spinosin,a C-glycoside flavonoid from semenZizhiphi Spinozae,potentiated pentobar⁃bital-induced sleep via the serotonergic system[J].Pharmacol Biochem Behav,2008,90(3):399-403.
[51]Wang LE,Cui XY,Cui SY,Cao JX,Zhang J,Zhang YH,et al.Potentiating effect of spinosin,a C-glycoside flavonoid of Semen Ziziphi spinosae,on pentobarbital-induced sleep may be related to postsynaptic 5-HT(1A)receptors[J].Phytomedi⁃cine,2010,17(6):404-409.
[52]Cao JX,Zhang QY,Cui SY,Cui XY,Zhang YJ,Zhang H,et al.Hypnotic effect of jujubosides from SemenZiziphi Spinosae[J].J Ethnopharmacol,2010,130(1):163-166.
[53]Cui XY,Cui SY,Zhang J,Wang ZJ,Yu B,Sheng ZF,et al.Extract ofGanoderma lucidumprolongs sleep time in rats[J].J Ethnopharmacol,2012,139(3):796-800.
[54]Chu QP,Wang LE,Cui XY,Fu HZ,Lin ZB,Lin SQ,et al.Extract ofGanoderma lucidumpotentiates pentobarbital-induced sleep via a GABAergic mechanism[J].PharmacolBiochemBehav,2007,86(4):693-698.
[55]Cao Q,Jiang Y,Cui SY,Tu PF,Chen YM,Ma XL,et al.Tenuifolin,a saponin derived from Radix Polygalae,exhibits sleep-enhancing effects in mice[J].Phytomedicine,2016,23(14):1797-1805.
[56]Kryger MH,Roth T,Dement WC.Principles and Practice of Sleep Medicine[M].5th ed.St.Louis:Elsevier,2011.
[57]Qiu MH,Chen MC,Fuller PM,Lu J.Stimulation ofthe pontine parabrachialnucleus promotes wakefulness via extra-thalamic forebrain circuit nodes[J].Curr Biol,2016,26(17):2301-2312.
[58]Quera-Salva MA.Lemoine P,Guilleminault C. Impact of novel antidepressant agomelatine on disturbed sleep-wake cycles in depressed patients[J].Hum Psychopharmacol,2010,25(3):222-229.
[59]Roth BL.Dreadds for neuroscienists[J].Neuron,2016,89(4):683-694.
[60]Chen L,Yin D,Wang TX,Guo W,Dong H,Xu Q,et al.Basal forebrain cholinergic neurons primarily contribute to inhibition of electroencephalogram delta activity,ratherthan inducing behavioral wakefulness in mice[J].Neuropsychopharmacology,2016,41(8):2133-2146.
[61]Han Y,Shi YF,Xi W,Zhou R,Tan ZB,Wang H,et al.Selective activation of cholinergic basal fore⁃brain neurons induces immediate sleep-wake tran⁃sitions[J].Curr Biol,2014,24(6):693-698.
[62]Adamantidis AR,Zhang F,Aravanis AM,Deis⁃seroth K,De Lecea L.Neural substrates of awak⁃ening probed with optogenetic control of hypocretin neurons[J].Nature,2007,450(7168):420-424.
[63]Xu M,Chung S,Zhang S,Zhong P,Ma C,Chang WC,et al.Basal forebrain circuit for sleepwake control[J].Nat Neurosci,2015,18(11):1641-1647.
[64]Van Dort J,Zachs P,Kenny D,Zheng S,Gold⁃blum R,Gelwan A,et al.Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep[J].Proc Natl Acad Sci USA,2015,112(2):584-589.
[65]Franz W,Shinjae C,Beier KT,Xu M,Luo LQ,Dan Y.Control of REM sleep by ventral medulla GABAergic neurons[J].Nature, 2015, 526(7573):435-438.
[66]Jego S,Glasgow SD,Herrera CG,Ekstrand M,Reed SJ,Boyce R,et al.Optogenetic identifica⁃tion of a rapid eye movement sleep modulatory circuit in the hypothalamus[J].Nat Neurosci,2013,16(11):1637-1643.
[67]Eban-Rothschild A,Rothschild G,Giardino WJ,Jones JR,de Lecea L.VTA dopaminergic neurons regulate ethologically relevant sleep-wake behaviors[J].Nat Neurosci,2016,19(10):1356-1366.
[68]Ni KM,Hou XJ,Yang CH,Dong P,Li Y,Zhang Y,et al.Selectively driving cholinergic fibers optically in the thalamic reticular nucleus promotes sleep[J].Elife,2016,5:e10382.
Pharmacology of sleep in China:research and prospect
CUI Xiang-yu,ZHANG Yong-he
(Department of Pharmacology,School of Basic Medical Science,Peking University,Beijing 100191,China)
Sleep is a vital phenomenon of life,the disturbance of which could be associated with a wide range of diseases,such as depression,anxiety,memory loss and hypertension.After years of efforts,pharmacological research of sleep in China has been in line with the pace of international sleep study,especially in the mechanisms of sleep.Our research is beginning to involved in several hot spots of study,such as the relationship between sleep disorders and their comorbidities(PTSD,depression,hypertension,diabetes and neurodegenerative diseases).Attention has also been paid to the research and discovery of novel hypnotic drugs.Despite the gap in sleep research between China and other developed countries,sleep study in China will definitely step into a gold period as well as solve sleep problems for more patients as soon as possible with the joint efforts of researchers and with the increasing attention to healthy sleep.
sleep pharmacology;sleep disorder;hypnotics
ZHANG Yong-he,E-mail:zhyh@hsc.pku.edu.cn,Tel:(010)82801112
R96,R971
A
1000-3002-(2016)12-1290-11
10.3867/j.issn.1000-3002.2016.12.008
Foundation item:The project supported by National Natural Science Foundation of China(81302746);and National Natural Science Foundation of China(81573407)
2016-11-29接受日期:2016-12-19)
(本文编辑:齐春会)
国家自然科学基金(81302746);国家自然科学基金(81573407)
张永鹤, E-mail:zhyh@hsc.pku.edu.cn,Tel: (010)82801112
