消痈溃得康及其拆方抗氧化预防应激性大鼠胃黏膜损伤*
2016-02-14才丽平董文秀孙云峰TimothyHelland林庶茹郑洪新周学文
花 梦,才丽平**,董文秀,李 宁,,孙云峰,蒋 宁,Timothy Helland,林庶茹,郑洪新,周学文
(1.辽宁中医药大学分子生物实验室 沈阳 110084;2.辽宁中医药大学中医脏象理论及应用教育部重点实验室 沈阳 110084;3.辽宁中医药大学第一临床学院 沈阳 110032)
消痈溃得康及其拆方抗氧化预防应激性大鼠胃黏膜损伤*
花 梦1,才丽平1**,董文秀1,李 宁1,2,孙云峰1,蒋 宁1,Timothy Helland3,林庶茹1,郑洪新1,周学文3
(1.辽宁中医药大学分子生物实验室 沈阳 110084;2.辽宁中医药大学中医脏象理论及应用教育部重点实验室 沈阳 110084;3.辽宁中医药大学第一临床学院 沈阳 110032)
目的:探讨消痈溃得康及其拆方对水-束缚应激引起的大鼠胃黏膜损伤的保护作用及机制。方法:将大鼠随机平均分为正常组、模型组、消痈溃得康组、清热解毒组、和血止血组、托里生肌组。每天早晚两次灌胃,正常组和模型组给予等体积生理盐水,连续5天,末次给药1h后造模。取大鼠血、胃,将胃拍照、分割。结果:水-束缚应激引起大鼠胃及血清中谷胱甘肽(Glutataione,GSH)含量降低、脂质过氧化物(Lipid Hydroperoxide,LPO)含量升高,谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPX)、诱导型一氧化氮合酶(Inducible Nitric Oxide Synthase,iNOS)酶活力降低。消痈溃得康及各拆方均能够抑制水-束缚应激引起的大鼠胃黏膜损伤,提高水-束缚应激引起的大鼠胃组织及血清中GSH含量及GPX、iNOS酶活力;降低LPO含量。结论:消痈溃得康及其拆方对水-束缚应激引起的大鼠胃黏膜损伤起到保护,其中托里生肌组药物作用最明显,抗氧化作用可能是其重要的机制之一。
消痈溃得康 水-束缚应激 胃黏膜损伤 抗氧化
应激性胃损伤是临床常见的应激相关性消化系统疾病。应激性胃损伤是指机体在强烈而持久的应激状态下引起的胃黏膜保护机制和损伤机制失衡而出现的疾病,以胃黏膜出血、糜烂乃至溃疡为主要表现,甚者穿孔,引起急腹症,病死率高, 预后不良。复方中药消痈溃得康根据活动期胃溃疡的“毒热”病因理论[1,2],以黄芪、黄连为君药,苦参、浙贝母、蒲公英等为臣药,佐以白及、柴胡、人参,使以甘草,共奏清热解毒、消痈生肌之功效[3],对胃溃疡活动期患者具有较好的治疗作用[4],实验证明能够促进乙酸所致大鼠胃溃疡的愈合[5]。消痈溃得康及其拆方对水-束缚应激引起的大鼠胃黏膜损伤是否具有保护作用有待进一步研究。
应激性胃黏膜损伤涉及多种机制,包括神经内分泌失调、胃黏膜保护屏障破坏、胃黏膜损伤因素增强等。应激引起胃黏膜损伤的重要机制之一是活性氧(Reactive Oxygen Species,ROS)使脂质过氧化作用增强;应激诱发iNOS的产生,促进NO大量合成,过度产生的NO与超氧阴离子反应产生过氧亚硝基阴离子,后者进一步促进细胞内脂质过氧化,加重细胞膜损伤。GSH-PX通过使GSH氧化,而将过氧化氢分解为水,消除ROS的伤害性作用。本实验拟进一步研究中药消痈溃得康及其拆方水煎剂是否通过降低胃组织iNOS、提高GPX活性和还原型GSH水平,降低脂质过氧化水平,起到保护胃黏膜的作用。
1 材料与方法
1.1 药品和试剂
消痈溃得康组药物由黄芪、黄连、苦参、浙贝母、白及、海螵蛸、蒲公英、柴胡、丹参、人参、甘草、三七组成;清热解毒组药物由蒲公英、苦参、柴胡、浙贝母、黄连组成;和血止血组药物由海螵蛸、白及、丹参、三七组成;托里生肌组药物由黄芪、人参、甘草组成。以上药物均购自于北京同仁堂药店。GSH(批号:20151102)、GSH-PX(批号:20150518)、LPO(批号:20151104)、iNOS(批号:20150728)检测试剂盒均购自于南京建成生物工程研究所;BCA(批号:56100160)蛋白定量试剂盒购自于北京鼎国昌盛生物技术有限责任公司。
1.2 实验动物分组及模型制备
雄性SPF级Wistar大鼠48只(购于北京维通利华实验动物技术有限公司),体质量为300±20 g,许可证号:SCXK(京)2012-0001。随机平均分为6组:正常组、模型组、消痈溃得康组、清热解毒组、和血止血组、托里生肌组。除正常组、模型组外,各给药组大鼠按药物成人临床用药剂量6.25倍、每天早晚两次灌胃,连续5天。正常组和模型组给予等体积生理盐水。末次给药24 h前给予大鼠禁食、营养液支持,末次给药1 h后,将模型组和各给药组大鼠依次放入束缚笼并浸于23±1℃冷水至胸部,6 h后依次取出。
1.3 标本采集和处理
依次按0.35 mL/100 g大鼠体质量腹腔注射10%水合氯醛进行麻醉;打开腹腔,腹主动脉取血,分离胃。将血离心,取血清。将胃剪开,冲洗食物残渣,平展于展板上,以数码相机拍照。将一部分胃组织放入4%多聚甲醛溶液中固定,另一部分存于-70℃冰箱保存。
1.4 观测指标和方法
1.4.1 胃黏膜大体情况及损伤面积计算
按统一标准对胃进行拍照,记录胃黏膜损伤情况,在显微图像分析与处理系统(Image-Pro Plus6.0)中计算胃损伤指数以及损伤抑制率。
1.4.2 组织病理学检查
将固定的胃组织梯度脱水,石蜡包埋,制成5 μm切片,常规脱蜡脱水,进行苏木精-伊红染色,显微镜下观察各组胃组织切片。
1.4.3 样品准备及检测
将胃组织取出,按质量/g:体积/mL=1:4的比例加入生理盐水,冰水浴匀浆,离心,制备成20%的组织匀浆,取上清液;将血清取出后置于4℃冰箱解冻。胃组织、血清中各指标检测同时按操作规程进行。
1.5 统计学方法
采用SPSS 17.0软件处理,one-way ANOVA进行分析,方差齐采用LSD-t检验,方差不齐采用Tamhane's方法,数据以表示,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
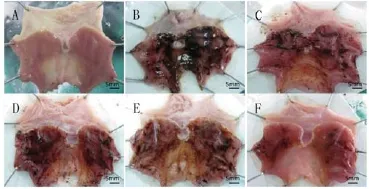
图1 各组大鼠胃黏膜大体标本观察
2 结果
2.1 各组药物对大鼠胃黏膜的损伤情况
以水-束缚应激的方法造成大鼠胃黏膜损伤后,模型组大鼠胃黏膜出现大面积出血、糜烂,血色呈褐色甚至黑色,部分皱襞消失;各给药组大鼠胃黏膜出血情况均有不同程度的减轻,其中托里生肌组大鼠胃黏膜保护情况最好(见图1)。
图像分析结果显示:与正常组相比,模型组大鼠胃黏膜损伤指数显著增大(P<0.01);与模型组相比,消痈溃得康组、清热解毒组、和血止血组、托里生肌组大鼠胃黏膜损伤指数均显著降低(P<0.01)。见表1,图2。
胃组织HE染色可见模型组大鼠胃组织黏膜上皮细胞脱落,黏膜表面出血、水肿,各给药组大鼠胃黏膜上皮细胞脱落少,完整性较好(图3)。
2.2 生化指标的变化
2.2.1 GSH含量
胃组织中:与正常组相比,模型组大鼠胃组织GSH含量显著降低(P<0.01),托里生肌组大鼠胃组织中GSH含量显著升高(P<0.01);与模型组相比,给药组GSH含量显著升高(P<0.01)。血清中:与正常组相比,模型组GSH含量显著降低(P<0.01);与模型组相比,各给药组组GSH含量显著降低(P<0.01)。见表2,图4。
2.2.2 GSH-PX酶活力
胃组织中:模型组GSH-PX酶活力与正常组相比显著降低(P<0.01);与模型组相比,消痈溃得康组、和血止血组GSH-PX酶活力升高,差异有统计学意义(P<0.05),托里生肌组GSH-PX酶活力显著升高(P<0.01),清热解毒组GSH-PX酶活力变化不显著(P>0.05)。血清中:模型组与正常组相比GSHPX酶活力显著降低(P<0.01);与模型组相比,清热解毒组大鼠胃组织GSH-PX酶活力升高(P<0.05),消痈溃得康组、和血止血组、托里生肌组大鼠胃组织GSH-PX酶活力显著升高(P<0.01)。见表3,图5。
2.2.3 LPO含量
胃组织中:与正常组相比,模型组大鼠胃组织中LPO含量显著升高(P<0.01);与模型组相比,消痈溃得康组、清热解毒组、和血止血组大鼠胃组织中LPO含量降低(P<0.05),托里生肌组大鼠胃组织中LPO含量显著降低(P<0.01)。血清中:与正常组相比,模型组大鼠血清中LPO含量显著升高(P<0.01);与模型组相比,各给药组大鼠血清中LPO含量均降低(P<0.05)。见表4,图6。
2.2.4 iNOS酶活力
胃组织中:与正常组相比,模型组大鼠胃组织中iNOS酶活力显著升高(P<0.01);与模型组相比,各给药组大鼠胃组织中iNOS酶活力显著降低(P<0.01)。血清中:与正常组相比,模型组大鼠血清中iNOS酶活力显著升高(P<0.01);与模型组相比,各给药组大鼠血清中iNOS酶活力均显著降低(P<0.01)。见表5,图7。

表1 各组大鼠胃黏膜损伤指数(n=8)

图2 各组大鼠胃黏膜损伤指数

图3 各组大鼠胃组织的形态学变化(HE×10)
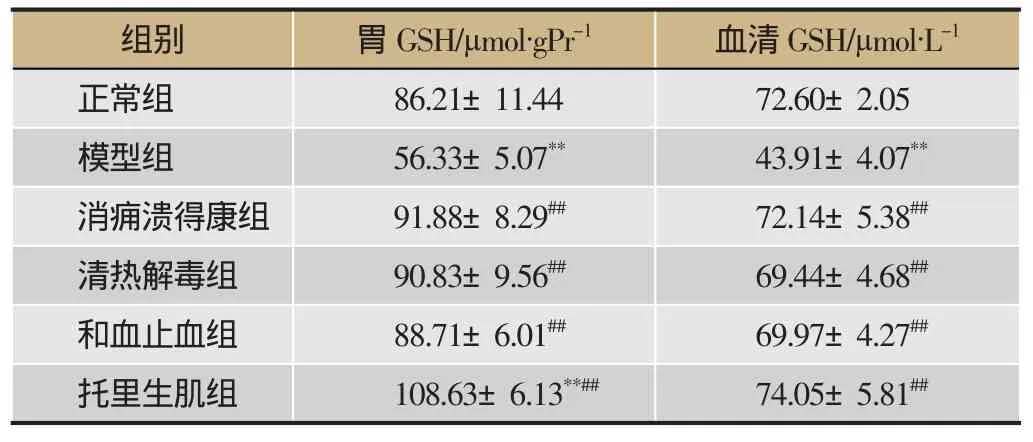
表2 各组药物对胃组织和血清中GSH含量的影响(n=8)
3 讨论
氧化应激是水-束缚应激性胃溃疡发生发展的主要机制,其过程中大量形成的超氧阴离子能够和细胞脂质发生过氧化反应,形成大量LPO,降低胃黏膜的抗氧化防御机能,从而导致胃黏膜损伤;脂质过氧化物在体内代谢为丙二醛(Malondialdehyde,MDA)和4-羟基壬烯酸,进一步加剧细胞膜的损伤。氧化应激能够诱发iNOS产生,促进NO大量合成,过度产生的NO与超氧阴离子反应产生过氧亚硝基阴离子,进一步促进细胞内脂质过氧化,加重细胞膜损伤。

图4 各组药物对胃组织和血清中GSH含量的影响

表3 各组药物对胃组织和血清中GSH-PX酶活力的影响(n=8)
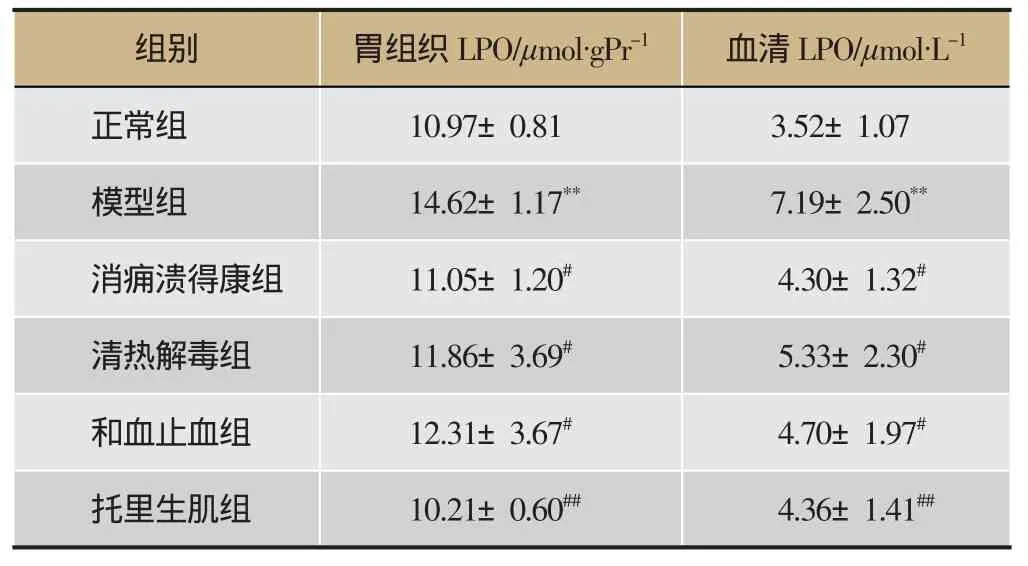
表4 各组药物对胃组织和血清中LPO含量的影响(n=8)

图5 各组药物对胃组织和血清中GSH-px酶活力的影响

图6 各组药物对胃组织和血清中LPO含量的影响
还原型GSH是抵抗ROS的第一道防线,是机体内最重要的非酶性抗氧化物,能够保护胃黏膜不受自由基损伤[6]。GSH是一种低分子清除剂,可清除超氧阴离子、过氧化氢和脂质过氧化物,因而GSH含量的多少是衡量机体抗氧化能力的重要因素。本实验中,模型组大鼠胃组织和血清GSH含量较正常组均显著降低,消痈溃得康组、清热解毒组、和血止血组、托里生肌组大鼠胃组织和血清中的GSH含量较应激模型组均显著升高。以上表明消痈溃得康及各拆方组药物均可以显著抑制水-束缚应激引起的GSH含量的降低,具有显著的抗氧化能力。
GPX的主要作用是催化过氧化氢分解。硒是GPX酶系的组成成分,它能催化还原型GSH变为氧化型GSH(也称作谷胱甘肽二硫化物,GSSG),使有毒的过氧化物还原成无毒的羟基化合物,把脂质氢过氧化物还原成相对稳定的醇类,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。人体有8种GPX同型抗原,它们的活性部位中大多包含硒代半胱氨酸残基。其中GPX-1普遍存在,GPX-2仅在上皮中特异性表达,能够抵抗食物中的氢过氧化物,在胃癌细胞中也可诱导产生。本实验结果表明,消痈溃得康方中托里生肌组药物对抑制水-束缚应激造成的GPX酶活力降低作用最为显著,故该复方抗氧化作用的主要药物可能主要是黄芪、人参、甘草,药中发挥作用的具体成分还需进一步的实验探讨。
NOS包括钙依赖的原生型一氧化氮合酶(cNOS)和钙非依赖性的诱导型一氧化氮合酶(iNOS),由cNOS催化产生的正常浓度的NO具有胃肠保护作用,而由iNOS催化的过度产生的NO与超氧阴离子反应产生过氧亚硝基阴离子,能够启动细胞内脂质过氧化,引起细胞膜损伤[7]。已有研究表明水-束缚应激大鼠胃黏膜iNOSmRNA表达增加[8];iNOS活性增强且与胃黏膜损伤呈正相关,投与选择性iNOS抑制剂可以减少水-束缚应激大鼠胃黏膜NO的产生,减轻胃黏膜损伤[9]。本实验中,模型组大鼠胃组织和血清中iNOS酶活力显著高于正常组;给药组与模型组相比均显著抑制了iNOS酶活力,减少了NO的合成,减低了脂质过氧化损伤,对水-束缚应激导致的胃黏膜损伤起到保护作用。

表5 各组药物对胃组织和血清中iNOS酶活力的影响(n=8)

图7 各组药物对胃组织和血清中iNOS酶活力的影响
细胞膜磷脂中含有大量的不饱和脂肪酸,其化学性质不稳定,容易被过氧化。脂质过氧化反应能够引起细胞膜的流动性降低、离子转运功能降低、细胞膜的完整性遭到破坏,最终引起细胞功能下降[10]。应激性胃溃疡的主要机制是氧化应激,氧化应激过程中形成的超氧阴离子能够和细胞脂质发生反应,形成大量脂质过氧化物,降低胃黏膜的防御机能,从而导致胃黏膜损伤[11]。水-束缚应激模型大鼠胃组织匀浆脂质过氧化产物明显增高[12]。水-束缚应激大鼠胃黏膜iNOS活性增加产生过量的NO参与了脂质过氧化的形成。本实验参照Guo等[13]的造模方法造成水-束缚应激性胃溃疡模型,结果符合胃溃疡的病理组织学质量评价。实验结果中,模型组胃组织和血清中LPO含量均显著高于正常组,与以往报道相一致[10];各给药组大鼠胃组织和血清中LPO较模型组均降低,以托里生肌组大鼠胃组织中LPO降低最为明显,接近正常组。表明水-束缚应激可以引起大鼠胃组织和血清中脂质过氧化水平增加,托里生肌组药物对抑制这种由氧化应激引起的脂质过氧化反应最为明显,起到保护细胞损伤的作用。
胃溃疡属于中医“胃痈”范畴,病因是由于感受外邪、情志不畅、饮食失常、脾胃虚弱等因素引起脾胃功能受损,导致胃肠功能紊乱、脉络受损,从而形成溃疡。病机变化可由气到血,由实转虚,或虚中夹实等。周学文教授提出“以痈论治”胃溃疡,拟定具有清热解毒、和血止血、托里生肌功效的消痈溃得康复方,在临床治疗“毒热证”胃溃疡中取得良好疗效[2]。本实验结果表明,消痈溃得康复方对水-束缚应激性胃溃疡的防治效果不及方中托里生肌药物,以方测证,可见水-束缚应激胃溃疡大鼠模型不属于中医“毒热证”范畴。托里生肌组药物黄芪,人参,甘草均为补益类中药,推测水-束缚应激胃溃疡大鼠模型当属于“虚证”胃溃疡模型。研究表明,黄芪可以改善水-束缚应激大鼠胃黏膜出血情况,降低胃溃疡指数,减轻胃黏膜损伤程度和毛细血管及其周围间质水肿[14]。黄芪总苷可以升高大鼠胃黏膜SOD酶活力、降低MDA含量、增加褪黑素受体1、2的表达[15]。人参头提取物可以增加大鼠胃黏液的分泌,人参根提取物可以诱导HSP27的表达,从而保护大鼠胃黏膜[16,17]。甘草可促进损伤黏膜的修复,可能与提高多胺含量和酸脱羧酶表达有关。甘草酸铋可改善水-束缚应激小鼠黏膜腺区局部充血、条索状和点状出血、糜烂情况,机制可能与抑制胃酸分泌、降低胃蛋白酶活性, 改善胃黏膜微循环有关[18]。3种药物是否对临床虚证胃溃疡具有防治作用,其机制如何,怎样的剂量配伍更有效将是本课题下一步工作的重点。
1 周学文,郑洪新.“毒热”与胃溃疡活动期.中国中医药报,2007-12-26(005).
2 周学文.胃溃疡活动期的中医证治.中华中医药学刊,2007,25(9):1775-1776.
3 郑洪新,王垂杰,王文萍,等.胃溃疡活动期“毒热”创新病因的系统研究.世界中医药,2014,9(5):557-560,567.
4 刘林,王垂杰,郑洪新,等.“以效证因”消痈溃得康治疗胃溃疡胃毒热证的随机双盲对照临床试验.世界科学技术-中医药现代化,2012,14(2):1399-1404.
5 蒋宁,才丽平,曲怡,等.消痈溃得康抑制局部炎性反应促进胃溃疡愈合的研究.中华中医药杂志,2015,30(4):1058-1061.
6 Sidahmed H M, Hashim N M, Amir J, et al. Pyranocycloartobiloxanthone A, a novel gastroprotective compound from Artocarpus obtusus Jarret, against ethanol-induced acute gastric ulcer in vivo. Phytomedicine, 2013, 20(10):834-843.
7 Konturek S K, Konturek P C. Role of nitric oxide in the digestive system. Digestion,1995,56(1):1-13.
8 Czekaj R, Majka J, Ptak-Belowska A, et al. Role of curcumin in protection of gastric mucosa against stress-induced gastric mucosal damage. Involvement of hypoacidity, vasoactive mediators and sensory neuropeptides. J Physiol Pharmacol, 2016, 67(2):261-275.
9 Nishida K, Ohta Y, Ishiguro I. Relation of inducible nitric oxide synthase activity to lipid peroxidation and nonprotein sulfhydryl oxidation in the development of stress-induced gastric mucosal lesions in rats. Nitric Oxide, 1998, 2(4):215-223.
10 Kudryavtsev K V, Markevich A O, Virchenko O V, et al. Pharmacological correction of stress-induced gastric ulceration by novel small-molecule agents with antioxidant profile. Scientific World Journal, 2014, 2014:1-6.
11 Kwiecien S, Brzozowski T, Konturek P C, et al. Effect of central and peripheral actions of histamine and its metabolite N-alpha methyl histamine on gastric secretion and acute gastric lesions. J Physiol Pharmacol, 2001, 52(4Pt1):625-638.
12 Gupta P C, Rao C V. Gastroprotective effect of standardized leaf extract from Careya arborea on experimental gastric ulcers in rats. Pharm Biol, 2014, 52(8):1003-1008.
13 Guo S, Gao Q, Jiao Q, et al. Gastric mucosal damage in water immersion stress: Mechanism and prevention with GHRP-6. World J Gastroenterol, 2012, 18(24):3145-3155.
14 曹焕军,张成明,孙永红.黄芪对大鼠应激性胃溃疡的预防作用.临床急诊杂志2008,9(3):161-163.
15 李燕舞,宋宁,王汝俊.黄芪总苷对应激大鼠胃黏膜氧自由基及褪黑素受体的影响.世界华人消化杂志,2008(29):3321-3323.
16 Jeong C S, Hyun J E, Kim Y S. Ginsenoside Rb1: the anti-ulcer constituent from the head of Panax ginseng. Arch Pharm Res, 2003,26(11):906-911.
17 Yeo M, Kim D K, Cho S W, et al. Ginseng, the root of Panax ginseng C.A. Meyer, protects ethanol-induced gastric damages in rat through the induction of cytoprotective heat-shock protein 27. Dig Dis Sci, 2008,53(3):606-613.
18 姬晓灵,蒋袁絮,任彬彬.甘草酸铋抗实验性胃溃疡作用及机制研究.中国中药杂志,2007,32(14):1429-1431.
Effects and Mechanisms of Xiao Yong Kui De Kang (XYKDK) on Water Immersion Restraint Stress-Induced Gastric Mucosal Injury in Rats
Hua Meng1, Cai Liping1, Dong Wenxiu1, Li Ning1,2, Sun Yunfeng1, Jiang Ning1, Timothy Helland3, Lin Shuru1, Zheng Hongxin1, Zhou Xuewen3
(1. Laboratory of Molecular Biology, Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China; 2. Key Laboratory of Ministry of Education for TCM Viscera-State Theory and Applications, Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China; 3. The First Clinical Medical Institute, Liaoning University of Traditional Chinese Medicine, Shenyang 110032, China)
This ostudy aimed at exploring the effects and mechanisms of XYKDK and its dissected constituents on water immersion restraint stress-induced gastric mucosal injury in rats. Wistar rats were randomly divided into the following 6 groups: the normal group, the model group, XYKDK group, Qing Re Jie Du (QRJD) group, He Xue Zhi Xue (HXZX) group and Tuo Li Sheng Ji (TLSJ) group. The rats in the XYKDK, QRJD, HXZX and TLSJ groups were pretreated with their corresponding medicine, while the normal and model groups received equal administration with normal saline, twice a day, for 5 days; An hour after the final dosing, the rats were caused acute gastric mucosa injury. Six hours later, the stomachs of the rats were removed, photographed and cut. As a result, water immersion restraint stress caused gastric mucosa damage and reduced the content of glutataione (GSH) and the corresponding enzyme activity of glutataione peroxidase (GSH-PX), and inducible nitric oxide syntahse (iNOS), while increasing lipid hydroperoxide (LPO) content in gastric and serum. XYKDK and its dissected constituents all can alleviated water immersion restraint stress-induced gastric mucosal injury in rats, increased the content of GSH, decrease LPO, and improve GSH-PX and iNOS activity. In conclusion, XYKDK and its dissected constituents presented protective effects on water immersion restraint stress-induced gastric mucosal injury in rats. The medicine used in the TLSJ group showed marked effects, an antioxidant effect may be the mechanisms behind this.
Xiao Yong Kui De Kang, water immersion restraint stress, gastric mucosal injury, anti-oxidation
10.11842/wst.2016.12.015
R229
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-10-21
修回日期:2016-12-13
* 国家自然科学基金委面上项目(81173380):基于表观遗传学技术研究“以痈论治”胃溃疡的分子机制,负责人:才丽平;辽宁省教育厅高等学校优秀人才支持计划(LR2012032):胃溃疡毒热病因及中药治疗分子机制研究,负责人:才丽平;沈阳市科技局重点实验室建设项目(F13-285-1-00):沈阳市中医药重点实验室建设项目,负责人:才丽平。
** 通讯作者:才丽平,医学博士,教授,博士生导师,主要研究方向:中药抗胃溃疡分子机制的研究。
