水中钙镁含量测定原理的深入解析及方法改进
2016-02-10罗承源刘小乐陈广慧
罗承源,刘小乐,姜 昆,陈广慧*
(1.汕头大学化学系,广东汕头 515063;2.汕头职业技术学院自然科学系,广东汕头 515078)
水中钙镁含量测定原理的深入解析及方法改进
罗承源1,刘小乐1,姜 昆2,陈广慧1*
(1.汕头大学化学系,广东汕头 515063;2.汕头职业技术学院自然科学系,广东汕头 515078)
采用EDTA测定水中钙镁离子含量的无机及分析化学实验,虽然步骤简单,但是涉及的知识点很多,学生通常对该实验原理理解不够深入.因此,文章就实验测定中所涉及的重要原理进行了深入解析,并对实验方法进行了适当的改进.
EDTA;pH值;钙镁含量;原理解析;实验改进
在讲授生物专业本科生一年级下学期所开设的《无机及分析化学实验》[1]时,发现实验《EDTA测定水中钙镁离子的含量》的操作步骤虽然简单,但是原理部分却涉及很多知识点,例如:采用缓冲溶液调控酸度的方法、钙指示剂和铬黑T指示剂的变色范围以及分子结构、溶度积和配合物稳定常数概念等.学生通常不能理解实验过程所涉及的原理,实验操作也是照方配药,只知其然,不知其所以然,没有在实验中联系并巩固在一年级上学期学到的《无机及分析化学》理论知识.因此,为达到理论指导实验的教学目的,对该实验涉及的知识点进行深入分析十分必要.此外,实验设计也存在一定的不足之处.例如:仅采用50 mL自来水样,滴定过程消耗EDTA量非常少,易引入较大的相对误差;没有考虑到自来水样中其他离子的可能影响,会导致方法误差.本文也尝试通过改进实验方法来减小误差.
1 实验原理解析
该实验[1]包括Ca2+的测定和Ca2+、Mg2+总量的测定.
1.1 钙离子的测定
1.1.1 操作步骤
用移液管准确移取100 mL自来水样于250 mL锥形瓶中,加2 mL 6 mol·L-1NaOH溶液(pH=12~13)、4~5滴钙指示剂.用EDTA溶液滴定时,不断摇动锥形瓶,当溶液变为纯蓝色时,即为终点.
1.1.2 钙离子的测定知识点分析
滴定过程所涉及的反应:
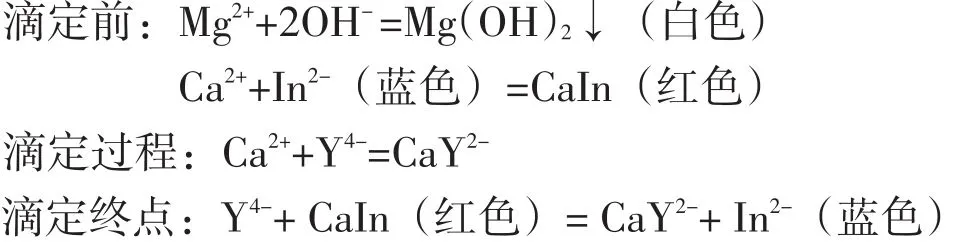
(1)镁离子的掩蔽:
滴定前预处理:加入2 mL 6 mol·L-1NaOH,调节溶液的pH在12~13内,反应式如下
Mg2++2OH-=Mg(OH)2↓ksp=[Mg2+][OH-]2=1.2×10-11
当pH=12时,[OH-]=0.01mol·L-1,则[Mg2+]=ksp/[OH-]2=1.2×10-11/0.012=1.2×10-7<10-5,
当pH=13时,[OH-]=0.1mol·L-1,则[Mg2+]=ksp/[OH-]2=1.2×10-11/0.12=1.2×10-9<10-5,即Mg2+已沉淀完全,由于Mg(OH)2与Ca(OH)2的溶度积之差ΔK>6,所以在Mg2+的沉淀过程中,Ca2+可以视为没有沉淀产生.
因此Mg2+的存在对Ca2+的测定基本没有影响.
(2)酸度的控制
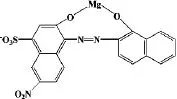
2)由于溶液的pH值对EDTA络合能力也有影响,当pH≥12时,酸效应系数αY(H)可视为1,EDTA的存在形式是Y4-.
3)pH值对Ca2+影响:
所以综合考虑各种因素,控制pH在12~13范围内最合适,而本实验用6 mol·L-1NaOH溶液来调控
1.2 钙镁离子总量的测定
1.2.1 操作步骤
准确移取100 mL自来水样于250 mL锥形瓶中,加入5 mL NH3·H2O-NH4Cl缓冲溶液、3滴铬黑T指示剂.采用EDTA溶液滴定,当溶液由酒红色变为纯蓝色时,即为终点.按公式(1)~式(3)分别计算Ca2+、Mg2+总量(以CaCO3含量表示,单位为mg·L-1)及Ca2+和Mg2+的分量(单位为mg·L-1).
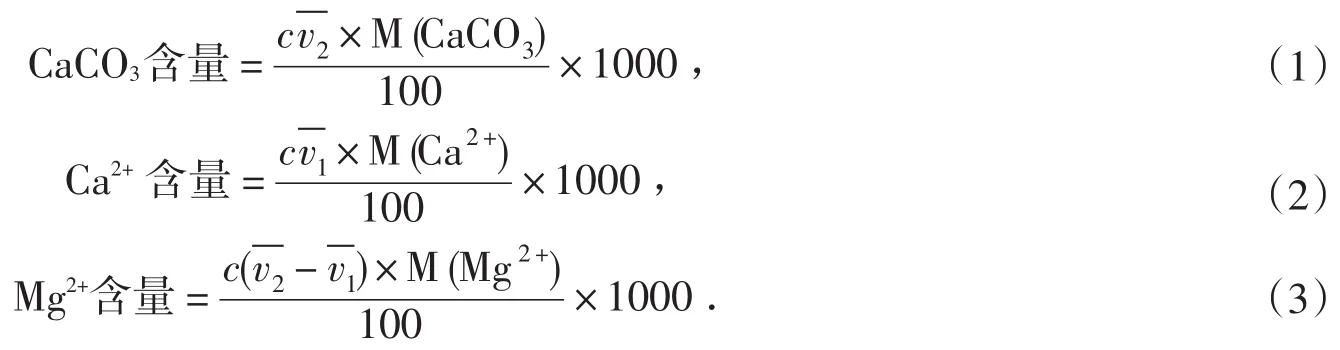
1.2.2 钙镁离子总量的测定知识点分析
滴定过程所涉及的反应:
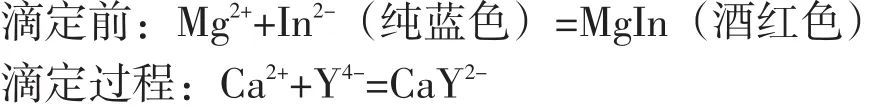
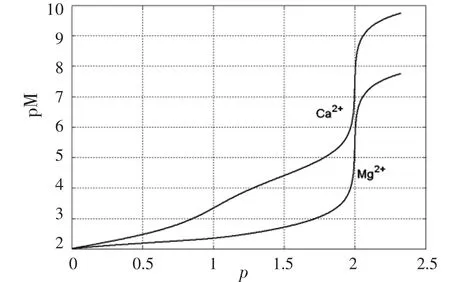
图1 0.01 mol·L-1EDTA滴定0.01 mol·L-1Ca2+和0.01 mol·L-1Mg2+混合溶液滴定曲线(pH=10.0)
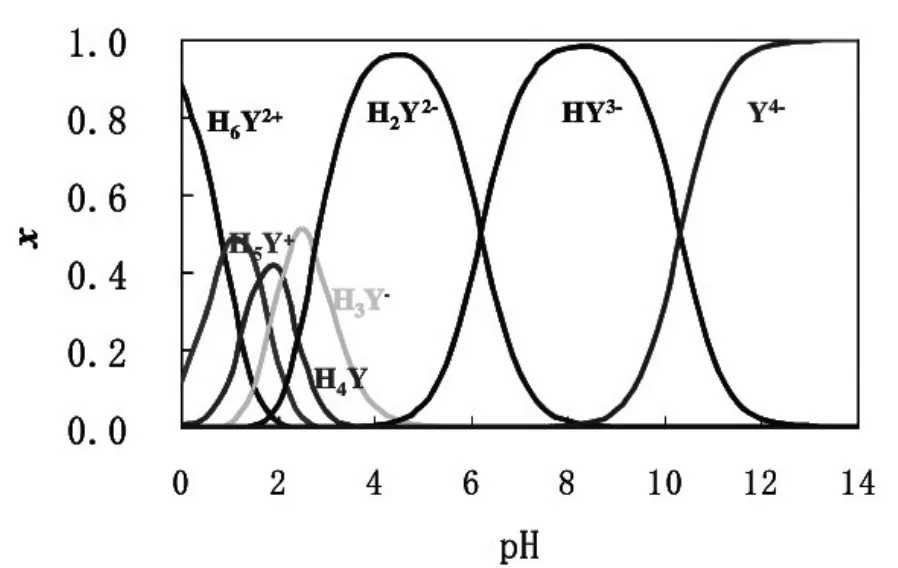
图2 不同pH下EDTA的各种存在形态分布图
测定Ca2+、Mg2+总量时,在pH=10的缓冲溶液中,以铬黑T为指示剂,用EDTA滴定.因稳定性顺序为CaY2->MgY2->MgIn>CaIn,全部铬黑T先与Mg2+配位生成酒红色的MgIn.因此,当EDTA滴入时,首先与游离的Ca2+配位,然后再夺取MgIn中的Mg2+,使铬黑T游离而到达滴定终点.溶液由酒红色变为纯蓝色,滴定曲线如图1[2]所示.根据EDTA标准溶液的用量,即可以计算样品中钙镁的总量,然后换算为相应的硬度单位.
1.2.3 总量测定过程中涉及到的酸效应问题和缓冲溶液调控原理
(1)酸效应
根据酸性不同,EDTA在水溶液中共有7种存在方式,如图2所示.在pH=10时,HY3-是EDTA主要存在形式,而在pH>10.34时,主要以Y4-形式存在.酸效应造成的误差可以用酸效应系数αY(H)表示:
当pH=10时
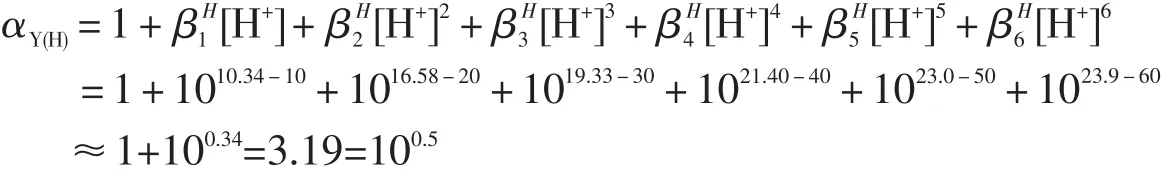
lgαY(H)=0.5,有lgKMgY=8.7和lgKCaY=10.7;则lgKMgY-lgαY(H)=8.2>8;lgKCaY-lgαY(H)=10.2>8
(若允许误差为±0.1%,而配位滴定目测终点的ΔpM值一般会有±0.2的误差,则要求lgc(M,计量点)·K′MY≥6,即c=0.01mol/L时,K′MY≥8)[3]374.
即酸效应对实验的影响不大.在不同pH值下做平行实验对比,也得出在pH=10时相对标准偏差仅为0.06%[4].
(2)缓冲溶液的调控原理
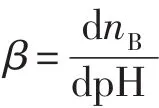
缓冲溶液由弱酸(HB)及其共轭碱(B)形成平衡:HB⇌H++B-;用β表示缓冲容量,,即当1L溶液的pH增加dpH,则相应需加入强碱的量为dnB.当CB=CA时,改变总浓度如表1所示:缓冲溶液总浓度越大,调节能力越强,在达到能调节pH的条件下选适中浓度以节约试剂.
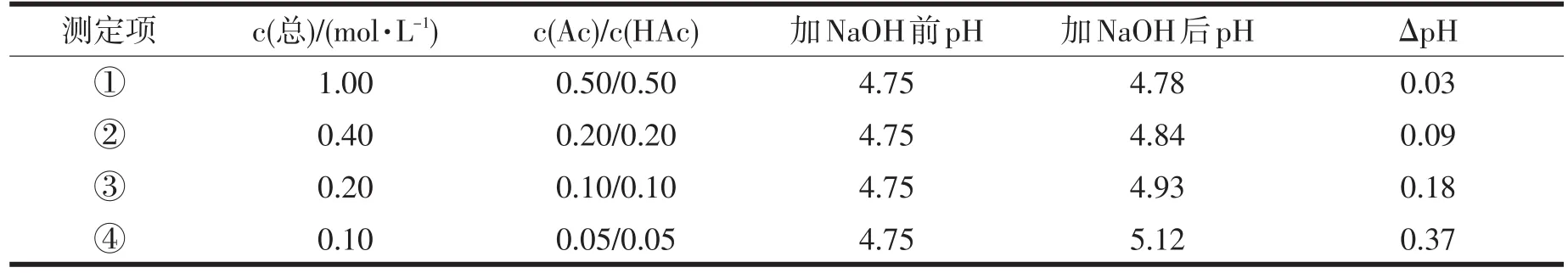
表1 缓冲溶液总浓度与缓冲容量的关系
当CB≠CA时,溶液缓冲能力如表2所示[3]86-88.发现当CB=CA时,缓冲能力最强.
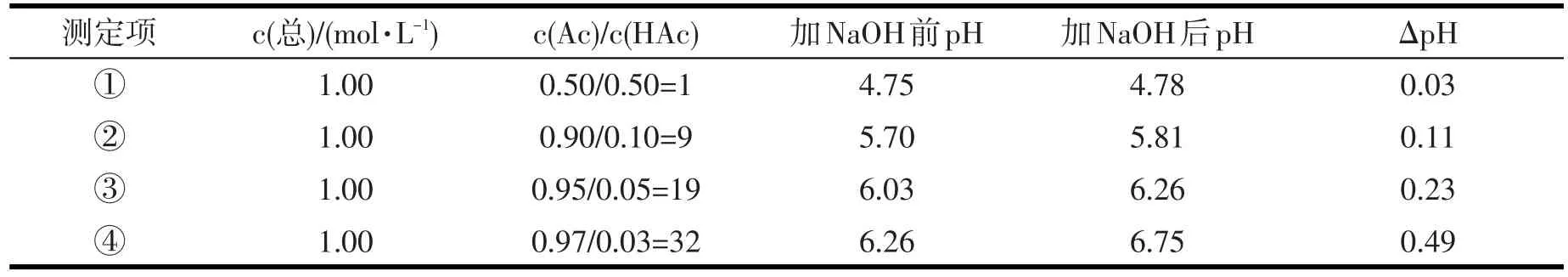
表2 缓冲对浓度比值与缓冲容量的关系
2 实验方法改进
考虑到实验设计存在若干不足,例如:实验中未消除可能的Fe3+、Al3+、Cu2+、Co2+、Ni2+等金属离子对铬黑T指示剂的影响,以及指示剂变色不灵敏等问题,因此尝试对实验方法作出了如下改进:
2.1 消除其它金属离子的影响
溶液中如果含有Fe3+、Fe2+、Zn2+、Co2+、Ni2+、Cd2+等离子会对铬黑T指示剂产生封闭作用[2].根据一些金属离子-EDTA配合物的曲线图[3]370可知,在pH=10时,上述离子的存在会对Ca2+、Mg2+离子的测定产生较大影响.结合《无机及分析化学》配位掩蔽剂[3]370中的常用掩蔽方法和中华人民共和国国家标准,水质-钙和镁总量的测定-EDTA滴定法(GB7477-87)[5]所使用的掩蔽其它金属离子的方法,加入KCN掩蔽剂可以掩蔽其它金属离子.如果存在与Ca2+、Mg2+性质相似的Ba2+或者缺少掩蔽剂的离子时,难以采用化学分析法进行分离或掩蔽,须采用原子吸收等仪器分析方法进行测定.
2.2 增加终点变色的灵敏度
测量Ca2+、Mg2+总量时,由于Mg2+与铬黑T指示剂结合的稳定性比Ca2+强,当水中Mg2+含量很少时,为减少误差通常应加入适量的Mg-EDTA,使终点变色灵敏.实验发现在100 mL水样里加入不少于3 mL Mg-EDTA时,变色灵敏[4].因此选取3 mL Mg-EDTA作为理想的加入体积.
2.3 增加自来水样的用量
众所周知,在滴定分析中,滴定管读数有±0.01 mL的误差,在一次滴定中需要读数两次,造成最大可能误差为±0.02 mL.由于水样中钙镁的含量较低,假设测定50 mL水样的硬度所消耗的EDTA体积为2.15 mL,则测定的100 mL水样所消耗的EDTA体积为4.30 mL,EDTA的浓度为0.010 33 mg·L-1,所以50 mL和100 mL水样测得Ca2+、Mg2+总量分别为(22.21±0.21)mg·L-1、(44.42±0.21)mg·L-1,浓度相对误差分别为:
50 mL水样的硬度测量造成的质量浓度相对误差为:0.21/22.21×100%=0.95%;
100 mL水样的硬度测量造成的质量浓度相对误差为:0.21/44.42×100%=0.47%;
100 mL与50 mL水样的硬度测量造成的质量浓度相对误差之比:0.47%/0.95%=0.49;
50 mL水样的硬度测量造成的物质的量浓度误差为:0.01033×0.02/50=4.132×10-6;
100 mL水样的硬度测量造成的物质的量浓度误差为:0.01033×0.02/100=2.066×10-6;
从以上的计算结果可知,若取50 mL水样,读数误差造成的相对误差很大,约为100 mL水样的2倍,另外锥形瓶容积仅为250 mL,水样量不应超过锥形瓶体积的1/2.综合以上影响因素,采用100 mL水样进行测量,不再额外添加蒸馏水.
2.4 实验数据处理方法的改进
《无机及分析化学实验》教材[1]是通过做三次平行实验取其体积平均值来计算总硬度值,对比改进的计算方法,前者的计算误差稍大一点.表3是一次总硬度测量的数据对比,根据公式(1)、(2)、(3)得:
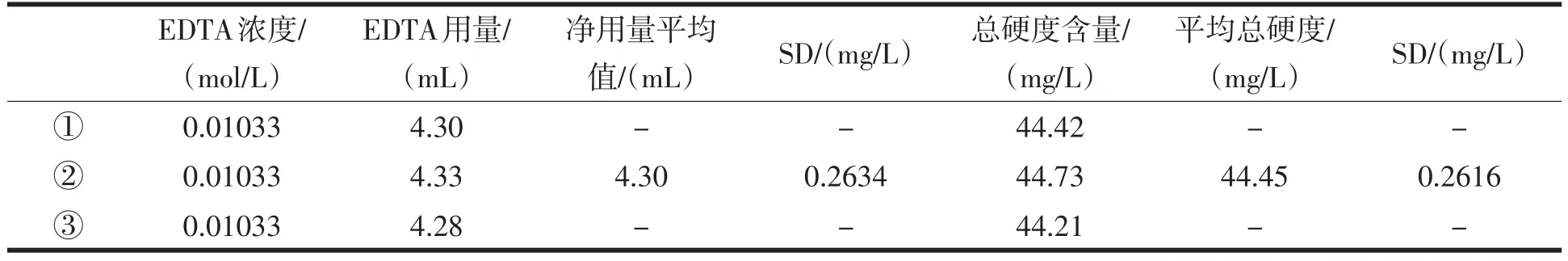
表3 Ca2+、Mg2+总硬度测定的一组数据
首先需对所测得的数据进行可疑值的检验,采用的方法是Q检验法,检验过程如下
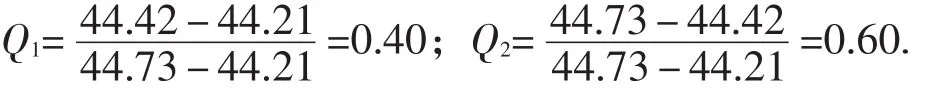
根据《无机及分析化学》[3]322-323Q值表可知,当n=3时,不同置信度的Q值为:Q0.90=0.94、Q0.96= 0.98、Q0.99=0.99,可知Q1<Q0.90,Q2<Q0.90,故44.42和44.73不应舍去.
即总硬度含量的最大值和最小值都不可舍去,所测得数据是可信的,可用于下一步的计算.
两种不同计算方法所对应的标准偏差分析:
①用体积计算标准偏差再转换成含量标准偏差
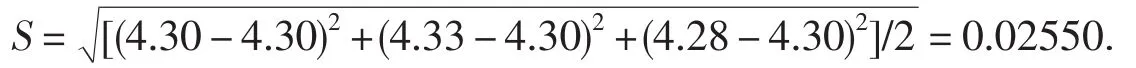
总硬度含量标准偏差:0.02550×0.01033×100×1000/100=0.263 4 mg·L-1.
②用总硬度含量计算标准偏差
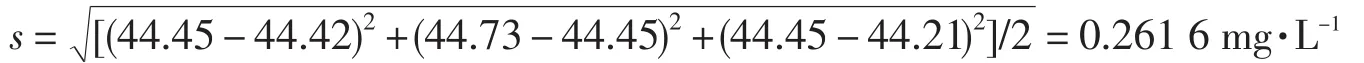
对比这两种计算方法可知:第二种计算方法所对应的标准偏差较小.
因此本文对计算方法进行了改进,采用分别计算总硬度含量,再求其平均值的方法来计算总硬度含量.
3 结论
通过解析《EDTA测定水中钙镁离子的含量》实验原理,阐述了铬黑T的变色原理、通过调控酸度来掩蔽Mg2+、配位滴定络合反应稳定常数、酸效应对EDTA络合能力的影响、以及缓冲溶液的调控原理等知识点.计算表明,测定Ca2+浓度时,控制pH=12~13能有效地掩蔽Mg2+.测定Ca2+、Mg2+总量在pH=10时EDTA主要存在形式为HY3-,表明该条件下酸效应对钙镁总量测定的影响很小,可忽略不计.同时,还对实验方法尝试进行了若干改进:加入KCN掩蔽剂,以消除其他金属离子对钙镁离子测量的影响;加入Mg-EDTA提高终点显色的灵敏度;增加水样的用量来减少测量误差;改变待测离子含量计算方式,通过分别计算待测离子的含量,再求其平均值以减少计算误差.
[1]南京大学《无机及分析化学实验》编写组.无机及分析化学实验.4版[M].北京:高等教育出版社,2006:137-138.
[2]占达东,柏文良,李攻科,等.计算机辅助配位滴定实验教学的若干实例[J].大学化学,2010,25(2):32-35.
[3]南京大学《无机及分析化学》编写组.无机及分析化学.4版[M].北京:高等教育出版社,2006.
[4]韦寿莲,叶泽龙,林泽卯.影响水硬度测定的若干因素[J].肇庆学院学报,2009,30(5):58-62.
[5]国家环境保护局.水质-钙和镁总量的测定-EDTA滴定法:GB 7477-87[S].北京:中国标准出版社,1987:3.
A Thorough Analysis of the Measurement Principle of the Ca2+and Mg2+Content in Aqueous Solution and the Corresponding Improved Method
LUO Cheng-yuan1,LIU Xiao-le1,JIANG Kun2,CHEN Guang-hui1*
(1.Department of Chemistry,Shantou University,Shantou,Guangdong,515063; 2.Department of Natural Sciences,Shantou Polytechnic,Shantou,Guangdong,515078)
For the experiment of inorganic and analytical chemistry,it is easy to measure Ca2+and Mg2+content in aqueous solution using EDTA.However,students usually cannot fully understand the related principle involved in this experiment.Thus,we aim to interpret the main principle in the process of the experiment, and even try to improve the experiment method in this article.
EDTA;pH;Ca2+and Mg2+content;principle analysis;experimental improvement
O 655.25
:A
:1007-6883(2016)06-0093-06
责任编辑 朱本华 周春娟
2016-01-18
汕头大学“创新强校工程”本科教学改革项目(项目编号:2016-2018).
罗承源(1989-),男,福建三明人,汕头大学化学系在读硕士研究生.陈广慧为通讯作者.
