大黄素维持肝硬化大鼠高动力循环状态下肠屏障完整性实验研究
2016-02-09施琳琳陈建永章佳颖
施琳琳 陈建永 徐 虹 章佳颖
大黄素维持肝硬化大鼠高动力循环状态下肠屏障完整性实验研究
施琳琳 陈建永 徐 虹 章佳颖
目的观察大黄素对肝硬化大鼠高动力循环状态下肠屏障完整性的维持作用。方法SD雄性大鼠25只,随机分为对照组5只、肝硬化模型组10只、大黄素干预组10只,模型组与干预组予500mL/L四氯化碳(3mL/100g)皮下注射复制肝硬化大鼠模型,对照组大鼠给予生理盐水(3mL/ 100g)皮下注射,均为8周。干预组制模第15天起予大黄素(5mg/mL,5mL/kg)灌胃,对照组和模型组每日给予相当体积的生理盐水灌胃,均1天1次。8周后处死大鼠,行墨汁推进试验测定肠道传输功能,测定门脉压力,血清生化指标测定,取末端回肠组织及肝脏组织观察组织病理学改变,肠黏膜TUNEL凋亡检测。结果(1)大鼠小肠黏膜损伤:模型组>干预组>对照组(P<0.05)。(2)门脉压力:模型组(13.73±1.81)mmHg,较对照组(5.64±0.88)mmHg显著升高(P<0.05),大鼠明显处于高循环状态;干预组门脉压力(10.25±1.47)mmHg,较模型组明显降低(P<0.05)。(3)血清生化指标(ALT、AST、TB、ALP)水平:模型组[(594.22±317.82)U/L,(1008.33±778.70)U/L,(6.00±5.29)μmol/L,(802.78± 396.94)U/L]较对照组[(60.20±21.30)U/L,(149.80±43.03)U/L,(1.00±0.44)μmol/L,(196.20±31.29)U/L]显著升高(P<0.05);干预组[(292.20±140.12)U/L,(350.40±173.35)U/L,(2.49±1.10)μmol/L,(552.20± 303.37)U/L]较模型组明显降低(P<0.05);ALB模型组(16.29±1.26)g/L较对照组(23.42±1.56)g/L明显下降(P<0.05),干预组(18.89±1.02)g/L较模型组明显上升(P<0.05)。(4)肠道黑染百分比:模型组(68.05±2.09)%,较对照组(81.68±3.15)%明显减少(P<0.05);干预组(74.50±4.28)%,较模型组明显增加(P<0.05)。(5)肠黏膜凋亡小体:模型组明显多于对照组,而干预组大黄素干预后的小肠上皮细胞凋亡较模型组明显下降。结论大黄素对肝硬化大鼠高动力循环状态下肠屏障完整性有较好的维持作用。
大鼠;肝硬化;门脉高压;肠屏障;大黄素
大黄素是一种葸醌类衍生物,主要来源于蓼科植物掌叶大黄根茎,其化学名称为1,3,8-三羟基-6-甲基蒽醌(1,3,8-thihydroxy-6-methyl-anthraquinone)肝硬化可导致肠屏障功能的受损,肠道细菌及内毒素发生移位,可导致多脏器功能障碍。以往研究表明大黄素有抗大鼠肝纤维作用,本研究探讨大黄素对于肝硬化高动力循环大鼠的肠屏障保护作用。
1 材料与方法
1.1 动物与造模 选择健康成年雄性SD大鼠25只,体质量(170±10)g,由上海斯莱克实验动物有限责任公司提供,饲养于浙江中医药大学动物实验中心,实验动物使用许可证号:SCXK(沪)2012-0002;饲养室温度22~23℃,环境湿度50%,喂以标准的大鼠饮食。分为正常对照组5只,肝硬化模型组10只,大黄素干预组10只。肝硬化模型组与大黄素干预组按Nakamura等[1]方法诱导肝硬化,500mL/L四氯化碳(3mL/100g)皮下注射,对照组大鼠给予生理盐水(3mL/100g)皮下注射,均1周2次,共8周。干预组制作模型第15天起每日予大黄素(5mg/mL,5mL/kg)灌胃,1天1次,对照组与模型组予同容量的生理盐水灌胃,1天1次;每周称体质量以调整给药剂量。大鼠正常进食和饮水。
1.2 药 品 四氯化碳(分析纯,武汉化学试剂公司出品),临用前用橄榄油稀释,配成50%(v/v)的溶液。大黄素,纯度≥98%,西安中鑫生物技术有限公司生产,临用前用0.5%羧甲基纤维素钠配成5mg/mL大黄素混悬液。
1.3 墨汁推进实验 实验第8周采用墨汁推进实验测定各组大鼠肠道传输功能,全部大鼠麻醉、取血处死后,立即剖腹取出幽门至直肠末段的全部肠道。在无张力状况下测量肠道全长、小肠长度、大肠长度和墨汁在肠道内推进的长度,并计算墨汁推进长度占肠道全长的百分比(黑染肠管长度/肠管总长度),最后计算每组平均值。
1.4 门脉压力测定 大鼠麻醉后将接有三通的PE50导管(含有抗凝剂肝素钠)插至肠系膜上静脉与脾静脉分叉处,固定导管并连接生理多导记录仪测定门静脉压力(PVP)。
1.5 肝脏生化指标检测 门静脉压力测定结束后,下腔静脉抽取血液5mL,静置1h后离心,立即检测肝功能指标(ALT、AST、ALB、ALP)。
1.6 肝、小肠组织的留取及病理检查 采各组大鼠新鲜肝脏组织及距回盲部10cm处末段回肠黏膜组织-70℃冰箱保存,部分组织用10%中性甲醛固定,常规石蜡包埋、脱水,4mm切片,作HE染色,光学显微镜下观察病理变化并按Chiu氏法[2]进行肠道损伤病理分级;小肠黏膜损伤分为6级进行评分:0分:肠黏膜绒毛正常;1分:绒毛顶端上皮下出现囊状间隙,并伴有毛细血管充血;2分:上皮下间隙扩大,中度固有层水肿.中央乳糜管扩张;3分:固有层明显水肿,肠黏膜上皮层细胞变性、坏死,少数绒毛顶端脱落;4分:上皮细胞层变性坏死、脱落,部分绒毛脱落.固有层裸露,毛细血管扩张、充血;5分:绒毛脱落,固有层崩解,出血或溃疡形成。
1.7 肠黏膜TUNEL凋亡检测 肠黏膜石蜡切片,烤片2~3h脱蜡,用二甲苯浸洗2次,每次5min;用梯度乙醇(无水乙醇、95%、90%、80%、70%)各浸洗1次,每次3min,0.01M PBS冲洗3次,每次3min,将切片浸入枸橼酸盐缓冲液(pH6.0)中,微波炉加热(750W high)1min,立即浸入 20℃的双蒸水冷却,0.01M PBS冲洗进行抗原修复,滴加封闭用正常山羊血清,室温孵育30min,倾去多余液体,勿洗,滴加50μL TUNEL反应液 37℃避光孵育 60min;0.01M PBS冲洗3次,每次3min;缓冲甘油封片,荧光显微镜下观察,激发光波长450~500nm,检测波长515~565nm(绿色),凋亡阳性位于细胞核,荧光显微镜下呈绿色荧光。每次都设立阴性对照。
1.8 统计学方法 应用SPSS17.0软件进行统计分析。数据以均数±标准差(±s)表示,计量数据和病理评分采用两独立样本比较的秩和检验(Mann-Whitney U检验),P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 对照组与干预组大鼠全部存活;模型组大鼠死亡1只,所有存活大鼠均进入统计。肝脏肉眼观:对照组大鼠肝脏颜色鲜红,有光泽,质地柔软,表面光滑细腻;模型组大鼠肝脏体积缩小,颜色晦暗,质地变硬,部分大鼠肝脏表面呈颗粒状改变;干预组大鼠颜色较模型组大鼠鲜红,质地偏软,颗粒状改变不明显。光镜下:对照组肝脏标本肝小叶结构正常,肝细胞无变性坏死,未见纤维组织增生;模型组镜下可见肝细胞变性、坏死,空泡样变性,汇管区纤维组织增生,部分可见假小叶形成;干预组镜下可见部分肝细胞出现气球样变,较模型组胶原纤维与网状纤维沉积较少,假小叶少见,见图1~4(插页)。小肠:对照组大鼠肠上皮绒毛完整,上皮细胞下无间隙,间质仅少量淋巴细胞浸润;模型组大鼠肠道绒毛上皮细胞可见脱落、部分坏死,上皮下间隙扩大,部分伴有毛细血管充血,并可见较多中性粒细胞、淋巴细胞浸润;干预组大鼠肠道绒毛上皮细胞坏死减少,毛细血管充血减少,淋巴管扩张不明显,少量淋巴细胞浸润,模型组大鼠病理损伤评分明显高于对照组(P<0.05),干预组较模型组评分有所下降(P<0.05),见图5~7(插页)、表1。
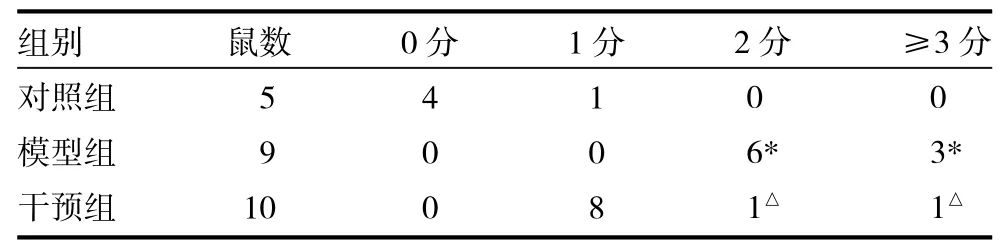
表1 三组大鼠肠道损伤病理分级比较(只)
2.2 三组大鼠门脉压力比较 与对照组比较,模型组与干预组门脉压力显著升高(P<0.05),大鼠明显处于高循环状态;但干预组门脉压力较模型组明显降低,差异有统计学意义(P<0.05),见表2。
2.3 三组肠道动力比较 墨汁推进实验显示,模型组肠道黑染百分比较对照组明显减少(P<0.05),肠道动力明显下降;干预组肠道黑染百分比较模型组明显增加(P<0.05),肠道动力有所改善,见表2。
表2 三组大鼠门脉压力与肠道动力比较(s)

表2 三组大鼠门脉压力与肠道动力比较(s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05
组别对照组模型组干预组鼠数5 9 1 0门脉压力(mmHg)5.64±0.88 13.73±1.81* 10.25±1.47*△肠道黑染百分比(%)81.68±3.15 68.05±2.09* 74.50±4.28△
2.4 三组大鼠生化指标检测比较 模型组各生化指标较对照组均有明显改变,肝功能受损明显,干预组ALT、AST、TBIL较模型组有所下降,ALB较模型组有所上升,差异有统计学意义(P<0.05),见表3。
表3 三组大鼠生化指标比较(±s)

表3 三组大鼠生化指标比较(±s)
注:与对照组比较,*P<0.05,与模型组比较,△P<0.05
组别对照组模型组干预组鼠数5 9 1 0 ALT(IU/L)60.20±21.30 594.22±317.82* 292.20±140.12△AST(IU/L)149.80±43.03 1008.33±778.70* 350.40±173.35△ALB(g/L)23.42±1.56 16.29±1.26* 18.89±1.02△TBil(μmol/L)1.00±0.44 6.00±5.29* 2.49±1.10△ALP(IU/L)196.20±31.29 802.78±396.94* 552.20±303.37
2.5 三组大鼠肠黏膜上皮细胞凋亡检测(TUNEL)荧光显微镜下模型组大鼠凋亡小体明显多于对照组,多位于绒毛体部及顶端,而干预组大鼠大黄素干预后小肠上皮细胞凋亡小体较模型组明显减少,见图8~10(插页)。
3 讨 论
肝硬化是由一种或多种病因长期或反复作用而造成的肝脏不可逆损害,以弥漫性纤维化为特征的肝组织结构异常,肝细胞变性坏死,纤维组织增生和肝结节再生的慢性进行性病理过程或疾病[3]。多项研究显示,肠屏障功能障碍与肝硬化并发症(如自发性细菌性腹膜炎、消化道出血和肝性脑病等)的发生发展密切相关[4-5]。国外相关研究[6]显示,在有自发性腹膜炎的肝硬化失代偿期患者其胆红素、肌酐水平明显增高,而总蛋白、白蛋白水平明显下降、凝血酶原时间显著延长。亦有报道显示,大约有50%的肝硬化合并肝功能衰竭患者死于细菌感染,其中70%~80%的病原菌为革兰阴性杆菌,且以大肠埃希菌为主,这提示肠道细菌是感染的主要来源[7-8]。肝硬化患者由于门脉高压、免疫功能下降、胆汁及SIgA分泌量明显减少、肠蠕动减弱、以及低蛋白血症等因素,导致肠屏障功能受损,通透性增加,肠道细菌及其代谢产物如内毒素等移位,成为引发肠源性感染、肝性脑病及肝损害加重的重要原因,如何有效保护肝硬化门脉高压患者肠屏障功能及及延缓肝硬化进程成为临床亟待解决的问题。
多项研究[9-10]显示,中药有抗肝纤维化作用,其中有研究显示大黄素能使肝纤维化大鼠血清透明质酸及层粘连蛋白降低、减少肝组织羟脯氨酸含量,并能降低肝纤维化分级评分。本研究也证实应用大黄素干预大鼠肝硬化进程后,大黄素组大鼠肝脏胶原纤维与网状纤维沉积较少,假小叶少见。且我们的研究发现大黄素干预后,大鼠的门脉压力有明显下降,可能与大黄素延缓大鼠肝纤维化进程相关,有待进一步研究。亦有实验证实大黄素对豚鼠、大鼠和家兔离体回肠具有调节作用,能够明显增加肠道平滑肌运动,促进肠道水的分泌,可促使结肠蠕动,抑制炎症反应和炎症介质的释放,清除氧自由基,降低细胞因子作用,双向调节免疫和凋亡[11-12];研究发现,大黄素可通过MLCK和PKCa信号途径收缩大鼠结肠平滑肌细胞[13]。研究发现,大黄素干预后,肝硬化门脉高压大鼠光镜下小肠黏膜损伤评分显著降低,肠动力明显好转,凋亡减少。在肝纤维化早期应用大黄素干预,可有效保护肝硬化门脉高压大鼠的肠屏障功能,并可有效延缓肝纤维化进程。一项包括684例慢性乙型肝炎患者的前瞻性研究显示,肝硬化的年发病率约为2.1%[14],20%的代偿期肝硬化患者在确诊后5年内进展为失代偿期,而10年后则高达60%[15-16]。在肝纤维化早期应用大黄素干预,可有效保护肝硬化门脉高压大鼠的肠屏障功能,并可有效延缓肝纤维化进程,基于庞大的患者群体,大黄素对临床改善肝硬化患者肠屏障功能,减少并发症具有研究价值,但对于其可能的分子学机制及不同剂量的大黄素的治疗作用及副作用、对肝硬化晚期的肠屏障是否有保护作用均有待进一步研究。
[1]Nakamura T1,Akiyoshi H,Saito I,et al.Adenovirus-mediated gene expression in the septal cells of cirrhotic rat livers[J].J Hepatol,1999,30(1):101-106.
[2]Chiu CT.Intestinal mucosal lesion in lowflow states[J].Arch Surg,1970,101(4):478.
[3]巫协宁.临床肝胆系病学[M].上海:上海科学技术文献出版社,2002:79.
[4]Sawhney R,Jalan R.The gut is a key target of therapy in hepatic encephalopathy[J].Nat Rev Gastroenterol Hepatol,2015,12(1):7-8.
[5]Taneja SK,Dhiman RK.Prevention and management of bacterial infections in cirrhosis[J].Int J Hepatol,2010,2011:784540.
[6]Danulescu RM,Stanciu C,Trifan A.Assessing the risk of decompensation by ascites and spontaneous bacterial peritonitis in cirrhosis[J].Rev Med Chir Soc Med Nat Iasi,2014,118(2):320-326.
[7]赵龙凤,韩德五.肝病患者内毒素血症的临床意义[J].世界华人消化杂志,1999,7(5):391-393.
[8]Borzio M,Salerno F,Piantoni L,et al.Bacterial infection in patients with advanced cirrhosis:a multicentre prospective study[J].Dig Liver Dis,2001,33(1):41-48.
[9]高晓倩,陈芝芸,张晓苹,等.银杏叶提取物抗肝纤维化作用的研究[J].中华中医药学,2008,26(4):779-781.
[10]展玉涛,魏红山,王志荣,等.大黄素抗肝纤维化作用的实验研究[J].中华肝脏病杂志,2001,9(4):235-237.
[11]Tong HF,Lin SZ,Yang X,et al.Empirical study on effect of emodin on acute rejection after orthotopic liver transplantation in rats[J].China J Trad Chin Med Pharmacy,2009,24(1):49-52.
[12]吕金胜,何凤慈,刘震东,等.大黄素对动物离体回肠收缩作用的影响[J].中国药业,2000,9(11):25.
[13]邱轶伟,马涛,吴双虎,等.大黄素收缩大鼠结肠平滑肌细胞的信号转异机制研究[J].天津医科大学学报,2005,11(2):205-208.
[14]Liaw YF,Leung N,Kao JH,et al.Asian—Pacific consensus statement on the management of chronic hepatitis B:a 2008 update[J].Hepatol Int,2008,2(3):263-283.
[15]Lefton HB,Rosa A,Cohen M.Diagnosis and epidemiology of cirrhosis[J].Med Clin North Am,2009,93(4):787-799.
[16]Vallet-Pichard A,Mallet V,Costentin CE,et al.Treatment of HBV-related cirrhosis[J].Expert Rev Anti Infect Ther,2009,7(5):527-535.
(收稿:2015-11-15 修回:2016-01-19)
Effects of Emodin on Maintaining Intestinal Barrier in Cirrhotic Rats with Portal Hypertension
SHI Linlin,CHEN Jianyong,XU Hong,ZHANG Jiaying.Department of Gastroenterology,Integrated Chinese and Western Medicine Hospital of Zhejiang Province,Hangzhou(310003),China
ObjectiveTo investigate the effects of emodin on intestinal mucosal barrier in cirrhotic rats with portal hypertension.MethodsTwenty-five male SD rats were randomly divided into three groups:control group(n= 5),model group(n=10),and emodin group(n=10).The model was induced by thesubcutaneous injection of 500mL/L CCL4(3mL/100g,twice a week for 8 weeks),then was intragastrically given saline in model group or emodin(5mg/ mL,5mL/kg,once a day)in emodin group from Day 15.Control group received normal saline(3mL/100g).At 8 weeks,rats were sacrificed to determine the changes of Ink propelling test,portal pressure,and serum variable and biopsies from the terminal ileum and liver were made for histology and apoptosis body detection with TUNEL.ResultsThe degree of intestinal mucosal injury was the severest in model group,followed by emodin group and control group(P<0.05).The portal pressure in model group was higher than that in control group(13.73±1.81mmHg vs 5.64±0.88mmHg,P<0.05),indicating a hyperkinetic circulatory state;that in emodin group(10.25±1.47mmHg)was lower than that in model group(P<0.05).ALT,AST,TB,and ALP in model group(594.22±317.82U/L,1008.33±778.70U/L,6.00±5.29μmol/L,802.78±396.94U/L)were higher than those in control group(60.20±21.30U/L, 149.80±43.03U/L,1.00±0.44μmol/L,196.20±31.29U/L)and in emodin group(292.20±140.12U/L,350.40±173.35U/L, 2.49±1.10μmol/L 552.20±303.37U/L),ALB in model group(16.29±1.26g/L)was lower than that in control group (23.42±1.56g/L)and emodin group(18.89±1.02g/L)(all P<0.05).The percentage of dyed intestinal black in model group(68.05%±2.09%)was lower than that in control group(81.68%±3.15%)and emodin group(74.50%±4.28%)(all P<0.05).The number of apoptosis body in model group was more than that in control group and emodin group.ConclusionEmodin could protect intestinal mucosal barrier in the hyperkinetic circulatory state in cirrhotic rats.
Rats;Hepatic cirrhosis;Portal hypertension;Intestinal barrier;Emodin
浙江省医药卫生科技项目(No.2011RCB029)
浙江省中西医结合医院消化科(杭州 310003)
施琳琳,Tel:15888805710;E-mail:jessicasll@163.com
