α-酮戊二酸对松浦镜鲤肠道形态与功能的影响
2016-02-07李晋南魏玉强徐奇友张冬梅
李晋南,魏玉强,徐奇友,张冬梅
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.上海海洋大学水产与生命学院,上海 201306)
α-酮戊二酸对松浦镜鲤肠道形态与功能的影响
李晋南1,魏玉强2,徐奇友1,张冬梅1
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.上海海洋大学水产与生命学院,上海 201306)
本试验旨在研究不同蛋白源饲料中添加α-酮戊二酸(AKG)对松浦镜鲤肠道形态与功能的影响。在水温23℃下,将初始体质量为(217.93±0.78)g的松浦镜鲤Cyprinus carpio Songpu 400尾,随机分成4组,每组5个重复,每个重复20尾鱼,饲养在控温循环水系统中,投喂4种在不同蛋白源的等氮等脂饲料中添加不同剂量的α-酮戊二酸(AKG)的饲料10周,即饲料1(44%豆粕+0%AKG)、饲料2(44%豆粕+1.5%AKG)、饲料3(30%豆粕+10%鱼粉+0%AKG)、饲料4(30%豆粕+10%鱼粉+1.5%AKG),饲料中蛋白质和脂肪水平分别为28%和5.1%。结果表明:不同蛋白源饲料中添加AKG能显著提高松浦镜鲤后肠皱襞高度、前肠肌层厚度和前肠Na+,K+-ATP酶活性(P<0.05);蛋白源和AKG对肠道形态指标和Na+,K+-ATP酶活性无显著交互作用(P>0.05);饲料中蛋白源添加AKG能显著提高松浦镜鲤前肠和中肠蛋白酶、脂肪酶活性(P<0.05),蛋白源和AKG对后肠蛋白酶活性具有显著交互作用(P<0.05)。综上所述,饲料中添加1.5%AKG可以促进松浦镜鲤肠道发育,增强肠道消化酶活性。
α-酮戊二酸;松浦镜鲤;肠道形态;消化酶;Na+,K+-ATP酶
α-酮戊二酸(α-ketoglutarate,AKG)是生物体三羧酸循环中重要的中间产物,是谷氨酰胺的前体物,在溶液中具有良好的稳定性,能够克服谷氨酰胺的缺点[1]。在三羧酸循环过程中,AKG能够运载和贮存氮,参与多种氨基酸转氨基作用,为精氨酸、鸟氨酸、谷氨酰胺和谷氨酸的合成提供碳骨架。外源性AKG可以替代部分谷氨酸和谷氨酰胺,为肠黏膜细胞和肠道菌群的代谢提供能量,提高机体消化功能,诱导肠黏膜细胞的增殖,促进营养物质的吸收[2],减少细菌移位,维持肠道屏障功能。近年来,关于AKG对促生长、肠道发育、消化吸收及抗氧化能力等方面的影响,已经在大鼠[2]、肉仔鸡[3]以及仔猪[4,5]中进行了相关研究。通过对水产动物的研究表明,AKG可以提高松浦镜鲤增重率和蛋白质效率[6]。但AKG对水产动物的其他作用,还需要进一步的研究。
豆粕蛋白质含量高、来源广,是替代饲料鱼粉的最佳植物蛋白源。但有研究表明,豆粕能引起大马哈鱼 Oncorhynchus tshawytscha和虹鳟 Oncorhynchus mykiss肠道病理变化[7,8],而对比目鱼Hippoglossus hippoglossus和鲳Pampus sinensis的肠道发育却没有不良影响[9,10]。本试验在不同蛋白源饲料中添加AKG投喂松浦镜鲤,研究不同蛋白源饲料中添加AKG对松浦镜鲤肠道形态与功能的影响,为AKG在水产动物中的应用提供参考。
1 材料与方法
1.1 材料
AKG购自Sigma-Aldrich公司,白色粉末,纯度≥98.5%。
本试验按2×2因子设计配制成4种等氮等脂的试验饲料,即饲料1(44%豆粕+0%AKG)、饲料2(44%豆粕+1.5%AKG)、饲料3(30%豆粕+10%鱼粉+0%AKG)、饲料4(30%豆粕+10%鱼粉+1.5% AKG)。饲料蛋白质和脂肪水平分别为28%和5.1%,其饲料配方和营养成分见参考文献[11]。各饲料原料粉碎后,过80目筛,逐级混合均匀,用小型颗粒机挤压成颗粒饲料,常温风干后,于-20℃冰柜中保存待用。
试验鱼选自黑龙江水产研究所呼兰试验站。
1.2 方法
试验选择健康、规格一致的初始体质量为(217.93±0.78)g的松浦镜鲤400尾,预饲2周后,随机分成4组,每组5个重复,每个重复20尾,在可控温循环水系统中养殖10周,分别投喂不同试验饲料。试验期间,水温23℃,溶氧大于5mg/L,氨氮小于0.1mg/L。每天8:00、13:00、18:00,饱食投喂3次,记录投喂量和鱼摄食情况,定期检测水质,确保水质良好。
1.3 肠道形态结构观察
肠道组织切片的制备:试验结束时,将鱼禁食24h,每缸随机选取4尾鱼,用麻醉剂(MS222)麻醉,置于冰盘上解剖,取肠道,去除肠表面脂肪,用冰浴的0.86%生理盐水冲洗后去除内容物,滤纸吸干水分,将肠道分为前肠、中肠和后肠(第一个回折拐弯点前为前肠,第二个回折拐弯处至最后一个拐弯处为中肠,最后一个回折拐弯点至肛门之间为后肠),固定于Bouin氏液中。将Bouin氏液中固定的肠道,经过乙醇逐级脱水、二甲苯透明、石蜡包埋、切片、HE染色、脱水、透明,最后用中性树胶封片,每段肠样品用Motic显微图像系统(Motic Images Plus 2.0软件)测量8个以上完整皱襞高度和肌层厚度(单位μm,成像倍数为10×100)。
1.4 肠道消化酶活性的测定
试验结束时,按上述方法测量鱼体长、体质量,剥离肠道,测量肠长度,计算肠长指数(肠长/体长)、肠体指数(肠质量/体质量)。前肠、中肠和后肠分别以生理盐水按1∶9质量体积比,用FJ-200CL高速组织匀浆机冰浴匀浆,匀浆液4℃4 000r/min离心10min,上清液为粗酶液,分装后保存于-20℃冰箱,用于测定蛋白酶、脂肪酶和淀粉酶活性[12]。
1.5 肠道Na+,K+-ATP酶活性的测定
采用南京建成试剂盒测定Na+,K+-ATP酶活性,其活力单位定义为每h每g组织分解ATP产生1mol无机磷为1个ATP酶活单位。
1.6 统计分析
数据采用平均值±标准差表示,用SPSS 17.0软件分析,采用双因素方差分析和Duncan′s多重比较进行统计,显著性水平为P<0.05。
2 结果与分析
2.1 不同蛋白源和AKG剂量对松浦镜鲤肠道形态结构的影响
松浦镜鲤摄食添加1.5%AKG的饲料时,后肠皱襞高显著高于不添加AKG的对照鱼(P<0.05),而在复合蛋白源中添加1.5%AKG显著提高了中肠皱襞高度和前肠肌层厚度(P<0.05)。与豆粕蛋白源饲料比较,复合蛋白源饲料显著降低了中肠皱襞高度(P<0.05)。蛋白源和AKG对前肠肌层厚度具有显著的交互作用(P<0.05)(表1)。
蛋白源和AKG剂量对松浦镜鲤肠长指数和肠体指数均无显著影响(P>0.05)(表2)。双因素方差分析表明,蛋白源和AKG剂量对肠长指数和肠体指数均没有交互作用(P>0.05)。
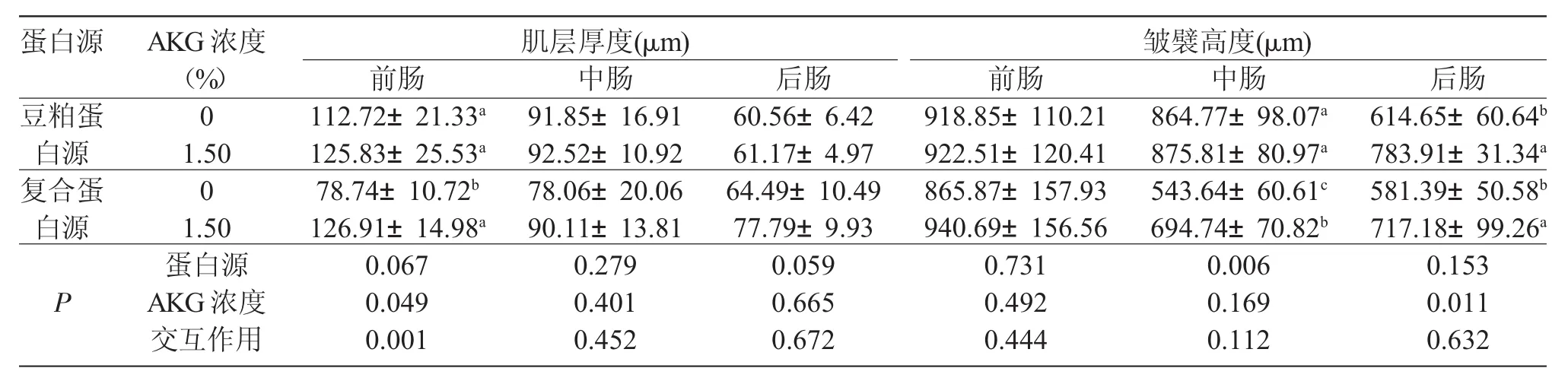
表1 饲料蛋白源和AKG剂量对松浦镜鲤肠道形态结构的影响(n=5)Tab.1 Effects of different dietary protein sources and doses of α-ketoglutarate(AKG)on intestinal morphology of Songpu mirror carp

表2 饲料蛋白源和AKG剂量对松浦镜鲤肠道肠体指数和肠长指数的影响(n=10)Tab.2 Effects of different dietary protein sources and doses of α-ketoglutarate(AKG)on Intestine body length index and body weight index of Songpu mirror carp

表3 饲料蛋白源和AKG剂量对松浦镜鲤肠道消化酶活性的影响(n=4)Tab.3 Effects of different dietary protein sources and doses of α-ketoglutarate(AKG)on activities of intestinal digestive enzymes in Songpu mirror carp(U/g prot)
2.2 不同蛋白源和AKG剂量对松浦镜鲤肠道消化酶活性的影响
由表3可知,在复合蛋白源饲料中添加1.5% AKG显著提高了松浦镜鲤前肠和中肠蛋白酶以及脂肪酶活性(P<0.05);在豆粕蛋白源饲料中添加AKG显著提高前肠和中肠蛋白酶、前肠淀粉酶和脂肪酶活性(P<0.05)。双因素方差分析可知,饲料中添加AKG显著提高了前肠和中肠蛋白酶、脂肪酶活性(P<0.05)。蛋白源和AKG对后肠蛋白酶具有显著交互作用(P<0.05)。
2.3 不同蛋白源和AKG剂量对松浦镜鲤肠道Na+,K+-ATP酶活性的影响
由表4可知,在复合蛋白和豆粕蛋白源饲料中添加AKG分别显著提高了松浦镜鲤前肠和后肠Na+,K+-ATP酶的活性(P<0.05)。蛋白源和AKG对肠道Na+,K+-ATP酶活性不存在交互作用(P>0.05)。
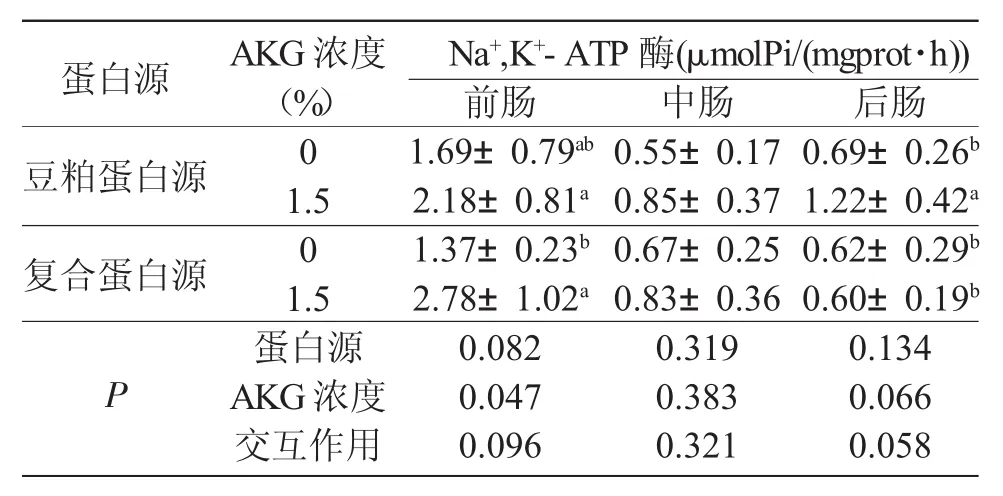
表4 饲料蛋白源和AKG剂量对松浦镜鲤肠道Na+,K+-ATP酶的影响(n=8)Tab.4 Effects of different dietary protein sources and doses of α-ketoglutarate(AKG)on intestinal Na+, K+-ATPase activities in Songpu mirror carp
3 讨论
鱼类肠道是营养物质消化和吸收的重要场所,无胃鱼类松浦镜鲤肠道的结构功能与其生长发育更为密切相关。鱼类肠道形成许多皱襞,其高度增加,微绒毛长度及粘膜厚度的增加,可以扩大肠道的表面积,增加肠道对营养物质的吸收能力,是水生动物肠道发育和吸收能力的重要标志[13]。有研究表明,饲料中添加豆粕对大西洋大比目鱼Hippoglossus hippoglossus[14]、斑点叉尾鮰Ictalurus punctatus[15]、埃及鳎Solea aegyptiaca[16]等的肠道形态没有显著影响。本试验中除中肠皱襞高度外,豆粕蛋白源饲料组与复合蛋白源饲料组相比,肠道形态没有明显差异。而复合蛋白源饲料组显著降低了中肠皱襞高度,其原因有待进一步研究。饲料中添加1% AKG可以显著提高仔猪肠道绒毛高度与隐窝深度的比值,提高绒毛表面积[13,17-19]。本试验中,饲料中添加AKG能显著提高松浦镜鲤肠道皱襞高度和肌层厚度。由此可知,AKG可以改善松浦镜鲤肠道结构,增加肠道对营养物质的吸收和消化能力。这可能是因为AKG为肠上皮细胞代谢提供能量[18],促进肠道细胞的生长发育,促进肠道皱襞高度和肌层厚度的增加。
Na+,K+-ATP酶作为一种重要的膜转运蛋白,能分解体内ATP,为机体的各项生理活动提供能量,其活力是肠黏膜生长发育的重要标志之一[20]。肠道Na+,K+-ATP酶活性的升高表明肠道消化吸收能力增强。本试验中,饲料中添加AKG显著提高了松浦镜鲤肠道Na+,K+-ATP酶活性,改善了肠道对营养物质的吸收能力。有研究[21]表明,豆粕替代鱼粉对建鲤的Na+,K+-ATP酶活性没有显著影响,这与本试验结果一致。
肠道消化酶可以作为衡量鱼类对营养物质消化、吸收的重要指标[22]。动物机体生长发育的快慢与消化酶活性的高低存在一定的正相关性[23]。有研究表明,豆粕替代鱼粉对翘嘴红鲌Erythroculter Ilishaeformis Bleeker肠道淀粉酶和脂肪酶活性没有显著影响[24],这与本试验结果相一致。本试验结果显示,不同蛋白源饲料中添加AKG显著提高了松浦镜鲤前肠和中肠蛋白酶、脂肪酶活性和前肠淀粉酶活性,这与AKG可以显著提高松浦镜鲤前肠淀粉酶和脂肪酶的活性[12]的结果较为一致。这些结果说明,饲料中添加AKG可以提高松浦镜鲤肠道消化酶活性,能促进肠道对营养物质的消化吸收,提高鱼体的生长速度。其原因可能是:AKG能够促进肠道和消化腺的生长发育,增加肠道消化酶的分泌量,提高肠道消化酶含量。饲料中添加AKG提高了松浦镜鲤的摄食量,即提高了肠道酶消化的底物浓度,刺激了肠道消化酶活性的增加[6,12,25]。
[1]Pierzynowski S G and Sjodin A.Perspectives of glutamine and its derivatives as feed additives for farm animals[J]. Journal ofAnimal and Feed Sciences,1998,7:79-91.
[2]Filip R,Wdowiak L,Harrison A P.et al.Dietary supplementation with phytohemagglutinin in combination with alpha-ketoglutarate limits the excretion of nitrogen via urinarytract[J].Ann Agric Environ Med,2008,15(2):309-315.
[3]余亲平,陈雁群,谢金蝉,等.日粮添加α-酮戊二酸对肉仔鸡生长性能及组织器官发育的影响[J].中国畜牧兽医,2010,37(10):10-14.
[4]Kristensen N B,Jungvid H,Fernández J A,et al.Absorption and metabolism of alpha-ketoglutarate in growing pigs[J].J AnimPhysiol AnimNutr,2002,86(7-8):239-245.
[5]Buddington R K,Pajor A,Buddington K K,et al.Absorption of alpha-ketoglutarate by the gastrointestinal tract of pigs[J].Comparative Biochemistry and Physiology,Part A: Molecular and Integrative Physiology,2004,138:215-220.
[6]位莹莹,徐奇友,李晋南,等.不同蛋白质水平饲料中添加α-酮戊二酸对松浦镜鲤生长性能、体成分和血清生化指标的影响[J].动物营养学报,2013,25(12):2958-2965.
[7]Bureau DP,Harris AMand YoungCC.The effects ofpuri-fied alcohol extracts from soy products on feed intake and growth ofchinook salmon(Oncorhynchus tshawytscha)and rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1998,161(1-4):27-43.
[8]Burrells C,Williams P D,Southgate P J,et al.Immunological,physiological and pathological responses of rainbow trout(Oncorhynchus mykiss)to increasing dietary concentrations of soybean proteins[J].Veterinary Immunology Immunopathology,1999,72(3-4):277-288.
[9]Grisdale-Helland B,Ruyter B,Rosenlund G,et al.Influence of high contents of dietary soybean oil on growth,feed utilization,tissue fatty acid composition,heart histology and standard oxygen consumption of Atlantic salmon(Salmo salar)raisedattwotemperatures[J].Aquaculture,2002,207(3-4):311-329.
[10]Ostaszewska T,Dabrowski K,Palacios ME,et al.Growth and morphological changes in the digestive tract of rainbow trout(Oncorhynchus mykiss)and pacu(Piaractus mesopotamicus)due to casein replacement with soybean proteins[J].Aquaculture,2005,245(1-4):273-286.
[11]魏玉强,徐奇友,位莹莹,等.不同蛋白源饲料中添加α-酮戊二酸对松浦镜鲤肌肉成分、血清氨基酸和生化指标的影响[J].东北农业大学学报,2015(1):94-100.
[12]李晋南,徐奇友,王常安,等.谷氨酰胺及其前体物对松浦镜鲤肠道消化酶活性及肠道形态的影响[J].动物营养学报,2014,26(5):1347-1352.
[13]王蕾,刘坚,侯永清,等.α-酮戊二酸对LPS慢性应激仔猪小肠黏膜形态与功能的影响[J].畜牧兽医学报, 2010,41(1):46-52.
[14]Grisdale-Helland B,Helland S J,Baeverfjord G,et al. Full-fat soybean meal in diets for Atlantic halibut:growth, metabolism and intestinal histology[J].Aqu Nutr,2002, 8(4):265-270.
[15]Evans J J,Pasnik D J,Peres H,et al.No apparent differences in intestinal histology of channel catfish(Ictalurus punctatus)fed heat-treated and non-heat-treated raw soybeanmeal[J].AquacultureNutrition,2005,11(2):123-129.
[16]Bonaldo A,Roem A J,Pecchini A,et al.Influence of dietary soybean meal levels on growth,feed utilization and gut histology of Egyptian sole(Solea aegyptiaca)juveniles[J].Aquaculture,2006,261(2):580-586.
[17]王金泉,项方献,姚刚.中草药结合AKG对断奶仔猪生长及消化吸收功能的影响[J].西北农林科技大学学报:自然科学版,2011,39(5):27-31.
[18]胡泉舟,侯永清,丁斌鹰,等.α-酮戊二酸对仔猪小肠组织学形态与功能的影响[J].动物营养学报,2008,20(6):662-667.
[19]胡泉舟.α-酮戊二酸对断奶仔猪生长性能和肠道功能的影响[D].武汉:武汉工业学院硕士学位论文,2008.
[20]Veillette P Aand YoungG.Temporal changes in intestinal Na+,K+-ATPase activity and in vitro responsiveness to cortisol in juvenile chinook salmon[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2004,138(3):297-303.
[21]姜俊,周小秋,银龙,等.膨化饲料中豆粕替代鱼粉对建鲤生长性能、体成分和消化吸收功能的影响[J].华北农学报,2015(S1):107-111.
[22]Tang L,Wang G X,Jiang J,et al.Effect of methionine on intestinal enzymes activities,microflora and humoral immune of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture Nutrition,2009,15(5):477-483.
[23]叶元土,张勇,张字,等.酶制剂EA-II和生物制剂BA-I对鲤肠道、肝胰脏的蛋白酶和淀粉酶活力的影响[J].大连水产学院学报,1993,8(1):79-82.
[24]钱曦,王桂芹,周洪琪,等.饲料蛋白水平及豆粕替代鱼粉比例对翘嘴红鲌消化酶活性的影响[J].动物营养学报,2007(2):182-187.
[25]李晋南,徐奇友,位莹莹,等.谷氨酰胺及其前体物对松浦镜鲤生长性能、体成分和血清生化指标的影响[J].东北农业大学学报,2013,44(12):119-125.
Effects of α-ketoglutarate Supplementation on Intestinal Morphology and Function of Songpu Mirror Carp(Cyprinus carpio Songpu)
LI Jin-nan1,WEI Yu-qiang2,XU Qi-you1,ZHANG Dong-mei1
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China; 2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
The aim of this study was to investigate the dietary effects of α-ketoglutarate(AKG)supplementation and protein source treatments on the intestinal morphology and function of Songpu mirror carp(Cyprinus carpio Songpu).Four experimental diets were formulated to contain two protein sources(soybean meal or fish meal+soybean meal)and two levels of α-ketoglutarate(0%or 1.5%). A total of 400 Songpu mirror carp with an average initial body weight of(217.93±0.78)g was divided into 4 groups reared in a recycling system and fed one of the four experimental diets at water temperature of 23℃for 10 weeks with 5 replicates per group and 20 fish per replicate.The results showed that fold height of hindgut and muscular thickness of foregut and Na+,K+-ATPase activity in foregut were significantly improved by AKG(P<0.05).However,there was no significant interaction influence of protein source and AKG on intestinal morphology and Na+,K+-ATPase activity(P>0.05).The activities of protease and lipase in foregut and midgut were shown to be significantly increased in the fish fed the diets containing the diets supplemented with AKG(P<0.05).There was significant interaction influence of protein source and AKG on protease activity in hindgut(P<0.05).It is concluded that supplementation of 1.5%AKG can promote intestine development and digestive enzyme activities in Songpu mirror carp.
α-ketoglutarate;Songpu mirror carp;intestinal morphology;digestive enzyme;Na+,K+-ATPase
S948
A
1005-3832(2016)04-0043-05
2016-04-05
中国水产科学研究院基本科研业务费(2014A08XK03);现代农业产业技术体系建设专项(CARS-46).
李晋南(1983-),女,助理研究员,博士,从事水产动物营养与饲料研究.E-mail:lijinnan123@163.com
