微囊化间充质干细胞活力检测方法比较
2016-02-06李保国佀国宁汤亭亭
李保国, 刘 荣, 佀国宁, 汤亭亭
(1.上海理工大学 医疗器械与食品学院,上海 200093; 2.上海交通大学附属第九人民医院 骨科实验室,上海 200011)
微囊化间充质干细胞活力检测方法比较
李保国1, 刘 荣1, 佀国宁1, 汤亭亭2
(1.上海理工大学 医疗器械与食品学院,上海 200093; 2.上海交通大学附属第九人民医院 骨科实验室,上海 200011)
对微囊化间充质干细胞(MSCs)采用EB/Calcein-AM和MTS/PMS细胞检测新方法,并与传统的台盼兰及MTT染色检测法进行比较,探索适合于微囊化细胞活力检测的方法.研究表明:分别采用EB/Calcein-AM,台盼兰,MTT,MTS这4种方法,检测海藻酸钠-聚赖氨酸-海藻酸钠(APA)微囊内MSCs细胞活力,传统的台盼兰与MTT检测法不适用APA微囊化MSCs细胞活力检测,EB/Calcein-AM与MTS是检测APA微囊化MSCs细胞活力的有效方法.
微囊; 间充质干细胞; 活力检测; 台盼兰; EB/Calcein-AM法; MTT法; MTS法
间充质干细胞(mesenchymal stem cell,MSCs)具有很强的增殖能力,且易于外源基因的转染和表达,被认为是细胞治疗和基因治疗的理想靶细胞[1].将MSCs作为转基因靶细胞用微囊包裹移植到体内,可使细胞表达目的基因的同时起到免疫隔离作用[2].这种以外源基因为模板,免疫隔离细胞为微加工器,生产治疗性重组蛋白的设想,已被国际上大量实验证明是可行的[3-4].而微囊化细胞移植治疗的前提条件是,微囊化后细胞仍然存活,因此,在实验中微囊化细胞活力的检测是一项重要指标.对于内分泌组织如胰岛细胞,可通过测量微胶囊外的分泌物进行活力评估[5-8],但是,对于MSCs等细胞则无分泌物指标,大多采用传统的台盼兰及MTT染色检测微囊化细胞的活力[9-12].目前关于微囊化细胞活力检测的方法报道较少,本文尝试采用EB/Calcein-AM和MTS细胞检测方法,并与台盼兰及MTT染色法进行比较,期望能选出适合于微囊化细胞活力检测的方法.
1 材料与方法
1.1 材料与仪器
材料:SD大鼠MSCs(上海市第九人民医院骨科实验室),α-MEM细胞培养液(Gibco,含10%胎牛血清,1%penicillin/ streptomycin),PBS,海藻酸钠(Sigma公司),聚赖氨酸(Sigma公司),台盼兰(typan blue),溴化乙啶(ethidium bromide,上海申能博彩生物技术有限公司),钙黄绿素(Calcein-AM,Calbiochem,Cat206700),MTT(Promega,G4000),MTS(Promega,G5421).仪器:酶标检测仪,Olympus IX71荧光显微镜,Olympus DP70图像采集系统.
1.2 实验方法
[2]中的方法制备微胶囊.制备好后将微囊化MSCs细胞放入无菌培养皿中,加入α-MEM细胞培养液,放入温度为37 ℃、体积分数为5%的CO2培养箱中培养.分别于第0,1,3,7,14,21,28,35,42 d进行细胞活力检测.
1.2.1 台盼兰染色方法
取微囊化MSCs细胞液适量,置于载玻片上,以体积比1∶1滴加质量分数为0.4%的台盼兰染液,在显微镜下随机取视野计数,数取染为蓝色的细胞数量Td与未染蓝色的细胞数量Tl,计算出活细胞百分率S1=Tl/(Td+Tl)×100%,取3次均值.
1.2.2 EB/Calcein-AM染色方法
Calcein-AM是一种胞浆荧光标记物,本身无荧光,渗入细胞后细胞内酯酶催化生成的水溶性绿色荧光物质不易透出细胞[13-14].而溴化乙啶(EB)仅能透过胞膜受损的细胞,嵌入核DNA,发橘红色荧光.将微囊化细胞用PBS洗涤后,向96孔板中每孔加入微囊化细胞液100 μl,向每孔中加入100 mg/L的EB溶液3 μl(终浓度为8 μmol/L)及50 μmol/L的Calcein-AM溶液10 μl(终浓度为5 μmol/L).培养20 min后,在荧光显微镜下随机取视野计数,数取染为绿色的细胞数量El与红色细胞数量Ed,计算出活细胞百分率S2=El/(Ed+El)×100%,取3次均值.
1.2.3 MTT染色[6]
换培养基后,于96孔板中每孔加入微囊化细胞液30 μl(含微囊数30±3个)及70 μl培养基,再加入染液15 μl培养4 h后加入溶解/终止液100 μl,培养1 h后于酶标仪上波长570 nm、参考波长650 nm处检测,每个样品4个复孔取平均值,得到吸光度OD1值.
1.2.4 MTS染色[10]
换培养基后,于96孔板中每孔加入微囊化细胞液30 μl(含微囊数30±3个)及70 μl培养基,加入MTS/PMS染液20 μl培养4 h后于酶标仪上波长490 nm、参考波长630 nm处检测,每个样品4个复孔取平均值,得到吸光度OD2值.
2 结果与分析
2.1 台盼兰染色与EB/Calcein-AM染色
台盼兰染色常用来将死细胞染成蓝色,而活细胞不着色,但是,当其加入到微囊化细胞样品后,会将整个微胶囊染成蓝色,导致很难区分微胶囊内的死细胞与活细胞.用盖玻片将微胶囊轻轻压碎,囊内细胞流出,在显微镜下观察计数,如图1所示(见下页).但是,当采用EB/Calcein-AM染色,在荧光显微镜下可清楚地数取染为绿色及红色的细胞数量(见下页图2),即EB/Calcein-AM染色不受微胶囊的干扰.
采用两种方法得到的细胞活力随时间变化如图3所示(见下页).由图3可以看出,采用台盼兰染色法得到的细胞活率比EB/Calcein-AM染色法的低.这可能是由于台盼兰染色需将微胶囊破坏后才能观察到活细胞,在此过程中,将会对部分细胞有损害,
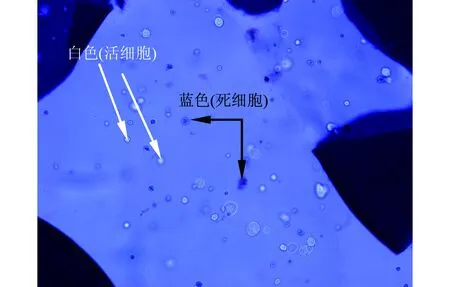
图1 台盼兰染色图片
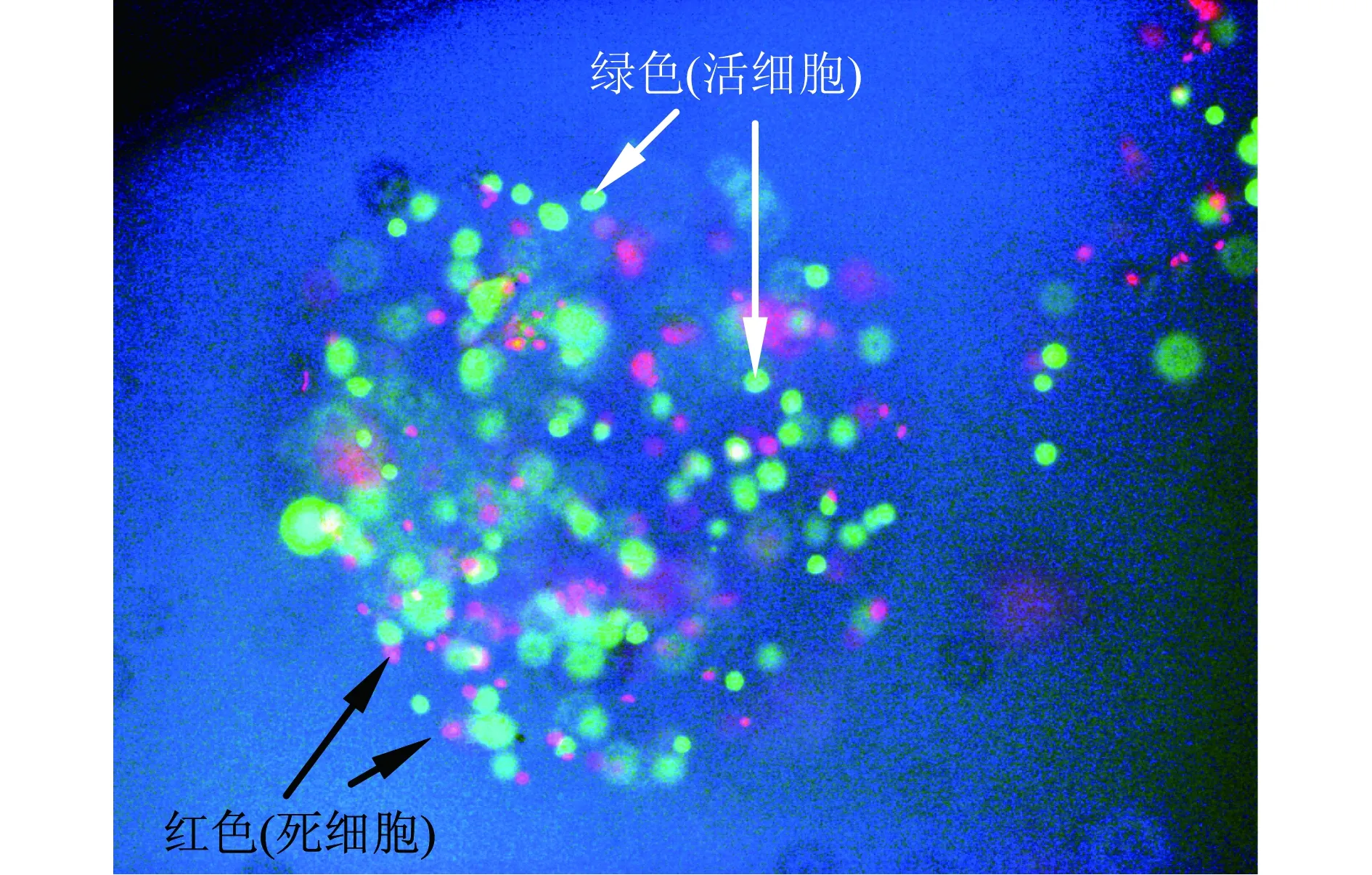
图2 EB/Calcein-AM染色图片
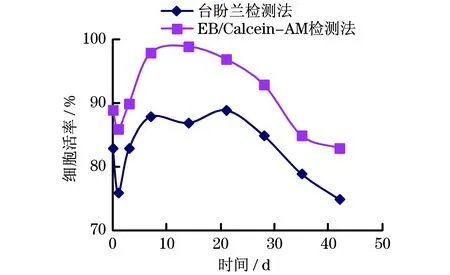
图3 台盼兰与EB/Calcein-AM检测细胞活力随时间变化曲线
而且将微胶囊压破后细胞并不能全部溢出囊外,微囊外物质会产生干扰,因此,测出的细胞活率较低.EB/Calcein-AM染色不受微胶囊影响,产生的图象比台盼兰清晰并容易区分活细胞与死细胞.在荧光显微镜下可显见随时间增长细胞由最初的单个细胞逐渐增殖至成团细胞.
2.2 MTT与MTS染色
采用MTT与MTS方法测得的细胞活率随培养时间变化如图4所示.由图4可知,经MTT染色后测量的吸光度OD值随时间基本没有变化,而经MTS/PMS染色后检测出的OD值随着培养时间的延长而增加,与显微镜下采用EB/Calcein-AM染色观察结果相吻合.
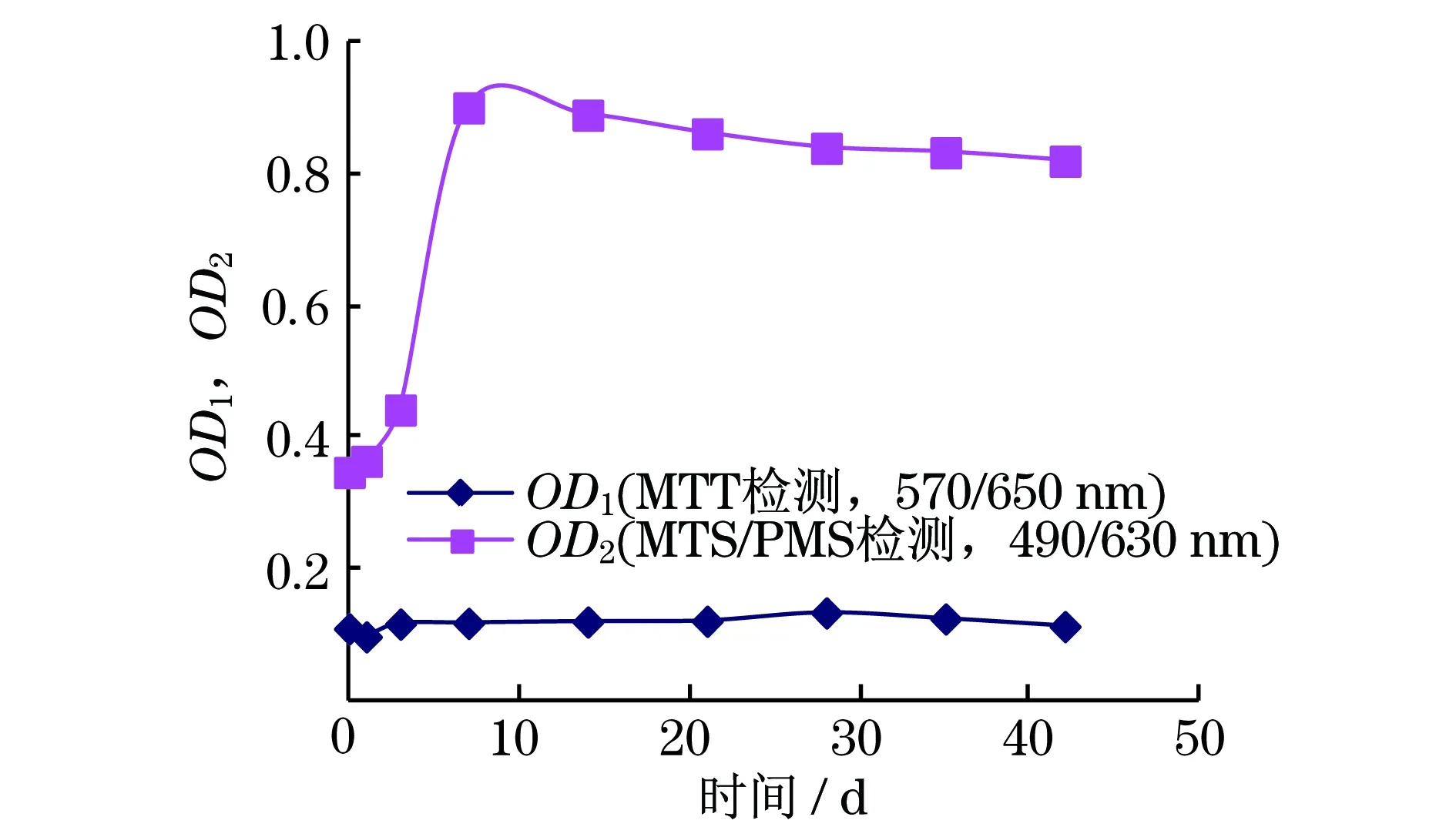
图4 MT与MTS/PMS染色检测细胞活力岁时的变化曲线
MTT法和MTS法都是细胞生长定量检测方法,其原理是靠活细胞中线粒体内的琥珀酸脱氢酶将外源性的四甲基偶氮唑盐(MTT或MTS)还原为兰紫色的甲臢化合物(Formazan),通过酶联检测仪,测量吸光度OD值,该值所表示的甲臢产物的量与活细胞的数量成正比.区别在于MTT形成的甲臢化合物不溶于水,需要一些特殊的溶解液(如质量分数为10%的SDS加0.01 mol的HCl等),而MTS是经活细胞线粒体脱氢酶转化成液态可溶的甲臢化合物,这对于微囊化细胞检测特别重要.
实验观察到MTT染色会引起微囊膜皱缩,破坏微囊结构.未加入终止液前,在显微镜下观察可见微囊内有紫红色结晶,加入终止液后培养1 h,虽部分有所减淡但仍可见微囊内紫红色,说明生成的结晶未完全均匀溶解.而加入MTS染色剂培养后,可明显观察到培养基逐渐变色,并深浅不一,显微镜下观察微囊结构未变化,颜色均匀.
3 结 论
微囊化细胞移植技术是采用微胶囊将细胞进行包裹起到免疫隔离作用,微囊化细胞移植到受体内,可避免机体排斥反应,功能细胞可长期存活,发挥其生物学效应,该技术使得异种组织细胞和基因工程细胞移植成为可能.为检测微囊化后细胞的活力,本文研究了微囊化细胞活力检测新方法,得到如下结论:
a. EB/Calcein-AM染色比台盼兰染色更适用于APA微囊化细胞活力的检测.
b. EB/Calcein-AM染色能直观地显示出细胞活性,这不仅适用于MSCs细胞,对于其他微囊化细胞也适用.
c. MTT染色不适合于APA微囊化细胞活力检测,而MTS/PMS方法检测结果与EB/Calcein-AM染色观察结果相吻合,是APA微囊化细胞活力检测的有效方法.
d. MTS/PMS染色对于其他不可通过测量微囊外分泌物来评估细胞活力的纤维细胞等也适用.
参考文献:
[1] 余勤,连俊兰.间充质干细胞研究进展及应用前景[J].浙江中西医结合杂志,2005,15(2):130-132.
[2] 张武杰,李保国,张超,等.载间充质干细胞海藻酸钠-壳聚糖微胶囊的制备及工艺优化[J].细胞与分子免疫学杂志,2007,23(9):864-866.
[3] MOREAU J L,XU H H K.Mesenchymal stem cell proliferation and differentiation on an injectable calcium phosphate-chitosan composite scaffold[J].Biomaterials,2009,30(14):2675-2682.
[4] SOLOMON T P J,MALIN S K,KARSTOFT K,et al.Determining pancreaticβ-cell compensation for changing insulin sensitivity using an oral glucose tolerance test[J].American Journal of Physiology:Endocrinology and Metabolism,2014,307(9):822-829.
[5] 李保国,华泽钊,张洪德,等.胰岛移植用免疫隔离微胶囊的牢固度、生物相容性和通透性研究[J].中国免疫学杂志,2001,17(2):85-88.
[6] 王雅光,田鹤,穆长征.微囊化胰岛素产生细胞的胰岛素释放情况观察[J].中国现代医生,2015,53(15):8-10.
[7] 陈水塘,蒋建强,姜迎春.微囊化胰岛细胞异种移植治疗糖尿病的研究[J].中国药物与临床,2013,13(4):455-457.
[8] 王恩达,马云胜,穆长征,等.胰岛素产生细胞微囊化后的活力观察[J].山东医药,2012,52(3):44-45.
[9] 綦文涛,刘袖洞,包德才,等.微囊化细胞培养过程的物质传递机理和细胞生长特性[J].中国生物工程杂志,2005,25(S1):131-136.
[10] 陈强,张进华,陈建庭,等.MTT染色法检测化疗后骨肉瘤细胞的凋亡[J].南方医科大学学报,2009,29(9):1899-1901.
[11] 肖静,张英,于玮婷,等.内质网应激对微囊化HepG2细胞脂代谢影响及调控研究[J].中国生物医学工程学报,2013,32(5):606-612.
[12] 刘洋,刘天庆,范秀波,等.微囊化基质细胞对脐带血造血干/祖细胞扩增支持[J].大连理工大学学报,2010,50(2):176-182.
[13] 吴兴,陈峥嵘,张光健.AO/EB双重染色法检测人骨肉瘤细胞凋亡[J].肿瘤,2004,24(1):88-89.
[14] 郏舜杰,姚灿,范历龙,等.甲基强的松龙对SD大鼠骨髓间充质干细胞的生物学特性的影响[J].医学研究杂志,2013,42(2):48-52.
(编辑:石 瑛)
Comparative Study on Assaying Methods for the Viability of APA Microencapsulated Mesenchymal Stem Cells
LI Baoguo1, LIU Rong1, SI Guoning1, TANG Tingting2
(1.SchoolofMedicalInstrumentandFoodEngineering,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China; 2.DepartmentofOrthopaedicSurgery,NinthPeople’sHospital,ShanghaiJiaotongUniversity,Shanghai200011,China)
New methods of EB/Calcein-AM and MTS/PMS were proposed to measure the microencapsulated mesenchymal stem cells (MSCs) viability,and compared with the trypan blue and MTT staining methods for exploring a suitable microencapsulated cell viability assay method.All the four kinds of methods,the trypan blue,EB/Calcein-AM,MTT,and MTS,were used to measure the cell viability of sodium alginate polylysine alginate (APA) microencapsulated MSCs.The results show that the conventional trypan blue and MTT detection methods are not suitable,while the EB/Calcein-AM and MTS are effective for measuring the vicbility of microencapsulated MSCs.
microcapsule;mesenchymalstemcells;viabilityassay;trypanblue;EB/Calcein-AMassay;MTTassay;MTSassay
1007-6735(2016)06-0594-04
10.13255/j.cnki.jusst.2016.06.015
2016-10-07
上海市联盟计划资助项目(LM201514)
李保国(1961-),男,教授.研究方向:食品、药品的微囊化研究.E-mail:lbaoguo@126.com
Q 813.
A
