周年温度变化对泡桐丛枝病植原体分布和消长的影响
2016-02-06曹亚兵翟晓巧介大委范国强
曹亚兵,翟晓巧,介大委,范国强*
(1.河南农业大学 泡桐研究所,河南 郑州450002; 2.河南省林业科学研究院,河南 郑州450008)
周年温度变化对泡桐丛枝病植原体分布和消长的影响
曹亚兵1,翟晓巧2,介大委1,范国强1*
(1.河南农业大学 泡桐研究所,河南 郑州450002; 2.河南省林业科学研究院,河南 郑州450008)
为探讨温度变化对泡桐树体内丛枝病植原体分布和消长的影响,利用巢式PCR和直接PCR研究了植原体在泡桐不同器官内的分布及相对含量的周年变化。结果表明,不同发病程度泡桐中丛枝病植原体的分布不同,发病程度相同泡桐不同器官内植原体含量也存在一定差异。在中等发病程度的泡桐中,丛枝病植原体全年存在于枝条内,并且其含量随温度升高逐渐升高,8月份达到最高,此后开始下降;叶片内植原体含量随温度升高明显增加,7月份含量最高,随后减少,10月份降到最低;根部植原体含量随温度升高也相应增加,在9月份达到最高,之后开始降低,全年含量变化较小,且含量最高值较叶片和枝条中低。表明泡桐丛枝病植原体在寄主体内的消长与温度的周年变化关系紧密。
泡桐丛枝病植原体; PCR; 温度; 消长
丛枝病是泡桐生产中发生最普遍、危害最严重的传染性病害,可导致泡桐幼树死亡、大树生长缓慢,极大限制了泡桐的种植[1-2]。植原体作为一类植物病原物,由于不能够体外培养,其生物学特性研究进展缓慢,防治手段有限。自20世纪40年代以来,虽然在泡桐丛枝病病原的检测方面已积累了不少技术和方法[3-7],但对患病植株体内植原体的分布特点和周年消长规律尚缺乏系统研究[8-10]。有报道称低温可以减轻丛枝病症状[11-13],但低温对植原体浓度的影响仍不清楚。聚合酶链式反应(PCR)是目前应用比较广泛和成熟的植原体检测方法[14-20]。本研究以毛泡桐患丛枝病植株为试材,采用PCR方法探讨温度的周年变化与泡桐植原体在寄主体中分布及数量的关系,为科学开展泡桐丛枝病的药物防治提供理论依据。
1 材料和方法
1.1 试验材料
试验于2014年 4月至2015年3月进行,以河南农业大学郑州林业试验站树龄为12 a的毛泡桐(Paulowniatomentosa)为试验材料,包括3株新发病树、3株中度发病树和3株重度发病树,以河南农业大学泡桐研究所培养的健康毛泡桐组培苗为对照。试验期间,每月20日左右分别采集适量泡桐树的根、枝条、叶片及距离地面1.5 m处树干韧皮部,休眠季采样部位为枝条和根部以及主干韧皮部。采样时,枝条、叶片等样品从树体不同主枝上分别采取;根样品为地下20 cm处不同方向的侧根,保证样品能够全面代表树体的病原携带情况。
1.2 方法
1.2.1 直接PCR检测 直接PCR采用植原体16S rDNA通用引物,序列分别为Primer1:5′-ACGACTGCTAAGACTGG-3′; Primer2:5′-GCGGTGTGTACAAACCCCCG-3′(由上海生工生物工程有限公司合成)。PCR反应体系25 μL,其中模板DNA 0.3~400 ng,10×PCR Buffer 2.5 μL,dNTP(10 mmol/L) 0.25 μL,TaqDNA聚合酶(5 U/μL) 0.25 μL,上、下游引物(10 μmol/L) 各 0.5 μL, 然后用双蒸水补足。PCR扩增在PTC-200基因扩增仪上进行,程序为:94 ℃预变性3 min;94 ℃变性1 min,52 ℃ 退火1.5 min,72 ℃ 延伸2 min,共30个循环;最后72 ℃延伸10 min。取扩增产物2.5 μL,在1%琼脂糖凝胶(含0.5% EB)中以80 V电泳1 h,观察电泳结果[18-20]。不同样品间的植原体含量差异用直接PCR扩增的方法检测。将需要检测的模板DNA浓度进行2倍梯度稀释,经直接PCR扩增确定不同样品检测到植原体所需的最少模板用量。以不同样品检测到植原体的最少模板用量的倒数作为参数,比较不同样品之间的植原体含量差异。每个样品重复检测2次[11,21]。
1.2.2 巢式PCR检测 采用巢式PCR检测植原体在不同发病程度泡桐植株体内的分布特点。植原体16S rDNA采用Nest-PCR进行2轮扩增,第1轮扩增引物序列为R16mF1:5′-CATGCAAGTCGAACGGA-3′,R16mR1:5′-CTTAACCCCAATCATCGAC-3′;第2轮扩增引物序列为R16F2:5′-ACGACTGCTAAGACTGG-3′,R16R2:5′-CGGGGTTTGTACACACCGC-3′(由上海生工生物工程有限公司合成)。第1轮反应体系和基本条件同直接PCR检测;第2轮PCR反应的体系中,模板DNA(第1轮PCR产物稀释50倍)1 μL,引物R16F2、R16R2 (10 μmol/L) 各0.5 μL, 其他成分同第1轮PCR,反应程序同上。待PCR程序结束后,取第2轮扩增产物2.5 μL,在1%琼脂糖凝胶(含0.5% EB)上以80 V电泳1 h,观察电泳结果。
1.2.3 统计分析 采用SPSS 24.0进行月平均气温与植原体相对含量关系的公式拟合及相关性分析。其中,月平均气温数据由河南省气象局提供。
2 结果与分析
2.1 植原体在不同发病程度泡桐植株体内的分布特点
2.1.1 轻度发病 从图1可以看出,轻度发病程度泡桐植株体内,除了丛枝病枝条和叶片含大量植原体外,同一主枝上邻近丛枝病发病部位的健康枝条和叶片也有少量植原体的分布,而其他营养器官检测结果呈阴性,表明植原体在寄主体内未发生大范围扩散。推测植原体在寄主体内的移动规律是由发病部位先向邻近的营养器官进行扩散,而不是先向根部扩散。
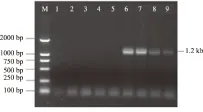
M.DNA Marker;1.对照;2.健叶;3.健枝;4.主干韧皮部;5.根;6.丛枝病叶;7.丛枝病枝;8.附近叶;9.附近枝
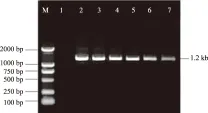
2.1.2 中度发病 检测结果表明(图2),在中度患病的泡桐植株体内,植原体的分布具有对应性的特点。表现为患丛枝病相同方向的健康枝条、叶片、根和主干韧皮部中可以检测到植原体的存在,含量较丛枝病叶片和枝条偏低;而与发病部位不同方向的营养器官中,则没有检测到植原体的存在。说明泡桐丛枝病植原体纵向运输能力强,而横向运输能力相对较弱,也可能是泡桐自身的物质运输特点主要是纵向运输,抑制了植原体的横向扩散。对应性的分布特点说明,植原体在中度发病程度的树木体内已经发生了很大范围的扩散,但是因为其含量较低,未达到致病浓度,所在部位没有产生丛枝病症状。

M.DNA Marker;1.对照;2.异侧健叶;3.异侧健枝;4.异侧主干韧皮部;5.异侧根;6.丛枝病叶;7.丛枝病枝;8.同侧健叶;9.同侧健枝;10.同侧主干韧皮部;11.同侧根
2.1.3 重度发病 重度发病程度植株上,丛枝病枝条大且生长旺盛,在树体上广泛分布。巢式PCR检测结果表明(图3),所有采集的营养器官都含有植原体,植原体在树体内的分布呈现出普遍性。植原体的这种分布特点,可能是由于植原体的扩散,到达了原来发病程度较轻或中度发病程度的病树上不含植原体的营养器官,并增殖生长致使丛枝病发生;也可能是由于传毒昆虫的传播作用,加剧了植株的病情恶化。
M.DNA Marker;1.对照;2.丛枝病叶;3.丛枝病枝;4.健叶;5.健枝;6.主干韧皮部;7.根
2.2 植原体在中度发病程度泡桐植株体内的周年消长规律
2.2.1 叶片 直接PCR检测结果表明(图4),叶片中植原体的周年消长规律为:4月份泡桐枝条萌发时,叶片中植原体含量处于一个非常低的水平;5、6、7三个月份寄主的症状表现日益严重,植原体的含量逐月上升,7月达到最大;此后植原体含量下降,8—9月下降幅度较小,9—10月剧烈下降,至10月即将落叶时达到较低的水平。叶片中植原体含量(Y)与月平均气温(X)呈极显著正相关,其指数函数关系为:Y=0.000 1e0.340X,r=0.943 (图5)。通过将叶片中植原体的含量变化与叶片的生长周期对比可以发现,丛枝病叶片的生长决定着植原体的含量,当叶片进入生长旺季,植原体含量急剧增加,当叶片的生长进入衰退期时,植原体的含量也随之下降。

图4 泡桐丛枝病植原体相对含量的周年变化

图5 泡桐叶片植原体相对含量与月平均气温的关系
2.2.2 枝条 从图4可以看出,4、5月份随温度回升,泡桐枝条中植原体含量逐渐增加;7—8月植原体含量增加很快,8月份达到最高,此时症状也最严重;随秋季来临植原体含量下降,8—9月是植原体含量下降最快的阶段,之后植原体含量一直呈下降趋势,直到次年1—3月病枝中植原体含量降到一年中的最低值。枝条中植原体含量(Y)与月平均气温(X)也呈极显著正相关,其指数函数关系为:Y=0.01e0.141X,r=0.930 (图6)。
2.2.3 根 从图4可以看出,12月份到次年的2月份,泡桐根中植原体相对含量处于全年最低水平,到了3月份以后,植原体含量开始缓慢增加,9月份达到全年最高值,随后含量明显下降,10月份以后趋于平稳。根中植原体含量(Y)与月平均气温(X)的函数关系为:Y=0.014e0.091X,r=0.839,同样二者存在显著的相关性(图7)。根据r大小可知,根中植原体含量与月平均气温的相关性小于枝条和叶片,表明植原体在泡桐根部对温度的敏感性较在茎叶中低。植原体没有在冬季产生由枝条大批转移到根部躲避低温的现象。

图6 泡桐枝条植原体相对含量与月平均气温的关系

图7 泡桐根部植原体相对含量与月平均气温的关系
3 结论与讨论
泡桐丛枝病植原体在病株体内含量的周年变化存在一定的规律性,并与泡桐丛枝病外部症状表现的周期变化相吻合。在春季的生长初期,植原体在寄主各部位含量都很低;随着寄主的生长,植原体含量越来越高,丛枝病症状也逐渐明显;至7—8月病状最严重时,植原体在寄主叶和枝条中的含量也达到最高。此外,寒冷季节仅在泡桐病株的发病枝条和根中检测到植原体,而其他部位则检测不到植原体的存在,这可能与低温抑制了寄主的生理生化活动,进而影响植原体的增殖和生存有关。
从泡桐植原体周年含量变化来看,植原体可以在丛枝病枝条中成功越冬。这与桑树植原体不能在枝条中越冬的结果不同[11-12]。泡桐植原体与桑树植原体属同一组的不同亚组,与枣树植原体则不属于同一组[9-10],说明3种植原体存在一定的遗传差异。至于越冬能力的差异是否与植原体种类不同、地域差别、不同树种对植原体的抗性不同有关,有待进一步研究证明。
泡桐植原体的周年消长规律可直接为丛枝病治疗时期的确定提供理论依据。根据植原体在患病植株中的分布情况,可以选择合适的时间对其进行物理和药物治疗,使每一项防治工作都能做到有针对性,对植原体分布较为集中的营养器官及位置进行有效地治疗和处理,避免人力、物力不必要的浪费。
[1] 蒋建平.泡桐栽培学[M].北京:中国林业出版社,1990.
[2] 卓玛措.泡桐丛枝病的发病规律及防治措施[J].现代农业科技,2008(11):156.
[3] 金开璇,田国忠,汪跃.组织化学技术快速检测泡桐丛枝病研究[J].植物病理学报,1989(19):185-188.
[4] 刘仲健,罗焕亮,张景宁.植原体病理学[M].北京:中国林业出版社,1999.
[5] 王秀伶,刘孟军,刘丽娟.荧光显微技术在枣疯病病原鉴定中的应用[J].河北农业大学学报,1999,22(4):46-49.
[6] 朱澄,徐丽云,金开璇.用DAPI荧光显微技术检测泡桐丛枝病[J].植物学报,1991,33(7):495-499.
[7] 蔡红,李小林,孔宝华,等.黄槐丛枝病植原体的检测及鉴定[J].植物病理学报,2005,35(1):19-23.
[8] 赵艳琴,武海龙,张丽娟,等.冬季桃黄花植原体在树体内分布消长动态的研究[J].内蒙古民族大学学报(自然科学版),2012,27(3):293-296.
[9] 赵锦,刘孟军,周俊义,等.枣疯植原体的分布特点及周年消长规律[J].林业科学,2006,42(8):144-147.
[10] 赵锦.枣疯病病原分布消长规律及其病害生理研究[D].保定:河北农业大学,2003:26-28.
[11] 戴群,刘秉胜,何放亭,等.温度周年变化与桑树植原体消长的关系[J].林业科学,1998,34(5):74-78.
[12] 刘秉胜,戴群.桑树植原体含量的周年变化及其对寄主激素水平的影响[J].山东大学学报(自然科学版),1999,34(1):98-102.
[13] 张锡津,田国忠,黄钦才.温度处理和茎尖培养结合脱除泡桐丛枝病类菌原体(MLO)[J].林业科学,1994,30(1):34-38.
[14] 安凤秋,吴云锋,顾沛雯.巢式PCR(Nested-PCR)在植原体检测中的应用[J].陕西农业科学,2008,54(3):50-52.
[15] 邓兆群,胡勤学,林木兰,等.用PCR和RFLP方法分析支原体与植原体的同源性[J].生物多样性,2000,8(1):103-105.
[16] Lee I M,Hammond R W,Davis R E,etal.Universal amplification and analysis of pathogen 16S rDNA for classification and identification of mycoplasma like organisms[J].Phytopathology,1993,83:834-842.
[17] 李婷婷,史梦蝶,张宁,等.许昌泡桐丛枝病植原体的分子鉴定[J].河南农业科学,2013,42(2):78-82.
[18] 邱并生,李横虹,史春霖,等.从我国20种感病植物中扩增植原体16S rDNA片段及其RFLP分析[J].林业科学,1998,34(6):67-74.
[19] 单卫星,李振层.PCR技术在植物病原物和植物抗病研究中的应用[J].植物生理学通讯,1995,31(2):137-143.
[20] 宋卡魏,王星云,张荣意.PCR相关技术在植物病原细菌检测和鉴定中的应用[J].广西热带农业, 2006(4):45-47.[21] Zhang C L,Lin M L,Hu Q X,etal.Year round distribution of paulownia witches’ broom phytoplasma monitored by DNA hybridization analysis[C].The Fifth International Workshop on Phytoplasms,1996,28:25-28.
Impact of Annual Temperature Variation on Distribution and Year-round Concentration Variation of Paulownia Witches’ Broom Phytoplasma
CAO Yabing1,ZHAI Xiaoqiao2,JIE Dawei1,FAN Guoqiang1*
(1.Institute of Paulownia,Henan Agricultural University,Zhengzhou 450002,China; 2.Henan Academy of Forestry,Zhengzhou 450008,China)
To explore the effect of temperature variation on the distribution of witches’ broom phytoplasma and its annual changes of relative content in paulownia,direct-RCR and nest-PCR were used to research the seasonal variation of the phytoplasma content and distribution.Our result showed that the distribution of phytoplasma in varying degree of diseased paulownia was different,meanwhile the concentration in different organs of the same plant was not the same.In the moderately diseased plant,phytoplasma survived all the year round in branches and increased gradually with the rising of temperature.The highest concentration of phytoplasma appeared in August,and subsequently,the concentration of phytoplasma gradually decreased.The similar situation appeared in leaves,except that the concentration of phytoplasma reached the maximum in July and the minimum in October.In root,the phytoplasma concentration was lower and changed less than in leaves and branches,which reached the maximum in September,and then reduced.In all,the relationship between the variation of phytoplasma concentration in paulownia and annual changes of temperature was very close.
paulownia witches’ broom phytoplasma; PCR; temperature; variation
2016-04-20
国家自然科学基金项目(30271082,30571496); 高等学校博士学科点专项科研基金项目(20050466003)
曹亚兵(1989-),女,河南禹州人,在读硕士研究生,研究方向:林木抗性机制。E-mail:cyb201406@163.com
*通讯作者:范国强(1964-),男,河南禹州人,教授,主要从事林木抗性机制研究。E-mail:zlxx64@163.com
S763.1
A
1004-3268(2016)10-0085-05
