热激对家蚕后部丝腺磷酸化蛋白质组的影响
2016-02-06夏爱华李季生贾漫丽杨贵明
夏爱华,李季生,3*,李 娜,贾漫丽,王 晖,杨贵明
(1.河北省高校特产蚕桑应用技术研发中心,河北 承德 067000; 2.承德医学院 蚕业研究所,河北 承德 067000; 3.浙江大学 动物科学学院,浙江 杭州 310029)
热激对家蚕后部丝腺磷酸化蛋白质组的影响
夏爱华1,2,李季生1,2,3*,李 娜1,2,贾漫丽1,2,王 晖1,2,杨贵明1,2
(1.河北省高校特产蚕桑应用技术研发中心,河北 承德 067000; 2.承德医学院 蚕业研究所,河北 承德 067000; 3.浙江大学 动物科学学院,浙江 杭州 310029)
为了探索蛋白质磷酸化在高温环境胁迫中发挥的作用,以秋丰×白玉家蚕为试验材料,将5龄第3天的家蚕放置在40 ℃培养箱内热激10 min,以未热激的家蚕为对照,利用双向电泳和质谱技术对后部丝腺磷酸化蛋白进行了分析和鉴定。结果发现,与对照相比,9个磷酸化蛋白在短期的热激之后表达量下降,包括腺苷酸激酶,延伸因子EF-1 δ、EF-1 β′,核糖体蛋白 P0、P1、P2以及轻链丝心蛋白等。GO分析表明,这些蛋白质主要参与能量代谢和丝心蛋白合成。对以上磷酸化蛋白的结构和功能进行分析,并利用NetPhos工具进行磷酸化位点预测,结果表明,这些蛋白质二级结构主要以α螺旋或无规则卷曲为主,无跨膜结构域,均存在磷酸化修饰。
热激; 家蚕; 后部丝腺; 磷酸化蛋白; 双向电泳; 质谱; 生物信息学
家蚕是重要的经济昆虫,在许多国家其已经成为蚕农的主要生活来源,除了具有经济价值,家蚕作为鳞翅目昆虫的代表还是研究昆虫生理学、生物学和遗传学著名的模式生物[1]。丝腺是家蚕最重要的器官之一,在丝蛋白分泌、合成等一系列生命活动中发挥重要的作用。根据解剖结构和生理功能的不同,一般将其划分为3个重要的组成部分,即前部丝腺、中部丝腺和后部丝腺。前部丝腺无分泌功能,中部丝腺负责合成丝胶蛋白类物质,后部丝腺是丝腺中最长的部分,它主要承担着丝心蛋白合成的功能。丝心蛋白主要由丝素重链、丝素轻链、P25蛋白以6∶6∶1比例组成[2]。尤其到了5龄期,家蚕的丝腺细胞急剧膨大,大量合成丝蛋白。5龄第3天通常被看作是家蚕后部丝腺发育的里程碑。从性状来看,5龄第2天之后家蚕食桑量显著提高,丝腺细胞快速生长[3]。从基因表达谱来看,5龄第3天和第5天率先聚类到一起,表达模式与5龄第1天和4龄眠蚕有一定差异,而且从蚕丝蛋白基因表达上也能明显看到这一点[4]。因此,研究5龄家蚕后部丝腺对揭示丝蛋白基因表达、转录后调控及茧丝高产机制等具有至关重要的作用。
温度是养蚕过程中最值得关注的环境因素,高温可导致家蚕正常的生理代谢出现故障,从而引发多种疾病,导致蚕茧质量和产量下降[5-8]。然而,在一些热带地区或国家,夏季室内的温度常常能达到40 ℃以上。因此,探索极端高温天气对生物的影响,以及如何提高生物的抗逆性等,这些问题一直是学者们关注的热点[9]。近年来,人们利用蛋白质组学技术研究高温条件对水稻[10]、大豆[11]、马齿苋[12]产量和生长的影响,揭示了一些功能蛋白在高温胁迫条件下参与的积极作用。家蚕是模式昆虫中不可多得的材料,而蚕体也是个微妙的系统。因此,从分子水平探索高温胁迫对家蚕蛋白质组学的影响,可为今后的分子育种提供参考。
蛋白质的磷酸化修饰是一种广泛存在于生物体内各种组织细胞中的蛋白质翻译后修饰方式,机体大约30%的蛋白质均可发生不同形式的磷酸化[13],其磷酸化位点主要发生于酪氨酸、丝氨酸与苏氨酸残基[14]。蛋白质磷酸化在一些模式生物上的研究是一个热点,但在家蚕中的相关研究还处在初级阶段。
综上所述,利用磷酸化蛋白质组学探索家蚕分子水平上的热激应答,不仅对于挖掘抗性蛋白质或基因用于家蚕抗性分子育种具有潜在价值,而且对于深入探索磷酸化蛋白在逆境胁迫中发挥的作用和分子机制也具有重要的意义。为此,通过高温胁迫家蚕,利用双向电泳、Pro-Q Diamond荧光检测法以及基质辅助激光解吸电离飞行时间质谱来研究家蚕后部丝腺蛋白质组的磷酸化现象,分析其磷酸化差异蛋白的表达变化,旨在探讨磷酸化蛋白在环境胁迫中发挥的作用,为今后的家蚕分子育种提供参考。
1 材料和方法
1.1 材料
供试的家蚕品种为适宜夏秋期饲养的单限性品种秋丰×白玉(QB),由浙江大学动物科学学院蚕桑馆提供。本研究采用新鲜桑叶,在25 ℃条件下按每天早、中、晚3次饲育方式养殖家蚕。饲喂至5龄第3天,选取大小、龄期基本一致的家蚕60头,雌雄各半,随机分为2组,即热激组和对照组。热激组在40 ℃的条件下进行10 min的热激处理,之后,热激组组和对照组均在4 ℃、0.7%的氯化钠溶液中解剖经过液氮冷冻的家蚕后部丝腺。洗净后置于70%乙醇中浸泡10 min,在显微镜下剥取丝腺组织,装入1.5 mL离心管中,-20 ℃保存备用。
1.2 蛋白质制备
称取一定量的家蚕后部丝腺组织,放在冰上使其缓慢溶解,然后按 1 mg丝腺细胞加10 μL 磷酸缓冲液抽提液,分次加入样品裂解缓冲液,冰上研磨。每研磨1 min低速离心10 s,共研磨10 min,然后室温放置10 min。超声波处理30 s,然后冰上放置30 s,重复4次。25 ℃下15 000 r/min离心10 min,取上清,重复2次,取上清液分装。蛋白质定量方法采用Bradford法[15],在595 nm处测定标准蛋白和样品蛋白的吸光度,并采用标准曲线法计算样品蛋白的浓度。最后,根据所需蛋白质量分装至离心管中,-20 ℃下保存备用。
1.3 双向电泳及染色
双向电泳参考Zhou等[16]的方法,采用Ettan IPGphor3等电聚焦和SDS-PAGE垂直电泳系统Ettan Daltsix (Amersham Biosciences)。胶条采用pH值为3~10的24 cm线性干胶条。双向电泳完成后,小心取出凝胶,清洗后进行硝酸银和Pro-Q Dia-mond荧光染色。
1.4 图谱扫描和分析
银染胶采用Image Scanner 2D扫描仪(Amersham Bioscience)进行扫描。通过Image Master 2D platinum 分析软件进行图像分析,检测蛋白质斑点,并预测其分子质量和等电点。
1.5 后部丝腺磷酸化蛋白质谱鉴定和表达分析
挖取Pro-Q Diamond荧光染色胶中对应的蛋白质点送交浙江理工大学进行质谱鉴定。胶内酶解参照文献[17]的方法。质谱鉴定采用文献[16]中的方法和参数,质谱仪采用ABI公司的4700 proteomics Analyzer。数据库选用NCBInr,搜库软件为GPS ExploreTMsoftware。
1.6 鉴定蛋白质的磷酸化位点预测
利用TMHMM Server.v.2.0在线软件(http://www.cbs.dtu.dk/services/TMHMM/)对氨基酸序列的跨膜结构域进行分析,SignalP-4.1在线软件对氨基酸序列进行信号肽预测(http://www.cbs.dtu.dk/services/SignalP/),PBIL在线软件对氨基酸序列的二级结构进行分析(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html),SWISS-MODEL在线软件进行同源建模(http://swissmodel.expasy.org/)。利用UniProt数据库(http://www.expasy.org/sprot/)对磷酸化蛋白进行基因注释,然后根据该数据库的注释信息,利用InterproScan 搜索引擎 (http://www.ebi.ac.uk/InterProScan/)找出每个蛋白质对应的Gene Ontology (GO)的编号。利用GO在线分析软件WEGO (http://wego.genomics.org.cn/) 对所有含有GO编号的蛋白质进行GO分类分析。最后利用NetPhos 2.0 Server在线软件(http://www.cbs.dtu.dk/services/NetPhos/) 预测磷酸化位点。
2 结果与分析
2.1 家蚕后部丝腺磷酸化蛋白图谱分析
从图1中可以看出,对照组和热激处理组的后部丝腺蛋白双向电泳图谱点分布情况大致相同,磷酸化蛋白基本分布在pH值4.0~6.0的垂直区域,分子质量大小不一。表明,后部丝腺磷酸化蛋白含酸性氨基酸较多,基本为酸性蛋白质。另外,从右侧荧光染色图中可以看出分离较好的蛋白质点有10个,而在图谱的偏上部分存在一些不易分离的蛋白质谱带。这些谱带中的蛋白质分子质量普遍比其他的蛋白质偏大(分子质量在50 ku以上),含量极为丰富,有可能为同类功能蛋白。
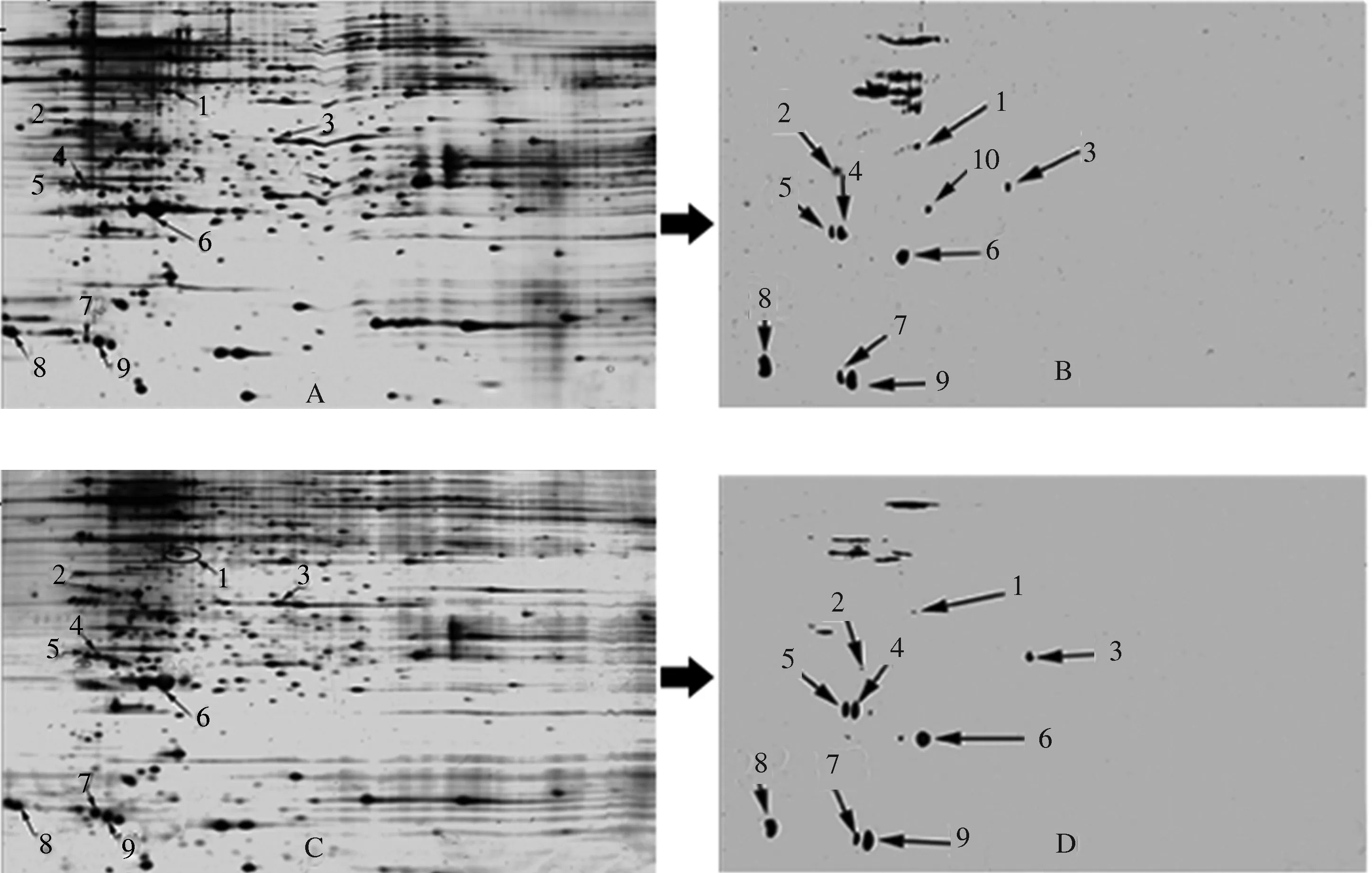
A、B为对照处理的电泳图谱;C、D为热激处理的电泳图谱;左侧A、C为银染图;右侧B、D为Pro-Q Diamond荧光染色图图1 家蚕后部丝腺磷酸化蛋白图谱
2.2 家蚕后部丝腺磷酸化蛋白点的质谱鉴定
对图1中分离较好的10个蛋白质点进行了凝胶取点、胶内酶切和质谱分析鉴定,成功鉴定了9个蛋白质,占鉴定蛋白质总数的90%。采用Image Master 2D platinum 分析软件对图谱进行分析发现,经过10 min热激处理后,上述9个蛋白质均呈现表达下调趋势。这说明短时间热激在一定程度上影响了这些蛋白质的合成。
质谱鉴定结果表明(表1),所鉴定蛋白质的蛋白质得分以及置信区间均较高,说明鉴定结果具有可靠性。有4个蛋白质点为核糖体,3个蛋白质点为延伸因子,另外2个蛋白质分别是蛋白质点1的腺苷酸激酶和蛋白质点6的轻链丝心蛋白。
此外,分析发现,凝胶上的蛋白质斑点4、5以及7、9各自被鉴定为同一蛋白质。造成这种现象的原因可能是由于翻译后修饰,比如糖基化、磷酸化、甲基化等。

表1 热激条件下家蚕后部丝腺磷酸化蛋白质谱鉴定
2.3 家蚕后部丝腺磷酸化蛋白的生物信息学分析
从磷酸化蛋白的结构预测来看,这些蛋白质的二级结构主要以α螺旋或无规则卷曲为主,延伸链在所有蛋白质中的比例均不高(表2)。TMHMM跨膜结构分析结果显示,所有的磷酸化蛋白均不存在跨膜区(图2)。SignalP-4.1分析结果显示,9个蛋白质中仅有蛋白质点6的轻链丝心蛋白在16—17位存在剪切位点,此处C值达到最高值,S值陡峭,Y值处于最高峰,表明该蛋白质存在信号肽(图3)。采用NetPhos 2.0预测蛋白质的磷酸化位点,发现所有蛋白质都至少存在1种磷酸化修饰(表3)。

表2 后部丝腺磷酸化蛋白结构预测
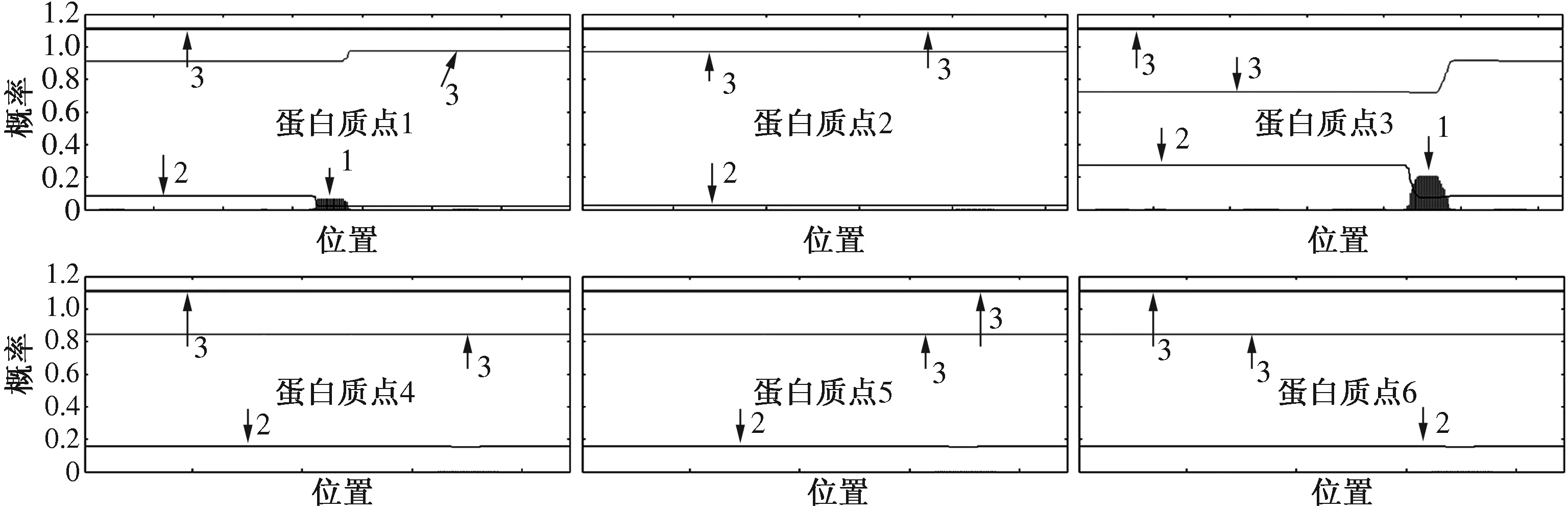
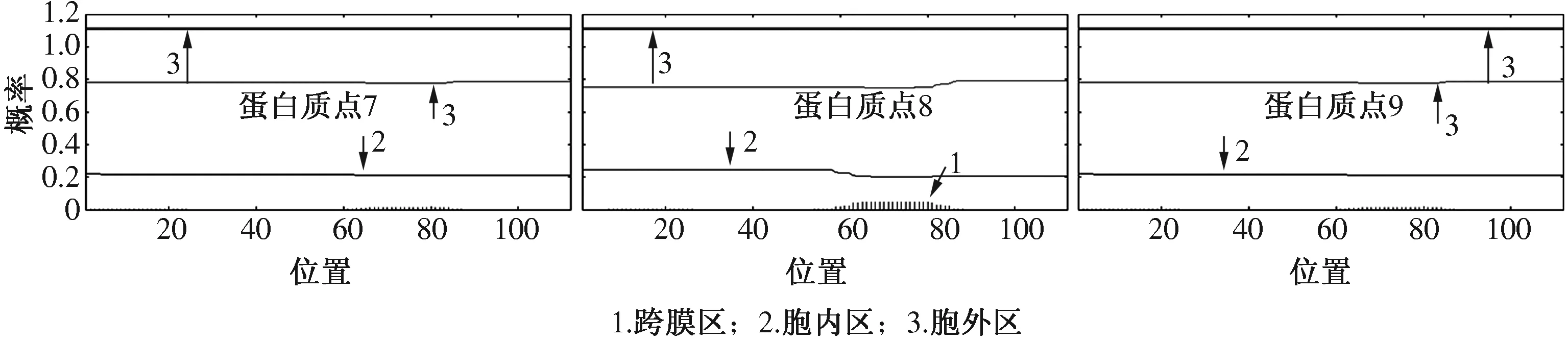
图2 TMHMM预测的跨膜结构域

图3 SignalP-4.1预测信号肽

表3 蛋白质磷酸化位点预测

续表3 蛋白质磷酸化位点预测
注:□表示磷酸化位点。
GO分析发现, 9个磷酸化蛋白中只有3个延伸因子没有找到相应的GO信息。从图4可以看出,在细胞组成层次上,磷酸化蛋白主要涉及细胞、细胞部分和细胞内等;在分子功能层次上,主要涉及核糖体结构成分和分子结构等;在生物学进程中,很多蛋白质主要参与细胞代谢进程、细胞进程、代谢进程和初级代谢进程。说明后部丝腺的磷酸化蛋白主要集中在胞内参与分子和能量代谢,主要发挥结构合成功能,与丝心蛋白的合成密切相关。

图4 待鉴定的磷酸化蛋白GO分类
3 结论与讨论
通过对热激组和对照组家蚕后部丝腺蛋白质组进行双向电泳和质谱分析,最终鉴定了9个磷酸化蛋白。Image Master图谱分析表明,与对照相比,热激后这些蛋白质的表达量短时间内出现了下降趋势。功能分析结果显示,除3个延伸因子未找到对应的GO编号外,腺苷酸激酶、核糖体蛋白 P0、P1、P2以及轻链丝心蛋白等6个蛋白主要集中在胞内参与分子和能量代谢,其主要功能为参与结构合成,与蚕丝的合成密切相关。其中,腺苷酸激酶(ADK)一般被认为是看家酶,它与腺苷的回收有着直接的关系,通过使腺苷磷酸化来产生5′-腺嘌呤核苷酸(5′-AMP)[18]。因为AMP 能够刺激非发酵蔗糖激酶1(sucrose non-fermenting-1 kinase,SNF1)的活性,而AL2/L2可以使SNF1和 ADK失活,这可能是一种双重机制用来对抗SNF1参与的非生物刺激[19]。核糖体蛋白可以调节rRNA的机构和功能[20],这些蛋白质在老鼠[21]、人类[22]、卤虫藻[23]、林蛙[24]、酵母菌[25]和家蚕[26]中均有报道。另外,有研究表明,丝腺延伸因子复合体EF-1ββ′γ 可催化GDP结合到EF-1α 交换外源GTP,同时刺激EF-1α 依赖氨酰tRNA结合核糖体[27]。而且,根据以前的研究结果,EF-2和EF-1γ亚基的表达在人工饲料饲育的家蚕中也呈现下调状态[16]。结合本试验及其他生物模型的研究推测,延伸因子EF-1β′、EF -1δ很有可能参与蚕丝的合成。
热激是非常重要的非生物胁迫因子,异常的温度刺激往往会给生物带来一定的影响,不仅能制约其正常生长,严重的还会造成蛋白质磷酸化,导致生物死亡。热激引起功能蛋白翻译后修饰[28-31],介导丝氨酸、苏氨酸、酪氨酸残基的可逆磷酸化,从而调节真核生物蛋白质和多肽的功能[32]。因此,磷酸化蛋白质组学分析在确认细胞中蛋白质的调节功能上有着巨大的潜力,包括对高温胁迫的应答。磷酸化蛋白在热激后表达量下调,可能是家蚕通过减少蚕丝合成这种复杂的代谢进程来应对高温胁迫的一种机制。另外,本研究借助生物信息学软件对鉴定的磷酸化蛋白进行了分析,对了解这些蛋白的结构、功能以及磷酸化位点提供了参考。
[1] Nagaraju J.Recent advances in molecular genetics of the silk moth,Bombyxmori[J].Current Science,2000,78(2):151-161.
[2] Inoue S,Tanaka K,Arisaka F,etal.Silk fibroin ofBombyxmoriis secreted,assembling a high molecular mass elementary unit consisting of H-chain,L-chain,and P25,with a 6∶6∶1 molar ratio[J].Journal of Biological Che-mistry,2000,275(51):40517-40528.
[3] Grzelak K.Control of expression of silk protein genes[J].Comparative Biochemistry and Physiology(Part B:Biochemistry & Molecular Biology),1995,110(4):671-681.
[4] Li J Y,Yang H J,Lan T Y,etal.Expression profiling and regulation of genes related to silkworm posterior silk gland development and fibroin synthesis[J].Journal of Proteome Research,2011,10(8):3551-3564.
[5] Kobayashi M,Inagaki S,Kawase S.Effect of high temperature on the development of nuclear polyhedrosis virus in the silkworm,Bombyxmori[J].Journal of Invertebrate Pathology,1981,38(3):386-394.
[6] Aruga H,Tanaka S.Effect of high temperature on the resistance of silkworm,Bombyxmorito flacherie-virus di-sease[J].Jour Sericult Sci Jap,1968,37: 441-444.
[7] Krieg A.Diseases caused by bacteria and other prokaryotes[J].Epizootiology of Insect Diseases,1987,8: 323-355.
[8] Watanabe H.Resistance of the silkworm,Bombyxmori,to viral infections[J].Agriculture Ecosystems & Environment,1986,15(2/3):131-139.[9] Altenbach S B.New insights into the effects of high temperature,drought and post-anthesis fertilizer on wheat grain development[J].Journal of Cereal Science,2012,56 (1):39-50.
[10] Raveendran M,Jagadish K V,Craufurd P Q,etal.Proteomic response of rice floral organs and lemma-palea to high temperature stress[J].Gene,Genomes and Geno-mics,2012,6(1):22-25.
[11] Wang L,Ma H,Song L,etal.Comparative proteomics analysis reveals the mechanism of pre-harvest seed deterioration of soybean under high temperature and humidity stress[J].Journal of Proteomics,2012,75(7):2109-2127.
[12] Yang Y,Chen J,Liu Q,etal.Comparative proteomic analysis of the thermotolerant plantPortulacaoleraceaacclimation to combined high temperature and humidity stress[J].Journal of Proteome Research,2012,11(7):3605-3623.
[13] Raggiaschi R,Gotta S,Terstappen G C.Phosphoproteome analysis[J].Bioscience Reports,2005,25(1/2):33-44.
[14] Wu H Y,Tseng V S,Liao P C,etal.Mining phosphopeptide signals in liquid chromatography-mass spectrometry data for protein phosphorylation analysis [J].Journal of Proteome Research,2007,6(5):1812-1821.
[15] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(2):248-254.
[16] Zhou Z H,Yang H J,Chen M,etal.Comparative proteomic analysis between the domesticated silkworm (Bombyxmori) reared on fresh mulberry leaves and on artificial diet[J].Journal of Proteome Research,2008,7(12):5103-5111.
[17] Gharahdaghi F,Weinberg C R,Meagher D A,etal.Mass spectrometric identification of proteins from silver-stained polyacrylamide gel: A method for the removal of silver ions to enhance sensitivity[J].Electrophoresis,1999,20(3):601-605.
[18] Wang H,Hao L,Shung C Y,etal.Adenosine kinase is inactivated by geminivirus AL2 and L2 proteins[J].The Plant Cell,2003,15(12):3020-3032.
[19] Wang H,Buckley K J,Yang X,etal.Adenosine kinase inhibition and suppression of RNA silencing by geminivirus AL2 and L2 proteins[J].Journal of Virology,2005,79(12):7410-7418.
[20] Noller H.Ribosomal RNA and translation[J].Annual Review of Biochemistry,1991,60(1):191-227.
[21] Wool I G,Chan Y L,Glück A,etal.The primary structure of rat ribosomal proteins P0,P1,and P2 and a proposal for a uniform nomenclature for mammalian and yeast ribosomal proteins[J].Biochimie,1992,73(7/8):861-870.
[22] Rich B E,Steitz J A.Human acidic ribosomal phosphoproteins P0,P1,and P2: Analysis of cDNA clones,invitrosynthesis,and assembly[J].Molecular and Cellular Biology,1987,7(11):4065-4074.
[23] Uchiumi T,Wahba A J,Traut R R.Topography and stoichiometry of acidic proteins in large ribosomal subunits fromArtemiasalinaas determined by crosslinking[J].Proceedings of the National Academy of Sciences of the United States of America,1987,84(16):5580-5584.
[24] Wu S,Storey K B.Up-regulation of acidic ribosomal phosphoprotein P0 in response to freezing or anoxia in the freeze tolerant wood frog,Ranasylvatica[J].Cryo-biology,2005,50(1):71-82.
[25] Remacha M,Jimenez-Diaz A,Santos C,etal.Proteins P1,P2,and P0,components of the eukaryotic ribosome stalk.New structural and functional aspects[J].Biochemistry and Cell Biology,1995,73(11/12):959-968.
[26] Shimizu T,Nakagaki M,Nishi Y,etal.Interaction among silkworm ribosomal proteins P1,P2 and P0 required for functional protein binding to the GTPase-associated domain of 28S rRNA[J].Nucleic Acids Research,2002,30(12):2620-2627.
[27] Kamiie K,Taira H,Kobayashi K,etal.Expression of elongation factor 1 beta′ inEscherichiacoliand its inte-raction with elongation factor 1 alpha from silk gland[J].Bioscience Biotechnology and Biochemistry,1999,63(4):666-671.
[28] Kalume D E,Molina H,Pandey A.Tackling the phosphoproteome: Tools and strategies[J].Current Opinion in Chemical Biology,2003,7(1):64-69.
[29] Beretta L,Dubois M F,Sobel A,etal.Stathmin is a major substrate for mitogen-activated protein kinase during heat shock and chemical stress in HeLa cells[J].The FEBS Journal,1995,227(1/2):388-395.
[30] Marklund U,Brattsand G,Osterman O,etal.Multiple signal transduction pathways induce phosphorylation of serines 16,25,and 38 of oncoprotein 18 in T lymphocytes[J].The Journal of Biological Chemistry,1993,268(34):25671-25680.
[31] de la Fuente van Bentem S,Hirt H.Using phosphoproteomics to reveal signalling dynamics in plants[J].Trends in Plant Science,2007,12(9):404-411.
[32] Reinders J,Sickmann A.State-of-the-art in phosphoproteomics[J].Proteomics,2005,5(16):4052-4061.
Effect of Heat Shock on Phosphorylation Proteins of Silkworm Posterior Silk Gland
XIA Aihua1,2,LI Jisheng1,2,3*,LI Na1,2,JIA Manli1,2,WANG Hui1,2,YANG Guiming1,2
(1.Hebei Universities R&D Centre for Sericulture and Specialty Enabling Technologies,Chengde 067000,China; 2.Institute of Sericulture,Chengde Medical University,Chengde 067000,China; 3.College of Animal Sciences,Zhejiang University,Hangzhou 310029,China)
In order to preliminarily explore the function of protein phosphorylation under environmental stress from the molecular level,silkworm strain Qiufeng×Baiyu of 5th instar 3rd day were placed into incubator at 40 ℃ for 10 min.We analyzed and identified the differentially expressed phosphorylation proteins of silkworm utilizing two-dimensional electrophoresis and mass spectrometry.Results showed that nine protein spots related to silk synthesis,including adenosine kinase,elongation factor 1 delta,elongation factor 1 beta′,ribosomal protein P0,ribosomal protein P1,ribosomal protein P2 and fibroin L-chain,etc.,showed down-regulated trends after heat shock.Functional analysis revealed that these proteins were involved in energy metabolism and fibroin synthesis.In addition,we further analyzed the structure and function of these phosphorylated proteins,and employed the NetPhos to predict their phosphorylation sites.Results showed that these proteins took alpha helix or random curl as their main secondary structure form,and did not possess transmembrane domain.Moreover,phosphorylated modification was found in all proteins.
heat shock; silkworm; posterior silk gland; phosphorylation proteins; two-dimensional electrophoresis; mass spectrometry; bioinformatics
2015-08-22
河北省教育厅资助项目(Q2012026);承德医学院院级课题(201538)
夏爱华(1979-),女,山东青州人,助理研究员,硕士,主要从事家蚕遗传学和生物技术方面的研究。 E-mail:aihuaxia2008@163.com
*通讯作者:李季生(1978-),男,山东泰安人,助理研究员,博士,主要从事蚕桑分子生物学方面的研究工作。 E-mail:jshlee@163.com
时间:2016-02-02 17:40:12
S885
A
1004-3268(2016)02-0127-08
网络出版地址:http://www.cnki.net/kcms/detail/41.1092.S.20160202.1740.002.html
