拟南芥SOAR1基因响应ABA与渗透胁迫的表达分析
2016-02-06姜上川王小芳张大鹏
姜上川,梅 超,王小芳,张大鹏
(清华大学 生命科学学院,北京 100084)
拟南芥SOAR1基因响应ABA与渗透胁迫的表达分析
姜上川,梅 超,王小芳,张大鹏*
(清华大学 生命科学学院,北京 100084)
拟南芥PPR蛋白SOAR1是ABA信号转导的关键调节因子。为阐明SOAR1基因表达对ABA和渗透胁迫的响应,以及其对不同时期幼苗生长响应ABA的调控,通过拟南芥基因调控信息网站(AGRIS)分析了SOAR1基因上游可能的转录因子结合位点(顺式作用元件),并进行了不同时期幼苗受ABA诱导的生长抑制试验以及ABA处理、渗透胁迫条件下SOAR1基因的表达分析。结果表明,SOAR1启动子序列中存在多个潜在的应答ABA和逆境胁迫信号的顺式作用元件。SOAR1调控不同时期幼苗生长对ABA的敏感性,SOAR1表达调低的突变体soar1-2显著促进植物对ABA的敏感反应,而SOAR1过表达株系OE1则对ABA显著不敏感。基因表达分析结果显示,SOAR1表达量在低浓度ABA处理6 h后小幅度上调,高浓度ABA处理6 h后变化程度较低;而在低浓度ABA处理后萌发24 h的种子和生长7 d的幼苗中,SOAR1表达随ABA浓度增长而上调。在甘露醇和PEG-6000诱导的渗透胁迫处理后,SOAR1表达受到一定抑制。
脱落酸(ABA); SOAR1; 幼苗生长; 渗透胁迫; 基因表达
作为最重要的植物激素之一,脱落酸(abscisic acid,ABA)参与调控植物生长发育各个阶段,包括种子休眠、萌发,幼苗生长,侧根生长,气孔运动以及营养生长向生殖生长转换等过程,并在植物对外界多种逆境胁迫(包括干旱、高盐、低温、渗透胁迫等非生物胁迫,以及病虫害等生物胁迫)的响应中起着重要作用[1-3]。由于植物体自身生长发育的局限性以及全球气候环境变化等因素的影响,植物ABA信号转导通路分子机制的阐明对促进现代农业生产发展具有重要意义[4]。在非生物胁迫中由干旱、高盐、低温所引起的渗透胁迫是制约植物生长、降低作物产量的重要因素。处于逆境中的植物通过调节生理、代谢上的变化以及相关基因的表达适应多变的环境。ABA在这种变化中可作为一种逆境信号,调节多种相关基因的表达。目前已经发现多种ABA响应调节子,包括PP2C与PP2A磷酸酶[5-6]、SNF1相关蛋白激酶SnRK2s[7-8]、钙依赖蛋白激酶(CDPK)[9]、丝裂原活化蛋白激酶(MAPK)[10]以及bZIP、MYC/MYB、ABI3/VP1、WRKY等转录因子家族等[11-14],这些发现为阐明植物抗渗透胁迫的分子机制奠定了基础。
PPR(pentatricopeptide repeats)基因家族是在植物中发现的最大家族之一,最早在拟南芥基因组序列中发现[15]。在陆生植物中来自不同种属的PPR蛋白具有高度同源性。在拟南芥中有450多个PPR蛋白,其他陆生植物基因组序列中可编码更多的PPR蛋白[16-17]。PPR蛋白在细胞内主要分布在线粒体与叶绿体中,在线粒体和叶绿体基因组RNA代谢过程中起着重要作用[17]。目前在拟南芥中已经发现几个线粒体定位的PPR蛋白参与了ABA信号转导过程,包括ABO5[18]、SLO2[19]、SLG1[20]、AHG11[21]、PPR40[22]与PGN[23]等,这几种PPR蛋白通过调控线粒体中活性氧(ROS)的变化参与ABA信号转导过程。
Jiang等[24]、Mei等[25]在拟南芥中发现一种细胞质-核定位的PPR蛋白SOAR1参与ABA信号转导,改变SOAR1基因的表达可以大幅度调控拟南芥种子萌发与萌发后生长对ABA的响应。然而SOAR1基因表达变化如何影响拟南芥对ABA和渗透胁迫的响应,及幼苗不同生长时期响应ABA的调控仍有待阐明。鉴于此,本研究通过拟南芥基因调控信息网站(AGRIS)对SOAR1基因启动子元件进行分析,进一步检测SOAR1表达变化对不同时期幼苗生长响应ABA的影响,并分析不同ABA处理以及由甘露醇或PEG-6000诱导的渗透胁迫处理后SOAR1基因表达的变化特性,为研究SOAR1在ABA信号转导网络和植物抗逆反应中的作用提供新的信息。
1 材料和方法
1.1 材料
拟南芥(Arabidopsisthaliana)野生型(Col)种子购自美国俄亥俄州立大学拟南芥生物资源中心(ABRC);SOAR1(AT5G11310)基因表达调低的T-DNA插入突变体soar1-2(FLAG_546D07)种子购自凡尔赛遗传学和植物育种实验室拟南芥资源中心(http://dbsgap.versailles.inra.fr/portail/),其遗传背景为Col生态型;SOAR1过表达转基因株系OE1的构建方法见文献[25]报道;ABA信号传导正调节子bZIP转录因子ABI5(AT5G36270)功能缺失突变体abi5-1(CS8105:abi5-1)购自ABRC,其与野生型Col回交,作为对ABA不敏感的对照[25-26]。以上所有植物材料均为纯合体并经过分子鉴定,见文献[25]报道。
1.2 方法
1.2.1SOAR1基因启动子元件分析 通过拟南芥基因调控信息网站(AGRIS,http://arabidopsis.med.ohio-state.edu/)分析SOAR1基因上游可能的转录因子结合位点(顺式作用元件)。
1.2.2 拟南芥培养 将拟南芥种子消毒后播种于含有固体MS培养基的培养皿中,经4 ℃低温处理3 d后取出,置于光照培养箱中培养10~14 d,光周期为光照16 h/黑暗8 h,温度20 ℃,光强约为80 μmol/(m2·s)。幼苗移入土中生长后,光周期为光照16 h/黑暗8 h,温度22~24 ℃,光照强度为120 μmol/(m2·s)。
1.2.3 ABA诱导的幼苗生长抑制试验 将野生型Col、突变体soar1-2、SOAR1过表达株系OE1、ABI5突变体abi5-1(对照,对ABA不敏感)种子直接播种在无ABA(0 μmol/L)以及含有0.5、1、3 μmol/L ABA的MS培养基上生长10 d,观察不同生长阶段幼苗对ABA的响应。
为排除种子萌发差异对早期幼苗生长的影响,将在普通MS培养基上正常生长2 d和4 d的上述不同基因型幼苗分别转移至含有3、5、10 μmol/L ABA和50、150、250 μmol/L ABA(由于已经萌发的幼苗对ABA的耐受性相对增加,因此处理时提高ABA浓度)的MS培养基上,生长7 d后观察表型。
1.2.4 ABA处理后SOAR1基因的表达分析 ABA喷施处理试验中,分别用低浓度(0、1、3、5 μmol/L)、高浓度(0、50、100、150 μmol/L)ABA溶液喷施野生型Col生长2周和生长4周的幼苗,于22 ℃光照条件下放置6 h后取样。
ABA处理种子试验中,将拟南芥野生型Col种子置于含有不同浓度(0、1、3、5 μmol/L)ABA的滤纸上,低温处理3 d后在20 ℃培养箱中(光照16 h/黑暗8 h)萌发生长24 h,取样。
幼苗移苗生长ABA处理试验中,将正常生长2 d的野生型Col幼苗转移至含有不同浓度(0、1、4、8 μmol/L)ABA的MS培养基上,在20 ℃培养箱中(光照16 h /黑暗8 h)生长7 d后取样。
以受到ABA诱导表达上调的RD29B基因[27]作为对照,实时荧光定量PCR检测上述ABA处理后野生型Col种子或幼苗样品中SOAR1基因的表达变化。
1.2.5 渗透胁迫条件下SOAR1基因表达分析 选择在普通MS培养基中正常生长约2周的拟南芥野生型Col幼苗,22 ℃光照条件下将其置于分别含有300 mmol/L 甘露醇和30% PEG-6000的1/2 MS培养液中浸泡摇晃3、6、9 h后取样,以不含甘露醇和PEG-6000的1/2 MS培养液处理作为对照。以RD29B基因[27]作为受到渗透胁迫诱导对照,实时荧光定量PCR检测渗透胁迫处理后野生型Col幼苗中SOAR1基因的表达变化。
1.2.6 实时荧光定量PCR检测基因表达 采用通用植物总RNA提取试剂盒提取不同植物材料RNA,反转录后采用实时荧光定量PCR分析。所用的引物见表1。反应体系(10 μL)中加入SYBR Premix ExTaq(2×)5 μL,正向与反向引物(20 μmol/L)各0.1 μL,cDNA 模板0.2 μL,ddH2O补至10 μL。每个反应体系重复3次,充分混匀,短暂离心后采用CFX96荧光定量PCR仪(Bio-Rad,美国)
进行扩增。实时荧光定量PCR反应程序:95 ℃ 30 s;94 ℃ 5 s、60 ℃ 20 s读取荧光值并重复40个循环;95 ℃ 10 s,65 ℃升温至95 ℃,每次上升0.5 ℃,每次5 s读取荧光值。数据分析:Ct值为PCR反应荧光信号达到所设域值时对应的循环数,ΔCt为目的基因引物Ct(基因)与内参引物Ct(Actin)值之差,ΔΔCt为处理组与对照组ΔCt之差,以2-ΔΔCt衡量标准化后基因表达差异。
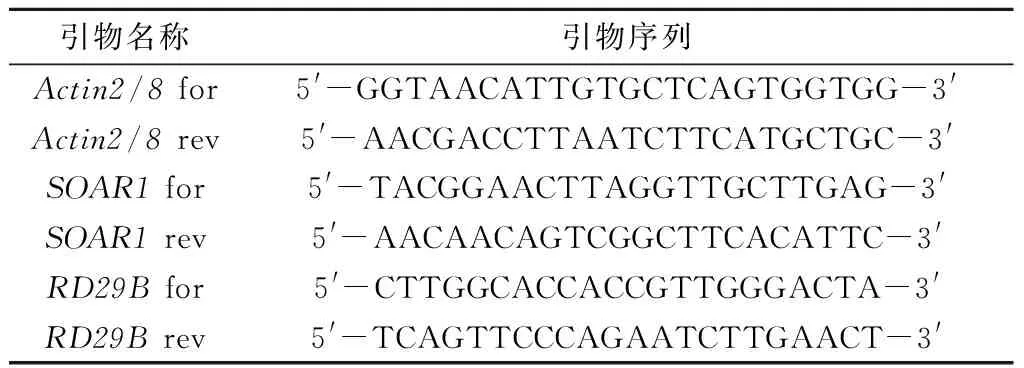
表1 实时荧光定量PCR试验引物
2 结果与分析
2.1SOAR1基因启动子元件分析结果
转录因子作为植物激素信号转导与逆境反应中的重要调节子,可以调控相关基因表达以响应ABA信号或逆境胁迫。根据TAIR数据库(http://www.arabidopsis.org/)预测结果,SOAR1基因(AT5G11310)的启动子区位于拟南芥5号染色体基因组序列3 605 258至3 606 402区段,对应SOAR1基因起始密码子上游-1 232 bp至-89 bp区段。进一步分析SOAR1基因上游可能的转录因子结合位点(顺式作用元件)(表2)可知,SOAR1基因启动子中含有:5个RAV1-A binding site motif(对应ABI3/VP1转录因子),分别位于SOAR1基因上游-332 bp至-337 bp、-607 bp至-612 bp,以及互补链的-100 bp至-105 bp、-972 bp至-977 bp、-1 224 bp至-1 229 bp;2个W-box promoter motif(对应WRKY转录因子),分别位于互补链-359 bp至-365 bp、-505 bp至-511 bp;1个MYB4 bin-ding site motif(对应MYB转录因子),位于互补链-921 bp至-928 bp。这些启动子元件可能在响应ABA以及非生物胁迫信号中发挥作用,从而调控SOAR1基因表达。

表2 SOAR1基因部分启动子元件结合位点及对应序列
2.2SOAR1调控不同时期幼苗生长对ABA的敏感性
与野生型Col相比,突变体soar1-2表现出对ABA显著敏感;而SOAR1过表达株系OE1的生长则基本不受ABA抑制(图1A,D)。在生长2 d的幼苗移栽处理试验中(图1B,E),SOAR1过表达植株OE1在不同浓度ABA处理后基本不受抑制,仍表现出显著不敏感表型;而soar1-2突变体、野生型Col以及abi5-1突变体均受到ABA抑制,生长基本停滞,表现为子叶不转绿以及根部生长受到严重抑制,所受抑制程度与直接萌发后生长试验中3 μmol/L ABA处理后(图1A)类似。在生长4 d的幼苗移栽处理试验中(图1C,F),SOAR1过表达植株OE1的子叶与根部仍能继续发育出真叶与根系,对ABA不敏感程度显著高于abi5-1突变体;而突变体soar1-2与野生型Col受到高浓度ABA的显著抑制,基本无法继续生长,且突变体soar1-2受到ABA的抑制程度高于野生型Col。可见,SOAR1在调控不同时期幼苗生长对ABA的敏感性中发挥关键作用。

A.种子萌发后生长对ABA的响应; B.正常生长2 d幼苗对ABA的响应; C.正常生长4 d幼苗对ABA的响应。D、E、F分别对应A、B、C不同浓度ABA处理后的根长,不同字母表示同一浓度ABA处理的不同基因型植株根长差异显著(P<0.05)图1 SOAR1调控不同时期幼苗生长对ABA的敏感性
2.3 ABA处理后SOAR1基因的表达分析结果
如图2A所示,生长2周幼苗中SOAR1表达受相对低浓度(1、3、5 μmol/L)ABA诱导小幅度上调;生长2周或4周幼苗在高浓度(50、100、150 μmol/L)ABA处理后,仅在100 μmol/L ABA处理时SOAR1表达量小幅上调,其他浓度处理对SOAR1表达变化无显著影响。说明在相对短期(6 h)的ABA处理中,SOAR1表达受低浓度ABA诱导,但整体表达变化程度较低。
如图2B所示,低浓度(0、1、3、5 μmol/L)ABA处理后,萌发生长24 h的野生型Col种子中SOAR1表达随ABA浓度增加而显著升高;正常生长2 d幼苗经ABA(0、1、4、8 μmol/L)处理7 d后,SOAR1表达受到ABA的小幅度诱导。表明在相对长期低浓度ABA处理的种子萌发与幼苗生长过程中,SOAR1基因受到诱导表达上调。
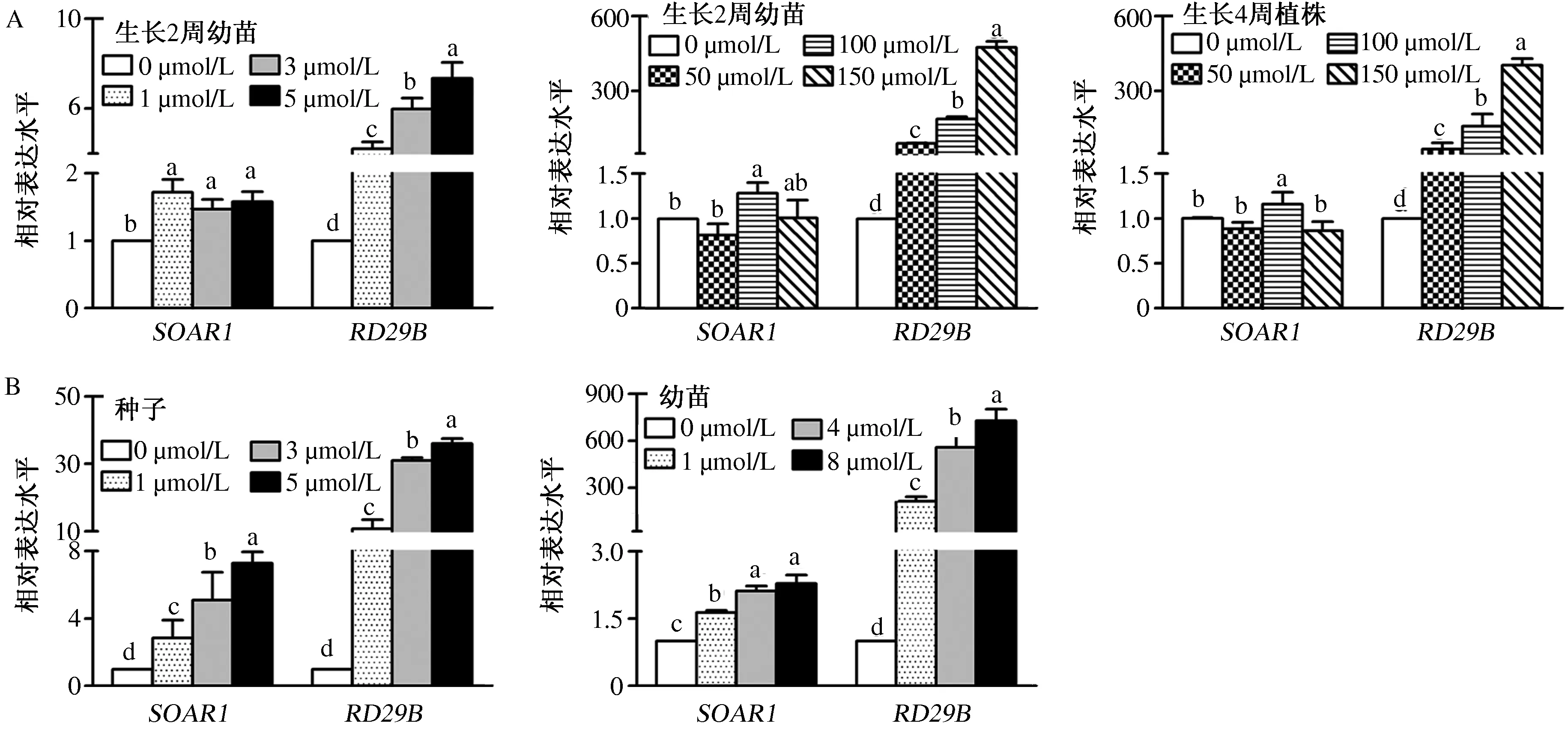
A.不同浓度ABA喷施生长2周和4周幼苗后基因的表达情况; B.野生型Col的种子及其正常生长2 d的幼苗受到ABA处理后基因的表达情况。不同字母表示不同浓度ABA处理后同一基因表达水平差异显著(P<0.05)图2 ABA处理后SOAR1基因的表达分析
2.4 渗透胁迫条件下SOAR1基因的表达分析结果
如图3所示,在甘露醇或PEG-6000处理后,RD29B表达量随处理时间增长而大幅上调,且受到PEG-6000诱导的渗透胁迫后上调幅度最高;而SOAR1表达量在渗透胁迫处理后与对照相比均有一定程度下降,甘露醇或PEG-6000处理对SOAR1表达的抑制程度接近。表明,SOAR1能够响应渗透胁迫,在渗透胁迫处理后SOAR1受到一定程度抑制。

不同字母表示同一处理时间不同处理条件下基因表达差异显著(P<0.05)图3 渗透胁迫处理下SOAR1基因的表达分析
3 结论与讨论
本研究结果表明:SOAR1基因启动子序列中存在多个潜在的应答ABA和逆境胁迫信号的顺式作用元件。SOAR1调控不同阶段幼苗生长对ABA的敏感性,SOAR1表达调低显著促进植物对ABA的敏感反应,而SOAR1过表达株系则对ABA显著不敏感。基因表达分析表明,SOAR1表达量在相对短期低浓度ABA处理后小幅度上调,高浓度ABA处理后变化程度较低;而在相对长期低浓度ABA处理后的种子和幼苗中,SOAR1表达随ABA浓度增长而上调;在甘露醇和PEG-6000诱导的渗透胁迫处理后,SOAR1表达受到一定抑制。
陆生植物在整个生长发育阶段都可能受到外界各种逆境胁迫的影响。干旱、高盐和低温所引起的渗透胁迫严重制约植物生长发育、产量及品质等。植物激素可能是抗逆基因表达的启动因素,其中ABA与非生物胁迫关系最密切,在植物对外界各种逆境胁迫的抗逆反应中起着重要作用[28-29]。非生物逆境胁迫中由干旱、高盐和低温等造成的渗透胁迫信号转导,可导致转录因子量的增加和活性的增强,并与顺式作用元件互相作用,进而诱导基因表达。依赖ABA的逆境胁迫信号转导关键转录因子包括bZIP家族、ABI3/VP1家族、MYC与MYB家族、WRKY家族等,在调控植物抗逆反应过程中发挥着重要作用[11-14]。启动子元件分析显示,SOAR1基因启动子序列中存在多个潜在的应答ABA或非生物胁迫的顺式作用元件,包括RAV1-A binding site motif(对应ABI3/VP1转录因子)、W-box promoter motif(对应WRKY转录因子)以及MYB4 binding site motif(对应MYB转录因子),这些元件可能在响应ABA与逆境胁迫信号中发挥作用,从而调控SOAR1基因表达。
在ABA诱导的生长抑制试验中,为排除种子萌发差异对早期幼苗生长的影响,将正常生长2 d和4 d后的幼苗移至含有不同浓度ABA的MS培养基上生长,与野生型Col相比,SOAR1表达下调的突变体soar1-2表现出对ABA显著敏感,而SOAR1过表达株系OE1则表现出对ABA显著不敏感表型,且不敏感程度高于突变体abi5-2。这些结果与拟南芥种子直接在ABA培养基上萌发后的生长状态趋势一致,表明SOAR1能够调控不同阶段幼苗生长对ABA的响应。
基因表达分析表明,SOAR1表达在不同处理条件下以及材料的不同生长发育时期对ABA的响应存在差异。SOAR1表达能够响应ABA信号,并在一定程度上受ABA诱导。同时,SOAR1表达在渗透胁迫处理不同时间后受到一定抑制,表明其响应逆境胁迫信号后自身表达也发生变化,从而调控下游基因表达。SOAR1响应ABA与渗透胁迫的表达调控可能是通过相关转录因子与SOAR1启动子中对应的作用元件结合实现的。此外,在应对不同的外源ABA处理以及渗透胁迫处理条件下,SOAR1表达的变化趋势有所不同,说明SOAR1调控ABA信号转导与抗逆反应的机制可能存在一定差异,同时也暗示着植物在响应ABA与逆境信号过程中对SOAR1表达具有复杂且精细的调控机制。
[1] Adie B A T,Pérez-Pérez J,Pérez-Pérez M M,etal.ABA is an essential signal for plant resistance to pathogens affecting JA biosynthesis and the activation of defenses inArabidopsis[J].The Plant Cell,2007,19(5):1665-1681.
[2] Cutler S R,Rodriguez P L,Finkelstein R R,etal.Abscisic acid:Emergence of a core signaling network[J].Annual Review of Plant Biology,2010,61:651-679.
[3] Finkelstein R R,Gampala S S L,Rock C D.Abscisic acid signaling in seeds and seedlings[J].The Plant Cell,2002,14(S):S15-S45.
[4] Hirayama T,Shinozaki K.Research on plant abiotic stress responses in the post-genome era:Past,present and future[J].The Plant Journal,2010,61(6):1041-1052.
[5] Schweighofer A,Hirt H,Meskiene I.Plant PP2C phosphatases:Emerging functions in stress signaling[J].Trends in Plant Science,2004,9(5):236-243.
[6] Ma Y,Szostkiewicz I,Korte A,etal.Regulators of PP2C phosphatase activity function as abscisic acid sensors[J].Science,2009,324:1064-1068.
[7] Kulik A,Wawer I,Krzywińska E,etal.SnRK2 protein kinases—Key regulators of plant response to abiotic stresses[J].OMICS,2011,15(12):859-872.
[8] Fujii H,Verslues P E,Zhu J K.Identification of two protein kinases required for abscisic acid regulation of seed germination,root growth,and gene expression inArabidopsis[J].The Plant Cell,2007,19(2):485-494.
[9] Das R,Pandey G K.Expressional analysis and role of calcium regulated kinases in abiotic stress signaling[J].Current Genomics,2010,11(1):2-13.
[10] Nakagami H,Pitzschke A,Hirt H.Emerging MAP kinase pathways in plant stress signalling[J].Trends in Plant Science,2005,10(7):339-346.
[11] Jakoby M,Weisshaar B,Dröge-Laser W,etal.bZIP transcription factors inArabidopsis[J].Trends in Plant Science,2002,7(3):106-111.
[12] Dubos C,Stracke R,Grotewold E,etal.MYB transcription factors inArabidopsis[J].Trends in Plant Science,2010,15(10):573-581.
[13] Rushton P J,Somssich I E,Ringler P,etal.WRKY transcription factors[J].Trends in Plant Science,2010,15(5):247-258.
[14] Lopez-Molina L,Mongrand S,McLachlin D T,etal.ABI5 acts downstream of ABI3 to execute an ABA-dependent growth arrest during germination[J].The Plant Journal,2002,32(3):317-328.
[15] Small I D,Peeters N.The PPR motif—A TPR-related motif prevalent in plant organellar proteins[J].Trends in Biochemical Sciences,2000,25(2):46-47.
[16] Lurin C,Andrés C,Aubourg S,etal.Genome-wide ana-lysis ofArabidopsispentatricopeptide repeat proteins reveals their essential role in organelle biogenesis[J].The Plant Cell,2004,16(8):2089-2103.
[17] Schmitz-Linneweber C,Williams-Carrier R E,Williams-Voelker P M,etal.A pentatricopeptide repeat protein facilitates the trans-splicing of the maize chloroplast rps12 pre-mRNA[J].The Plant Cell,2006,18(10):2650-2663.
[18] Liu Y,He J,Chen Z,etal.ABAoverly-sensitive5 (ABO5),encoding a pentatricopeptide repeat protein required for cis-splicing of mitochondrialnad2 intron 3,is involved in the abscisic acid response inArabidopsis[J].The Plant Journal,2010,63(5):749-765.
[19] Zhu Q,Dugardeyn J,Zhang C,etal.TheArabidopsisthalianaRNA editing factor SLO2,which affects the mitochondrial electron transport chain,participates in multiple stress and hormone responses[J].Molecular Plant,2014,7(2):290-310.
[20] Yuan H,Liu D.Functional disruption of the pentatricopeptide protein SLG1 affects mitochondrial RNA editing,plant development,and responses to abiotic stresses inArabidopsis[J].The Plant Journal,2012,70(3):432-444.
[21] Murayama M,Hayashi S,Nishimura N,etal.Isolation ofArabidopsisahg11,a weak ABA hypersensitive mutant defective in nad4 RNA editing[J].Journal of Experimental Botany,2012,63(14):5301-5310.
[22] Zsigmond L,Rigó G,Szarka A,etal.ArabidopsisPPR40 connects abiotic stress responses to mitochondrial electron transport[J].Plant Physiology,2008,146(4):1721-1737.
[23] Laluk K,Abuqamar S,Mengiste T.TheArabidopsismitochondria-localized pentatricopeptide repeat protein PGN functions in defense against necrotrophic fungi and abio-tic stress tolerance[J].Plant Physiology,2011,156(4):2053-2068.
[24] Jiang S C,Mei C,Wang X F,etal.A hub for ABA signaling to the nucleus:Significance of a cytosolic and nuc-lear dual-localized PPR protein SOAR1 acting downstream of Mg-chelatase H subunit[J].Plant Signaling & Behavior,2014,9(11):e972899.
[25] Mei C,Jiang S C,Lu Y F,etal.Arabidopsispentatricopeptide repeat protein SOAR1 plays a critical role in abscisic acid signalling[J].Journal of Experimental Bo-tany,2014,65(18):5317-5330.
[26] Finkelstein R R,Lynch T J.TheArabidopsisabscisic acid response geneABI5 encodes a basic leucine zipper transcription factor[J].The Plant Cell,2000,12(4):599-609.
[27] Yamaguchi-Shinozaki K,Shinozaki K.A novel cis-acting element in anArabidopsisgene is involved in responsiveness to drought,low-temperature,or high-salt stress[J]. The Plant Cell,1994,6(2):251-264.
[28] Qin F,Shinozaki K,Yamaguchi-Shinozaki K.Achievements and challenges in understanding plant abiotic stress responses and tolerance[J].Plant & Cell Physiology,2011,52(9):1569-1582.
[29] Xiong L,Zhu J K.Abiotic stress signal transduction in plants:Molecular and genetic perspectives[J].Physiologia Plantarum,2001,112(2):152-166.
Expression Analysis ofArabidopsisSOAR1 in Response to ABA and Osmotic Stress
JIANG Shangchuan,MEI Chao,WANG Xiaofang,ZHANG Dapeng*
(School of Life Sciences,Tsinghua University,Beijing 100084,China)
TheArabidopsisPPR(pentatricopeptide repeats) protein SOAR1 is a crucial regulator of ABA signaling.In order to elucidate howSOAR1 expression responds to ABA and osmotic stress,and howSOAR1 regulates seedlings response to ABA during different post-germination growth stages,in this study, we usedArabidopsisGene Regulatory Information Server(AGRIS) to analyze the potential ABA and stress response elements in upstream region ofSOAR1 gene,conducted the ABA-induced post-germination growth arrest assay in different growth stage,and analyzedSOAR1 expression level under ABA or osmotic treatment.The results showed that there were several potential ABA and stress response elements in the promoter region ofSOAR1 gene.SOAR1 regulated the seedlings sensitivity to ABA in different post-germination growth stage,soar1-2 mutant withSOAR1 expression decreased showed promoted sensitivity to ABA,whileSOAR1 overexpression line OE1 was significantly insensitive to ABA.The expresssion analysis showed thatSOAR1 was slightly increased after 6 h treatment of low concentration ABA,but was not changed much after 6 h treatment of high concentration ABA;while in the germinating seeds(24 h) or seedlings(7 d) after treatment of low concentration ABA,SOAR1 was up-regulated with the increase of ABA concentration.Under the osmotic stresses induced by D-mannitol and PEG-6000,the expression level ofSOAR1 was repressed.
abscisic acid (ABA); SOAR1; seedling growth; osmotic stress; gene expression
2015-07-27
国家转基因作物品种培育科技重大专项(2014ZX08009003);国家基础研究重大专项(2012CB114300-002)
姜上川(1987-),女,河南洛阳人,博士,主要从事植物分子生物学研究。E-mail:jsc_w@163.com
*通讯作者:张大鹏(1956-),男,陕西大荔人,教授,博士,主要从事脱落酸与植物抗逆分子机制研究。 E-mail:zhangdp@tsinghua.edu.cn
Q78
A
1004-3268(2016)02-0029-07
