microRNA-375在肝纤维化中的作用及其调控信号通路的研究
2016-02-06刘晓峰麻树霖
陈 征 刘晓峰 麻树霖
·论著·
microRNA-375在肝纤维化中的作用及其调控信号通路的研究
陈 征 刘晓峰 麻树霖
目的 通过提高肝星状细胞(HSC)中微小核糖核酸(microRNA-375,miR-375)的表达水平,探讨miR-375在肝纤维化进程中的作用及其靶向信号通路。方法 通过瞬时转染将miR-375mimic或者miR-375 mimic negative control (NC)转染到大鼠肝星状细胞(HSC-T6),将细胞分为mimic组、NC组和空白对照组。通过实时荧光定量聚合酶链反应(qRT-PCR)、免疫印迹实验(Western blot)检测细胞中蛋白激酶B(Akt)基因、3-磷酸肌醇依赖性蛋白激酶1(PDK1)基因表达水平的变化。分别用细胞流式技术、细胞计数实验(CCK-8)试剂盒和细胞迁移实验检测过表达的miR-375对HSC-T6的细胞周期、增殖和迁移能力的影响。结果 与其他两组相比,mimic组细胞中Akt、PDK1含量明显下降(P<0.05),细胞停滞在G0/G1期的比例升高(P<0.05)、增殖受到抑制(P<0.05),细胞迁移的差异无统计学意义(P>0.05)。结论 miR-375可抑制HSC的增殖,负性调控肝纤维化进程。
miRNA-375;肝纤维化;转染;信号通路
肝星状细胞(HSC)在肝纤维化形成的过程中起着重要的作用。HSC在正常肝脏中处于静止状态,在肝脏受损时被激活,活化的HSC分泌大量的细胞外基质和活性细胞因子,自身持续激活是肝纤维化形成的中心环节[1]。在HSC活化过程中伴随许多基因表达的改变,进而导致细胞中一系列转录因子、信号通路蛋白以及胶原蛋白含量的改变。微小核糖核酸(microRNA, miRNA)是一类长约20~25个核苷酸的非编码的单链RNA分子,它通过与靶基因mRNA 3′端非翻译区(3′UTR)完全或不完全配对,降解靶基因mRNA,在转录后水平调控基因表达[2-3]。目前很多研究发现,多种miRNA参与了HSC的活化和纤维化形成。本课题小组的前期实验研究发现,与静止期HSC相比,miR-375在活化期HSC中表达下调。本研究通过提高肝星状细胞中miR-375的表达水平,探讨其在肝纤维化进程中的作用及其靶向信号通路。
1 材料与方法
1.1 主要材料
大鼠HSC-T6细胞购自湘雅医学院细胞库,miR-375 mimic(miR-375类似物)、miR-375 mimic negative control (NC, miR-375阴性对照物)、转染试剂盒引物购自广州锐博公司,总RNA提取试剂Trizol和反转录聚合酶链反应(RT-PCR)试剂盒购自Takara公司,3-磷酸肌醇依赖性蛋白激酶1(PDK1)抗体、蛋白激酶B(Akt)抗体购自青岛昊航科贸公司。
1.2 方法
HSC-T6细胞培养条件为含有12%胎牛血清的DMEM完全培养液,置于5%CO2、37 ℃、饱和湿度的细胞培养箱中培养。1.2.1 转染和细胞分组 本实验涉及铺6孔板、12孔板、24孔板及96孔板。以铺24孔板为例:(1)接种细胞 将大约5×105个HSC-T6细胞接种于24孔培养板中,置入细胞培养箱(5%CO2,37 ℃,饱和湿度)中培养24 h,转染时的细胞密度约为50%。(2)转染步骤 弃去旧培养基,每孔加入含适量完全培养基(V1),吸取1.25 μL 20 μmol/L miR-375 mimic(V3)到EP管中,然后加入用30 μL 1X riboFECTTMCP Buffer(V2)对其进行稀释并混匀,向EP管中再加入3 μL riboFECTTMCP Reagent(V4)并混匀,于室温下孵育0~15 min,将上述混合液加入到培养板中并混匀。将培养板置入培养箱(5%CO2,37 ℃,饱和湿度)中培养24~96 h(实验目的决定培养时间)。细胞分为3组:mimic组(转染miRNA-375 mimic),NC组(阴性对照组,转染阴性对照物miRNA-375 mimic negative control),空白对照组(未进行处理)。具体用量见表1。
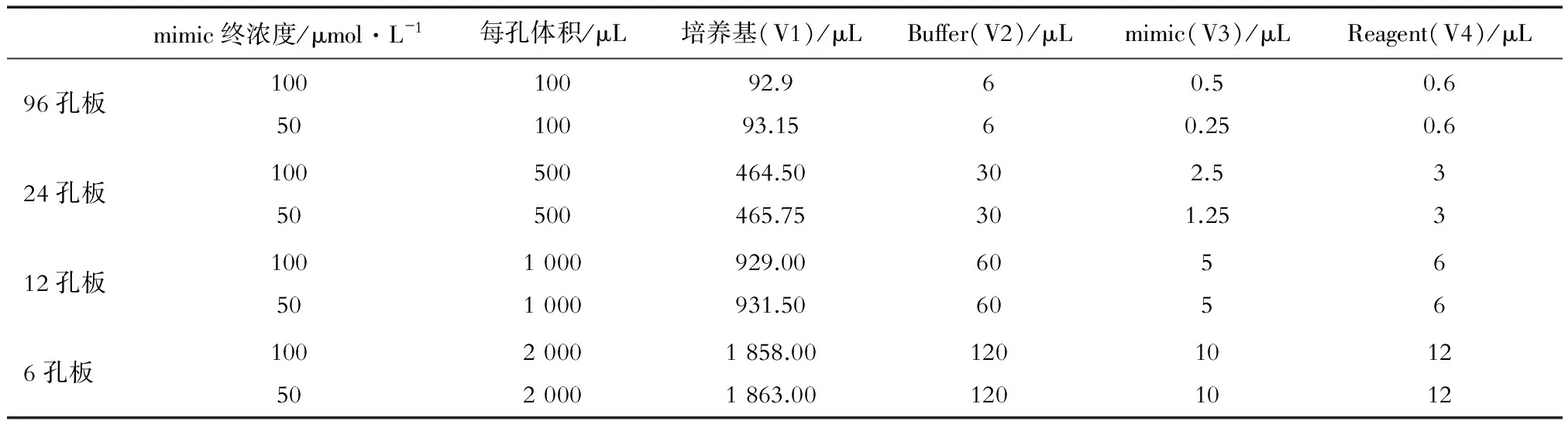
表1 使用riboFECTTM CP转染miRNA mimic参考用量
注:V1 细胞培养基;V2 1X riboFECTTMCP Buffer;V3 20 μmol·L-1miRNA mimic;V4 riboFECTTMCP Reagent
1.2.2 实时定量PCR检测转染效率 用Trizol法分别提取3组细胞的总Small RNA,选U6为内参基因。PCR反应液的组成与用量见表2。PCR循环步骤:(1)预变性 95 ℃ 30 s,1个循环。(2)PCR反应 95 ℃ 5 s,60 ℃ 20 s,40个循环,80 ℃单次检测荧光。(3)溶解曲线分析 95 ℃ 0 s,65 ℃ 15 s,95 ℃ 0 s。采用2-△△Ct法对各样品目的mRNA进行定量分析,△Ct待测样品=Ct待测样品-Ct U6,△Ct对照=Ct对照-Ct U6,△△Ct=△Ct待测样品-△Ct对照。用SPSS 17.0统计学软件分析数据。

表2 PCR反应液的组成与用量
1.2.3 实时定量PCR检测Akt和PDK1 用Trizol法分别提取3组细胞总RNA,以GAPDH为内参,引物长度及序列见表3。RT-PCR反应混合液的组成及用量见表4。PCR循环条件:95 ℃ 10 min;40个PCR循环(95 ℃ 10 s,60 ℃ 60 s)。扩增反应结束后建立PCR产物的熔解曲线:95 ℃ 10 s,60 ℃ 60 s,95 ℃ 15 s。采用2-△△Ct法对各样品目的mRNA进行定量分析,△Ct待测样品=Ct待测样品-Ct GAPDH,△Ct对照=Ct对照-Ct GAPDH,△△Ct=△Ct待测样品-△Ct对照。用SPSS17.0统计学软件分析数据。
1.2.4 Western blot测量Akt和PDK1蛋白含量 用蛋白质抽提试剂分别抽提3组细胞中的蛋白,然后进行SDS-PAGE电泳。按“夹板负极-吸水纸-滤纸-凝胶-PVDF膜-滤纸-吸水纸-夹板正极”顺序在转移装置上装配,4 °C、200 mA恒流,转移2 h。在20 ℃~30 ℃下,5% BSA溶液中把PVDF膜封闭1 h。加入一级抗体后在4 ℃过夜,加入二级抗体后在20 ℃~30 ℃下孵育1 h。在发光试剂中放入PVDF膜,室温下孵育3 min。两塑料薄膜封住PVDF膜,用X光胶片进行曝光。对图片进行扫描,ImageJ分析软件将每个特异条带灰度值数字化。

表3 引物序列与引物长度(大鼠)

表4 RT-PCR反应混合液
1.2.5 流式细胞术检测细胞周期 取HSC-T6细胞接种于6孔板,细胞密度为2.5×106/mL。置于细胞培养箱(5%CO2,37 ℃,饱和湿度)中培养24 h后转染,分为mimic组,NC组和空白对照组,每组至少3个复孔。置于细胞培养箱(5%CO2,37 ℃,饱和湿度)中继续培养48 h。消化细胞后弃上清,用预冷的PBS洗细胞沉淀1次。用100 μL PBS重悬细胞沉淀并加入900 μL预冷70%乙醇,4 ℃固定过夜。染色:离心(1500 rpm,15 min)后去上清,PBS洗细胞沉淀。再次离心(1500 rpm,5 min)后去上清液;加入细胞染色剂RNaseA、PI和PBS共500 uL,使RNaseA终浓度约为40 μg/mL、PI终浓度约为50 μg/mL。4 ℃避光染色30 min。上机:将细胞悬液转移至流式上机管中,上机检测,分别测定细胞在G0、G1、S及G2各期细胞的百分数。
1.2.6 CCK-8检测细胞增殖情况 取HSC-T6细胞接种于96孔板,细胞密度2 000个/孔。置于细胞培养箱(5% CO2,37 ℃,饱和湿度)中培养24 h后转染,分为mimic组、NC组、空白对照组,每组至少设6个复孔。置于细胞培养箱(5% CO2,37 ℃,饱和湿度)中继续培养。分别于接种后24、48和72 h后加入CCK-8试剂:弃去旧培养基,每孔迅速加入100 μL培养基和10 μL CCK-8溶液,置于细胞培养箱(5%CO2,37 ℃,饱和湿度)中继续培养2 h。于酶标仪中检测各组细胞在450 nm波长处的OD值。计算公式如下:细胞增殖抑制率=(空白对照组OD值-mimic组OD值)/空白对照组OD值×100%。
1.2.7 Transwell实验检测细胞迁移情况 取HSC-T6细胞接种于12孔板,细胞密度为1×106/mL,置于细胞培养箱(5%CO2,37 ℃,饱和湿度)中培养24 h后转染,分为mimic组,NC组和空白对照组,每组至少设3个复孔。将细胞置于细胞培养箱(5%CO2,37 ℃,饱和湿度)中继续培养48 h。弃去原有培养基,加入不含血清的培养基,继续培养12 h。消化细胞,去上清,用PBS洗细胞沉淀2遍,用含BSA(0.05%~0.20%)的无血清培养基重悬细胞,使细胞密度为1×106/mL。取细胞悬液150 uL加入至Transwell小室。下室加入含FBS(2.5%)的培养基600 uL。置于细胞培箱(5%CO2,37 ℃,饱和湿度)中继续培养24 h。计数:用棉签轻轻擦去上室内的细胞。染色:甲醇、固定细胞30 min,0.1%结晶紫、染色20 min,清水清洗3遍。将下室倒置在倒置显微镜下,每组细胞在200倍镜下取5个视野进行计数。
1.3 统计学处理
用SPSS 17.0统计学软件分析结果,数据用均数±标准差表示。任意两组间比较采用t检验,方差不齐时采用Kruskal-Wallis检验。P<0.05为差异有统计学意义。
2 结果
2.1 转染效率的检测
RT-PCR检测转染前后HSC-T6细胞中miR-375的含量。结果显示,与未转染的HSC-T6细胞(△Ct为3.6)相比,转染miR-375 mimic后的HSC-T6细胞(△Ct为25.4)中miR-375表达明显升高(转染后48 h,P<0.05),可进行下一步的实验。
2.2 过表达的miR-375对肝纤维化进程的影响
RT-PCR结果显示,转染miR-375 mimic后的细胞中Akt mRNA和PDK1 mRNA浓度明显降低(P<0.05)(见表5)。Western blot结果与RT-PCR结果一致(见图1)。

表5 各组HSC-T6细胞中PDK1 mRNA和Akt mRNA的水平变化

图1 3组HSC-T6细胞中PDK1和Akt蛋白的表达
注:M mimic组;N NC组;O 空白对照组
2.3 过表达的miR-375抑制HSC增殖
于HSC-T6细胞转染后24、48、72 h检测各组细胞的OD值,见表6。转染了miRNA-375 mimic的细胞在24、48、72 h对HSC的抑制率均明显高于NC组,差异有统计学意义(P<0.05),见图2。

表6 各组HSC-T6细胞的OD值

图2 两组HSC-T6细胞的增殖抑制率
2.3 过表达的miR-375使HSC在G0/G1期停滞
HSC-T6细胞转染后48 h,对mimic组、NC组、空白对照组的细胞周期进行检测,结果见表7。与NC组、空白对照组相比,mimic组中停滞在G0/G1期的细胞比例升高,差异有统计学意义(P<0.05),NC组和空白对照组的细胞周期差异无统计学意义(P>0.05),提示提高细胞内miR-375含量可使HSC-T6细胞停滞在G0/G1期的比例升高,抑制细胞周期从G1期向S期转化。

表7 各组HSC-T6细胞停滞在G0/G1期的比例
2.4 过表达的miR-375对HSC迁移的影响
HSC-T6细胞转染后48 h,对mimic组、NC组、空白对照组的穿膜细胞数进行检测。细胞迁移实验结果显示,mimic组、NC组和空白对照组发生迁移的细胞数量差异无统计学意义(P>0.05),见表8。

表8 各组HSC-T6细胞的穿膜细胞数
3 讨论
肝纤维化是肝硬化形成的必经阶段。各种损伤因素的作用导致肝脏受损,肝脏发生肝纤维进行修复,而HSC活化是肝纤维化发生发展的中心环节。有研究表明多种microRNA参与了HSC的增殖、分化和凋亡,从而参与肝纤维化的发生发展[4-10]。Chen等[4]的研究发现miR-335可抑制HSC的活化和迁移、抑制肝纤维化进程,He等[5]的研究发现miR-146a通过调节靶基因SMAD4抑制活化期HSC分裂。Ji等[6]的研究发现miR-27a和miR-27b可使活化期HSC转变为静止期,并可抑制HSC增殖。虢灿杰等[7]利用miRNA基因芯片技术研究发现,在活化期HSC中miR-375表达下调。
PDK1属于AGC激酶家族,可直接作用于细胞内重要的信号转导通路——PI3K/Akt途径,活化的Akt可通过多种途径影响蛋白转录翻译、细胞生长、迁移等生物效应[11-12]。有研究将人HSC(LX-2)和Huh7细胞一起培养24 h,Huh7细胞通过激活PI3K/Akt通路促进HSC的增殖、迁移。很多研究都表明,miR-375可直接靶向作用于PDK1,降低其mRNA和蛋白质的水平[5-6]。
转染miR-375 mimic后,利用qRT-PCR和Western blot技术,发现转染提高HSC内miR-375水平后,PDK1、Akt的mRNA和蛋白水平都明显下降。对HSC进行功能性学实验研究,流式细胞技术检测结果显示,过表达的miR-375使细胞停滞在G0/G1期的比例升高,CCK8实验结果显示过表达的miR-375可抑制细胞增殖,而细胞迁移实验结果显示提高miR-375含量对HSC迁移无影响。有研究发现PDK1是miR-375的靶基因,可直接靶向作用于PDK1,降低其mRNA和蛋白质的水平。由此可见,过表达的miR-375可通过靶向作用于PDK1抑制PI3K/Akt信号通路,抑制HSC增殖,负性调控肝纤维化进程。本研究揭示了miR-375在肝纤维化发生发展中的作用及其部分调控机制。
1 Tacke F, Weiskirchen R. Update on hepatic stellate cells: pathogenic role in liver fibrosis and novel isolation techniques[J]. Expert Rev Gastroenterol Hepatol, 2012, 6: 67-80.
2 Shaer A, Azarpira N, Vahdati A, et al. miR-375 induces human decidua basalis-derived stromal cells to become insulin-producing cells[J]. Cell Mol Biol Lett, 2014, 19: 483-499.
3 Li JS, Yao ZX. MicroRNAs: novel regulators of oligodendrocyte differentiation and potential therapeutic targets in demyelination-related diseases[J]. Mol Neurobiol, 2012, 45: 200-212.
4 Chen C, Wu CQ, Zhang ZQ, et al. Loss of expression of miR-335 is implicated in hepatic stellate cell migration and activation[J]. Exp Cell Res, 2011, 317: 1714-1725.
5 He Y, Huang C, Sun X, et al. MicroRNA-146a modulates TGF-beta1-induced hepatic stellate cell proliferation by targeting SMAD4[J]. Cell Signal, 2012, 24: 1923-1930.
6 Ji J, Zhang J, Huang G, et al. Over-expressed microRNA-27a and 27b influence fat accumulation and cell proliferation during rat hepatic stellate cell activation[J]. FEBS Lett, 2009, 583: 759-766.
7 虢灿杰, 潘勤, 罗声政, 等. MicroRNA在肝星状细胞活化过程中表达差异谱的研究[J]. 胃肠病学和肝病学杂志, 2010, 19: 20-24.
8 Philippe L, Alsaleh G, Suffert G, et al. TLR2 expression is regulated by microRNA miR-19 in rheumatoid fibroblast-like synoviocytes[J]. J Immunol, 2012, 188: 454-461.
9 Zhang ZW, Zhang LQ, Ding L, et al. MicroRNA-19b downregulates insulin 1 through targeting transcription factor NeuroD1[J]. FEBS Lett, 2011, 585: 2592-2598.
10 Mavrakis KJ, Van Der Meulen J, Wolfe AL, et al. A cooperative microRNA-tumor suppressor gene network in acute T-cell lymphoblastic leukemia (T-ALL)[J]. Nat Genet, 2011, 43: 673-678.
11 El Ouaamari A, Baroukh N, Martens GA, et al. miR-375 targets 3′-phosphoinositide-dependent protein kinase-1 and regulates glucose-induced biological responses in pancreatic beta-cells[J]. Diabetes, 2008, 57: 2708-2017.
12 Tsukamoto Y, Nakada C, Noguchi T, et al. MicroRNA-375 is downregulated in gastric carcinomas and regulates cell survival by targeting PDK1 and 14-3-3zeta[J]. Cancer Res, 2010, 70: 2339-2349.
(本文编辑:林磊)
Function and signaling pathway regulated by microRNA-375 in hepatic fibrosis
CHENZheng,LIUXiaofeng,MAShulin.
DepartmentofGastroenterology,GeneralHospitalofJinanMilitaryCommand,Jinan(250000),China
Objective To explore the function and signaling pathway regulated by microRNA-375 (miR-375) in hepatic fibrosis, the expression levels of miR-375 in hepatic stellate cells (HSC) were increased. Methods The miRNA-375 mimic or miRNA-375 mimic negative control (NC) was transduced into the HSC-T6 cell lines. All cells were divided into three groups and designated as the mimic group, the NC group, and the blank control group. The qRT-PCR and western blot were used to test the change of expression levels of Akt and PDK1 gene. The change of HSC-T6 cell cycle, cell proliferation and cell migration were assessed by cell cycle assay, cell proliferation assay and cell migration assay. Results The expression levels of Akt and PDK1 gene in the mimic group were found lower than those of other groups (P<0.05), while the G0/G1 phase fractions and the cell growth inhibition rate of the mimic group were higher than those of other groups (P<0.05). However, there was no significant difference in cell migration of the three groups (P>0.05). Conclusions miRNA-375 suppresses the process of liver fibrosis by inhibiting the proliferation of HSC and arresting the cell cycle of them at the G0/G1 phaseinvitro.
miRNA-375; Hepatic fibrosis; Transfection; Signaling pathway
250000 济南军区总医院消化科
刘晓峰,Email: liuxf0531@126.com
10.3969/j.issn.1673-534X.2016.06.009
2016-06-01)
