BDNF基因与抑郁*
2016-02-01田相娟王美萍
田相娟 王美萍
(山东师范大学心理学院, 济南 250014)
1 引言
抑郁是世界范围内最常见的心理问题。据世界卫生组织统计, 2012年全球范围内共有超过3.5亿人患有抑郁。流行病学的研究显示, 抑郁的终生患病率约为10%~15% (Lépine & Briley, 2011), 女性的患病率约为 10%~30%, 男性约为 7%~15%(Briley & Moret, 2000)。抑郁不仅会增加个体吸烟、物质滥用和肥胖的概率(Thapar, Collishaw, Pine,& Thapar, 2012), 提高个体自杀和死亡的风险, 同时会给家庭和社会造成严重的经济负担(Hashmi,Butt, & Umair, 2013)。基于此, 抑郁的病因学研究得到了心理学、精神病学、流行病学和社会学等领域众多研究者的关注。
迄今, 研究者已经提出了几种有关抑郁发生机制的假说。如多巴胺(dopamine, DA)假说、5-羟色胺(5-hydroxytryptamine, 5-HT)假说、谷氨酸(glutamate, Glu)假说和神经营养因子(neurotrophic factor, NT)假说, 其中神经营养因子假说是较具代表性的一种。该假说认为, 脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)有促进突触生长和维持神经元存活的作用, BDNF的减少会导致大脑相应功能的紊乱进而诱发抑郁,而提高脑内BDNF水平可以起到治疗抑郁的作用(Duman & Monteggia, 2006)。分子遗传学的诸多研究(Elfving et al., 2012; González-Castro et al., 2015)进一步表明, BDNF水平受BDNF基因Val66Met多态性的影响。因此, BDNF基因日益受到研究者的关注, 并成为抑郁遗传基础研究的重要候选基因之一。自21世纪伊始, 研究者已经获得了有关BDNF基因与抑郁关系的较为丰富的研究资料。然而, 通览这些文献资料可以发现, 相关研究结论尚存在分歧甚至相互矛盾。鉴于此, 本文将在回顾与梳理已有研究的基础上, 分析研究结论存在分歧和矛盾的原因, 并对未来的研究方向进行展望, 以期能助益于后续相关研究的开展。
2 BDNF 基因简介
BDNF作为神经营养因子家族中的重要成员,是在脑内合成并在中枢神经系统与外周神经系统均广泛存在和表达的一种蛋白质。BDNF主要通过与高亲和力的酪氨酸激酶受体 B (Tropomyosin-related kinase B, TrkB)结合, 从而刺激和促进神经细胞生长分化, 维持神经细胞存活和正常功能,防止神经元受损死亡。
BDNF基因调控BDNF的表达。人类BDNF基因位于第11号染色体短臂1区3带(11p13), 由11个外显子组成, 其中研究最多的是BDNF基因Val66Met多态性。该多态性是由于编码区第 196个位点上发生了一个由G (鸟嘌呤)到A (腺嘌呤)的错义突变(编码某种氨基酸的密码子经碱基替换以后, 变成编码另一种氨基酸的密码子, 从而使多肽链的氨基酸种类和序列发生改变), 导致其所在密码子对应的氨基酸发生缬氨酸-蛋氨酸(valinemethionine, Val-Met)的置换而产生的。其在单核苷酸多态性数据库(single nucleotide polymorphism database, dbSNP)中的编号为rs6265。有资料显示,BDNF Met等位基因与BDNF的分泌减少和活性降低有关(González-Castro et al., 2015)。
3 BDNF 基因与抑郁关系的研究现状
目前, 抑郁的分子遗传学研究大多考察了5-HT和 DA系统的相关基因与抑郁的关联, 对BDNF基因的研究则起步较晚。文献检索显示, 21世纪初该基因才逐渐引起研究者的关注。早期的相关研究主要考察了BDNF基因与抑郁的直接关联。随着研究的深入, 愈来愈多的研究开始关注环境因素以及其他基因对BDNF基因与抑郁关系的调节作用。但总体而言, 已有研究结论仍存在分歧甚至相互矛盾(详见表1)。
3.1 BDNF 基因对抑郁的直接效应
依据抑郁的神经营养因子假说, 神经可塑性与细胞再生能力的损伤可能是抑郁的病理生理基础, BDNF对神经的结构可塑性和功能可塑性具有调节作用。因此, 编码神经营养因子的 BDNF基因Val66Met多态性可能和抑郁存在密切关联。
迄今为止, 以人类为被试的部分研究显示, Met等位基因是抑郁的风险基因。例如, Hwang等(2006)通过对60岁以上中国汉族被试(110名抑郁患者和171名控制组被试)进行研究发现, 抑郁患者组的Met等位基因频率分布显著高于控制组, 而 Val等位基因频率分布显著低于控制组。与携带Val/Val型基因的个体相比, 携带BDNF Met等位基因(Met/Met型和Val/Met型)的个体患抑郁的风险更高。例如一项对韩国 209名抑郁患者和 101名健康被试(18岁以上)进行的对照研究发现,Val/Met型和Met/Met型基因携带者患抑郁的风险分别是Val/Val型基因携带者的1.67倍和2.58倍(Lee et al., 2013)。此外, Pei等(2012)对以高加索人(3项)和亚洲人(2项)为被试的5项研究进行元分析。结果显示, 与 Val/Val型基因携带者相比,Met等位基因携带者(Met/Met型和Val/Met型)患老年抑郁障碍的风险更高。然而, 也有研究获得了截然相反的结果。例如, Duncan, Hutchison, Carey和Craighead (2009)对189名18~55岁的高加索人进行研究发现, Val/Val型基因与较高水平的抑郁相关。还有研究显示, BDNF基因Val66Met多态性与抑郁无显著关联(Liu et al., 2009; Schumacher et al., 2005)。
简言之, 有关 BDNF基因对抑郁直接效应的研究结论存在明显的分歧, 这表明或许二者的关系还受到环境或其他基因等因素的影响。因此,愈来愈多的研究者开始采用G (gene) × G (gene)和G (gene) × E (environment)研究设计考察BDNF基因对抑郁的影响。
3.2 BDNF 基因与其他基因对抑郁的交互作用
来自神经生物学的证据表明, 5-HT系统和BDNF系统对神经环路的发展和可塑性具有交互作用。BDNF系统与5-HT系统在细胞内和细胞间水平上相互影响, BDNF促进5-HT能神经元的存活和分化, 5-HT转运可以控制BDNF的表达。因而有研究者指出, 5-HT系统基因和BDNF基因可能与抑郁的发生存在交互作用(Comasco, Aslund,Oreland, & Nilsson, 2013; Lee et al., 2014)。目前,研究者主要探查了 5-HT系统的常见候选基因5-HTTLPR对BDNF基因Val66Met多态性与抑郁关联的调节作用。譬如, Lee等(2014)以186名韩国抑郁障碍患者(平均年龄52.14岁)和1032名健康个体为被试(平均年龄24.43岁), 考察了BDNF基因Val66Met多态性、5-HTTLPR基因与抑郁障碍发病年龄的关系。结果表明, 在携带5-HTTLPR S等位基因(S/S型和S/L型)的女性抑郁障碍患者中, BDNF Met等位基因(Met/Met型和Val/Met型)与较晚的发病年龄有关; 而在携带 5-HTTLPR L/L型基因的女性患者中, Val等位基因(Val/Val型和Val/Met型)则与较晚的发病年龄有关。这表明BDNF基因不是独立地影响抑郁障碍的发病年龄,而是与 5-HTTLPR基因存在交互作用, 且这种交互作用具有性别差异。Grabe等(2012)通过对4308名20~70岁的高加索人进行了为期5年的追踪研究发现, 同时携带 5-HTTLPR S/S型和 BDNF Val/Val型基因的个体罹患抑郁障碍的风险最高。
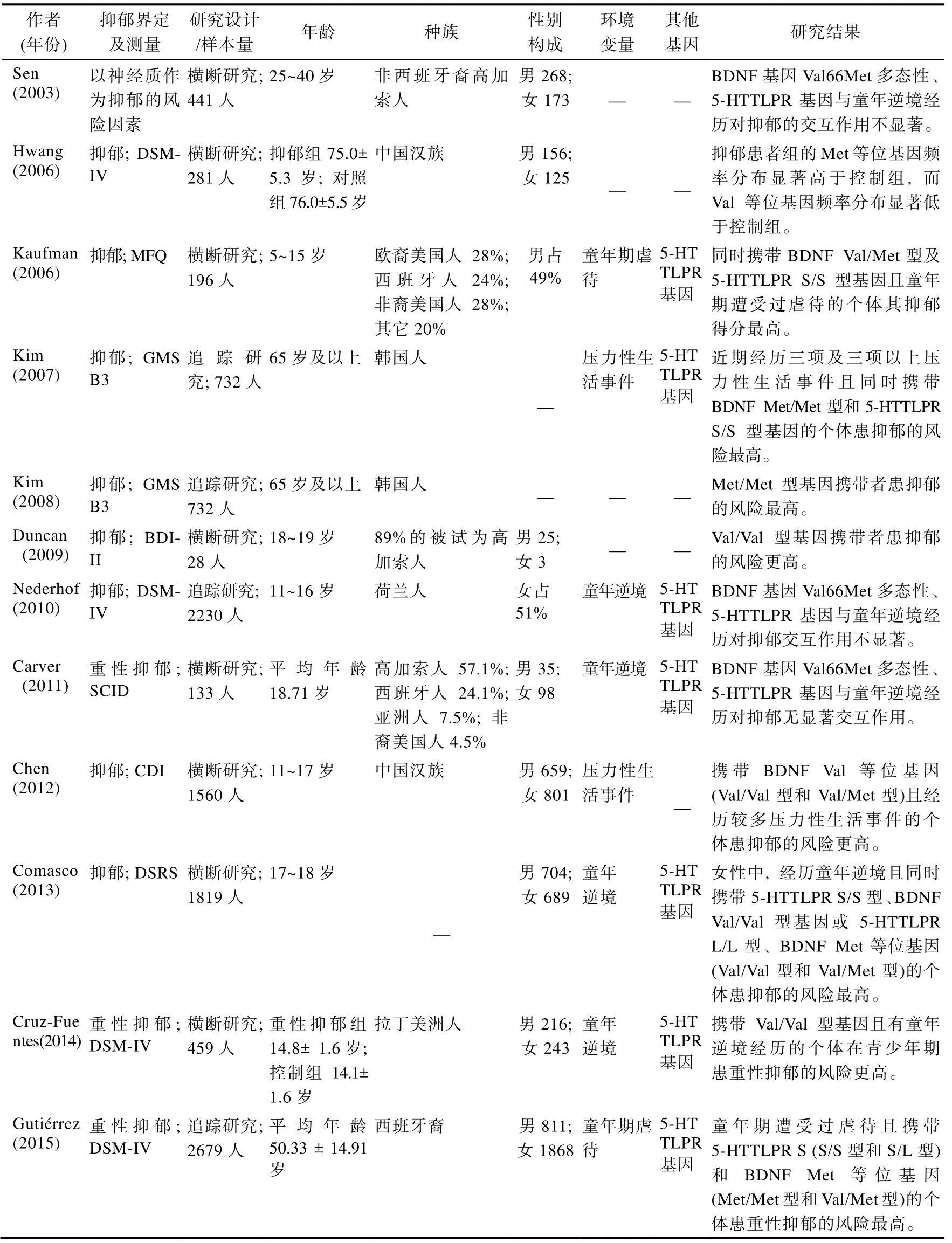
表1 BDNF 基因与抑郁的关系
此外, 少数研究关注了 BDNF信号传导通路关键节点基因, 如GSK3B基因(Yang et al., 2010)、FKBP5 基因(Lavebratt, Aberg, Sjöholm, & Forsell,2010), 以及BDNF基因C-218A多态性(Suchanek,Owczarek, Kowalczyk, Kucia, & Kowalski, 2011)与BDNF基因Val66Met多态性对抑郁的影响, 结果显示交互作用显著。譬如, Suchanek等人(2011)以波兰高加索人中 116名重性抑郁住院病人和218名健康个体(平均年龄 54.13±9.7岁)为被试进行病例–对照研究, 考察 BDNF基因 C-218A(rs28383487)多态性与BDNF基因Val66Met多态性对重性抑郁的交互作用。结果显示, 同时携带BDNF C/C型和Val/Val型基因的个体患重性抑郁的风险最高。
迄今, 考察其他基因与 BDNF基因对抑郁的联合作用的研究仍然较为鲜见, 据我们所知不超过10项, 且主要集中于5-HT系统基因。已有研究表明, 多巴胺系统(Ludmer et al., 2015; Zhang et al.,2015)和乙酰胆碱系统(Jeon, Dean, Scarr, & Gibbons,2015; 王美萍, 张文新, 2010)基因也是抑郁的重要候选基因, 与抑郁的发生存在显著关联。然而,关于这些递质系统的基因是否也对BDNF基因与抑郁的关系起调节作用, 如何起调节作用的问题仍有待考察。
3.3 BDNF 基因与环境对抑郁的交互作用
通过梳理BDNF基因Val66Met多态性与环境对抑郁的交互作用研究, 不难发现此类研究大致可划分为两种模式:单基因–环境设计和多基因–环境设计。其中环境指标多采用父母教养、压力性生活事件和童年虐待等微系统或者近端环境变量。
3.3.1 单基因–环境设计研究
采用单基因–环境设计考察 BDNF基因Val66Met多态性与抑郁关联的研究约起始于2009年, 至今已有20多项研究成果。例如, 张璠、陈杰和李新影(2015)以838对11~17岁的中国汉族双胞胎为被试, 考察了BDNF基因Val66Met多态性与温暖的教养方式对青少年抑郁的影响。结果表明, 在较高水平的母亲温暖教养环境下, Val等位基因(Val/Val型和 Val/Met型)携带者表现出较低的抑郁水平; 在较低水平的母亲温暖教养环境下, 则表现出较高的抑郁水平。然而, 也有少数研究获得了与上述研究不一致的结论。如 Gatt等(2009)的研究发现在那些经历过早期生活压力的个体中, Met等位基因(Met/Met型和 Val/Met型)携带者患抑郁的风险高于Val/Val型基因携带者。由此可见, 单基因–环境对抑郁的交互作用研究结论尚存在分歧。此外, 迄今所发现的单基因的效应非常微弱, 通常不足2%。抑郁的发生可能受到多种基因与环境的影响, 因此多基因–环境研究设计日益受到研究者的青睐。
3.3.2 多基因–环境设计研究
作为一种新兴的研究范式, 多基因–环境研究设计能够同时考察某一或某几种神经生物系统的多个基因位点的联合效应与环境因素对抑郁的影响(Mullins et al., 2016)。可以预期, 该研究范式将成为未来抑郁分子遗传学研究中的必然趋势。时至今日, 该领域的研究主要考察了BDNF基因、5-HTTLPR基因与近端消极环境因素对抑郁的交互作用。例如, Kim等(2007)选取了732位韩国老年人(65岁及以上)为被试, 并对其中的 521人进行了两年半的追踪研究。结果显示, 近期经历三项及三项以上压力性生活事件, 且同时携带BDNF Met/Met型和5-HTTLPR S/S型基因的个体患抑郁的风险最高。Wichers等(2008)以 621名18~46岁的白种女性为被试进行研究。结果显示,同时携带 BDNF Met等位基因(Met/Met型和Val/Met型)和5-HTTLPR S/L型基因, 且经历过童年逆境的个体其抑郁得分最高。此外, 亦有研究获得了不同的研究发现。譬如, Nederhof, Bouma,Oldehinkel和 Ormel (2010)以 2230名 11~16岁的荷兰儿童为被试进行追踪研究。结果表明, BDNF基因Val66Met多态性、5-HTTLPR基因和童年逆境经历对个体抑郁的发生没有显著交互作用。由此可见, 采用多基因–环境设计考察BDNF基因对抑郁影响的研究结论也存在分歧。而且该领域研究尚未考察积极环境因素对BDNF基因与其他基因效应的调节作用及其模式。
3.4 研究结论存在分歧的可能原因
如前所述, 目前有关 BDNF基因与抑郁关系的研究结论尚存在分歧。这可能源于不同研究在研究设计、环境指标和抑郁的测量、被试种族、性别构成和年龄等方面的差异。
(1)研究设计方面的差异。早期的相关研究主要考察了 BDNF基因与抑郁的直接关联, 且发现了基因的主效应, 但当把其他基因或环境变量纳入抑郁的发生机制进行考察时, 结果却显示BDNF基因对抑郁的主效应不再显著或仅边缘显著。此外, 采用不同的研究设计, 所获得的关于风险或者易感基因的结论也往往不同。例如, 直接考察BDNF基因Val66Met多态性与抑郁关联的绝大多数研究结果表明, Met等位基因是抑郁的风险基因(如Lee et al., 2013; Pei et al., 2012)。采用基因–环境设计的研究却发现, Val等位基因可能是抑郁的易感基因(如Zhang et al., 2016; 张璠等, 2015),即个体在积极教养环境下表现出较低的抑郁水平,在消极教养环境下则表现出较高的抑郁水平。
(2)环境指标测量方面的差异。梳理已有相关研究文献可以发现, 考察 BDNF基因与环境因素对抑郁交互作用的研究时所选择的环境指标往往存在差异。有些选取童年早期消极环境经历(童年逆境、童年虐待), 有些则选取近期压力性生活事件, 这可能是导致已有研究结论存在分歧的另一重要原因。譬如Jiang, Brummett, Babyak, Siegler和 Williams (2013)以个体正在经历的压力性事件作为环境指标, 考察其与 BDNF 基因 Val66Met多态性对抑郁的交互作用。结果表明, Val/Val型基因携带者的抑郁水平高于 Met等位基因(Met/Met型和 Val/Met型)携带者。Gatt等(2009)对被试的早期生活压力进行测量得出了相反的结论, 即Met等位基因(Met/Met型和Val/Met型)携带者患抑郁的风险高于Val/Val型基因携带者。
(3)抑郁测量方面的差异。根据严重程度抑郁可分为3种类型:抑郁情绪(depression mood)、抑郁综合征(depressive syndromes)和抑郁障碍(depressive disorder) (Compas, Ey, & Grant, 1993)。抑郁障碍即抑郁症又可进一步分为轻、中、重度三种类型。不同研究所选用的测量工具往往不同, 因而所测量的抑郁类型也存在差异, 这可能也是导致已有研究结论存在分歧的原因之一。例如, Liu等(2009)依据 DSM-Ⅳ的诊断标准筛选重性抑郁被试进行考察, 结果表明BDNF基因Val66Met多态性与抑郁无显著关联。Duncan等(2009)采用贝克抑郁量表(BDI-II)对被试抑郁情绪、抑郁综合征和抑郁障碍同时进行测评, 结果表明Val/Val型基因携带者患抑郁的风险更高。
(4)研究对象种族背景的差异。BDNF基因Val66Met多态性的频率分布存在种族差异, 高加索人、亚洲人的 Met等位基因频率分别约为25%~31%和 40%~50%, 这可能是导致已有研究结论存在分歧的另一原因。例如, Chen, Li和McGue (2013)以中国汉族人为被试, 考察 BDNF基因 Val66Met多态性与抑郁的关联。结果显示,Val等位基因携带者(Val/Val型和Val/Met型)更容易受到压力性生活事件的影响而表现出更高的抑郁水平。Gatt等(2009)以高加索人为被试进行的研究则发现, 携带 Met等位基因(Met/Met型和Val/Met型)的个体在经历压力性生活事件后患抑郁的风险更高。这表明在考察BDNF基因与抑郁的关系时, 应充分考虑种族因素的影响。然而, 迄今尚未有研究对此问题进行深入探查。
(5)被试性别构成的差异。荷尔蒙分泌会影响基因的表达, 例如, 雌性激素可以调节中脑中基因的表达。这表明性别因素可能干扰研究结果的一致性。然而, 已有研究中被试性别的构成往往存在差异。有些研究的被试男女比例均衡, 如Gujral, Manuck, Ferrell, Flory 和 Erickson (2014)以525名男性和547名女性为被试, 考察BDNF基因Val66Met多态性与抑郁的关系。结果表明, 男性被试中Met等位基因(Met/Met型和Val/Met型)携带者比 Val/Val型基因携带者患抑郁的风险更高,在女性被试中二者无显著关联。有些研究则男女比例失衡, 如 Duncan等(2009)以 25名男性和 3名女性为被试进行研究, 结果表明Val/Val型基因与更高的抑郁风险相关。
(6)被试年龄的差异。有研究者曾指出, 在个体不同的发展阶段BDNF的水平与功能表现出差异性, 因此会导致不同的行为结果(Perea, Paternina,Gomez, & Lattig, 2012)。因此, 研究所选取被试的年龄阶段不同, 研究结果也可能存在差异。例如,Kaufman等(2006)以平均年龄为9.3岁的儿童为被试进行研究, 结果显示同时携带BDNF Val/Met型及5-HTTLPR S/S型基因且童年期遭受过虐待的个体其抑郁得分最高。Nederhof等(2010)以11~16岁的青少年为被试进行研究, 结果表明 BDNF基因Val66Met多态性、5-HTTLPR基因与童年逆境对抑郁没有显著交互作用。
4 研究展望
抑郁具有复杂的遗传基础, 尽管已有研究结论仍存在分歧甚至相互矛盾, 但它们为我们开展后续研究提供了重要的和有价值的参考与启示,未来研究应该更加关注以下几个方面:
(1)多基因–环境研究设计。愈来愈多的资料显示抑郁具有复杂的发病机制, 并非像苯丙酮尿症等单基因遗传疾病一样存在简洁清晰的遗传模式,个体抑郁的发生发展依赖于基因与环境以及基因与基因间复杂的交互作用。因而未来研究应同时选择多个重要候选基因, 考察其与环境因素对抑郁的复杂作用机制。此外, 目前有关 BDNF基因与环境对抑郁交互作用的研究主要是以素质–压力模型(diathesis-stress model)为理论基础, 考察的是童年逆境、压力性生活事件等消极环境因素对BDNF基因与抑郁关系的调节作用。然而, 根据新近兴起的不同易感性模型(differential susceptibility model)和优势反应敏感性模型(vantage sensitivity model), 消极环境因素的缺失并非等同于积极环境因素的存在, 那些在消极环境条件下发展不良的个体, 可能在积极环境条件下会表现出更少的问题或者发展良好。因而, 为了更科学而深入地揭示 BDNF基因与环境对抑郁的交互作用机制,未来研究中应同时测评个体成长的积极与消极环境。此外, 根据布朗芬布伦纳的发展生态系统理论的观点(Bronfenbrenner, 1979), 已有研究的环境指标主要为微观系统中的风险因素。而有关其他环境因素, 譬如同伴关系、父母社会支持、社区环境和社会价值观念(如集体主义与个体主义)等的研究亟待加强。
(2)重视被试种族、性别构成和年龄的调节作用。如前所述, 被试种族、性别构成以及年龄的差异可能是导致已有关于 BDNF基因 Val66Met多态性与抑郁关系的研究结果不一致的原因(见表1)。今后可以开展跨文化研究, 专门考察BDNF基因 Val66Met多态性与抑郁关系的种族差异及其表现; 选取不同年龄阶段的个体或者采用纵向设计深入探究二者关系随个体年龄增长的发展变化性或者稳定性; 同时, 在选取研究样本时应注意男女比例的均衡性。
(3)探究BDNF基因作用于抑郁的机制。尽管有较为丰富的资料显示, BDNF基因与抑郁的发生存在密切关联。然而, 迄今为止我们对其作用机制仍知之甚少。值得庆幸的是, 少量采用影像遗传学技术探查BDNF基因与抑郁相关脑区结构与功能的关联研究为我们提供了启示。例如, 有研究表明与Val/Val型基因携带者相比, 携带Met等位基因(Met/Met型和 Val/Met型)的个体, 其海马神经元突触复杂性较低、突触可塑性较差(Chen et al., 2004; Egan et al., 2003; MacQueen & Frodl,2011), 前额叶皮质部分区域、右侧杏仁核体积以及海马体积较小(Montag, Weber, Fliessbach, Elger,& Reuter, 2009)。而杏仁核和梭状回等脑区的过度激活, 以及前额叶皮质、前扣带回等脑区活性不足与抑郁症患者的情绪加工和认知控制功能有关(廖成菊, 冯正直, 2010; 刘耀中等, 2015)。此外,还有研究发现, 相较于 Val/Val型基因携带者,Val/Met型和Met/Met型基因携带者的工作记忆得分较低(Miyajima et al., 2008; Rybakowski et al.,2006), 而工作记忆是遗传因素作用于抑郁的一个关键的中间表型(陈楚侨, 杨斌让, 王亚, 2008)。
综合这些已有的研究发现, 我们推断 BDNF基因影响抑郁的机制可能是:BDNF基因Val66Met多态性通过复杂的分子机制导致大脑的情绪调节和认知加工的关键脑区(如海马和前额叶皮质)的形态结构发生改变, 进而引起这些区域神经可塑性及功能的改变, 影响个体对外界环境刺激的情绪和认知加工功能, 继而作用于抑郁。目前尚无研究直接考察“BDNF基因–脑–抑郁”的作用通路。未来研究可凭借影像遗传学技术, 重点考察BDNF基因是如何通过作用于大脑相关区域而影响抑郁的。然后在获得较为可靠结论的基础上,进一步引入归因方式、认知加工偏向、情绪刺激的偏差加工和面孔表情反应等心理变量, 深入探查BDNF基因是如何通过作用于大脑神经系统而改变个体情绪和认知加工功能, 进而影响个体抑郁的。
5 小结
BDNF基因是抑郁遗传基础研究的重要候选基因。鉴于研究设计、测量方法、被试群体等方面的差异, 已有关于 BDNF基因与抑郁关系的研究结论仍存在分歧。目前也未有研究考察 BDNF基因与环境作用于抑郁的具体神经生物机制。多基因–环境设计与影像遗传学技术手段的运用等,能够有力推进抑郁发生机制的研究。
陈楚侨, 杨斌让, 王亚. (2008). 内表型方法在精神疾病研究中的应用.心理科学进展, 16(3), 378–391.
廖成菊, 冯正直. (2010). 抑郁症情绪加工与认知控制的脑机制.心理科学进展, 18(2), 282–287.
刘耀中, 柳昀哲, 林碗君, 何振宏, 张丹丹, 关青, 罗跃嘉.(2015). 抑郁障碍的核心脑机制—基于 fMRI元分析的证据.中国科学: 生命科学, 45(12), 1214–1223.
王美萍, 张文新. (2010). CHRM2基因rs1824024多态性与青少年早期抑郁的关系.心理学报, 42(8), 853–861.
张璠, 陈杰, 李新影. (2015). BDNF Val66Met基因多态性和温暖的教养方式对青少年抑郁的影响.中国临床心理学杂志, 23(1), 52–55.
Briley, M., & Moret, C. (2000). Present and future anxiolytics.IDrugs: The Investigational Drugs Journal, 3(7), 695–699.
Bronfenbrenner, U. (1979).The ecology of human development:Experiments by nature and design. Cambridge, MA:Harvard University Press.
Carver, C. S., Johnson, S. L., Joormann, J., LeMoult, J., & Cuccaro,M. L. (2011). Childhood adversity interacts separately with 5-HTTLPR and BDNF to predict lifetime depression diagnosis.Journal of Affective Disorders,132(1-2), 89–93.
Chen, J., Li, X., & McGue, M. (2012). Interacting effect of BDNF Val66Met polymorphism and stressful life events on adolescent depression.Genes, Brain and Behavior,11(8), 958–965.
Chen, J., Li, X. Y., & McGue, M. (2013). The interacting effect of the BDNF Val66Met polymorphism and stressful life events on adolescent depression is not an artifact of gene-environment correlation: Evidence from a longitudinal twin study.Journal of Child Psychology and Psychiatry,54(10), 1066–1073.
Chen, Z. Y., Patel, P. D., Sant, G., Meng, C. X., Teng, K. K.,Hempstead, B. L., & Lee, F. S. (2004). Variant brain- derived neurotrophic factor (BDNF) (Met66) alters the intracellular trafficking and activity-dependent secretion of wild-type BDNF in neurosecretory cells and cortical neurons.The Journal of Neuroscience, 24(18), 4401–4411.
Comasco, E., Aslund, C., Oreland, L., & Nilsson, K. W. (2013).Three-way interaction effect of 5-HTTLPR, BDNF Val66Met,and childhood adversity on depression: A replication study.European Neuropsychopharmacology, 23(10), 1300–1306.
Compas, B. E., Ey, S., & Grant, K. E. (1993). Taxonomy,assessment, and diagnosis of depression during adolescence.Psychological Bulletin, 114(2), 323–344.
Cruz-Fuentes, C. S., Benjet, C., Martínez-Levy, G. A., Pérez-Molina, A., Briones-Velasco, M., & Suárez-González, J.(2014). BDNF Met66 modulates the cumulative effect of psychosocial childhood adversities on major depression in adolescents.Brain and Behavior, 4(2), 290–297.
Duman, R. S., & Monteggia, L. M. (2006). A neurotrophic model for stress-related mood disorders.Biological Psychiatry, 59(12), 1116–1127.
Duncan, L. E., Hutchison, K. E., Carey, G., & Craighead, W.E. (2009). Variation in brain-derived neurotrophic factor(BDNF) gene is associated with symptoms of depression.Journal of Affective Disorders, 115(1-2), 215–219.
Egan, M. F., Kojima, M., Callicott, J. H., Goldberg, T. E.,Kolachana, B. S., Bertolino, A., ... Weinberger, D. R.(2003). The BDNF val66met polymorphism affects activitydependent secretion of BDNF and human memory and hippocampal function.Cell, 112(2), 257–269.
Elfving, B., Buttenschøn, H. N., Foldager, L., Poulsen, P. H.P., Andersen, J. H., Grynderup, M. B., ... Mors, O. (2012).Depression, the Val66Met polymorphism, age, and gender influence the serum BDNF level.Journal of Psychiatric Research, 46(9), 1118–1125.
Gatt, J. M., Nemeroff, C. B., Dobson-Stone, C., Paul, R. H.,Bryant, R. A., Schofield, P. R., ... Williams, L. M. (2009).Interactions between BDNF Val66Met polymorphism and early life stress predict brain and arousal pathways to syndromal depression and anxiety.Molecular Psychiatry,14(7), 681–695.
González-Castro, T. B., Nicolini, H., Lanzagorta, N., López-Narváez, L., Genis, A., Pool García, S., & Tovilla-Zárate,C. A. (2015). The role of brain-derived neurotrophic factor(BDNF) Val66Met genetic polymorphism in bipolar disorder: A case-control study, comorbidities, and metaanalysis of 16,786 subjects.Bipolar Disorders, 17(1), 27–38.
Grabe, H. J., Schwahn, C., Mahler, J., Appel, K., Schulz, A.,Spitzer, C., ... Völzke, H. (2012). Genetic epistasis between the brain-derived neurotrophic factor Val66Met polymorphism and the 5-HTT promoter polymorphism moderates the susceptibility to depressive disorders after childhood abuse.Progress in Neuro-Psychopharmacology and Biological Psychiatry, 36(2), 264–270.
Gujral, S., Manuck, S. B., Ferrell, R. E., Flory, J. D., & Erickson,K. I. (2014). The BDNF Val66Met polymorphism does not moderate the effect of self-reported physical activity on depressive symptoms in midlife.Psychiatry Research,218(1-2), 93–97.
Gutiérrez, B., Bellón, J. Á., Rivera, M., Molina, E., King, M.,Marston, L., ... Cervilla, J. (2015). The risk for major depression conferred by childhood maltreatment is multiplied by BDNF and SERT genetic vulnerability: A replication study.Journal of Psychiatry & Neuroscience,40(3), 187–196.
Hashmi, A. M., Butt, Z., & Umair, M. (2013). Is depression an inflammatory condition? A review of available evidence.Journal of the Pakistan Medical Association, 63(7),899–906.
Hwang, J. P., Tsai, S. J., Hong, C. J., Yang, C. H., Lirng, J. F.,& Yang, Y. M. (2006). The Val66Met polymorphism of the brain-derived neurotrophic-factor gene is associated with geriatric depression.Neurobiology of Aging, 27(12),1834–1837.
Jeon, W. J., Dean, B., Scarr, E., & Gibbons, A. (2015). The role of muscarinic receptors in the pathophysiology of mood disorders: A potential noveltreatment?.Current Neuropharmacology, 13(6), 739–749.
Jiang, R., Brummett, B. H., Babyak, M. A., Siegler, I. C., &Williams, R. B. (2013). Brain-derived neurotrophic factor(BDNF) Val66Met and adulthood chronic stress interact to affect depressive symptoms.Journal of Psychiatric Research, 47(2), 233–239.
Kaufman, J., Yang, B. Z., Douglas-Palumberi, H., Grasso, D.,Lipschitz, D., Houshyar, S., ... Gelernter, J. (2006). Brainderived neurotrophic factor-5-HTTLPR gene interactions and environmental modifiers of depression in children.Biological Psychiatry, 59(8), 673–680.
Kim, J. M., Stewart, R., Kim, S. W., Yang, S. J., Shin, I. S., Kim,Y. H., & Yoon, J. S. (2007). Interactions between life stressors and susceptibility genes (5-HTTLPR and BDNF)on depression in Korean elders.Biological Psychiatry,62(5), 423–428.
Kim, J. M., Stewart, R., Kim, S. W., Yang, S. J., Shin, I. S., Kim,Y. H., & Yoon, J. S. (2008). BDNF genotype potentially modifying the association between incident stroke and depression.Neurobiology of Aging, 29(5), 789–792.
Lavebratt, C., Aberg, E., Sjöholm, L. K., & Forsell, Y. (2010).Variations in FKBP5 and BDNF genes are suggestively associated with depression in a Swedish population-based cohort.Journal of Affective Disorders,125(1-3), 249–255.
Lee, K. Y., Jeong, S. H., Kim, S. H., Ahn, Y. M., Kim, Y. S.,Jung, H. Y., ... Joo, E. J. (2014). Genetic role of BDNF Val66Met and 5-HTTLPR polymorphisms on depressive disorder.Psychiatry Investigation,11(2), 192–199.
Lee, Y., Lim, S. W., Kim, S. Y., Chung, J. W., Kim, J.,Myung, W., ... Kim, D. K. (2013). Association between the BDNF Val66Met polymorphism and chronicity of depression.Psychiatry Investigation, 10(1), 56–61.
Lépine, J. P., & Briley, M. (2011). The increasing burden of depression.Neuropsychiatric Disease and Treatment,7(Suppl 1), 3–7.
Liu, X. H., Xu, Y. F., Jiang, S. D., Cui, D. H., Qian, Y. P., & Jiang,K. D. (2009). Family-based association study between brain-derived neurotrophic factor gene and major depressive disorder of Chinese descent.Psychiatry Research, 169(2),169–172.
Ludmer, J. A., Levitan, R., Gonzalez, A., Kennedy, J., Villani,V., Masellis, M., ... Atkinson, L. (2015).DRD2andSLC6A3moderate impact of maternal depressive symptoms on infant cortisol.Psychoneuroendocrinology, 62, 243–251.
MacQueen, G., & Frodl, T. (2011). The hippocampus in major depression: Evidence for the convergence of the bench and bedside in psychiatric research?.Molecular Psychiatry,16(3), 252–264.
Miyajima, F., Ollier, W., Mayes, A., Jackson, A., Thacker, N.,Rabbitt, P., ... Payton, A. (2008). Brain-derived neurotrophic factor polymorphism Val66Met influences cognitive abilities in the elderly.Genes, Brain and Behavior,7(4),411–417.
Montag, C., Weber, B., Fliessbach, K., Elger, C., & Reuter,M. (2009). The BDNF Val66Met polymorphism impacts parahippocampal and amygdala volume in healthy humans:Incremental support for a genetic risk factor for depression.Psychological Medicine, 39(11), 1831–1839.
Mullins, N., Power, R. A., Fisher, H. L., Hanscombe, K. B.,Euesden, J., Iniesta, R., ... Lewis, C. M. (2016). Polygenic interactions with environmental adversity in the aetiology of major depressive disorder.Psychological Medicine,46(4), 759–770.
Nederhof, E., Bouma, E. M. C., Oldehinkel, A. J., & Ormel,J. (2010). Interaction between childhood adversity,brain-derived neurotrophic factorval/metand serotonin transporter promoter polymorphism on depression: The TRAILS study.Biological Psychiatry, 68(2), 209–212.
Pei, Y., Smith, A. K., Wang, Y. J., Pan, Y. L., Yang, J., Chen,Q., ... Ma, X. (2012). The brain-derived neurotrophicfactor (BDNF) val66met polymorphism is associated with geriatric depression: A meta-analysis.American Journal of Medical Genetics Part B: Neuropsychiatric Genetics,159B(5), 560–566.
Perea, C. S., Paternina, A. C., Gomez, Y., & Lattig, M. C.(2012). Negative affectivity moderated by BDNF and stress response.Journal of Affective Disorders, 136(3),767–774.
Rybakowski, J. K., Borkowska, A., Skibinska, M., Szczepankiewicz,A., Kapelski, P., Leszczynska-Rodziewicz, A., ... Hauser, J.(2006). Prefrontal cognition in schizophrenia and bipolar illness in relation to Val66Met polymorphism of the brain-derived neurotrophic factor gene.Psychiatry and Clinical Neurosciences, 60(1), 70–76.
Schumacher, J., Jamra, R. A., Becker, T., Ohlraun, S., Klopp,N., Binder, E. B., ... Cichon, S. (2005). Evidence for a relationship between genetic variants at the brain-derived neurotrophic factor (BDNF) locus and major depression.Biological Psychiatry, 58(4), 307–314.
Sen, S., Nesse, R. M., Stoltenberg, S. F., Li, S., Gleiberman,L., Chakravarti, A., ... Burmeister, M. (2003). A BDNF coding variant is associated with the NEO personality inventory domain neuroticism, a risk factor for depression.Neuropsychopharmacology, 28(2), 397–401.
Suchanek, R., Owczarek, A., Kowalczyk, M., Kucia, K., &Kowalski, J. (2011). Association between C-281A and val66met functional polymorphisms of BDNF gene and risk of recurrent major depressive disorder in Polish population.Journal of Molecular Neuroscience,43(3),524–530.
Thapar, A., Collishaw, S., Pine, D. S., & Thapar, A. K.(2012). Depression in adolescence.The Lancet, 379(9820),1056–1067.
Wichers, M., Kenis, G., Jacobs, N., Mengelers, R., Derom, C.,Vlietinck, R., & van Os, J. (2008). The BDNF Val66Met ×5-HTTLPR × child adversity interaction and depressive symptoms: An attempt at replication.American Journal of Medical Genetics Part B: Neuropsychiatric Genetics,147B(1), 120–123.
Yang, C. X., Xu, Y., Sun, N., Ren, Y., Liu, Z. F., Cao, X. H.,& Zhang, K. R. (2010). The combined effects of the BDNF and GSK3B genes modulate the relationship between negative life events and major depressive disorder.Brain Research, 1355, 1–6.
Zhang, L. L., Li, Z., Chen, J., Li, X. Y., Zhang, J. X., &Belsky, J. (2016). The BDNF Val66Met polymorphism interacts with maternal parenting influencing adolescent depressive symptoms: Evidence of differential susceptibility model.Journal of Youth and Adolescence, 45(3), 471–483.
Zhang, W. X., Cao, Y. M., Wang, M. P., Ji, L. Q., Chen, L., &Deater-Deckard, K. (2015). The dopamine D2 receptor polymorphism (DRD2 TaqIA) interacts with maternal parenting in predicting early adolescent depressive symptoms: Evidence of differential susceptibility and age differences.Journal of Youth and Adolescence, 44(7),1428–1440.
