糖代谢异常对大鼠肝脏组织中巨噬细胞移动抑制因子及C-Jun氨基端激酶表达水平的影响
2016-01-28樊林花刘建新李丹卫兵艳刘茂林王春芳刘田福
樊林花,刘建新,李丹,卫兵艳,刘茂林,王春芳,刘田福
(1.山西医科大学实验动物中心,实验动物和人类疾病动物模型山西省重点实验室,太原 030001;
2.山西省一0九医院,太原 030006;3.山西医科大学第二医院肿瘤生物治疗科,太原 030001)
糖代谢异常对大鼠肝脏组织中巨噬细胞移动抑制因子及C-Jun氨基端激酶表达水平的影响
樊林花1,刘建新2*,李丹3,卫兵艳1,刘茂林1,王春芳1,刘田福1
(1.山西医科大学实验动物中心,实验动物和人类疾病动物模型山西省重点实验室,太原030001;
2.山西省一0九医院,太原030006;3.山西医科大学第二医院肿瘤生物治疗科,太原030001)
【摘要】目的观察巨噬细胞移动抑制因子(MIF)和C-Jun氨基端激酶(JNK)在糖代谢异常大鼠肝脏组织中表达水平的变化,探讨糖代谢异常合并非酒精性脂肪肝(NAFLD)的病理机制。方法 将60只大鼠随机分为糖耐量受损(IGT)模型组(n=20)、2型糖尿病(T2DM)模型组(n=20)、IGT对照组(n=10)及T2DM对照组(n=10),高脂饲料喂养复制IGT大鼠模型,高脂饲料喂养加腹腔注射小剂量链脲佐菌素(STZ)制备T2DM大鼠模型,采用TUNEL法检测各组大鼠肝脏细胞凋亡;实时荧光PCR 技术检测肝脏组织中MIF mRNA的表达; Western blot方法检测肝脏组织中MIF、caspase-3、JNK蛋白表达及磷酸化JNK(p-JNK)的表达。结果IGT大鼠及T2DM大鼠肝组织凋亡细胞明显增多;IGT组和T2DM组肝组织MIF基因表达较各自对照组明升高(P<0.01),MIF、caspase-3、JNK蛋白表达及JNK磷酸化水平也明显升高(P<0.05或P<0.01);与IGT组相比,T2DM组caspase-3、MIF、JNK蛋白表达水平明显降低(P<0.01),而JNK磷酸化水平是明显升高(P<0.01)。结论糖代谢异常合并非酒精性脂肪肝的发生可能与MIF、caspase-3、JNK表达水平的升高及JNK磷酸化水平的增强有关。
【关键词】巨噬细胞移动抑制因子;C-Jun氨基端激酶; Caspase-3;糖耐量受损;2型糖尿病
糖代谢异常往往伴随脂代谢紊乱,而游离脂肪酸是一种细胞毒性物质,若肝细胞摄取过多,成脂性转化的肝细胞会分泌多种细胞因子,导致肝细胞脂肪浸润及微环境炎性反应[1],在众多细胞因子中,巨噬细胞移动抑制因子(MIF)是一个重要的促炎因子,在胰岛素抵抗(IR)和糖尿病等疾病的发生和发展中及其并发症发病机制中起关键作用[2], MIF通过与CD74/CD44复合物结合,直接激活丝裂原活化蛋白激酶(MAPK)通路[3],其中C-Jun氨基端激酶(JNK)是MAPK家族中一个重要成员,与细胞凋亡和慢性炎症相关[4]。在高糖压力下,心肌细胞中存在MIF表达增加和JNK的激活[5]。然而高糖高脂条件下,肝细胞内 MIF和JNK是否激活,与肝细胞凋亡是否有一定的联系,还需进一步研究。本实验室前期研究表明,在不同糖代谢异常状态下,大鼠出现不同程度的脂肪肝,因此本次实验是在前期研究的基础上,探讨糖代谢异常合并非酒精性脂肪肝可能的病理机制。
1材料与方法
1.1实验动物
清洁级60只雄性SD大鼠, 体重(190±20)g,来源于山西医科大学实验动物中心【SCXY(晋)2009-0001】,饲养于本中心屏障环境动物实验设施内【SYXY(晋)2009-0004】。
1.2主要仪器与试剂
Sigma公司3-18K型高速冷冻离心机,ABI 7300型荧光定量PCR仪;Bio-Rad垂直电泳仪。蛋白提取试剂盒及BCA蛋白定量试剂盒由生工生物工程(上海)有限公司提供, MIF、caspase-3、JNK、p-JNK、GAPDH抗体由Abclonal Biotechnology公司提供;D9108A RNAiso Plus总RNA提取试剂、RR036A RT试剂盒、RR820A PCR试剂盒由大连TaKaRa生物工程有限公司提供,β-actin、MIF引物由大连TaKaRa生物工程有限公司合成。TUNEL试剂盒购于凯基生物公司。
1.3动物分组、模型建立及样本收集
选用本中心前期复制的动物模型。大致方法如下:60只大鼠适应实验环境后随机分为4组,即IGT对照组(IGT control,n=10)及其模型组(IGT,n=20),2型糖尿病对照组(T2DM control,n=10)及其模型组(T2DM,n=20),对照组饲喂普通饲料(3.2 kCal/g,由本中心提供),模型组饲喂高脂饲料(D12492,5.24 kCal/g,由广东省医学实验动物中心提供),IGT模型组及其对照组饲养12周后,进行葡萄糖耐量试验,参照文献[6]选出IGT模型大鼠,T2DM组高脂饲料饲养4周后,腹腔注射STZ(35 mg/kg),72 h后,检测空腹血糖(FBG),参照文献[7]选出2型糖尿病大鼠模型。取上述成模大鼠各6只,腹主动脉放血处死,摘取肝脏,切取一部分于4%的中性甲醛中固定,以备TUNEL检测,另一部分于液氮中速冻后,保存于-80℃冰箱,以备PCR和Western检测。
1.4TUNEL法检测肝组织细胞凋亡
将固定好的肝组织,石蜡包埋,切片,常规脱蜡至水化,然后严格按试剂盒说明书进行操作。以细胞核中有棕黄色颗粒者为凋亡细胞。
1.5实时荧光定量PCR检测肝脏MIF的转录水平
按各试剂说明书,常规步骤操作分别提取总RNA,反转录成CDNA,然后利用ABI Stepone Plus定量PCR仪进行PCR 扩增, 以β-actin作为内参,β-actin 上游引物5’- CCACCCGCGAGTACAACCTTC-3’,下游引物5’-CCCATACCCACCATCACACC-3’,MIF上游引物5’- CTTGGGTCACACCGCACTT -3’,下游引物5’- ACC GATCTTGCCGATGCT -3’。扩增条件为:95℃ 30 s, 95℃ 5 s,60℃ 31 s,循环40次。使用StepOne所提供的Study软件进行分析,用2-△△Ct值表示MIF基因的相对表达水平。
1.6Western 印迹法检测肝脏组织中MIF、Caspase-3、JNK、p-JNK蛋白的表达
将定量好的组织蛋白变性后,进行SDS-PAGE电泳将蛋白分离,然后转膜,封闭,加入1∶1000稀释的一抗(兔抗大鼠),4℃孵育过夜,加入1∶5000稀释的HRP标记的二抗(山羊抗兔IgG)中,孵育后DAB显色,Bandscan软件分析各条带的灰度值,以目的蛋白条带灰度值与内参GAPDH灰度值的比值表示目的蛋白的相对表达量;以磷酸化蛋白条带灰度值与其总蛋白条带灰度值的比值表示蛋白磷酸化水平的相对表达量。
1.7统计学方法
2结果
2.1各组大鼠肝脏组织细胞凋亡情况

注:A:IGT 对照组;B:T2DM对照组;C:IGT组;D:T2DM组。 图1 TUNEL检测各组肝细胞凋亡Note. A: IGT control group; B: T2DM control group; C: IGT group; D: T2DM group. Scale bar=50 μm. Fig.1 Detection of apoptotic hepatocytes by TUNEL in rat liver tissues of the four groups
由TUNEL染色显示,糖代谢异常组均出现了凋亡细胞,IGT组凋亡细胞(图1C)多于T2DM组(图1D),IGT对照组有散在的凋亡细胞(图1A),T2DM对照组没有出现凋亡细胞(图1B)。同时与凋亡相关的蛋白caspase-3表达水平在IGT组和T2DM组与各自的对照组相比也明显升高(P<0.01),T2DM组与IGT组相比,表达水平明显降低,差异有统计学意义(P<0.01)(图2)。 2.2各组大鼠肝脏组织MIF转录水平的变化
IGT组和T2DM组与各自对照组相比,肝组织MIF基因表达明显升高,分别是各自对照组的(1.15±0.28)倍和(1.38±0.09)倍(P<0.01);T2DM组与IGT组相比,MIF基因表达有所升高,但无统计学差异(P>0.05)(图3)。
2.3各组大鼠肝脏组MIF、JNK和 p-JNK蛋白表达变化
与相应的对照组相比,肝组织MIF、JNK蛋白表达水平在各模型组明显升高(P<0.05或P<0.01),JNK磷酸化水平在各模型组也明显升高(P<0.01);与IGT组相比,T2DM组MIF、JNK蛋白表达水平明显降低(P<0.01),而JNK磷酸化水平明显升高(P<0.01)(图4-5)。

注:A:Caspase-3 Western blot条带图,B:图A的半定量结果;1:IGT对照组;2:T2DM 对照组;3:T2DM组;4 :IGT组。对照组;#P<0.01 vs IGT组。 图2 各组大鼠肝组织Caspase-3蛋白的表达Note. A: Representative results of Western blotting , B: Semiquantitative results of A. 1: IGT control group; 2: T2DM control group; 3: T2DM group, 4: IGT group. ± s; n = 6; *P<0.01 vs. control group, respectively; #P<0.01 vs. IGT group. Fig.2 Expression of caspase-3 protein in rat liver tissues of the four groups.

注: A:IGT对照组;B:T2DM 对照组;C: IGT组;D: T2DM组。各自对照组。 图3 各组大鼠肝组织MIF mRNA的表达Note. A: IGT control group; B: T2DM control group; C: IGT group; D: T2DM group. ± s, n =6, *P<0.01, vs. control group, respectively. Fig.3 Expression of MIF mRNA in rat liver tissues of the four groups.
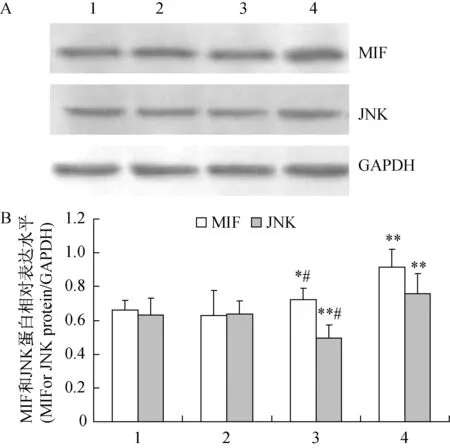
注:A:MIF、JNK Western blot条带图;B:A的半定量结果;对照组;#P<0.01 vs. IGT组,其他图注同图2。 图4 各组大鼠肝组织MIF和JNK蛋白的表达Note. A: Representative results of Western blotting; B: Semiquantitative results of A. ± s ,n =6,*P<0.05, ** P<0.01 vs. control group, respectively; # P<0.01 vs IGT group; Other notes are the same as in Fig. 2. Fig.4 Expression of MIF and JNK proteins in rat liver tissues of the four groups.

注:A:p-JNK Western blot条带图;B:A的半定量结果;对照组;#P<0.01 vs IGT组;其他图注同图2。 图5 各组大鼠肝组织p-JNK蛋白表达Note. A: Representative results of Western blotting. B: Semiquantitative results of A. ±s, n=6,*P<0.01 vs. control group respectively; #P<0.01 vs IGT group; Other note is the same as the figure 2. Fig.5 Expression of p-JNK protein in rat liver tissues of the four groups.
3讨论
高脂饮食能引起糖代谢异常,而糖代谢异常常伴有脂代谢紊乱,肝是糖脂代谢的中心器官,因此肝脏是高脂饮食受影响的重要靶器官之一[8]。当过多游离脂肪酸进入肝脏,使脂质沉积于肝脏,就会形成非酒精性脂肪肝。成脂性转化的肝细胞会分泌白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等炎症介子,可能介导肝细胞内氧化应激、内质网应激和细胞凋亡等各种事件的发生[1],最终导致肝细胞的损伤。但高脂饮食诱导的脂肪肝往往与血糖异常、腹型肥胖等肝外病理状态并存,既往对非酒精性脂肪肝进行相关研究时,并未对这些肝外病理状态进行一致性控制,在糖代谢异常情况下尤其是在糖耐量受损状态下,对肝脏损伤影响的研究较少。已有研究表明, STZ所诱导的大鼠糖尿病模型中,雄性大鼠血糖稳定性明显高于雌性大鼠[9]。因此,本课题选择雄性大鼠作为实验材料,选用高脂饲料喂养和高脂饮食加STZ复制的IGT大鼠模型和T2DM大鼠模型为研究对象进行了相关研究。
MIF除了能抑制巨噬细胞随机移动外,还是一种重要的促炎因子[10], 在IR、糖尿病等疾病的发生发展中具有重要作用,相比IL-6等其它炎症因子,MIF与IR和糖尿病的关系更密切[11]。已研究表明,MIF在酒精性脂肪肝中表达明显增高[12]。本研究检测了糖代谢异常合并非酒精性脂肪肝大鼠肝组织中MIF的表达情况,结果表明:IGT和T2DM组肝组织MIF基因和蛋白表达都明显高于对照组,说明MIF参与了糖代谢异常合并非酒精性脂肪肝的发生发展过程。随着糖耐量受损程度的加重(由IGT→T2DM),MIF基因表达水平有所升高,但两者之间差异不显著(这可能是实验例数较少所致),而MIF蛋白表达明显降低,这提示,在IGT阶段MIF已经起重要作用,若在此阶段有针对性的控制其表达水平,有可能逆转MIF介导的对肝细胞损伤和IGT转化为T2DM的趋势。
既往研究表明,炎症通路与NAFLD的发生发展密切相关,其中JNK途径是两条主要炎性反应通路标志物之一[13],JNK又称为应激活化激酶,在参与应激诱导的细胞凋亡中发挥重要作用[4]。JNK在肝脏中广泛表达,当其长期处于活化状态,会使肝细胞凋亡而造成肝损伤[14],JNK介导了高脂喂养小鼠脂肪肝的发生发展[15]。本实验结果表明, IGT组肝组织JNK表达水平较对照组明显升高, T2DM组则显著降低,且IGT和T2DM组之间差异有显著性,说明高脂引起肝组织JNK表达异常,且在IGT阶段已起重要作用,与MIF的表达趋势相一致。JNK的活化即磷酸化水平在两模型组均明显升高,且随着糖代谢异常的加重,JNK的活化水平呈进行性升高,说明糖代谢受损程度与JNK的激活程度呈正相关。
本实验结果表明,模型组大鼠肝组织中均出现了较多的凋亡细胞,IGT大鼠较T2DM大鼠多,同时参与细胞凋亡启动、执行的关键蛋白酶caspase-3的表达水平也明显升高,与TUNEL染色结果相一致,说明在糖代谢异常的情况下,伴有肝脏脂质沉积的同时,肝细胞出现了凋亡,进而导致肝组织损伤。
综上所述,高脂饮食喂养大鼠后导致的糖代谢异常合并非酒精性脂肪肝的发生可能与肝脏组织MIF和JNK高表达及JNK活化水平增强有关,而且在IGT阶段肝损伤中就已发生了明显改变,若在此阶段对进行干预,可能减轻肝脏脂质沉积等肝损伤,进而减轻肝脏胰岛素抵抗,可以减缓向糖尿病的进展,使血糖水平回归正常。当然糖代谢异常合并脂肪肝的发病机制复杂,尚需要进行大量的实验进行探讨。
参考文献
[1]Jarrar MH, Baranova A, Collantes R, et al.Adipokines and cytokines in non-alcoholic fatty liver disease [J].Aliment Pharmacol Ther, 2008, 27(5): 412-421.
[2]Verschuren L, Kooistra T, Bernhagen J, et al. MIF deficiency reduces chronic inflammation in white adipose tissue and impairs the development of insulin resistance, glucose intolerance, and associated atherosclerotic disease [J]. Circ Res, 2009, 105 (1) : 99-107.
[3]Shi X, Leng L, Wang T, et al.CD44 is the signaling component of the macrophage migration inhibitory factor-CD74 receptor complex [J]. Immunity, 2006, 25(4): 595-606.
[4]Giakoustidis AE, Giakoustidis DE, Koliakou K, et al. Inhibition of intestinal ischemia/repurfusion induced apoptosis and necrosis via down-regulation of the NF-kB, c-Jun and caspace-3 expression by epigallocatechin-3-gallate administration [J]. Free Radic Res, 2008, 42 (2): 180-188.
[5]Liang JL, Feng ZK, Liu XY, et al.Effect of impaired glucose tolerance on cardiac dysfunction in a rat model of prediabetes [J]. Chin Med J, 2011, 124(5): 734-739.
[6]李军, 李秀钧, 张杰, 等. 糖耐量受损大鼠胰胰岛细胞高血糖素及神经及Y的表达 [J].中华内分泌代谢杂志, 2004, 20(3): 185-189.
[7]吴晏, 韩静, 黄黎明, 等. 高脂喂养合并小剂量链脲佐菌素建立2型糖尿病大鼠模型 [J]. 中国实验动物学报, 2012, 20(2):11-15.
[8]Moore JB. Non-alcoholic fatty liver disease: the hepatic consequence of obesity and the metabolic syndrome [J]. Proc Nutr Soc, 2010, 69(2) : 211-220.
[9]蒋升,谢自敬,张莉.链脲佐菌素诱导Ⅰ型糖尿病大鼠模型稳定性观察[J]. 中国比较医学杂志, 2006, 16(1): 16-18.
[10]Toubai T, Tanaka J, Nishihira J,et al. Effect of macrophage migration inhibitory factor (MIF) on acute graft-versus-host disease in a murine model of allogeneic stem cell transplantation [J]. Transplant Immunology, 2006, 16(2): 117-124.
[11]Toso C, Emamaullee JA, Merani S, et al.The role of macrophage migration inhibitory factor on glucose metabolism and diabetes [J]. Diabetologia, 2008, 55(11): 1937-1946.
[12]Nanji AA, Lau GK, Tipoe GL, et al. Macrophage migration inhibitory factor expression in male and female ethanol-fed rats [J]. J Interferon Cytokine Res, 2001, 21(12): 1055-1062.
[13]Kodama Y, Brenner DA. c-Jun N-terminal kinase signaling in the pathogenesis of nonalcoholic fatty liver disease: multiple roles in multiple steps [J]. Hepatology, 2009, 49(1): 6-8.
[14]金磊, 刘立杰, 李慧. 2型糖尿病大鼠肝脏损伤与固醇调节元件结合蛋白-1C、c-Jun氨基末端激酶表达的关系 [J].中国医药导报, 2013,10(5): 19-21.
[15]任路平, 胡志娟, 宋光耀, 等. 短期高脂喂养诱导脂肪肝的肝胰岛素敏感性和炎性因子变化 [J]. 基础医学与临床, 2013, 33(1): 66-69.

2015年《中国实验动物学报》《中国比较医学杂志》专题计划
2013-2014年度《中国实验动物学报》入选"中国科协精品科技期刊工程项目",影响因子与被引频次不断提升,充分彰显了期刊在业界的权威性与影响力。依靠编委、审稿专家和广大实验动物工作者组织高水平的专题是主要的成功之道。
2015年《中国实验动物学报》《中国比较医学杂志》将计划由以下编委组织7期高水平专题:(1)顾为望教授:小型猪在生物医药研究中的应用(已完成);(2)范慧敏教授:实验动物心肺移植模型的建立及相关研究(已完成);(3)范永升教授:中医药研究与"病症"结合动物模型(杂志截稿日期:2015年2月28日);(4)高诚教授:实验动物质量检测、标识标记、模型和评价(学报截稿日期:2015年5月31日);(5)王强教授:斑马鱼在发育生物学及实验动物模型中的应用(学报截稿日期:2015年7月31日);(6)代解杰教授:实验动物新资源标准化研究及疾病动物模型的创建(杂志截稿日期:2015年8月31日);(7)肖杭教授:实验动物在药理毒理方面的应用研究(杂志截稿日期:2015年9月30日)。
欢迎全国的同道积极参与符合上述专题内容的论文撰写、投稿,请注意各个专题的截稿日期;论文可以通过《中国实验动物学报》网站(http://zgsydw.alljournal.ac.cn/sydwybjyx/ch/index.aspx);《中国比较医学杂志》网站(http://zgsydw.alljournal.ac.cn/zgbjyxzz/ch/index.aspx)上的两刊远程稿件管理系统注册并投稿(请在投稿后,在"消息管理"中向编辑部发送消息,注明是哪个专题),收到后将与上述各位教授所组织的专题论文一起进行严谨的审稿,入选论文将在两刊专题中刊出。我刊还特别欢迎各位专家教授撰写有学术导向和指导意义的评论性文章(包括专家论坛、专论、学术争鸣,等等),此类论文可以随时通过Email直接发送到邮箱:b67761337@126.com。
研究报告
Effect of abnormal glucose metabolism on the expression of
macrophage migration inhibitory factor and JNK in the rat liver
FAN Lin-hua1, LIU Jian-xin2, LI Dan3, WEI Bing-yan1, LIU Mao-lin1, WANG Chun-fang1, LIU Tian-fu1
(1. Laboratory Animal Center of Shanxi Medical University, Shanxi Key Laboratory of Experimental Animal and
Human Diseases Animal Models, Taiyuan 030001, China; 2. 109 Hospital of Shanxi Province, Taiyuan 030006;
3. Department of Tumor Biological Therapy, the Second Hospital of Shanxi Medical University, Taiyuan 030001)
【Abstract】ObjectiveTo investigate the expression changes of macrophage migration inhibitory factor(MIF)and C-Jun N-terminal kinase (JNK) in the liver of rat with abnormal glucose metabolism and explore the pathological mechanism of abnormal glucose metabolism with non-alcoholic fatty liver disease (NAFLD). MethodsSixty SD rats were randomly divided into impaired glucose tolerance (IGT) model group (n=20), type 2 diabetes mellitus (T2DM) model group (n=20), IGT control group (n=10) and T2DM control group (n=10). IGT models were produced by feeding high-fat diet, T2DM models were produced by feeding high-fat diet for 4 weeks and intraperitoneally injected streptozotocin. Liver cell apoptosis was detected by TUNEL staining. The expression of MIF mRNA in liver tissue was determined by real-time PCR. The expressions of MIF, caspase-3, JNK proteins and phosphorylated JNK(p-JNK)in the liver tissue were determined by Western blotting. ResultsApoptotic cells were obviously increased in the IGT and T2DM groups. Expression of MIF mRNA in the IGT and T2DM groups was markedly higher than that in the control group, respectively (P<0.01). The expressions of MIF, caspase-3, JNK proteins and phosphorylated JNK were markedly higher than that of the control group, respectively (P<0.05 or P<0.01). The expressions of MIF, caspase-3, JNK proteins in the T2DM group were significantly decreased compared with those of the IGT group, while the expression of phosphorylated JNK was significantly higher (P<0.01). Conclusions Abnormal glucose metabolism accompanied with NAFLD is probably related to the increase of MIF, Caspase-3, JNK and phosphorylated JNK expression.
【Key words】Macrophage migration inhibitory factor; C-Jun N-terminal kinase; Caspase-3; Impaired glucose tolerance; Type 2 diabetes mellitus; Rat
[收稿日期]2014-10-24
Doi:10.3969/j.issn.1005-4847.2015.02.012
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2015) 02-0165-06
[通讯作者]刘建新, E-mail: jianxinliu690101@sina.com
[作者简介]樊林花 (1972-), 女, 硕士, 研究方向:人类病病动物模型。E-mail: flhlx@sina.com
[基金项目]山西省实验动物专项资金资助项目(2013k11);山西医科大学科技创新基金(01201425)。