和田羊抗苦马豆素抗体间接ELISA检测方法的建立
2016-01-27陈根元贾琦珍胡建军
王 帅 陈根元 贾琦珍 胡建军
(塔里木大学动物科学学院/新疆生产建设兵团塔里木畜牧科技重点实验室, 新疆 阿拉尔 843300)
和田羊抗苦马豆素抗体间接ELISA检测方法的建立
王 帅陈根元贾琦珍胡建军*
(塔里木大学动物科学学院/新疆生产建设兵团塔里木畜牧科技重点实验室, 新疆 阿拉尔 843300)
摘要建立特异性强、敏感性高的和田羊血清抗苦马豆素(Swainsonine,SW)抗体ELISA检测方法。利用自行制备的人工抗原SW-BSA(牛血清白蛋白)免疫接种和田羊,获得SW抗血清后以间接ELISA法检测血清抗体效价,通过分析包被抗原种类、浓度,血清稀释度等指标对检测数据的影响,选择最适条件,确定检测方法。试验表明,以质量浓度为10 μg/mL 的SW-卵清蛋白(OVA)偶联抗原作为包被抗原,4 ℃下包被过夜,质量浓度为20 g/L的明胶封闭,酶标二抗的最佳稀释比为1/1 600,试验条件为37 ℃温育1 h;样品血清最佳稀释比为1/80,试验条件为37 ℃温育2 h,底物最佳显色时间为30 min。建立的抗SW抗体ELISA检测方法,特异性强、稳定性高,为进一步研究SW人工抗原的免疫原性等奠定了基础。
关键词苦马豆素; 抗苦马豆素抗体; ELISA检测
疯草(Locoweed)是豆科棘豆属(Oxytropis)、黄芪属(Astragalas)和苦马豆属(Sphaerophysa)等有毒植物的总称,是世界范围内对草地畜牧业危害最严重的毒草。具有返青早、抗逆性强、根系发达、繁殖系数高等特点,冬末春初牧草缺乏时放牧家畜经常因饥饿而被迫采食,从而导致中毒甚至死亡。其中对外来引进物种的种畜、孕畜危害尤为严重[1]。苦马豆素(Swainsonine,SW)是一种多羟基吲哚里西啶生物碱,国内外研究认为其是疯草的主要毒性成分,可造成机体细胞空泡变性,导致内质网断裂、线粒体损伤等病理性变化[2]。但疯草生物量大,营养成分也较为丰富,王帅[3]等研究发现疯草小花棘豆的粗蛋白、氨基酸及微量元素组成与优质紫花苜蓿(Medicago sativa)相近;而家畜少量采食疯草时增膘也表明了疯草具有一定的应用价值。如能将占西部草原30%以上的疯草合理利用,可有效促进新疆草原畜牧业的可持续发展。
和田羊是新疆南疆地区的主要放牧品种,对本区的荒漠性气候有较好的适应性,具有耐粗饲、耐热等特点,目前已占本区绵羊存栏总数的70. 97%以上。近年来,和田羊小花棘豆中毒已成为本区畜牧业发展面临的严重问题[4]。现有研究认为将SW与大分子载体蛋白(如BSA)偶联成人工抗原(SW-BSA),然后将其免疫家畜,诱导家畜产生抗SW抗体,可在一定程度上防治家畜的疯草中毒。王帅等[5,6]利用SW人工抗原免疫接种家兔,以小花棘豆作为攻毒饲草进行试验,发现该方法具有一定的保护效果。但SW免疫原性的分析和免疫效果的确定有赖于其抗体的准确检测。ELISA法因具有快速、敏感、准确等优点而得到广泛应用,童德文[7]等以SW为包被抗原进行检测,发现SW因分子量小存在与酶标板结合弱的问题,不利于试验结果的稳定性和精密性。有鉴于此,本试验以和田羊抗SW血清为试验材料,通过重新筛选包被抗原,优化测定条件,以期建立和田羊抗SW抗体的特异性ELISA检测方法,为和田羊安全利用疯草奠定基础。
1材料和方法
1.1试验材料、试剂与仪器
SW、SW与牛血清白蛋白(BSA)偶联抗原SW-BSA、SW与卵清蛋白(OVA)偶联抗原SW-OVA、SW与人血清白蛋白(HSA)偶联抗原SW-HSA均由兵团塔里木畜牧科技重点实验室制备;山羊抗SW阳性血清,西北农林科技大学馈赠;3,3′,5,5′-四甲基联苯胺(TMB,CAS: 54827-17-7),购自美国Amresco公司;弗氏不完全佐剂(FAI),弗氏完全佐剂(FAC),均购自德国Sigma;羊IgG,HRP-兔抗羊IgG抗体,均购自北京普利莱基因技术有限公司;其它试剂均为国产分析纯。
和田羊6只,年龄2岁左右,体重(28±1. 2kg),购自和田地区策勒县。
全波长酶标仪(美国Bio-Tek公司PowerWave XS);智能生化培养箱(江苏金坛医疗仪器厂SPX250),精密电子天平(德国Sartorius BS124);高速冷冻离心机(法国Jouan公司MR231);超纯水系统(美国Millipore公司Direct-Q3)。
1.2和田羊抗SW血清的制备
将和田羊随机分为阴性对照组(1只)和SW-BSA免疫组(5只),参考王帅等[8]的研究进行基础免疫和加强免疫,其中基础免疫使用FAC,首免和加强免疫均使用佐剂和生理盐水的混合液乳化人工抗原SW-BSA,免疫程序见表1。对照羊仅注射佐剂与生理盐水的混合液,第三次加强免疫7 d后,所有试验羊颈静脉采血,分离血清,-20 ℃保存。

表1 免疫组的免疫时间和免疫剂量
1.3间接ELISA的操作
以0. 1 mol/L的碳酸盐缓冲液为包被缓冲液,将包被抗原稀释至10 μg/mL,每孔加100 μL,4℃包被过夜;弃去包被液,洗涤3次后拍干,每孔再加封闭剂(20 g/L明胶)200 μL,37℃孵育;弃去封闭剂,洗涤3次后拍干,每孔加血清100 μL,37℃孵育;弃去血清,洗涤3次后拍干,每孔加HRP-兔抗羊IgG 100 μL,37℃孵育;弃去酶标二抗,洗涤3次后拍干,每孔加底物溶液(TMB-H2O2)100 μL,37 ℃孵育,终止液为2 mol/L的硫酸溶液。同时设置阳性对照孔(SW阳性血清)、阴性对照孔(阴性对照组羊血清)和空白对照孔(PBS液),检测阴性对照孔OD450值(N)与待测样品孔OD450值(P),以P/N≧2. 1判定样品为阳性[9]。
1.4酶标抗体最适稀释度的选择
制备质量浓度为100 ng/mL的羊IgG工作液以取代包被抗原,按照1.3中操作进行ELISA检测,将HRP-兔抗羊IgG按照1/100,1/200,1/400,1/800,1/1 200,1/1 600,1/2 400和1/3 200的比例分别进行稀释。取OD450值最接近1. 0时的酶标二抗稀释度作为工作浓度。
1.5待检血清稀释倍数的选择
使用包被缓冲液将待检血清按照1/20,1/40,1/80,1/160,1/320和1/640的稀释度分别进行ELISA检测。血清最适稀释倍数的选择标准同上。
1.6包被抗原及最适浓度的选择
以棋盘滴定法选择SW-OVA、SW-HSA和SW分别作为包被抗原的工作浓度,使用包被缓冲液将三种抗原分别稀释为100,10,1,0. 1和0. 01μg/mL共5个质量浓度梯度,分别包被过夜,以PBS为空白对照,通过ELISA检测,计算P/N值,确定最适包被抗原及最佳浓度。
1.7抗原最佳包被条件的选择
抗原包被条件分别设置为4 ℃过夜、37 ℃孵育1 h、37 ℃孵育2 h和37 ℃孵育4 h,通过ELISA检测,计算P/N值,确定抗原最佳包被条件。
1.8血清最佳反应时间的选择
将阳性血清反应时间分别设置为0. 5 h、1 h、1. 5 h和2 h,通过ELISA检测,计算P/N值,确定血清最佳反应时间。
1.9酶标二抗最佳反应时间的选择
将酶标二抗反应时间分别设置为0. 5 h、1 h、1. 5 h和2 h,通过ELISA检测,计算P/N值,确定酶标二抗最佳反应时间。
1.10底物最佳显色时间的选择
将显色时间分别设置为10 min、15 min、20 min、25 min和30 min,通过ELISA检测,计算P/N值,确定底物最佳显色时间。
1.11ELISA检测和田羊血清的重复性试验
应用单项试验测定的最佳条件,对免疫组和田羊血清样品进行ELISA检测,并计算检测结果的批间变异系数(CV)。
2结果与分析
2.1酶标抗体最适稀释度的确定
由表2可知,当P/N值≧2. 1时,OD450值最接近1的酶标二抗稀释度为1/1 600,故选择1/1 600为ELISA检测酶标抗体工作浓度。

表2 酶标抗体最适稀释度的确定(n=12)
2.2血清稀释倍数的确定
由表3可知,当P/N值≧2. 1时,OD450值最接近1的血清稀释度为1/80,故选择1/80为ELISA检测血清最适稀释倍数。

表3 待检血清最适稀释度的确定(n=12)
2.3包被抗原及最适浓度的确定
由表4可知,质量浓度为10 μg/mL的SW-OVA的P/N值显著大于其余各组,试验结果表明SW-OVA作为包被抗原的敏感性明显高于其它抗原,因此选择10 μg/mL的SW-OVA作为ELISA检测的抗原包被浓度。
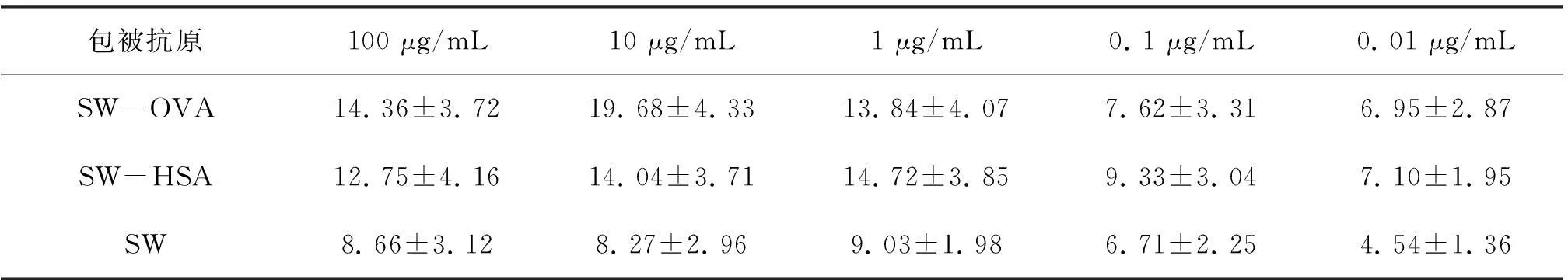
表4 包被抗原及最适工作浓度的确定(P/N值,n=3)
2.4抗原最佳包被条件的确定
由表5可知,当P/N值≧2. 1时,OD450值最接近1的包被条件为4 ℃过夜,故选择4 ℃过夜作为ELISA检测的抗原包被条件。

表5 抗原最佳包被条件的确定(n=12)
2.5血清最佳反应时间的确定
由表6可知,当P/N值≧2. 1时,OD450值最接近1的血清反应时间为2 h,故选择2 h作为ELISA检测的血清反应时间。

表6 血清最佳反应时间的确定(n=12)
2.6酶标二抗最佳反应时间的确定
由表7可知,当P/N值≧2. 1时,OD450值最接近1的酶标二抗反应时间为1 h,故选择1 h作为ELISA检测的酶标二抗反应时间。

表7 酶标二抗最佳反应时间的确定(n=12)
2.7底物最佳显色时间的确定
由表8可知,当P/N值≧2. 1时,OD450值最接近1的底物显色时间为30 min,故选择30 min作为ELISA检测的底物显色时间。

表8 底物最佳显色时间的确定(n=12)
2.8ELISA检测和田羊血清的重复性试验结果
重复性试验结果见表9,试验和田羊血清抗体ELISA检测值的CV值为0. 21%~0. 56%,表明测定结果具有较好的重复性和稳定性。试验建立的SW抗体间接ELISA检测方法:以10 μg/mL 的SW-OVA作为包被抗原,于4 ℃包被过夜, 封闭剂为20 g/L的明胶,待检血清稀释倍数为1/80,最佳反应时间为37 ℃2 h,酶标抗体的工作浓度为1/1 600,最佳反应时间为37 ℃1 h,底物溶液最佳显色时间为30 min。具有较好的重复性和稳定性。
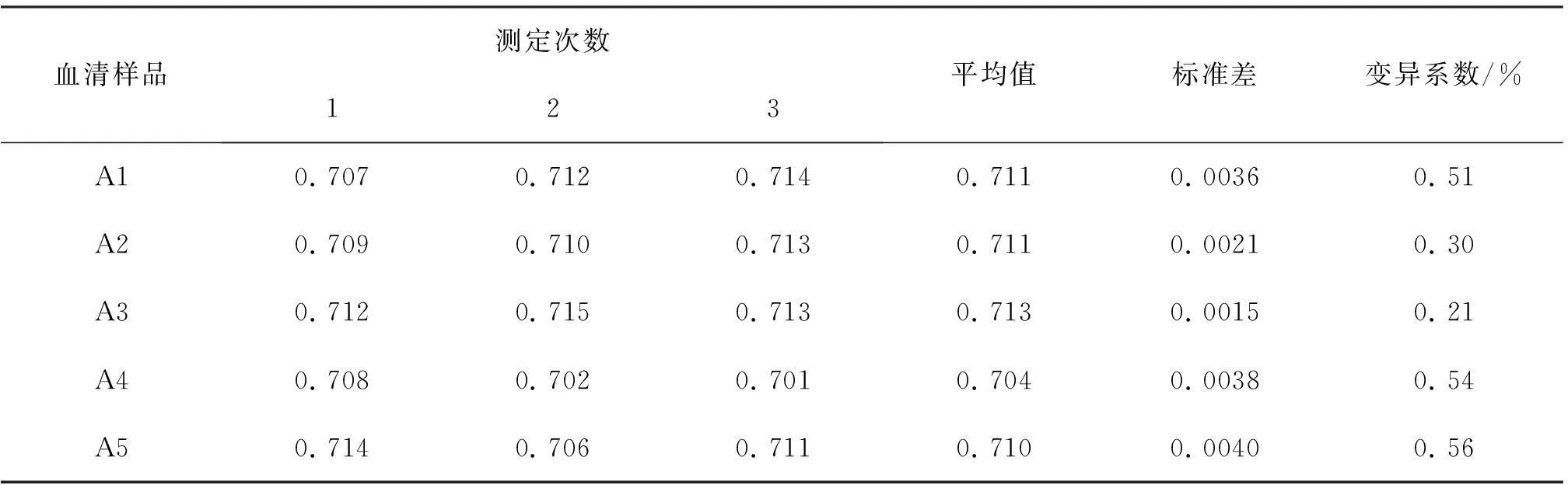
表9 抗SW抗体间接ELISA检测的重复性试验(n=3)
3讨论
我国现有黄芪属植物278种,棘豆属植物120余种,苦马豆素植物1种,其中新疆分布黄芪属植物81种,约占全国总种数的29%;棘豆属植物97种,约占中国总种数的81%,苦马豆属植物1种[10]。据报道新疆黄芪属、棘豆属和苦马豆属植物确定含有SW的共20种,其中优势种8种,分布面积已超过100万公顷,并且每年还在以3. 3%~3. 5%的速度蔓延[11]。疯草对新疆牧区草原畜牧业的危害极为严重,现已引起了各级政府和科研工作者的广泛关注。
通过免疫学方法接种放牧家畜,使其产生特异性抗体,从而在采食疯草时获得保护是目前的研究热点,其中抗SW抗体的准确检测是评价免疫效果的重要依据。童德文等[7]、陈根元等[12]分别建立了抗SW抗体的间接血凝检测方法和琼脂糖扩散检测方法,均对抗SW抗体进行了定量检测。但间接血凝检测需预先使用SW对羊的红细胞进行致敏,而致敏后的红细胞保存期不超过7 d,不利于试验结果的稳定性和重复性;而琼脂糖凝胶的机械强度差,又容易被细菌污染,极易影响测定结果。另外如免疫荧光技术和放射免疫测定等方法均需要特定的设备,不易推广。ELISA检测具有敏感、快速、准确、成本较低等优点,无疑是抗SW抗体测定的最佳选择。
ELISA检测方法的特异性首先取决于包被抗原的种类与纯度。童德文等[7]直接使用SW为包被抗原对家兔血清中的抗SW抗体进行了ELISA检测,但其特异性和敏感性均较差。这是因为包被抗原与酶标板的吸附结合主要依靠抗原蛋白的疏水基团与固相载体表面的相互作用,易受蛋白质等电点、分子量和质量浓度等的影响。SW分子量小,仅为173,极难与酶标板结合,需通过与蛋白载体偶联后才能包被抗原[13]。王爱华等[14]报道SW为包被抗原进行ELISA测定时阴性对照时的OD450值偏高,可能与SW同酶标板的结合较弱,易于脱落有关;也有可能是SW直接吸附后其抗原决定簇不能充分暴露,影响了与相应抗体的结合。本试验分别以不同质量浓度的SW、SW-OVA和SW-HSA作为包被抗原进行检测,表明质量浓度为10 μg/mL的SW-OVA包被效果最好,重复性试验表明以SW-OVA作为包被抗原提高了ELISA检测的稳定性和敏感性。另外ELISA检测的准确性还取决于包被抗原与免疫抗原的交叉性。OVA、BSA和HSA均为抗原制备的常见载体,三者间具有较低的抗原交叉性,其中以OVA为载体的人工抗原常被用作包被抗原以检测BSA载体抗原的抗体[15]。本研究选用SW-OVA作为包被抗原,避免了测定中可能出现的交叉反应,证明建立的方法,具有较高的准确性和特异性。
总之,本试验通过对SW-BSA免疫和田羊血清的测定,建立了特异性和稳定性强、敏感度高的抗SW抗体间接ELISA测定方法。操作程序如下:包被抗原为10 μg/mL的 SW-OVA,每孔加入100 μL后于4 ℃包被过夜,选用20 g/L的明胶为封闭剂,样品血清稀释倍数为1/80,最佳反应程序为37 ℃孵育2 h,酶标抗体的工作浓度为1/1 600,最佳反应程序为37 ℃孵育1 h,底物溶液最佳显色时间为30 min,终止液为2 mol/L的硫酸溶液。
参考文献
[1]Martyn A, Tyler J, Offord C, et al. Swainsona sejuncta: a species of ornamental promise or a potential weed [J]. Austvalian Journal of Experimental Agvicultuve, 2003,43:1369-1381.
[2]周启武,赵宝玉,路浩,等. 中国西部天然草地疯草生态及动物疯草中毒研究与防控现状[J].中国农业科学,2014,46(6):1280-1296.
[3]王帅,胡建军,阿里木别克,等.南疆地区小花棘豆的营养成分分析[J].草业科学, 2010,27(5):136-139.
[4]吴书奇,王帅,陈根元,等.小花棘豆对和田羊血液生化指标的影响[J].东北农业大学学报,2013, 44(6):62-68.
[5]王帅,陈根元,胡建军,等.苦马豆素人工抗原对家兔的免疫原性研究[J].中国草食动物科学,2012, 32(2):64-66.
[6]王帅,蒋慧,陈根元,等. 苦马豆素人工抗原免疫对饲喂小花棘豆家兔血清免疫和生化指标的影响[J].中国兽医学报,2013, 33(2):287-291.
[7]童德文,陈德坤,曹光荣. 苦马豆素-BSA对家兔的免疫原性研究[J]. 西北农林科技大学学报(自然科学版) ,2001, 29(5):11-14.
[8]王帅,胡建军,陈根元,等.苦马豆素人工抗原接种和田羊的免疫学研究[J]. 黑龙江畜牧兽医,2014, 56(5):21-24.
[9]Watanabe H, Satake A, Kido Y, et al. Monoclonal-based-enzyme-linked immunosorbent assay and immunochromatographic assay for enrofloxacin in biological matrices [J]. Analyst, 2002, 127:98-103.
[10]Masahiro M,Junichi T,Michiko N F,et al.Suppressive effects of swainsonine and N-Butyldeoxynojirimycin on human bone marrow neutrophil maturation [J].Biocnemical and Biophysical Reseavch Communications,2000,269:219-225.
[11]高木木.新疆棘豆属植物研究[D].新疆石河子:石河子大学硕士学位论文, 2008.
[12]陈根元,贾琦珍,潘伊微,等. 家兔苦马豆素多克隆抗体的制备及其对小花棘豆中毒的治疗效果[J]. 西北农业学报,2014, 24(1):23-29.
[13]Oladipo A O,Paulette M F H,Ibrahim L,et al.Enhanced proliferation of functionally competent bone marrow cells in different strains of mice treated with swainsonine [J].Intevnational Immunopharmacology,2003,3:445-455.
[14]王爱华,王建华,宋毓民. 抗苦马豆素抗体ELISA检测方法的建立[J].西北农林科技大学学报(自然科学版),2008, 36(11):52-56.
[15]王帅,陈根元,吴书奇,等.苦马豆素人工抗原的合成及其免疫原性研究[J].塔里木大学学报,2011, 23(3):46-53.
Establishment Detection Method of Indirect Enzyme-linked Immun
osorbent Assay of Anti-Swainsonine Antibody in Hetian Sheep
Wang ShuaiChen GenyuanJia QizhenHu Jianjun*
(College of Animal Science/ Key laboratory of Tarim Animal Husbandry Science and Technology,
XinJiang Production & Construction Corps, Alar, XinJiang 843300)
AbstractThe purpose of this experiment was to establish an detection methods of indirect enzyme-linked immunosorbent assay to determine the level of antibody against SW with high sensibility and specificity. The Hetian sheep SW antiserum was prepared by inoculating with home-made SW-BSA. SW antiserum was used to detect serum antibody titer by indirect ELISA method using different coating antigen, then to analyze the optimal conditions of the established indirect ELISA, such as type and concentration of coating antigen, different serum dilution, determine best method. The results showed that using SW-OVA as coating antigen was better than any other, the optimal conditions of the method were as follows: the density of coating antigen(SW-OVA) was 10 μg/mL, the reaction time was 12 h and reaction temperature was 4 ℃;the impacting medium gelatine of 20 g/L, the working concentration of enzyme labeled antibody was 1/1 600, the reaction time was 1 h and reaction temperature was 37 ℃; the serum dilution was 1/80, the reaction time was 2 h and reaction temperature was 37 ℃;the reaction time was 30 min for substrate colouration. This method was verified with high specificity and stability via the determination of the antibody anti- SW in serum of Hetian sheep, thus providing a basic method for further research of SW artificial antigen.
Key wordsswainsonine; antibody anti- swainsonine; Enzyme-Linked Immunosorbent Assay
中图分类号:S854.4
文献标识码:ADOI:10.3969/j.issn.1009-0568.2015.04.004
文章编号:1009-0568(2015)04-0025-07
通讯作者*为E-mail:hjjhpm@163.com
作者简介:王帅(1984-),男,实验师,硕士,研究方向为动物中毒病与毒理学。E-mail:wangshuaidky@126.com
基金项目:国家自然科学基金(31460678,31160497); 新疆生产建设兵团塔里木畜牧科技重点实验室开放课题(HS201207)。
收稿日期:2015-04-08
