饥饿及过量投喂下银鲳幼鱼形态学指标及体成分变化
2016-01-26王腾飞郭晓鸽谷江稳闫雪梅徐善良
王腾飞,郭晓鸽,谷江稳,闫雪梅,徐善良
(宁波大学 海洋学院,浙江 宁波 315211)
饥饿及过量投喂下银鲳幼鱼形态学指标及体成分变化
王腾飞,郭晓鸽,谷江稳,闫雪梅,徐善良*
(宁波大学 海洋学院,浙江 宁波 315211)
摘要:为了解饥饿及过量投喂对银鲳幼鱼体重、肥满度、比肝重及体成分的影响,对平均体重2.61±0.65 g的幼鱼进行了饥饿与分组投喂实验。分别测定了正常投喂组(C组)、饥饿5 d(S5组)、饥饿9 d(S9组)以及过量投喂组(D组)幼鱼的形体参数、肥满度、比肝重及鱼体基本营养成分。结果表明:(1) 与C组相比,D组各项指标均有显著性增加(p<0.05),增重率为(73.89±9.78)%,是正常组的1倍多,比肝重和肥满度分别增加了55.00%和25.10%;(2) 饥饿胁迫下幼鱼的比肝重和肥满度显著性下降(p<0.05),饥饿5 d和9 d后,比肝重分别下降了8.75%和11.25%,肥满度分别减小了21.18%和32.16%;(3) 饥饿银鲳幼鱼以粗脂肪损失幅度最大,饥饿5 d和9 d时分别为正常组的22.55%和18.10%,与此同时,粗蛋白仅损失了4.06%和4.90%,说明饥饿银鲳幼鱼以脂肪供能为主,蛋白质和糖类供能为辅;(4) 饥饿致死幼鱼的肥满度在不同体长组间无显著性差异(p>0.05),但体重损失率受体长影响,2.20~2.80 cm组的体重损失率为22.89%,体长2.80~3.40 cm以后上升为35.79%~40.28%,肥满度则随体长增加大致呈下降趋势,体长与幼鱼的耐饥能力呈正相关。
关键词:银鲳;饥饿;肥满度;比肝重;体成分
0引言
短期饥饿是鱼类在自然水域生态系中经常面临的一种生理胁迫现象,也是影响鱼类正常生长、发育和生存的一个重要因子。通常在饥饿过程中,鱼体的体重、比肝重、肥满度等形态性状指标会发生某些特定的变化。目前已有对大西洋鲱Clupeaharengus和鲽Pleuronectesplatessa[1]、花尾胡椒鲷Plectorhynchuscinctus[2]、萍乡肉红鲫Carassiusauratus[3]等多种鱼类在饥饿条件下形态学变化的研究。鱼类的肥满度会随着体长及体重的增长发生变化,郭焱 等[4]、陈林 等[5]分别研究了不同体长的新疆高原鳅Triplophysastrauchii、兴凯鱊Acheilognathuschankaensis的肥满度差异。
银鲳Pampusargenteus隶属鲈形目Perciformes,鲳科Stromateidae,鲳属Pampus,分布范围广泛。迄今,对银鲳的研究涉及到分类、资源评估、生态和繁殖特性、人工繁殖、营养成分分析等诸多方面[6-9],但未有关于银鲳在饥饿状态下形态学变化的研究报道。本文拟通过比较正常银鲳幼鱼与饥饿及过量投喂个体的体重、肥满度、比肝重和体成分的变化,建立银鲳幼鱼正常和饥饿状态下体长与体重的关系式,并分析饥饿对不同体长组幼鱼的影响程度,揭示其不同营养条件下的健康状态,为银鲳养殖技术的提高提供科学依据。
1材料与方法
1.1实验鱼来源及驯化
实验用银鲳幼鱼为室内人工养殖的鱼苗,饲养于浙江省海洋水产养殖研究所洞头基地。实验前2周开始驯化,在直径为100 cm的2个圆形水槽中驯养,每天投饵3次。实验鱼体重为0.40~3.90 g,体长为2.20~4.90 cm。实验期间水温为25~27 ℃。饲料为日本进口“鱼宝”饲料和新鲜马鲛鱼肉按1∶1反复绞碎制成的湿团状料。
1.2实验设计
驯化后选择大小基本一致,体重2.61±0.65 g,体长4.70±0.22 cm的银鲳幼鱼54尾,分3个实验组,1个正常投喂对照组、1个过量投喂组和1个饥饿处理组,每一处理组做3个重复,每一重复用3尾鱼。对照组(C组)正常投喂,每天投喂2次,投饵量约为体重的3%~5%;过量投喂组(D组)每天投喂4次,投饵量约为体重的8%~10%;饥饿处理组(S5组和S9组)分别指在持续饥饿5 d和9 d时及时解剖取样,C组和D组连续投喂12 d取样。所有样品均全鱼留样作体成分测定。
驯化后剩余的幼鱼在一个圆桶中继续投喂,饲养30 d后解剖取样(C1组)。另一圆桶中则采取饥饿处理,对饥饿致死鱼(Sd组)随时取样,依据体长分组统计。
1.3鱼体基本营养成分的测定
采用凯氏定氮法(GB/T6432—1994)测定粗蛋白含量;采用索氏乙醚抽提法(GB/T6433—1994)测定粗脂肪含量;采用105 ℃恒温烘干湿重法(GB/T6435—1986)测定水分;采用连续灰分测定仪,550 ℃灼烧6 h测定灰分含量。
1.4数据统计与分析
鱼体饥饿过程中的体重增重(损失)率、比肝重、肥满度、体长与体重关系表达式分别用以下公式计算:
体重增重(损失)率(%)=100×(W1-W0)/W0
(1)
比肝重=100×Wg/Wk
(2)
肥满度(g/cm3)K=100×W/L3
(3)
W=aLb
(4)
式中:W0和W1分别表示处理开始前和处理后的鱼体湿重(g),Wg和Wk分别为肝脏重量和空壳体重(g),W和L分别表示体重(g)和体长(cm),a和b为体长与体重函数中的常量和变量。
试验数据采用SPSS 17.0软件进行方差分析,用Duncan’S多重比较检验组间的差异,以p<0.05作为差异显著水平。每组数据用平均值±标准差(Mean±S.D.)表示。
2结果与分析
2.1饥饿和过量投喂下银鲳幼鱼形态指标比较
饥饿和过量投喂下银鲳幼鱼形态指标变化见表1。与正常组(C组)比较,过量投喂(D组)情况下,体重增重率达(73.89±9.78)%,是C组的1倍多,比肝重和肥满度两项指标也显著高于C组(p<0.05),比肝重和肥满度分别增加了55.00%和25.10%。经过5 d饥饿后的S5组体重已明显下降,体重损失率达到(22.36±5.33)%,比肝重和肥满度分别为(1.46±0.85)%和2.01±0.34 g/cm3,分别下降了8.75%和21.18%,显著低于C组(p<0.05);继续饥饿至9 d时(S9组),体重进一步显著下降,体重损失了近一半,损失率达到(42.25±10.84)%,比肝重和肥满度分别比C组下降了11.25%和32.16%,与C组有显著性差异(p<0.05),但与S5组无显著性差异(p>0.05)。正常及过量投喂下,体长与体高都出现明显增长,但饥饿对体长和体高基本没有影响。

表1 不同投喂条件下银鲳幼鱼的形态学指标变化
注:同一列数值中右上角不同小写字母表示差异显著(p<0.05),相同字母表示差异均不显著(p>0.05),下同。
2.2饥饿及过量投喂下银鲳幼鱼的体成分比较
银鲳幼鱼在饥饿及过量投喂条件下的体成分测定结果见表2。比较正常组、过量投喂组及饥饿组鱼体营养成分可见,过量投喂组幼鱼的水分含量显著低于正常组(p<0.05),但粗蛋白和粗脂肪含量略高于正常组,分别为81.62%和7.06%。饥饿胁迫下,银鲳幼鱼体内的粗脂肪、粗蛋白和非氮浸出物均出现不断降低,与正常组相比S5组和S9组粗蛋白分别损失了4.06%和4.90%。粗脂肪降幅最大,S5组和S9组分别仅为正常组的22.55%和18.10%;而S5组与S9组间各项指标无显著差异(p>0.05)。在饥饿期间鱼体水分和灰分含量显著增加(p<0.05)。
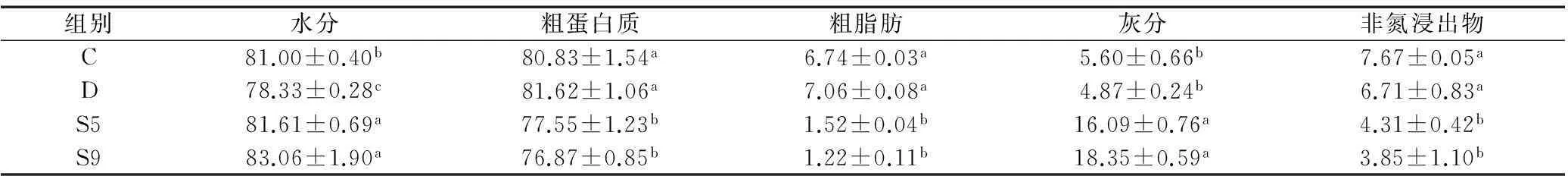
表2 不同投喂条件下银鲳幼鱼的体成分组成
2.3正常和饥饿银鲳幼鱼的体长与体重关系

2.4不同体长组饥饿致死幼鱼的体重和肥满度比较
测量体长2.20~5.20 cm银鲳幼鱼饥饿死亡(Sd组)时的体重和肥满度,并与正常投喂组(C1组)比较,结果如图2和图3所示。在不同的体长组,饥饿和正常鱼的体重皆存在显著差异(p<0.05),体重损失量随体长的增加而增大,体重损失率也受体长影响,2.20~2.80 cm组的损失率为22.89%,体长2.80~3.40 cm以后损失率迅速增加,为35.79%~40.28%(图2)。
同样,比较Cl组和Sd 组在不同体长下的肥满度
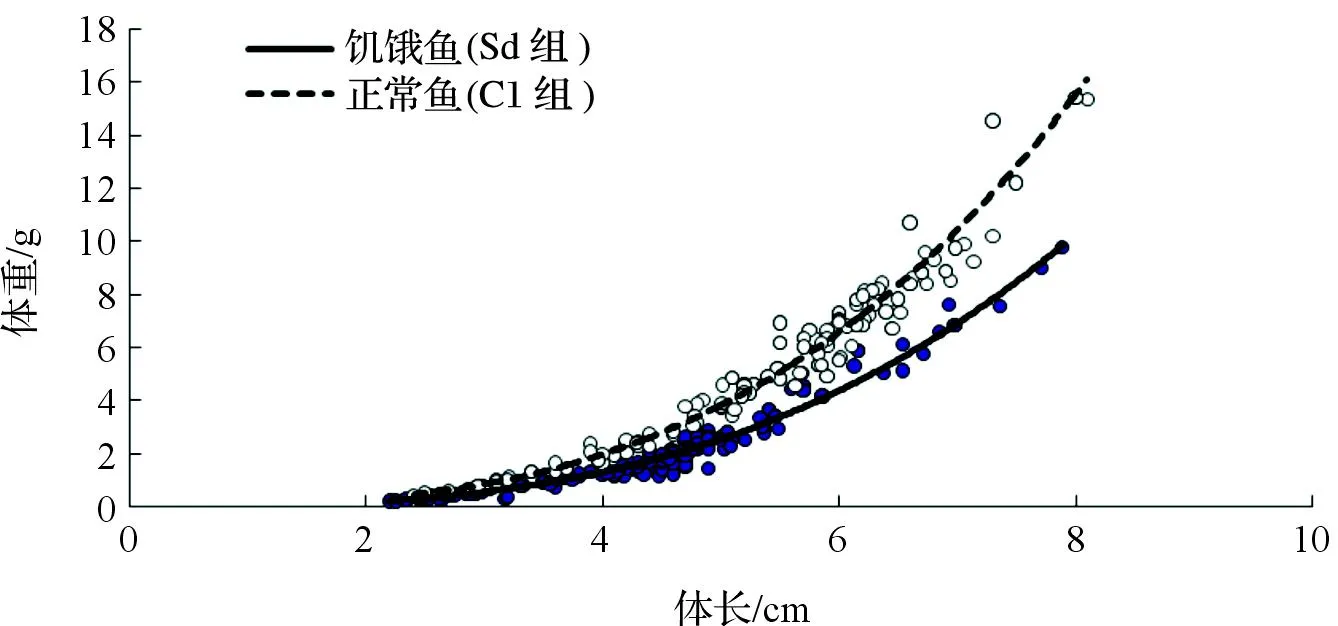
图1 银鲳幼鱼体长和体重的关系Fig.1 Length-weight relationships of juvenile Pampus argenteus
变化(图3),正常组的肥满度组间虽略有变化,但组间不存在显著性差异(p>0.05)。Sd 组幼鱼各体长组的肥满度均显著低于正常组(p<0.05),且随体长增加肥满度大致呈现下降趋势;2.20~2.80 cm体长组的肥满度为2.26±0.25 g/cm3,为同体长正常组的75.33%,4.60~5.20 cm组肥满度为1.92±0.14 g/cm3,仅为同体长正常组的58.72%。肥满度损失率波动幅度为24.66%~41.12%。
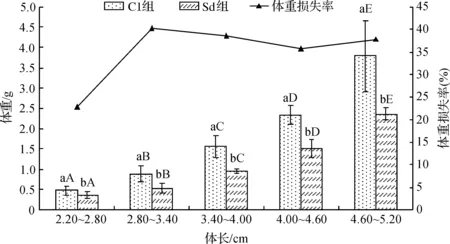
图2 不同体长组饥饿致死幼鱼体重的比较Fig.2 Comparison of body weight of different length groups in starvation death juvenile不同小写字母表示同体长组存在显著性差异(p<0.05),不同大写字母表示同处理组存在显著性差异(p<0.05),下图同Different small letters meant significant difference among the same length groups at 0.05 level, different capitalletters meant significant difference among the same treatments at 0.05 level, the same as below
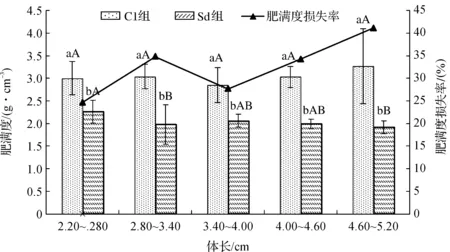
图3 不同体长组饥饿致死幼鱼肥满度的比较Fig.3 Comparison of relative fatness of different length groups in starvation death juvenile
3讨论
3.1饥饿和过量投喂对银鲳幼鱼的形态指标及体成分的影响
本研究结果显示,银鲳幼鱼受到饥饿胁迫时,体重和肥满度出现了显著的下降(p<0.05),与前人对几种鱼类的研究结果类似[10-14],如BISBAL et al[13]在对犬齿牙鲆Paralichthysdentatus的研究中发现肥满度随饥饿呈下降趋势;吴蒙蒙[14]在对金鳟Oncorhynchusmykiss的研究中也发现,饥饿后金鳟幼鱼的体重和肥满度呈显著性下降。比肝重被看作是对长期和短期营养方式很敏感的形态学指标[15]。银鲳幼鱼在饥饿时比肝重呈下降趋势(p<0.05)。说明银鲳幼鱼在饥饿过程中会大量动用肝脏中储存的能量,导致饥饿幼鱼的比肝重显著下降。实验鱼解剖发现,饥饿5 d 和饥饿 9 d后幼鱼的肝脏体积明显缩小,肝脏重量分别下降了20.93%和31.06%,但由于鱼体重与肝脏同步损失,出现S9与S5的比肝重无显著性差异的结果。从表2的体成分变化更能清楚地表明,饥饿导致银鲳幼鱼的粗脂肪、粗蛋白质及无氮浸出物均出现不同程度的损失,尤以粗脂肪损失幅度最大,饥饿5 d和9 d时分别仅为正常组的22.10%和18.10%,与此同时,粗蛋白仅损失了4.10%和4.90%。这是因为蛋白质是构成机体结构的框架物质,鱼类不轻易大量动用来供能,故短时间饥饿时银鲳幼鱼利用脂肪提供能量,就足以维持其基本生命活动,但当饥饿时间延长,饥饿胁迫加重时,便不得不利用蛋白质作为能源物质。许多鱼类的研究结果与银鲳十分相似,邓利 等[16]发现黑鲷白肌中脂肪含量在饥饿2 d后就开始下降,但肌蛋白质不变,15 d后蛋白质才显著降低;柳敏海 等[17]发现鮸鱼饥饿前9 d,粗脂肪下降了26.51%,粗蛋白仅下降了9.83%;刘波 等[18]、周爱国 等[19]的一些研究也得到了共同结论,鱼体粗脂肪的降幅高峰早于粗蛋白,且粗脂肪的降幅远大于粗蛋白。随着饥饿银鲳粗蛋白和粗脂肪含量的下降,鱼体灰分含量显著性增加,这也是个普遍现象[17, 20-21],由于鱼类机体内有机物含量减少,无机物相对含量便会提高。非氮浸出物主要是储存于鱼体肝脏和肌肉中的糖类,在银鲳幼鱼9 d饥饿过程中呈持续下降趋势,说明饥饿银鲳幼鱼也利用糖类供能,这也是银鲳幼鱼抵御饥饿胁迫的生存策略。
另外,还发现对银鲳幼鱼进行过量投喂后,其体重、肥满度和比肝重等发生了显著变化(p<0.05),比肝重的快速上升证明过量投喂下银鲳幼鱼更多地在肝脏积累能量物质。对星斑川鲽Platichthysstellatus[22]和黄鳝Monopterusalbus[23]的研究表明,增加投饲对体重等各项指标升高不明显,这与本研究的结论不同,可能是由于鱼种间的能量分配和积累机制不同引起的差异。
3.2银鲳幼鱼体长和体重的关系
在渔业资源调查中,通常是测量长度而较少称重量,经常需要对体长和体重进行换算,因此研究其关系具有重要意义[24-25]。国外也有许多学者进行过这方面的研究,MOREY et al[26]和ECOUTIN et al[27]分别对地中海西部和非洲西部沿海的冈比亚热带河口的多种鱼的体长和体重关系进行了深入探讨。从正常和饥饿银鲳幼鱼的体长与体重关系式W=aLb可见,b值十分接近3,银鲳幼鱼属于等速生长,又从肥满度公式K=100W/L3可知,当b值接近3时,a值的100倍可以看作是银鲳幼鱼的肥满度,则可推算正常和饥饿银鲳幼鱼的肥满度分别为3.07和2.16,与表1中的肥满度值较为接近。
3.3体长与银鲳幼鱼耐饥能力和肥满度的关系
图1和图2表明,体长与银鲳幼鱼的耐饥能力呈正相关,即体长越大饥饿鱼的体重损失绝对值和损失率也越大,体长越大幼鱼的耐饥能力也越强。这也与实验中观察到的事实相符,23~25 ℃水温下,实验鱼饥饿致死的时间一般为11~17 d,大多数小个体幼鱼先于大个体幼鱼饥饿而死。
鱼类的肥满度不仅与鱼种有关,还与鱼类的发育阶段及性别、生理状态有密切关系,故不同的鱼类肥满度与体长没有确定的规律[4-5]。图3表明,体长2.20~5.20 cm范围,正常投喂的银鲳幼鱼组间肥满度无显著性差异,而饥饿致死幼鱼的肥满度存在组间差异。饥饿致死时的肥满度是正常鱼的75.00%~59.00%,以2.20~2.80 cm组的肥满度最大,4.60~5.20 cm组的肥满度最小,这也与耐饥能力的分析相吻合。
4结论
银鲳幼鱼的饥饿与分组投喂实验结果表明:
(1)与正常投喂组相比,过量投喂能提高银鲳幼鱼增重率,显著增加其肥满度和比肝重。
(2)饥饿5 d的银鲳幼鱼开始体重下降,饥饿9 d时体重损失近一半,并导致比肝重和肥满度显著下降(p<0.05);
(3)饥饿银鲳幼鱼粗脂肪损失幅度最大,说明饥饿期间以消耗脂肪供能为主,蛋白质和糖类供能为辅。
(4)研究比较了正常和饥饿状态下银鲳幼鱼的体长与体重关系,得到正常组体长与体重的关系为:WC1=0.030 7LC12.993 1(R2= 0.982 4),饥饿幼鱼体长与体重的关系则为:WSd=0.021 6LSd2.965 8(R2=0.967 9)。受饥饿影响相同体长下饥饿幼鱼的体重明显小于正常幼鱼,且随体长增加差异增大。肥满度则随体长增加大致呈下降趋势,体长与幼鱼的耐饥能力呈正相关。
参考文献(References):
[1] ENRLICH K F, BLAXTER J H S, PEMBERTON R. Morphological and histological changes during the growth and starvation of herring and plaice larvae[J]. Marine Biology,1976,35(2):105-118.
[2] YIN Xiu-fen. Effects of starvation and re-feeding on biochemical and body parameters in gruntPlectorhynchuscinctus[D]. Shantou: Shantou University,2005.
尹秀芬.饥饿和再投喂对花尾胡椒鲷生化和形态形状指标的影响[D].汕头:汕头大学,2005.
[3] WANG Li-juan. Effects of starvation and re-feeding on compensatory growth inCarassiusauratus[D]. Nanchang: Nanchang University,2007.
万丽娟.饥饿和恢复投喂对萍乡肉红鲫补偿生长的影响[D].南昌:南昌大学,2007.
[4] GUO Yan, CAI Lin-gang,Turson, et al. The study on the biology ofT.strauchii(Kessler)in the lake of Sailimu[J]. Chinese Journal of Fisheries,2001,15(2):6-11.
郭焱,蔡林钢,吐尔逊,等.赛里木湖新疆高原鳅生物学研究[J].水产学杂志,2002,15(2):6-11.
[5] CHEN Lin, ZHOU Cai-Quan, WANG Hua, et al. Morphometric characteristics, length-weight relationship and fullness index ofAcheilognathusChankaensis[J]. Journal of China West Normal University:Natural Sciences,2009,30(4):388-391.
陈林,周材权,王华,等.兴凯鱊的比例性状、体长质量关系和肥满度[J].西华师范大学学报:自然科学版,2009,30(4):388-391.
[6] PENG Shi-ming, SHI Zhao-hong, SUN Peng, et al. Effects of breeding density on the growth and tissues biochemical indices of juvenileSilverpomfret(Pampusargenteus)[J]. Chinese Journal of Ecology,2010,29(7):1 371-1 376.
彭士明,施兆鸿,孙鹏,等.养殖密度对银鲳幼鱼生长及组织生化指标的影响[J].生态学杂志,2010,29(7):1 371-1 376.
[7] PENG Shi-ming, LIN Shao-zhen, SHI Zhao-hong, et al. Effects of rearing density on growth rate and digestive enzyme activity of juvenilePampusargenteus[J]. Marine Fisheries,2013,35(1):72-76.
彭士明,林少珍,施兆鸿,等.饲养密度对银鲳幼鱼增重率及消化酶活性的影响[J].海洋渔业,2013,35(1):72-76.
[8] SHI Zhao-hong, ZHAO Feng, WANG Jian-gang, et al. Artificial insemination and incubation ofsilverpomfret(Pampusargenteus)[J]. Fishery Modernization,2009,36(1):18-21,34.
施兆鸿,赵峰,王建钢,等.舟山渔场银鲳人工授精及孵化[J].渔业现代化,2009,36(1):18-21,34.
[9] SHI Zhao-hong,PENG Shi-ming,WANG Jian-gang, et al.Observationof embryonic, larval and juvenile development inpampusargenteusoffspring[J]. Journal of Fishery Sciences of China,2011,18(2):267-274.
施兆鸿,彭士明,王建钢,等.人工养殖银鲳子代胚胎发育及仔稚幼鱼形态观察[J].中国水产科学,2011,18(2):267-274.
[10] DU Zhen-yu, LIU Yong-jian, TIAN Li-xia, et al. Effects of starvation on visceral weight and main biochemical composition of the muscle, liver and serum in the Japanese Sea bass (Lateolabraxjaponicus)[J]. Acta Zoologica Sinica,2003,49(4):458-465.
杜震宇,刘永坚,田丽霞,等.饥饿对于鲈肌肉,肝脏和血清主要生化组成的影响[J].动物学报,2003,49(4):458-465.
[11] GUDERLEY H, LAPOINTE D, BEDARD M, et al. Metabolic priorities during starvation: enzyme sparing in liver and white muscle of Atlantic cod,GadusmorhuaL[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology,2003,135(2):347-356.
[12] LUO Zhi, LIU Yong-jian, MAI Kang-sen, et al. Effects of feeding levels on growth performance, feed utilization, body composition, and apparent digestibility coefficients of nutrients for grouperEpinepheluscoioidesjuveniles[J]. Journal of the World Aquaculture Society,2006,37(1):32-40.
[13] BISBAL G A, BENGTSON D A. Description of the starving condition in summer flounder,Paralichthysdentatus, early life history stages[J]. Fishery Bulletin,1995,93(2):217-230.
[14] WU Meng-meng. Study on compensatory growth inOncorhynchusmykissjuvenile[D]. Qingdao: Ocean University of China,2008.
吴蒙蒙.金鳟(Oncorhynchusmykiss)幼鱼的补偿生长研究[D].青岛:中国海洋大学,2008.
[15] FOSTER A R, HOULIHAN D F, HALL S I. Effects of nutritional regime on correlates of growth rate in juvenileAtlanticcod(Gadusmorhua): comparison of morphological and biochemical measurements[J]. Canadian Journal of Fisheries and Aquatic Sciences,1993,50(3):502-512.
[16] DENG Li, ZHANG Wei-min, LIN Hao-ran. Effects of starvation on the contents of growth hormone and triiodothyronine in serum, and lipid and protein of white muscles and livers inBlackSeabreams[J]. Zoological Research,2003,24(2):94-98.
邓利,张为民,林浩然.饥饿对黑鲷血清生长激素、甲状腺激素以及白肌和肝脏脂肪、蛋白质含量的影响[J].动物学研究,2003,24(2):94-98.
[17] LIU Min-hai, LUO Hai-zhong, FU Rong-bing, et al. Biochemical composition, amino acid and fatty acid composition in juvenile ofMiichthysmiiuyunder short-time starvation[J].Hydrobiologica Sinica,2009,33(2):230-235.
柳敏海,罗海忠,傅荣兵,等.短期饥饿胁迫对鮸鱼生化组成,脂肪酸和氨基酸组成的影响[J].水生生物学报,2009,33(2):230-235.
[18] LIU Bo, HE Qing-guo, TANG Yong-kai, et al. Effects of starvation on growth, physiological and biochemical parameter of GIFT strain ofNiletilapia(Oreochromisniloticus)[J]. Journal of Fishery Sciences of China,2009,16(2):230-237.
刘波,何庆国,唐永凯,等.饥饿胁迫对吉富罗非鱼生长及生理生化指标的影响[J].中国水产科学,2009,16(2):230-237.
[19] ZHOU Ai-guo, MAO Shen-li, WANG Chao, et al. Effects of starvation stress on growth and biochemical compositions inHybridSnakehead[J]. Journal of Hydroecology,2012,33(5):78-82.
周爱国,茅沈丽,王超,等.饥饿胁迫对杂交鳢生长及生化组成的影响[J].水生态学杂志,2012,33(5):78-82.
[20] QIU Ming, FENG Gong-neng, ZHANG Qi-huan, et al. Effects of starvation stress on muscle nutrients and blood indexes inPelteobagrusvachelli[J]. Feed Industry,2011,32(14):41-43.
仇明,封功能,张启焕,等.饥饿胁迫对瓦氏黄颡鱼(Pelteobagrusvachelli)幼鱼肌肉营养成分及血液指标的影响[J].饲料工业,2011,32(14):41-43.
[21] SUN Xiang-jun, LIANG Yong-jun, ZHANG Sheng-li, et al. Effects of starvation and subsequent feeding on biochemical composition and energy value ofPlatichthysstellatus[J]. Progress in Fishery Sciences,2011,32(1):24-31.
孙向军,梁拥军,张升利,等.饥饿后再投喂对星斑川鲽生化组成以及能值的影响[J].渔业科学进展,2011,32(1):24-31.
[22] SUN Li-huil, WANG Ji-ying, DING Li-yun, et al. Effects of feeding frequency on growth and body composition of juvenilePlatichthysstellatus[J]. Journal of Shanghai Ocean University,2010,19(2):190-195.
孙丽慧,王际英,丁立云,等.投喂频率对星斑川鲽幼鱼生长和体组成影响的初步研究[J].上海海洋大学学报,2010,19(2):190-195.
[23] YANG Fan, ZHANG Shi-ping, HAN Kai-jia, et al. Impact of feeding frequency on feeding, growth and feed utilization for juvenileMonopterusalbus[J]. Freshwater Fisheries,2011,41(3):50-54.
杨帆,张世萍,韩凯佳,等.投喂频率对黄鳝幼鱼摄食、生长及饵料利用效率的影响[J].淡水渔业,2011,41(3):50-54.
[24] FEI Hong-nian, ZHANG Shi-quan. Fishery resources research[M]. Beijing: Chinese Science and Technology Press,1990:245-254.
费鸿年,张诗全.水产资源学[M].北京:中国科技出版社,1990:245-254.
[25] WANG Xue-hui, DU Fei-yan, QIU Yong-song. Length-weight relationships of important commercial fishes in northern South China Sea[J].Journal of Oceanography in Taiwan Strait,2006,25(2):262-266.
王雪辉,杜飞雁,邱永松.南海北部主要经济鱼类体长与体重关系[J].台湾海峡,2006,25(2):262-266.
[26] MOREY G, MORANTA J, MASSUTI E, et al. Weight-length relationships of littoral to lower slope fishes from the western Mediterranean[J]. Fisheries Research,2003,62(1):89-96.
[27] ECOUTIN J M, ALBARET J J, TTAPE S. Length-weight relationships for fish populations of a relatively undisturbed tropical estuary: the Gambia[J]. Fisheries Research,2005,72(2-3):347-351.
Research on morphological indexes and body composition
change under starvation and excessive feeding situation
for juvenilePampusargenteus
WANG Teng-fei, GUO Xiao-ge, GU Jiang-wen, YAN Xue-mei, XU Shan-liang*
(SchoolofMarineScience,NingboUniversity,Ningbo315211,China)
Abstract:In order to explore the influence on body weight, relative fatness, hepatosomatic index and body composition under starvation and excessive feeding for juvenile Pampus argenteus, the juveniles (2.61±0.65 g) were fed by starvation and experimental groups. The physical parameters of juveniles, relative fatness, hepatosomatic index and fish essential nutrients were investigated under the conditions of normal feeding group (C), hunger 5 days (S5), starvation 9 days (S9) and the excess feeding group (D). The results are as follows: (1) Compared with the normal feeding group, all indexes of the D group are significantly increased (p<0.05), and weight gain rates (73.89±9.78)% are two times more than those in the normal group, the hepatosomatic index and relative fatness are increased 55.00% and 25.10% respectively. (2) The hepotosomatic index and relative fatness are significantly decreased under starvation stress (p<0.05). After starvation of 5 days and 9 days, the hepotosomatic indexes decreased by 8.75% and 11.25%, and the relative fatness is decreased by 21.18% and 32.16%. (3) Crude fat of starvation juvenile P. argenteus has maximum loss, and it is only 22.10% and 18.10% of the normal group respectively after starvation of 5 days and 9 days. In the meantime, the crude protein losses are only 4.06% and 4.90%. It may explain that starvation juvenile P. argenteus use the fat as the main energy, and the protein and carbohydrates as the subsidiary energy. (4) In the death group resulting from starvation, the relative fatness is no significant difference (p>0.05) in different body length groups, but the rates of weight loss are affected by body length. The loss rates are 22.89% in 2.20~2.80 cm group and increased to 35.79%~40.28% in 2.80~3.40 cm group. The relative fatness is substantially decreased with body length increasing. Body length and hunger resistance ability of juvenile P. argenteus are positively correlated.
Key words:Pampus argenteus; starvation; relative fatness; hepotosomatic index; body composition
Doi:10.3969/j.issn.1001-909X.2015.04.010
中图分类号:S965.331
文献标识码:A
文章编号:1001-909X(2015)04-0083-07
