3种蛋白含量大豆生育期内不同部位GS基因家族成员表达量差异及GS活性分析
2016-01-25杨美英张婷婷王春红武志海吉林农业大学生命科学学院吉林长春308吉林农业大学农学院吉林长春308
杨美英,韩 红,张婷婷,王春红,汲 添,于 婷,武志海(吉林农业大学生命科学学院,吉林长春308; 吉林农业大学农学院,吉林长春308)
3种蛋白含量大豆生育期内不同部位GS基因家族成员表达量差异及GS活性分析
杨美英1,韩红1,张婷婷1,王春红1,汲添1,于婷1,武志海2
(1吉林农业大学生命科学学院,吉林长春130118; 2吉林农业大学农学院,吉林长春130118)
摘要:【目的】研究谷氨酰胺合成酶(GS)各基因家族成员在不同蛋白含量大豆生育期间的表达量,认识高蛋白大豆籽粒蛋白质形成的特点.【方法】选择普通栽培大豆、高蛋白栽培大豆和高蛋白野生大豆为材料,研究了整个生育期间GS基因家族各成员在根、茎、叶和根瘤的表达量差异以及不同类型大豆根、茎和叶谷氨酰胺合成酶活性(GSA)的变化.【结果和结论】结果表明:不同蛋白含量大豆各器官中GS基因家族不同成员的表达量具有明显的差异.GSβ1在根、茎、叶和根瘤中都能高效表达;叶中GS2表达量显著升高,超过其他器官和根瘤.GSγ1在根、茎、叶中表达量极低,而根瘤GSγ1的表达量明显增加.生育期内各器官GSβ1及V3~R3期GS总表达量、叶GS2、根瘤GSγ1都表现为高蛋白类型大豆高于普通栽培大豆,这与不同蛋白含量大豆GSA的变化规律基本一致.在生育期间高蛋白类型大豆较普通栽培大豆能更有效地调控GS基因家族各成员的表达,获得GSA是籽粒蛋白质含量较高的生理特点之一.
关键词:高蛋白野生大豆;高蛋白栽培大豆;普通栽培大豆; GS基因;基因表达;谷氨酰胺合成酶活性
杨美英,韩红,张婷婷,等.3种蛋白含量大豆生育期内不同部位GS基因家族成员表达量差异及GS活性分析[J].华南农业大学学报,2015,36(3) : 83-90.
优先出版时间:2015-04-14
优先出版网址: http: / /www.cnki.net/kcms/detail/44.1110.s.20150414.0938.015.html
谷氨酰胺合成酶(GS,EC 6.3.1.2)催化谷氨酸(Glu)与NH3缩合形成谷氨酰胺(Gln),是植物氮代谢的关键酶.GS与氨的亲和力很高,还可以使植株避免氨积累所造成的毒害[1].高等植物的种子、叶、根和果实等器官中分布着多种GS的同工酶,GS的不同功能由不同的GS同工酶承担[2].Ochs等[3]已发现高等植物GS至少有2种形式,即细胞质GS和质体GS.质体GS主要存在于叶绿体基质中,为绿色组织的主要形式,叶片中质体GS的功能是通过硝酸还原和光呼吸过程来同化氨[4].细胞质GS主要存在于非光合组织内,为非光合组织的主要形式.细胞质GS的主要功能是同化由其他代谢过程(包括根瘤共生固氮)产生的氨[5-6].多数研究者认为细胞质GS是由1个小的基因家族编码,根据3'非翻译区的序列多样性,大豆细胞质GS基因可分为α、β和γ 3个种类,每个种类分别由2个成员组成,不同成员的表达有组织和器官的特异性[7].
目前关于栽培大豆谷氨酰胺合成酶活性(GSA)以及GS基因表达量变化的研究已有很多报道[8-9],GS在栽培大豆生育期间活性的变化对控制植物生长和产量形成的重要性方面已形成共识[10].但关于蛋白质含量不同大豆类型间GSA及基因表达量差异的研究报道尚不多见.我们在前期对高蛋白野生大豆与普通栽培大豆的研究中发现,高蛋白野生大豆初荚期开始各个时期的GSA都明显高于其他类型大豆[11].为明确GS各基因家族成员在不同类型大豆蛋白质形成过程中的表达量,进一步认识高蛋白类型大豆籽粒高蛋白形成的生理规律.本文选择普通栽培大豆、高蛋白栽培大豆和高蛋白野生大豆3个不同蛋白含量大豆为材料,对整个生育期内GS基因各成员的表达量以及根、茎、叶中GSA的变化进行研究,为提高普通栽培大豆籽粒蛋白质含量的选育工作提供依据.
1 材料与方法
1.1植物材料
本试验分别选用高蛋白野生大豆、高蛋白栽培大豆、普通栽培大豆(不同蛋白质含量大豆的划分方法参照文献[11])为研究材料,主要性状如表1所示.

表1 供试大豆的主要性状Tab.1 Main characteristics of different soybean varieties in the present study
1.2试验方法
1.2.1试验设计试验于2013年3月—2014年1月采用盆栽试验进行.将取自吉林农业大学试验田的耕层土壤装入盆内,每份材料种9盆,栽培大豆每盆播种3粒,野生大豆每盆播种6粒,整个生育期间不施肥料,具体方法同参考文献[11].
1.2.2植物叶、茎、根与根瘤样品的采集分别于幼苗期(V3)、分枝期(V6)、初荚期(R3)、鼓粒期(R6)、成熟期(R8)选择长势均匀的3株大豆,于上午进行叶片、根、茎和根瘤采集及指标测定;将采集的部分叶片、茎、根与根瘤用蒸馏水冲洗干净,快速用液氮处理后置于-80℃冰箱保存备用.
1.2.3引物设计利用野生大豆GS基因表达序列标签(EST)数据库,获取GS基因家族成员序列信息.根据GS基因家族各成员的3'端非编码区(3' UTR)进行qPCR引物设计,如果3'UTR序列长度不够,则向3'端编码区延伸.使用的引物设计软件为Primer Premier 5.0.qPCR引物由上海生工生物工程技术服务有限公司合成,引物序列见表2.
1.2.4叶片、茎、根和根瘤总RNA的提取、D值测定与cDNA的合成采用Trizol法提取大豆叶片、茎、根和根瘤总RNA.采用752N紫外分光光度计测定D260 nm和D280 nm.选择D260 nm/D280 nm介于1.7~2.0的样品,采用Easy ScriptTMFirst-strand cDNA Synthesis Super Mix反转录试剂盒合成cDNA.
1.2.5 GS基因家族各组分的qPCR测定通过ABI公司的Step one plus实时定量PCR仪进行扩增反应,反应体系设定20 μL: SYBR Premix ExTaqTMII (2×) 10 μL,上、下游引物各0.8 μL,ROX Reference Dye(50×) 0.4 μL,cDNA模板2.0 μL,dH2O 6.0 μL.PCR反应条件为: 95℃预变性30 s; 95℃5 s,60℃30 s,40个循环;每个反应设置3次重复.通过扩增曲线和熔解曲线,确定引物的特异性.qPCR检测数据的处理参照文献[13],采用相对定量的2-ΔΔCt方法进行.以普通栽培大豆根的GS2基因表达量为对照,对GS各基因相对表达量作图.
1.2.6生理指标的测定GSA测定采用文献[11]的方法进行;可溶性蛋白质含量采用考马斯亮蓝G-250法.
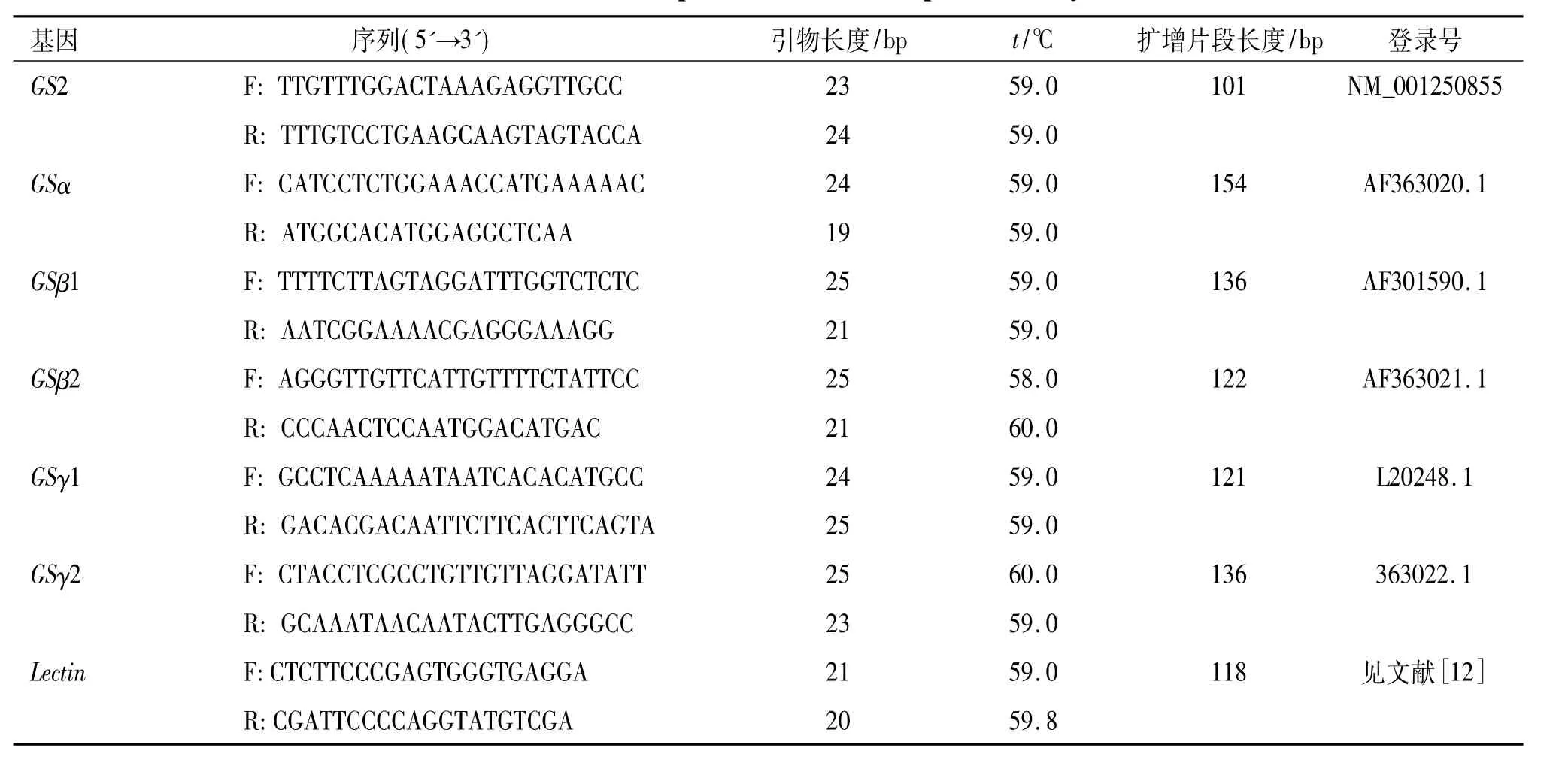
表2 供试PCR引物序列Tab.2 The PCR primers used in the present study
2 结果与分析
2.1不同类型大豆各生育期不同器官及根瘤GS基因家族各成员表达量分析
2.1.1不同蛋白含量大豆根中GS基因家族各成员表达量分析由图1可知,在整个生育期间,3种蛋白含量不同大豆GS各基因家族各成员都有表达,但GS2和GSγ与其他基因相比较,表达量极低.V3期GSα与GSβ的表达量相差不明显,但从V6~R8期,GSβ1的表达量明显高于其他基因.
从根部GS基因家族所有成员总表达量分析,R3期之前,高蛋白栽培大豆高于其他2个类型大豆,高蛋白野生大豆在R3期达到最大,普通栽培大豆各基因总表达量R6期最高,R3期略低于R6期.从GSβ1的表达量分析,高蛋白栽培大豆V6期高达3 000,高蛋白野生大豆在R3期接近2 500,普通栽培大豆最高值出现较晚,R6期的最高值也仅有1 600.3种大豆GSβ1的表达量达到最高值之后都开始下降,成熟期时3种大豆GSβ1的表达量以及基因总表达量都降至最低值,但表现为高蛋白野生大豆>高蛋白栽培大豆>普通栽培大豆.
2.1.2不同蛋白含量大豆茎中GS基因家族各成员表达量分析由图1和图2比较可知,整个生育时期,大豆茎中GS2的表达量明显高于同时期根中的表达量,GS1基因家族的各成员均有表达,但仍以GSβ的表达量最高,GS2和GSα其次,GSγ表达量持续偏低.高蛋白栽培大豆和高蛋白野生大豆各基因的总表达量以及GS2、GSβ和GSα的表达量均在V6期达到最高,随着生育进程推进表达量逐渐降低.普通栽培大豆GSβ的表达量虽在R6期达到最高,但V6~R6期间,GSβ表达量的值从587增加到686,与其他2类大豆相比增加趋势不明显.
2.1.3不同类型大豆叶的GS基因家族各成员表达量分析由图3可见,整个生育时期,3种蛋白含量不同大豆叶中GSα、GSβ1和GS2基因大量表达,GS2变化尤为明显.叶中GS2表达量高于其他任何器官和根瘤.R3期之前GS2明显高于GSβ1,R6期开始降低.从图3F中明显看出,高蛋白野生大豆叶中GS2 从V3~R3期一直增加,R3期达到最高值,然后急剧下降.整个生育期间高蛋白野生大豆GS2表达量都明显高于高蛋白栽培大豆和普通栽培大豆.

图1 3种蛋白含量大豆各生育期根GS基因家族各成员相对表达量变化Fig.1 Gene expression analyses of GS gene family members from roots of 3 types of soybean at different growth stages
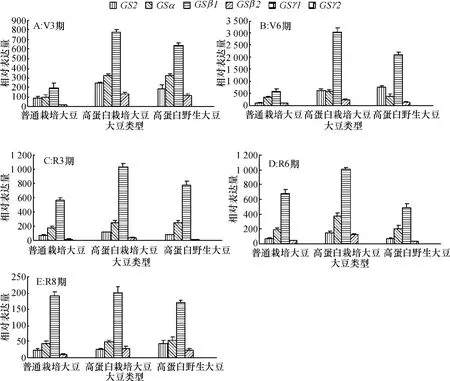
图2 3种蛋白含量大豆在不同生育时期茎的GS2和GS1家族各成员相对表达量变化Fig.2 Gene expression analyses of GS2 and GS1 family members from stems of 3 types of soybean at different growth stages
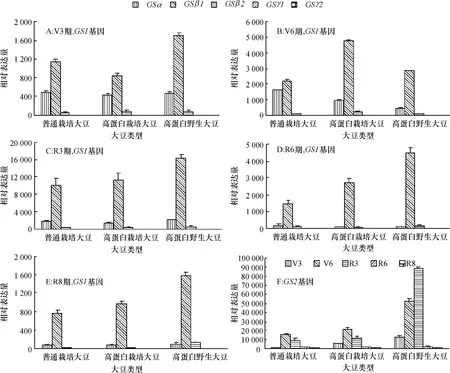
图3 3种蛋白含量大豆在不同生育时期叶GS1基因家族各成员和GS2相对表达量变化Fig.3 Gene expression analyses of GS1 gene family members and GS2 from leaves of 3 types of soybean at different growth stages
3种不同蛋白含量大豆叶片GSβ1和GSα基因的表达量在整个生育期呈现“低-高-低”的变化规律,R3期出现1个明显的峰值.GSα基因表达量就类型间比较,变化不明显.但GSβ1基因的表达量在3种大豆间明显不同.高蛋白栽培大豆GSβ1的表达量从V6期开始一直高于普通栽培大豆.高蛋白野生大豆GSβ1的表达量除V6期低于高蛋白栽培大豆外,其他时期均高于其他2类型大豆.
2.1.4不同类型大豆根瘤GS基因家族各成员表达量分析由图4可知,大豆根瘤中GSγ2的表达量较低,在图4中不能被显示出来,但其他基因都有不同程度的表达.与其他器官各基因表达量的变化相比,GSγ1表达量的增加最为明显.3种大豆根瘤GSγ1基因表达量在R3期均出现最大值,而且V3~R3期GSγ1表达量表现为高蛋白野生大豆>高蛋白栽培大豆>普通栽培大豆,R3期之后高蛋白栽培大豆GSγ1表达量略高于其他2类.
3种不同蛋白含量大豆根瘤GSβ的表达量在整个生育时期都较高,V3~V6期普通栽培大豆GSβ的表达量略高于其他2个类型大豆.高蛋白野生大豆和高蛋白栽培大豆GSβ1的表达量在R3期达到最大值,普通栽培大豆在R6期达到最高.从R3期开始,GSβ1的表达量都表现为高蛋白野生大豆>高蛋白栽培大豆>普通栽培大豆.蛋白含量大豆根瘤中GS2 和GSα也都有表达,但与GSγ1、GSβ相比,表达量仍较小,类型间相差不明显.

图4 3种蛋白含量大豆在不同生育时期根瘤的GS2和GS1家族各成员相对表达量变化Fig.4 Gene expression analyses of GS2 and GS1 family members from nodules of 3 types of soybean at different growth stages
2.2不同蛋白含量大豆不同生育期根、茎、叶GSA的变化
从图5可知,普通栽培大豆、高蛋白野生大豆和高蛋白栽培大豆在整个生育期内,根、茎和叶GSA都呈现单峰曲线的变化规律,R3期达到最高值.同一类型大豆,各器官GSA都表现为根>茎>叶.同一器官不同类型大豆相比较,R3期之前高蛋白栽培大豆GSA较高,R3期之后高蛋白野生大豆根、茎、叶各器官的GSA都要高于其他2类型大豆,这与我们前期的研究结果相一致[11].而且高蛋白野生大豆V6~R3期增长明显,R3期之后下降较缓慢.
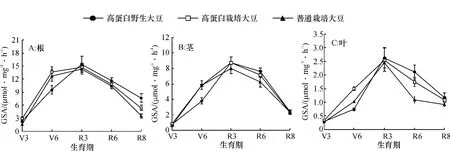
图5 3种类型大豆各生育期根、茎、叶谷氨酰胺合成酶活性(GSA)的变化Fig.5 Glutamine synthetase activaty (GSA) variation in root,stem and leaf at different growth stages of 3 types of soybean
3 讨论与结论
GS是高等植物氮素代谢的关键酶[14].根系从土壤中吸收的NO3-,通过茎、叶柄运往叶片,在硝酸还原酶等的作用下转化为氨态氮,再经GS的作用转化为谷氨酰胺,进入氮代谢.在ATP供能的情况下,它催化NH4+同化成谷氨酰胺.后者又在谷氨酸合酶(GOGAT)的催化下,将其酰胺转移到α-酮戊二酸上,从而生成2分子的谷氨酸.生物化学及遗传学研究表明,GS和GOGAT构成的循环反应是正常条件下高等植物氨同化的主要途径[15].大豆不同生育时期以及不同器官的GS基因家族各成员表现出特异的表达模式和调控方式.Bernard等[16]研究表明植物GS基因的表达受外界环境的影响,是环境因子调节植物氮素积累和利用的重要分子靶点.本试验利用盆栽的方式对全生育期3种不同蛋白含量大豆根、茎、叶和根瘤的GS2和GS1各基因家族成员表达量进行研究,结果发现同一基因在不同的器官及根瘤中表达量明显不同.GSβ1和GSβ2在各时期的根、茎、叶和根瘤中都有表达,但GSβ1的表达在各器官及根瘤中都占有绝对优势,根瘤GSβ2的表达略有增加.这与Morey等[7]和王晓波等[17]发现GSβ以根和成熟根瘤表达为主的结论有一定差异.本研究中叶GS2表达量超过其他任何基因的表达而达到最大.其他任何时期各器官GSγ1表达量与其他基因相比都极低,根瘤中GSγ1大量表达,这与Swarup等[18]和Bennett等[19]发现GSγ1表现为根瘤特异表达,GSγ在植物的茎、叶柄和正在发芽种子的子叶中能低水平表达的结果基本一致.许多研究表明,GSα基因主要在子叶、干种子胚轴、发芽2 d豆芽、维管组织幼根表达,根瘤中也有少量表达[18,20].本试验发现根、茎、叶和根瘤中GSα从V3~R8期都有表达,但与GSβ相比较,表达量较低.
本试验发现不同类型大豆GS基因家族各成员的表达也存在明显差异.GSβ1在各器官及根瘤都是主要的GS表达者,在较多的生长时期都表现出高蛋白大豆类型>普通栽培大豆的特点.叶片中GS2表达量和根瘤中GSγ1表达量明显上升,而且在V3~R3期间也出现高蛋白野生大豆>高蛋白栽培大豆>普通栽培大豆的规律.对不同类型大豆基因总表达量的比较分析也得出同样的规律,高蛋白野生大豆和高蛋白栽培大豆都要略高于普通栽培大豆,叶和根瘤表现明显.说明在整个生育期间,高蛋白类型大豆较普通栽培大豆能更有效地上调GS基因家族各成员的表达.
许多研究者认为GS1的调控主要发生在转录水平[21].但酶活性受品种自身遗传特性及光照、氮素形态、温度等环境因素的影响,栽培管理措施和生态环境条件亦具有十分重要的作用[22-24].在特定环境条件下,GS基因家族各成员转录活性与酶分子的组装之间存在近乎完美的协调关系,酶分子的利用率才是酶活性高低的先决条件[25].分析不同蛋白含量大豆的GSA发现,R3期之后,各类型大豆根、茎、叶的
GSA都表现为高蛋白野生大豆>高蛋白栽培大豆>普通栽培大豆的规律.这说明高蛋白类型大豆在R3期之后GSA高,同化氨较多,促进了GS基因家族各成员的表达.同时,各基因的高表达又有利于形成更多的酶分子,增加GSA.因此,在整个生育期内,高蛋白类型大豆较普通栽培大豆能有效地调控GS基因家族各成员的表达,获得高GSA是籽粒蛋白质含量较高的生理特点之一.这一规律可能有助于增加体内可供贮存与运输的有机氮总量,为高蛋白类型大豆籽粒蛋白质的合成提供充足的原料.
参考文献:
[1]GEBHARDT C,OLIVER J E,FORDE B G,et al.Primary structure and differential expression of glutamine synthetase genes in nodules,roots and leaves of Phaseolus vulgaris[J].EMBO J,1986,5(7) : 1429-1435.
[2]韩娜,葛荣朝,赵宝存,等.植物谷氨酰胺合成酶研究进展[J].河北师范大学学报:自然科学版,2004,28 (4) : 407-423.
[3]OCHS G,SCHOTH G,TRISCHLER M,et al.Complexity and expression of the glutamine synthetase multigene family in the amphidiploid crop Brassica napus[J].Plant Mol Boil,1999,39(3) : 395-405.
[4]LAM H M,COSCHIGANO K T,OLIVEIRA I C,et al.The molecular genetics of nitrogen assimilation into amino acids in higher plants[J].Annu Rev Plant Physiol Plant Mol Biol,1996,47(1) : 569-593.
[5]PETERMAN T M,GOODMAN H M.The glutamine synthetase gene family of Arabidopsis thaliana: Light-regulation and differential expression in leaves,roots and seeds [J].Mol Gen Genet,1991,230(1/2) : 145-154.
[6]MARSOLIER M C,DEBROSSES G,HIREL B.Identification of several soybean cytosolic glutamine synthetase transcripts highly or specifically expressed in nodules: Expression studies using one of the corresponding genes in transgenic Lotus corniculatus[J].Plant Mol Biol,1995,27(1) : 1-15.
[7]MOREY K J,ORTEGA J L,SENGUPTA-GOPALAN C.Cytosolic glutamine synthetase in soybean is encloded by a multigene family,and members are regulated in an organspecific and developmental manner[J].Plant Physiol,2002,128(1) : 182-193.
[8]李姚,马春梅,龚振平.春大豆谷氨酰胺合酶(GS)活性动态的研究[J].东北农业大学学报,2006,37(6) : 729-732.
[9]董守坤.大豆吸收利用氮素规律及相关酶活性研究[D].哈尔滨:东北农业大学,2008.
[10]MARTIN A,LEE J,KICHEY T,et al.Two cytosolic glutamine synthetase isoforms of maize are specifically involved in the control of grain production[J].The Plant Cell,2006,18(11) : 3252-3274.
[11]杨美英,赵洪锟,蒋春玲,等.不同蛋白含量大豆品种氮代谢关键酶活及叶片氮同化物含量变化[J].中国油料作物学报,2010,32(4) : 500-505.
[12]陈颖,徐宝梁,苏宁,等.实时荧光定量PCR技术检测转基因大豆方法的建立[J].食品与发酵工业,2003,29 (8) : 65-69.
[13]ZHANG B,CHEN K,BOWEN J,et al.Differential expression within the LOX gene family in ripening kiwifruit [J].J Exp Bot,2006,57(14) : 3825-3836.
[14]MIFLIN B J,LEA P J.Ammonia assimilation[M]/ / MIFLIN B J.Biochemistry of plants : Vol.5.New York: Academic Press,1980: 169-202.
[15]陈胜勇,李观康,汪云,等.谷氨酰胺合成酶的研究进展[J].中国农学通报,2010,26(22) : 45-49.
[16]BERNARD S M,HABASH D Z.The importance of cytosolic gluta-mine synthetase in nitrogen assimilation and recycling[J].New Phytol,2009,182(3) : 608-620.
[17]王晓波,滕婉,何雪,等.大豆谷氨酰胺合成酶基因的分类及根瘤特异表达GmGS1β2基因功能的初步分析[J].作物学报,2013,39(12) : 2145-2153.
[18]SWARUP R,BENNETT M J,CULLIMORE J V.Expression of glutamine-synthetase genes in cotyledons of germinating Phaseolus vulgaris L.[J].Planta,1990,183(1) : 51-56.
[19]BENNETT M J,LIGHTFOOT D A,CULLIMORE J V.cDNA sequence and differential expression of the gene encoding the glutamine synthetase γ polypeptide of Phaseolus vulgaris L.[J].Plant Mol Biol,1989,12(5) : 553-565.
[20]WATSON A T,CULLIMORE J V.Characterization of the expression of the glutamine synthetase gln-α gene of Phaseolus vulgaris using promoter-reporter gene fusions in transgenic plants[J].Plant Sci,1996,120(2) : 139-151.
[21]SINGH B K.Plants amino acids,biochemistry and biotechnology[M].New York: Marcel Dekker Inc,1998: 49-109.
[22]陈煜,朱保葛,张敬.不同氮源对大豆硝酸还原酶和谷氨酰胺合成酶活性及蛋白质含量的影响[J].大豆科学,2004,23(2) : 143-146.
[23]刘开昌,胡昌浩,董树亭.高油、高淀粉玉米籽粒主要品质成分积累及其生理生化特性[J].作物学报,2002,28(4) : 492-498.
[24]赵俊晔,于振文.施氮量对小麦强势和弱势籽粒氮素代谢及蛋白质合成的影响[J].中国农业科学,2005,38(8) : 1547-1554.
[25]CREN M,HIREL B.Glutamine synthetase in higher plants: Regulation of gene and protein expression from the organ to the cell[J].Plant Cell Physiol,1999,40(12) : 1187-1193.
【责任编辑柴焰】
Differences of GS gene family members expression and analyses of GS activation in different parts of three types of soybean at whole growth stage
YANG Meiying1,HAN Hong1,ZHANG Tingting1,WANG Chunhong1,JI Tian1,YU Ting1,WU Zhihai2
(1 College of Life Science,Jilin Agricultural University,Changchun 130118,China; 2 College of Agronomy,Jilin Agricultural University,Changchun 130118,China)
Abstract:【Objective】The purpose of this study was to explore the expression differences of glutamine synthetase (GS) gene family members in 3 types of soybean during growth stages and understand the characteristics of protein formation of soybean with high protein content.【Method】GS gene expression quantity and glutamine synthetase activaty (GSA) in root,stem,leaf and root nodul from three tested materials,Glycine max,G.max with high protein content and G.soja with high protein content,were investigated at whole growth stage,respectively.【Result and conclusion】The results were two as follows: the expression of each GS gene member in different organs of three types of soybean was obviously different.GSβ1 in root,stem,leaf and root nodules all expressed high.The expression quantity of GS2 in leaf was significantly higher than that of the other two organs and root nodules.The expression of GSγ1 inbook=84,ebook=88nodule increased,while the expression of GSγ1 in roots,stems,leaf was very low.The expression quantity of GSβ1 in root,stem,leaf and root nodules in whole growth period,GS2 in leaf,GSγ1 in root nodule and the general expression quantity of GS genes at V3-R3 stages were higher in high protein soybean variety than those of normally cultivated soybean variety.This variation was consistent with the variational rule of GSA of three types of soybean.Compared with G.max,effectively regulating the expression of GS gene family members and obtaining high GSA in the whole growth period are characteristics of high protein content soybean.
Key words:Glycine soja of high protein content; Glycine max of high protein content; Glycine max; GS gene; gene expression; glutamine synthetase ativaty(GSA)
基金项目:国家自然科学基金(31201687) ;吉林省自然科学基金(20101573)
作者简介:杨美英(1974—),女,副教授,博士,E-mail: jlaumeiying@ 163.com;韩红(1988—),女,硕士研究生,E-mail: hanhonghh1988@163.com;对本文具有同等贡献;通信作者:武志海(1975—),男,副教授,博士,E-mail: wuzhihai1116@163.com
收稿日期:2014-02-21
文章编号:1001-411X(2015) 03-0083-08
文献标志码:A
中图分类号:S565.101
