miR-122靶向示踪载体FA-OCC-QDs的生物学功能※
2016-01-22李润乐段路路刘昆梅
李润乐,廖 瑜,段路路,赵 杰,刘昆梅,汤 锋**
(1.青海大学高原医学研究中心,青海 西宁 810001;
2.宁夏医科大学颅脑疾病重点实验室,宁夏,银川,750004)
miR-122靶向示踪载体FA-OCC-QDs的生物学功能※
李润乐1,廖瑜1,段路路1,赵杰1,刘昆梅2*,汤锋1**
(1.青海大学高原医学研究中心,青海 西宁 810001;
2.宁夏医科大学颅脑疾病重点实验室,宁夏,银川,750004)
摘要目的明确小分子RNA-122(miR-122)靶向示踪载体FA-OCC-QDs的生物学功能。方法通过化学修饰得到了带有正电荷的叶酸靶向性双亲壳聚糖衍生物N-辛基O-羧甲基壳聚糖(FA-OCC),并通过其疏水腔包裹CdSe量子点获得了一种新型靶向性的示踪壳聚糖衍生物FA-OCC-QDs。通过显微结构观察、荧光波长扫描、zeta电位测定等方法考察FA-OCC-QDs的物理及光学活性,并对其靶向性、细胞摄取效率、转染效率及细胞毒性等生物学活性进行考察。结果FA-OCC-QDS具有靶向性高、转染效率高及细胞毒性小的特点。结论小分子RNA靶向示踪载体FA-OCC-QDs可作为靶向示踪的miRNA载体,为后续小分子RNA的基础研究提供有利的工具。
关键词N-辛基O-羧甲基壳聚糖靶向载体荧光标记
BIOLOGICAL FUNCTION OF TARGETING AND
TRACING DELIVERY FOR miR-122※
Li Runle1,Duan Lulu1,Zhao Jie1,Liu Kunmei2*,Tang Feng1**
(1.Research Center for High Altitude Medicine,Qinghai University,Xining 810001;
2.Ningxia Key laboratory of Cerebrocranial Diseases,School of Clinical Medicine,
Ningxia Medical University,Yinchuan 750004)
Abstract ObjectiveTo character the biological function and tracing delivery for miR-122.Method A novel targeting and biodegradable N-octyl-O,N-carboxymethyl chitosan-folic acid conjugate(OCC-FA)coated Quantum Dots(QDs)FA-OCC-QDs was designed and synthesized.The physicochemical properties of OCC-FA-QDs were investigated in detail.In addition,uptake efficiency,target efficiency and cytotoxicity were carried out in cell level with folate receptor overexpression on its surface.Results The result was shown that FA-OCC-QDS with evident targeting effect and no cytotoxicity.Conclution This research has successfully synthesized a targeting miR-122 carrier,It would provide a powerful tool for microRNA basic research.
KeywordsOCC-FA-QDsTargeting deliveryFluorescence labelin
荧光标记物量子点由于其优良的荧光性能,目前已在生物工程的各个领域广泛使用。量子点(Quantum dots,QDs)是一种由Ⅱ-Ⅵ族(如CdSe、CdTe、CdS、ZnSe等)或Ⅲ-Ⅴ族(如InP、InAs等)元素组成的纳米颗粒,又称半导体纳米晶体(nanocrystals,NCs),目前对CdSe、CdTe研究较多[1-2]。QDs一般是直径为1~10 nm的球状晶体[3],具有核壳结构,以CdSe、CdTe等量子点为核,外部使用ZnS、ZnSe、CdS等形成表面的薄膜,此结构具有较好的光化学稳定性和高的发光产率。荧光标记物的光谱性质与形成无关,主要取决于半导体纳米粒子的半径大小,量子点产生光子的波长与其粒径呈正相关,改变粒径的大小可以获得从紫外到近红外范围内任意点的光谱[4]。QDs是一类重要的纳米材料,经过修饰后,其表面带有活性功能集团,能够连接DNA和蛋白质等[5-7]。
壳聚糖(chitosan)是由甲壳素(chitin)脱乙酰化制得的一种聚氨基葡萄糖,是含有(1,4)-2-乙酰胺基-D-葡糖单元和(1,4)-2-氨基-D-葡糖单元的共聚物[8],后者一般超过65%。壳聚糖无毒,来源丰富,具有良好的可降解性和相容性[9]。近年来随着给药系统的发展,壳聚糖成为一种新型的辅料,在药物控释、缓释、靶向智能释药中应用广泛[10-14]。
本课题拟通过双亲化学集团修饰得到带有正电荷的叶酸靶向性双亲壳聚糖衍生物N-辛基O-羧甲基壳聚糖(FA-OCC),通过显微结构观察、荧光波长扫描、zeta电位测定等方法考察FA-OCC-QDs的物理及光学活性,并对其肿瘤靶向性、细胞摄取效率、转染效率及细胞毒性等生物学活性进行考察。
1材料与方法
1.1材料
壳聚糖(脱乙酰度60%,相对分子量70kd)购自南通双林生物制品有限公司;氧化铬(CdO)、十八烷酸stearic acidCAS:57-11-4、氧化三辛基膦TOPO CAS:78-50-2、十六胺CAS:143-27-1、硒粉、二甲基锌、六甲基二硅硫烷、正己烷、EDC、N,N-二甲基乙二胺、叶酸均购自美国Sigma公司。1640培养基、胎牛血清购自美国Gibico公司。乳腺癌MCF-7细胞株为本实验室保存品。乙酸、一氯乙酸、冰醋酸、正辛醛、甲醇等常规试剂均为市场分析纯。
1.2实验方法
1.2.1CdSe量子点的合成
1 mmol氧化铬溶于1 g十八烷酸并加热,当形成澄清溶液时,加入5 g氧化三辛基膦(TOPO)和5 g十六胺混合物,在氮气条件下加热至250 ℃反应10 min后升高至350 ℃时加入等摩尔的硒溶液注射至反应体系,当混合物变为橙红色表明量子点形成,350 ℃反应2 min得到绿色荧光量子点,400 ℃反应20 min得到红色荧光量子点,然后加入保护溶液20 mM二甲基锌和六甲基二硅硫烷去保护CdSe core。将量子点冷却至室温,加入甲醇和正己烷洗涤并离心。
1.2.2FA-OCC的合成
1.2.2.1合成N-辛基O-羧甲基壳聚糖(OCC)
将O-壳聚糖4 g和正辛醛4 mL加入到120 mL的甲醇中,30 ℃搅拌12 h,少量分批加入KBH4 3 g,持续搅拌12 h,用1 mol/L NaOH调节至中性后过滤。分别使用甲醇和水交替洗涤滤饼3~4次,并将滤饼真空干燥,得到中间产物N-辛基壳聚糖[15-16]。
1.2.2.2制备OCC-NH2
准确称取2 g OCC溶于浓度为1% 的乙酸溶液,然后借助pH测试仪调节溶液pH至5.0(5%NaOH),室温下边搅拌边加入EDAC活化羧基,继续搅拌18 h后加入叶酸,反应完成后使用5%NaOH调节pH至弱酸性,然后通过高速离心机离心溶解、超声细胞破碎仪超声、透析袋透析得到终产物FA-OCC[17]。
1.2.2.3修饰叶酸
参照Hou Z等人的方法[18]称取0.5 g OCC-NH2将其溶于浓度为1% 的乙酸溶液,调节pH至5.0,室温条件下边搅拌并缓慢加入EDAC活化羧基连续搅拌18 h后加入叶酸,待反应完成后用5% NaOH调节溶液体系pH至弱碱性(pH=8.0),经高速离心机离心溶解、超声细胞破碎仪超声、透析袋透析得到0.27 g最终产物FA-OCC[19]。
1.2.3FA-OCC包裹CdSe量子点
将配置好的FA-OCC溶液和过量的量子点氯仿溶液混合,摇匀后室温放置,离心后取上清得到相应发光波长的不同荧光强度的水溶性壳聚糖-量子点荧光探针,后用电子显微镜、荧光扫描仪等测定量子点标记壳聚糖的荧光、粒径及表面电荷等。
1.2.4叶酸靶向性的FA-OCC-QDs携带microRNA
配制2%的水溶性壳聚糖-量子点荧光RNA载体溶液,将壳聚糖溶液与5 μL的20 nM的miR-122-mimics的DEPC水溶液按体积比1:1、1:2、1:3、1:4、1:5混合,混匀,室温静置10 min,待壳聚糖与RNA结合后,用琼脂糖凝胶电泳检测。
1.2.5FA-OCC-QDs探针细胞毒性的检测
将miR-122-mimics与已经过化学结构修饰的壳聚糖载体按1:3的计量混合后,室温静置30 min,使目的RNA与量子点标记靶向性壳聚糖载体充分结合后分别将0.05、0.10、0.15、0.20、0.25、0.30、0.35 μL靶向性壳聚糖载体加入细胞培养板,每孔设3个副孔,培养24 h后加入MTT,用MTT法检测。
2结果
2.1CdSe量子点的光学活性
倒置荧光显微镜实验结果显示,在紫外激发光下,成功获得了具有绿色荧光和红色荧光的CdSe量子点,见图1A、C,其中绿色荧光CdSe量子点的最大发射为437 nm ,见图1B,红色荧光CdSe量子点的最大发射波长为535 nm,见图1D。

Figure 1 Optical characteristic of CdSe QDs
2.2N-辛基O-羧甲基壳聚糖FA-OCC-QDs的粒径
粒径仪检测结果显示,FA-OCC粒径的平均粒径为257.0 nm,制备的纳米粒粒度分析显示,纳米粒大小比较均匀,粒径分布范围较窄。
2.3N-辛基O-羧甲基壳聚糖FA-OCC-QDs 的电镜观察
电镜观察结果显示,FA-OCC-QDs的平均粒径大约为220 nm,并且呈球形分布,见图2。相比于粒径检测仪结果略小,原因可能是粒径分析仪显示的粒径是FA-OCC-QDs在水溶液中的分布,而电镜的检测条件是干燥的,这与先前的研究报道结果相似[20-21]。

Figure 2 Size distribution and TEM image of FA-OCC-QSs
2.4N-辛基O-羧甲基壳聚糖FA-OCC的Zeta电位
Zeta电位分析仪测定结果为FA-OCC-QDs的Zeta电位为0.8 mV。Zeta电位测定显示,FA-OCC-QDs纳米粒表面带有正电荷, 能够与RNA表面的负电荷利用正负电荷相互吸引偶联从而进行结合,见图3。
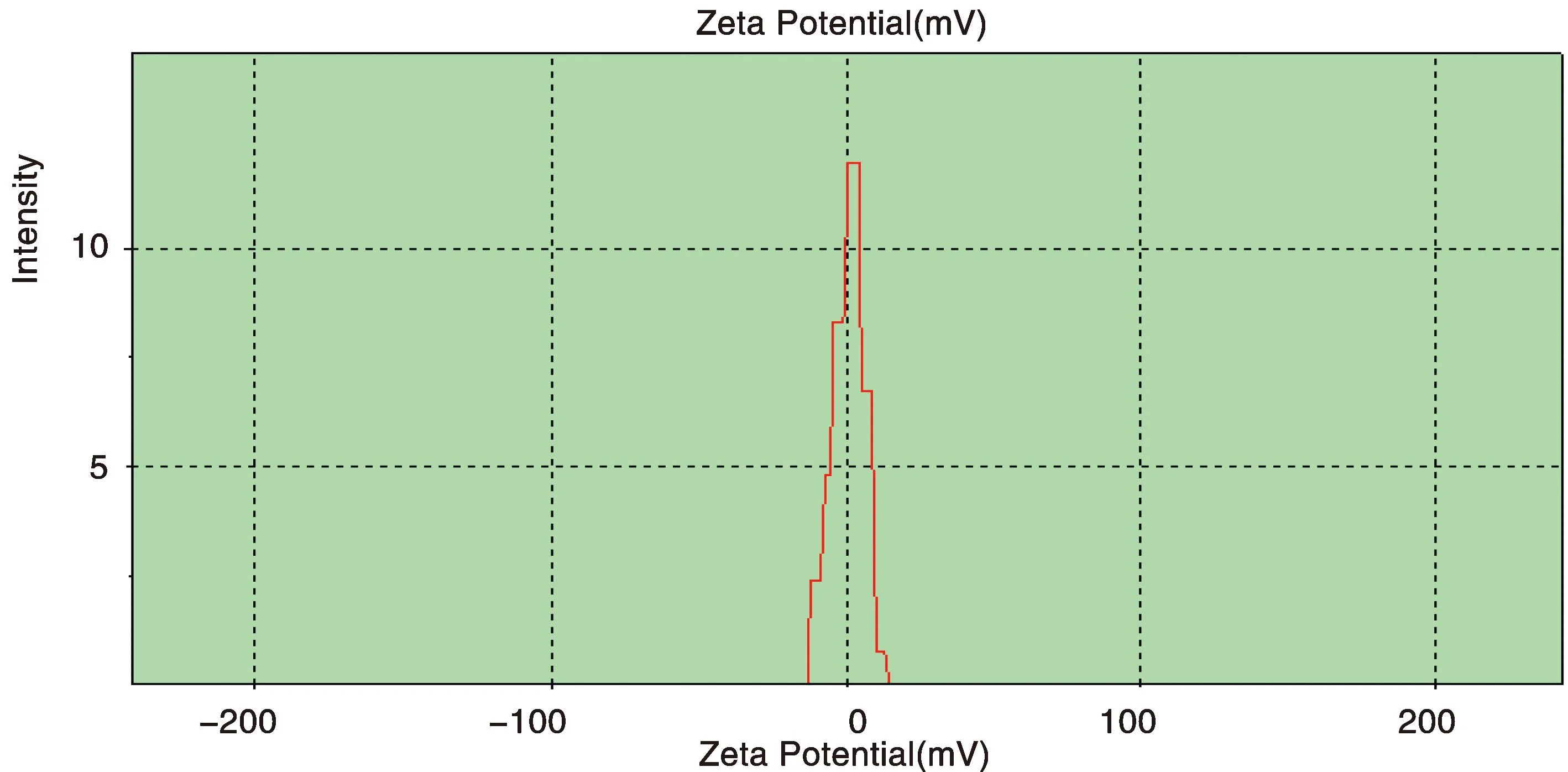
Figure 3 Zeta potential of FA-OCC-QDs
2.5N-辛基O-羧甲基壳聚糖FA-OCC-QDs的光学活性
结果表明,FA-OCC包裹CdSe红色量子点后荧光强度略微变小,见图4;激光共聚焦显微镜观察结果显示,FA-OCC-QDs分布均匀,且包裹率达到了后续实验的要求。

Figure 4 Optical characteristic of FA-OCC-QDs
2.6N-辛基O-羧甲基壳聚糖FA-OCC-QDs的细胞毒性
在FA-OCC-QDs的光学活性达到了示踪的要求后,我们运用MTT实验进一步验证了FA-OCC-QDs的细胞毒性。实验结果表明,FA-OCC-QDs在低浓度时无明显的抑制作用,IC50为0.22 μM,见图5。

Figure 5 Cytotoxicity of FA-OCC-QDs in breast cancer cell lines MCF-7
2.7N-辛基O-羧甲基壳聚糖FA-OCC-QDs的miRNA载体活性
由于FA-OCC-QDs表面带有正电荷的特性,我们考察了0.05 μM浓度FA-OCC-QDs溶液携带小分子RNA的能力,RNA的浓度为20 μM,见图6,当RNA与FA-OCC-QDs的体积比为1:3时,能够完全携带小分子RNA。

Figure 6 The capability of FA-OCC-QDs carrying RNA( RNA:FA-OCC-QDs)
2.8N-辛基O-羧甲基壳聚糖FA-OCC-QDs携带小分子RNA的转染效率
在验证了FA-OCC-QDs携带小分子RNA的能力后,我们将其与商业化转染试剂lipo-2000携带FITC标记的小分子RNA进行了转染效率的对比,发现转染效率与荧光强度均高于商业化的lipo-2000,见图7。
携带miR-122-mimics与携带对照组NC相比,在乳腺癌细胞系MCF-7中能够稳定上调miR-122的表达水平,但是表达水平略低于lipo-2000,见图8。可能原因是FA-OCC部分带正电荷的-NH2包裹在疏水腔内,结合带负电的RNA后起到了缓释作用而造成。

Figure 7 The transfection efficiency of FA-OCC-QDs compare to Lipo-2000
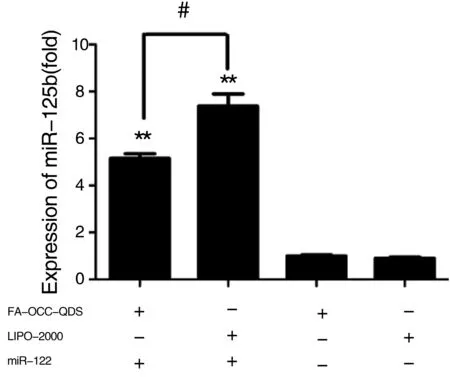
The normalized miR-122 expression for NC was set 1.Data were present as mean±SEM,n=3,*P<0.05,**P<0.01 vs. NC group, #P<0.05 vs. lipo-2000 group
Figure 8Expression of miR-122 by transfected with lipo-2000 and FA-OCC-QDs
3讨论
与传统的有机染料荧光物质相比较,量子点主要有以下几个方面的优点:(1)量子点是无机半导体荧光材料,用高于带隙能量的光均可以激发,激发谱为连续谱带,具有发射谱较窄的特点,半峰高宽通常为30 nm左右;(2)其光稳定性高于传统的有机发光染料,使得研究人员可以长时间观察细胞、分子在组织中的活动;(3)可以通过调整量子点的尺寸来得到不同颜色的发射荧光[20,22-23]。
目前应用广泛的RNA载体包括病毒载体系统及非病毒载体系统:病毒载体存在着致瘤或引发免疫应答等安全性问题,且质量控制困难、不易大量生产;非病毒载体主要是壳聚糖衍生物、二氧化硅、磁流体、聚乳酸等,由于CdSe量子点的毒性较大,非病毒载体需要在其表面进行包裹和修饰,从而降低毒性并引入活性基团,利于增强荧光示踪剂与生物素的亲和力和特异性。而壳聚糖是迄今发现的唯一天然碱性多糖,分子链上丰富的-NH2基和-OH基等活性基团有利于其化学结构修饰,壳聚糖改性后,显示出更好的溶解性、稳定性、低毒性、生物相容性等多种功能特性,作为载体的应用愈来愈具有广阔的研究前景,尤其是优良的生物相容性和生物可降解性,使壳聚糖成为当今最具潜力的非病毒性基因载体之一。随着对壳聚糖的修饰及其生物学活性不断地深入研究,壳聚糖作为载体材料的发展趋势将更加明朗,其应用领域也会不断趋向多元化。
本课题通过双亲基团修饰壳聚糖得到了双亲壳聚糖衍生物FA-OCC-QDs,双亲基团的修饰不但增强了壳聚糖水溶性,而且其内部的疏水腔可以用来包裹脂溶性药物或细胞毒性大的示踪物质;在双亲基团修饰的基础上,通过修饰-NH2可以控制FA-OCC-QDs表面的电位,为小RNA类药物提供新的药物载体。
参考文献
[1]Vanmaekelbergh D,Liljeroth P.Electron-conducting quantum dot solids:novel materials based on colloidal semiconductor nanocrystals[J].Chem Soc Rev,2005,34:299-312.
[2]Doty RC,Fernig DG,Levy R.Nanoscale science:a big step towards the Holy Grail of single molecule biochemistry and molecular biology[J].Cell Mol Life Sci,2004,61:1843-1849.
[3]Li ZH,Peng J,Chen HL.Bioconjugated quantum dots as fluorescent probes for biomedical imaging[J].J Nanosci Nanotechnol,2011,11:7521-7536.
[4]Lu ZS,Li CM.Quantum dot-based nanocomposites for biomedical applications[J].Curr Med Chem,2011,18:3516-3528.
[5]Barroso MM.Quantum dots in cell biology[J].J Histochem Cytochem,2011,59:237-251.
[6]Gao J,Chen X,Cheng Z.Near-infrared quantum dots as optical probes for tumor imaging[J].Curr Top Med Chem,2010,10:1147-1157.
[7]Ma Q,Su X.Near-infrared quantum dots:synthesis,functionalization and analytical applications[J].Analyst,2010,135:1867-1877.
[8]Ray SD.Potential aspects of chitosan as pharmaceutical excipient[J].Acta Pol Pharm,2011,68:619-622.
[9]Kean T,Thanou M.Biodegradation,biodistribution and toxicity of chitosan[J].Adv Drug Deliv Rev,2010,62:3-11.
[10]Zhang J,Xia W,Liu P,et al.Chitosan modification and pharmaceutical/biomedical applications[J].Mar Drugs,2010,8:1962-1987.
[11]Andrade F,Antunes F,Nascimento AV,et al.Chitosan formulations as carriers for therapeutic proteins[J].Curr Drug Discov Technol,2011,8:157-172.
[12]Chan P,Kurisawa M,Chung JE,et al.Synthesis and characterization of chitosan-g-poly(ethylene glycol)-folate as a non-viral carrier for tumor-targeted gene delivery[J].Biomaterials,2007,28:540-549.
[13]Park Y,Kang E,Kwon OJ,et al.Tumor targeted adenovirus nanocomplex ionically crosslinked by chitosan[J].J Control Release,2010,148:e124.
[14]Zu Y,Zhao Q,Zhao X,et al.Process optimization for the preparation of oligomycin-loaded folate-conjugated chitosan nanoparticles as a tumor-targeted drug delivery system using a two-level factorial design method[J].Int J Nanomedicine,2011,6:3429-3441.
[15]张灿,丁娅,平其能.新型两亲性N-辛基-N-PEG化壳聚糖衍生物的合成与表征[J].中国药科大学学报,2005,36:201-204.
[16]李红霞,张灿,尤启东.N-辛基-N'-亚氨基-o-羧甲基壳聚糖衍生物的合成、表征与体外PH敏感性[J].中国药科大学学报,2009,40(5):385-388.
[17]Zou A,Huo M,Zhang Y,et al.Octreotide-modified N-octyl-O,N-carboxymethyl chitosan micelles as potential carriers for targeted antitumor drug delivery[J].J Pharm Sci,2012,101:627-640.
[18]Hou Z,Zhan C,Jiang Q,et al.Both FA- and mPEG-conjugated chitosan nanoparticles for targeted cellular uptake and enhanced tumor tissue distribution[J].Nanoscale Res Lett,2011,6:563.
[19]Zhao H,Yung LY.Selectivity of folate conjugated polymer micelles against different tumor cells[J].Int J Pharm,2008,349:256-268.
[20]Cao J,Zhu H,Deng D,et al.In vivo NIR imaging with PbS quantum dots entrapped in biodegradable micelles[J].J Biomed Mater Res A,2012,100:958-968.
[21]Cadena-Nava RD,Hu Y,Garmann RF,et al.Exploiting fluorescent polymers to probe the self-assembly of virus-like particles[J].J Phys Chem B,2011,115:2386-2391.
[22]Thiollet S,Higson S,White N,et al.Investigation and Development of Quantum Dot-Encoded Microsphere Bioconjugates for DNA Detection by Flow Cytometry[J].J Fluoresc,2011.
[23]Chattopadhyay PK.Quantum dot technology in flow cytometry[J].Methods Cell Biol,2011,102:463-477.
收稿日期2015-07-10
DOI:10.13452/j.cnki.jqmc.2015.04.007
中图分类号R318.08
文献标识码A
※:国家自然科学基金项目(No.81360300);青海省自然科学基金项目(No.2013-Z-931Q)
李润乐(1987~),女,回族,宁夏籍,博士研究生. *:通讯作者,博士,副教授;**:通讯作者,副教授,硕导
