新生大鼠缺血缺氧性脑损伤组织中HAX-1、Caspase-3、bcl-2表达变化及意义
2016-01-20黄海英陈尚明赵建美南通大学附属医院江苏南通226001
黄海英,陈尚明,赵建美(南通大学附属医院,江苏南通226001)
新生大鼠缺血缺氧性脑损伤组织中HAX-1、Caspase-3、bcl-2表达变化及意义
黄海英,陈尚明,赵建美
(南通大学附属医院,江苏南通226001)
摘要:目的观察新生大鼠缺氧缺血性脑损伤( HIBD)组织中血细胞特异蛋白1相关蛋白X-1( HAX-1)、Caspase-3、bcl-2的表达,并探讨其意义。方法128只大鼠随机分为观察组和对照组各64只,观察组采用Rice法制备HIBD模型,对照组仅分离左侧颈总动脉不结扎。分别于造模后0、2、6、12、24、48、72 h断头取脑,采用Western blot法检测大脑皮层HAX-1、Caspase-3、bcl-2蛋白。结果与对照组同时点比较,观察组HAX-1于造模后6、12、18、48 h表达升高,Caspase-3于造模后6、12、18 h表达升高,bcl-2于造模后2、6、12 h表达升高,P均<0.05;观察组造模后12、18 h的HAX-1的表达水平均高于造模后6 h,P均<0.05。结论新生大鼠HIBD模型大脑皮层中存在HAX-1、Caspase-3、bcl-2高表达,三者共同参与了HIBD的发生、发展。
关键词:缺血缺氧性脑损伤;血细胞特异蛋白1相关蛋白X-1;凋亡蛋白; B淋巴细胞瘤/白血病2基因
新生儿缺血缺氧性脑损伤( HIBD)是导致儿童神经系统损伤和残疾的最常见原因[1,2],其发生机制目前尚未明确。血细胞特异蛋白1相关蛋白X-1( HAX-1)是一种抗凋亡基因[3],研究发现其在脑出血、创伤性脑外伤[4]、多囊肾[5]、系统性红斑狼疮[6]、银屑病[7]、中性粒细胞缺乏症[8]等疾病的发生、进展过程中起重要作用。但是,目前对于HAX-1在HIBD脑损伤中的作用尚未见报道。2012年9月~2013年2月,我们观察了HIBD大鼠大脑皮层中HAX-1、Caspase-3、bcl-2的表达,旨在探讨三者在HIBD发生、发展中的作用。现报告如下。
1 材料与方法
1.1动物与试剂动物: 7日龄清洁级SD大鼠128只,雌雄不限,体质量12~18 g,由南通大学实验动物中心提供。试剂: ITC标记的羊抗小鼠IgG (北京中杉),Cys标记的兔抗小鼠IgG (北京中杉),HAX-1单克隆抗体( BD),DAB试剂盒( DAKO),ELC化学发光试剂盒(碧云天生物技术研究所),3-磷酸甘油醛脱氢酶( GAPDH,Sigma),Caspase-3、bcl-2试剂( R&D)。
1.2动物分组与造模处理128只大鼠随机分为观察组和对照组各64只,观察组采用Rice方法[9]制备HIBD模型。造模后2.5 h采用Longa评分法[10]行神经行为缺损评分,2~3分视为造模成功。死亡12只,最终造模成功52只。对照组仅分离左侧颈总动脉,不做结扎处理,其余处理同观察组;死亡11只,最终观察53只。
1.3大脑皮层HAX-1、Caspase-3、bcl-2蛋白表达检测两组分别于造模后0、2、6、12、24、48、72 h各处死7~8只,断头取脑。在解剖显微镜下剥脱脑膜,取出海马CA1区对应大脑皮层,连续冠状切片,片厚4 mm。采用Western blot法检测大脑皮层HAX-1、Caspase-3、bcl-2蛋白,实验步骤严格按试剂盒说明进行。以GAPDH作为内参,采用Quantity-one软件计算各样品蛋白表达水平,进行相对表达量分析。
1.4统计学方法采用SPSS17.0统计软件。计量资料以珋x±s表示,采用单因素方差分析和q检验。P<0.05为差异有统计学意义。
2 结果
两组各时点大脑皮层HAX-1、Caspase-3、bcl-2蛋白相对表达量比较,见表1。
3 讨论
据统计,HIBD存活者25%~30%可能有不同程度的后遗症,严重影响患儿的生活质量[11,12]。目前,HIBD的发病机制仍未明确,但神经元细胞的破坏和凋亡是当前研究的热点[13]。
HAX-1基因位于染色体1q21.3,是新近发现的抗凋亡基因之一,其结构与bcl-2蛋白家族的BH1、BH2结构域相似。bcl-2家族是调节细胞凋亡的一
表1 两组各时点大脑皮层HAX-1、Caspase-3 及bcl-2蛋白相对表达量比较(±s)
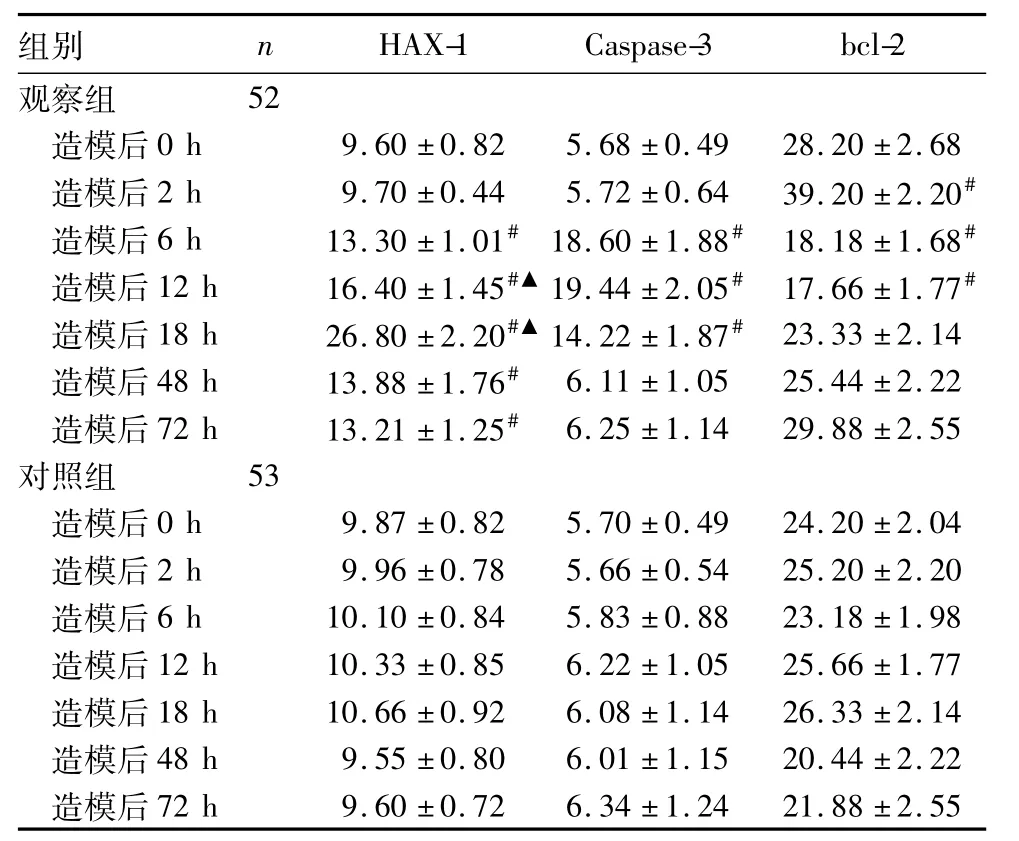
表1 两组各时点大脑皮层HAX-1、Caspase-3 及bcl-2蛋白相对表达量比较(±s)
注:与对照组同时点比较,#P<0.05;与观察组造模后6 h比较,▲P<0.05。
组别 n HAX-1 Caspase-3 bcl-2观察组52造模后0 h 9.60±0.82 5.68±0.49 28.20±2.68造模后2 h 9.70±0.44 5.72±0.64 39.20±2.20#造模后6 h 13.30±1.01#18.60±1.88#18.18±1.68#造模后12 h 16.40±1.45#▲19.44±2.05#17.66±1.77#造模后18 h 26.80±2.20#▲14.22±1.87#23.33±2.14造模后48 h 13.88±1.76# 6.11±1.05 25.44±2.22造模后72 h 13.21±1.25# 6.25±1.14 29.88±2.55对照组 53造模后0 h 9.87±0.82 5.70±0.49 24.20±2.04造模后2 h 9.96±0.78 5.66±0.54 25.20±2.20造模后6 h 10.10±0.84 5.83±0.88 23.18±1.98造模后12 h 10.33±0.85 6.22±1.05 25.66±1.77造模后18 h 10.66±0.92 6.08±1.14 26.33±2.14造模后48 h 9.55±0.80 6.01±1.15 20.44±2.22造模后72 h 9.60±0.72 6.34±1.24 21.88±2.55
种重要蛋白,bax能够促进凋亡[14],同时bcl-2能阻止凋亡的发生。HAX-1可通过抑制bax蛋白的激活,达到抗凋亡的作用,进而抑制Caspase-3的活性,起到抗凋亡的作用[15]。本研究发现,HAX-1与bcl-2的表达高峰存在时间差异,可能与残存神经元增加HAX-1表达有关。HAX-1通过其抗凋亡的作用,延缓神经元凋亡;而残存的神经元亦通过增加HAX-1表达,从而减轻或缓和幼鼠HIBD造成的脑损伤,两者可能存在正反馈调节机制。本研究发现,观察组大脑皮层HAX-1和Caspase-3的表达趋势均为先升高后降低,其中HAX-1表达高峰在造模后18 h,而Caspase-3的表达高峰在造模后12 h。其原因可能为缺血缺氧条件下,神经元的凋亡和抗凋亡共同存在。细胞凋亡过程中Caspase-3能剪切HAX-1,下调HAX-1的表达;同时HAX-1亦可抑制Caspase-3的活化,两者存在反馈性调节机制[9],且损伤12 h之前,Caspase-3占主导性优势;而损伤18 h后HAX-1的主导优势越来越强。
综上所述,新生大鼠HIBD大脑皮层中存在HAX-1、Caspase-3、bcl-2异常表达,三者共同参与了HIBD的发生、发展。
参考文献:
[1]刘俊燕,熊涛,冯虹,等.新生儿窒息多器官功能损害的危险因素分析[J].中国当代儿科杂志,2011,13 ( 12) : 940-943.
[2]王兴河,秦梅,樊绍曾,等.新生鼠缺氧缺血性脑损伤S100 NSE mRNA和蛋白水平变化[J].中国当代儿科杂志,2000,2( 6) : 381-385.
[3]Suzuki Y,Demoliere C,Kitamura D,et al.HAX-1,a novel intracellular protein,localized on mitochondria,directly associates with HS1,a substrate of Sr family tyrosine kinesis[J].J Immunol,1997,158( 6) : 2736-2744.
[4]Shi W,Shen A,Shao B,et al.Traumatic brain injury induces an up-regulation of Hs1-associated protein X-1( Hax-1) in rat brain cortex[J].Neurochem Res,2011,36( 3) : 375-382.
[5]Gallagher AR,Cedzich A,Gretz N,et al.The polycystic kidney disease protein PKD2 interacts with Hax-1,a protein associated with the actin cytoskeleton[J].Proc Natl Acad Sci USA,2000,97 ( 8) : 4017-4022.
[6]Deng YJ,Huang ZX,Zhou CJ,et al.Gene profiling involved in immatureT lymphocyte responsible for systemic lupus ery-thematosus[J].Mol Immunol,2006,43( 9) : 1497-1507.
[7]Mirmohammadsadegh A,Tartler U,Michel G,et al.HAX-1,identified by differential display reverse transcriptionpolymerase chain reaction is overexpressed in lesional psoriasis[J].J Invest Dermatol,2003,120( 6) : 1045-1051.
[8]Lee AY,Lee Y,Park YK,et al.HS1-associated protein X-1 is cleaved by Caspase-3 during apoptosis[J].Mol Cells,2008( 25) : 86-90.
[9]李登宇,李洪涛,潘志华,等.脑瘫动物模型研究进展[J].中国康复,2010,25( 3) : 227-229.
[10]Shen Y,Plane JM,Deng W.Mouse models of periventricular leukomalacia[J].J Vis Exp,2010,18( 39),25-29.
[11]宋彦文,寻文龙,律洁,等.HIBD患儿血浆蛋白C和S、AT-Ⅲ活性变化及意义[J].山东医药,2006,46 ( 28) : 55-56.
[12]易璐,吕剑,刘海英,等.地塞米松产前应用对新生大鼠皮层神经元惊厥损伤后GR表达的影响[J].山东医药,2013,53 ( 28) : 17-24.
[13]邵肖梅,叶鸿帽,邱小汕,等.实用新生儿学[M].4版.北京:人民卫生出版社,2011: 699-705.
[14]Matsuda G,Nakajima K,Kawaguchi Y,et al.Epstein Barr virus ( EBV) nuclear antigenleader protein( EBNA-LP) forms complexes with a cellular anti-apoptosis protein Bcl-2 or its EBV counterpart BHRF1through HS1-associated protein-1[J].Microbiol Immunol,2003,47( 1) : 91.
[15]Lee AY,Lee Y,Park YK,et al.HS1-associated protein X-1 is cleaved by Caspase-3 during apo ptosis[J].Mol Cells,2008,25 ( 1) : 86-90.
收稿日期:( 2014-12-05)
通信作者:赵建美
文章编号:1002-266X( 2015)30-0030-02
文献标志码:A
中图分类号:R364.1
doi:10.3969/j.issn.1002-266X.2015.30.011
