双丹口服液对大鼠糖尿病肾病的作用研究
2016-01-19刘竹影周福兴孙纪元王四旺
陈 颖,刘竹影,周福兴,杨 倩,李 骅,孙纪元,王四旺*
(1.第四军医大学药学院天然药物学教研室,西安 710032;2.第四军医大学口腔医学院正畸科,西安 710032;3.第四军医大学附属西京医院妇产科,西安 710032)
双丹口服液对大鼠糖尿病肾病的作用研究
陈颖1,刘竹影2,周福兴3,杨倩1,李骅1,孙纪元1,王四旺1*
(1.第四军医大学药学院天然药物学教研室,西安710032;2.第四军医大学口腔医学院正畸科,西安710032;3.第四军医大学附属西京医院妇产科,西安710032)
摘要:目的探讨双丹口服液(SDO)对大鼠糖尿病肾病(DN)的治疗效果及其作用机制。方法采用高脂高糖饲料加30 mg·kg-1链脲佐菌素诱导大鼠DN模型,随机分为治疗组、阳性对照组、模型组和正常对照组。治疗组分别灌胃(ig)10.0,5.0和2.5 mL·kg-1SDO高剂量组,皮下注射10 μ·kg-1胰岛素组(阳性对照),模型组和正常组分别ig 5.0 mL·kg-1生理盐水,各组给药2次/d,连续给药8周后检测大鼠空腹血糖(FBG)、糖化血红蛋白(HbA1c)、24 h尿量、血肌酐、尿素氮和血脂等生化值,测定T-SOD、T-AOC、MDA和NO等氧化应激指标,血液流变仪测定全血黏度,光镜下观察肾脏组织病理学改变。结果SDO各给药组大鼠24 h尿量、血肌酐、尿素氮、血总胆固醇、三酰甘油和低密度脂蛋白的含量明显较模型组降低,高密度脂蛋白含量升高,血黏度降低(P<0.05或P<0.01);SDO各剂量组大鼠血T-SOD、T-AOC活力明显升高,MDA、NO含量降低(P<0.05或P<0.01);SDO各给药组对血糖及糖化血红蛋白无影响(P>0.05);SDO各给药组对大鼠的全血黏度和肾组织损伤均有所改善。结论首次证实SDO对大鼠DN具有显著治疗作用,其机制与改善血脂代谢紊乱、促进抗氧化应激能力有关。
关键词:双丹口服液;DN模型;氧化应激
糖尿病肾病(diabetic nephropathy,DN)[1]是在糖尿病(diabetes mellitus,DM)病程中出现的以高血压、水肿、蛋白尿及肾功能不全等肾脏病变为特征的疾病,是DM常见的严重微血管并发症之一;DN是多因素共同作用的结果,其中自由基的作用极为重要,患DM时体内自由基生成增多造成氧化损伤,自由基可能还参与了DM早期肾小球血流动力学的变化过程,脂质过氧化物可直接损伤基底膜和内皮细胞膜,导致肾功能障碍[2]。DM长期高血糖可致内皮细胞功能异常,导致大血管和微血管的病变,是DM各种并发症的重要的病理基础[3]。因此,保护血管内皮细胞是防治DM并发症的关键。双丹口服液(SDO)主要活性成分为丹参素和丹皮酚等[4-6],丹参素对DN的作用机制可能为:清除组织中的氧自由基,保护肾血管内皮细胞[7];抑制血小板聚集,降低血液黏度,显著改善微循环;能够抑制细胞内源性胆固醇合成及抑制脂质过氧化[8]。同时丹皮酚能降低模型动物血清中总胆固醇(TC)和低密度脂蛋白(LDL)水平[9],具有改善血液流变学、降低脂质、抑制脂质过氧化等作用[10]。由此可见,SDO中主要成分的药理作用恰好与DN微血管病变机制相一致,但SDO对DN是否有效,其机制又如何,基于该疑问,我们首次设计和研究了SDO对DN大鼠的作用,并探讨SDO治疗早期DN的作用机制。
1仪器与材料
1.1仪器独立通风动物饲养系统(IVC,北京金业德祥科技有限公司);半自动生化仪(雷杜RT-9600,美国);光学显微镜(奥林巴斯IX3,日本);全自动血液黏度仪(LG-R-80A,北京中勤世帝科学仪器有限公司);电子天平(赛多利斯,德国);尿液分析仪及配套试纸(优利特尿液分析仪-180,中国);血糖仪及配套试纸(罗氏卓越型,德国);冷冻离心机(艾本德5418-R,德国);恒温水浴锅(西安禾普生物科技有限公司)。
1.2试药SDO(10 mL/支,国药准字号Z20093086;批号130323,北京九龙制药有限公司);注射用胰岛素(国药准字H20043335;批号20140102,江苏万邦生化医药有限公司);链脲佐菌素(STZ,SIGMA,产品批号20140314)。
1.3动物健康雄性SD大鼠70只,体质量220±20 g,购于陕西西安第四军医大学实验动物中心,许可证号:SCXK-(军)2012-0007。
1.4实验用试剂盒肌酐试剂盒(批号2014058),尿素氮试剂盒(批号2014009),三酰甘油试剂盒(批号2014031),总胆固醇试剂盒(批号2014036),高密度脂蛋白试剂盒(批号2014040),低密度脂蛋白试剂盒(批号2014043),均购自长春汇力生物有限公司;糖化血红蛋白(批号20141013),T-AOC试剂盒(批号20141007),T-SOD试剂盒(批号20141018),NO试剂盒(批号20141024)及MDA试剂盒(批号20141008),均购于南京建成生物工程研究所。
2方法
2.1动物分组及模型的建立SD大鼠70只,适应性饲养1周后,按照体质量分段随机选取10只为正常组,其余60只SD大鼠造模:进食高脂、高糖饲料(其中猪油、葡萄糖、胆固醇、胆酸钠和基础饲料的质量比例为10∶20∶2.5∶1∶66.5)。用高脂高糖饲料喂养8周,将STZ溶于0.1 mol·L-1枸橼酸盐缓冲液(pH值为4.4)中,以30 mg·kg-1一次性空腹进行腹腔注射,72 h后监测血糖。连续3次空腹血糖≥16.7 mmol·L-1,尿糖呈阳性。尿微量白蛋白定性测量阳性者为DN模型制备成功。挑选造模成功后的大鼠,按照体质量区段随机分为5组,即模型组(生理盐水5 mL·kg-1,灌胃),胰岛素组(10 μ·kg-1,皮下注射),SDO各组分别ig 10.0,5.0和2.5 mL·kg-1,每组10只,各组给药均2次/d,连续给药8周。
2.2观察指标及检测方法
2.2.1观察大鼠一般状态包括精神活动状态、皮毛色泽、净饮食量和二便等状况。每天给药前称量并记录体质量。
2.2.2血生化指标检测分别在给药8周后,取血针从尾部取血检测血糖;大鼠用乙醚麻醉,从眼底静脉丛取血1.5 mL置于离心管中,离心取上层血清,检测血肌酐、血尿素氮和三酰甘油等生化指标。
2.2.3肾组织病理学观察8周后取大鼠肾脏并称取质量,取部分肾脏组织放入中性福尔马林中固定,HE染色,光镜下观察肾组织病理学改变。
通过问卷调查、社区走访及向相关医生咨询等途径,我们对用户的需求进行了切实的分析。根据分析,得到系统的功能性需求,分为以下4部分。
3结果
3.1SDO对DN大鼠一般状态的影响实验期间,正常组生长良好、饮食正常、反应灵敏;模型组大鼠逐渐出现多饮、多尿、多食、消瘦以及反应迟钝、毛发枯黄、尾巴苍白湿冷、精神萎靡等现象。与模型组比较各给药组,第1~4周与模型组表现相似;但用药5周后,SDO各组大鼠精神、进食量、饮水量、尿量都有所改善。实验过程中,模型组死亡3只,胰岛素组、SDO高剂量组和SDO中剂量组各死亡1只,SDO低剂量组死亡2只;可能与造模过程中STZ的毒性作用有关,具体原因有待进一步研究。
3.2SDO对DN大鼠血糖、糖化血红蛋白及24 h尿量的影响模型组与正常对照组相比,血糖及糖化血红蛋白含量显著升高(P<0.01);SDO各给药组对血糖及糖化血红蛋白没有显著影响(P>0.05),而胰岛素组则显著降低血糖及糖化血红蛋白(P<0.05)。与模型组比,SDO各组和胰岛素组均可显著降低大鼠24 h尿量(P<0.01) 。见表1。
表1SDO对DN大鼠血糖、糖化血红蛋白及24 h尿量的影响
Tab.1 Effects of Shuangdan Oral Liquid on glucose,HbAlC and 24 h Urine in DN rats


组别数量剂量/mg·kg-1血糖/mmol·L-1糖化血红蛋白/ABS·10gHemoglobin-124h尿量/mL正常组10等体积生理盐水6.3±0.9**29.96±4.41**13.67±4.37**模型组12(3#)等体积生理盐水26.7±5.155.93±4.0386.87±11.73胰岛素组12(1#)5.0mL·kg-113.4±3.3**31.26±5.24**57.80±16.83**SDO高剂量组12(1#)10.0mL·kg-123.3±4.850.09±4.7265.30±15.84**SDO中剂量组12(1#)5.0mL·kg-124.1±4.351.86±3.8363.33±18.06**SDO低剂量组12(2#)2.5mL·kg-124.2±5.854.03±6.2457.22±24.86**
注:#实验期间死亡的大鼠;*P<0.05,**P<0.01VS模型组。
3.3SDO对DN大鼠体质量和肾质量系数的影响表2结果表明,与正常组相比,模型组大鼠体质量明显降低(P<0.01);与模型组大鼠相比SDO各剂量组大鼠体质量明显升高(P<0.05)。与正常组相比模型组肾质量/体质量比明显升高(P<0.01),SDO各剂量组大鼠肾质量/体质量比显著降低(P<0.05)。
表2SDO对DN大鼠体质量及肾质量系数的影响
Tab.2 Effects of Shuangdan Oral Liquid on kinedy weight / body weight in DN rats
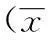
±s)
注:#实验期间死亡的大鼠;**P<0.01,△P<0.05VS胰岛素组。
3.4SDO对DN大鼠血肌酐、尿素氮的影响由表3可见,与正常组相比,模型组大鼠血肌酐和尿素氮的含量明显升高(P<0.05);与模型组大鼠相比,SDO各剂量组大鼠血肌酐和尿素氮水平显著降低(P<0.05)。在降低血尿素氮方面SDO高剂量组较优(P<0.05);在降低血尿素氮方面双SDO高、中剂量组作用效果显著优于胰岛素组(P<0.01)。
表3SDO对DN大鼠血尿素氮、血肌酐的影响
Tab.3 Effects of Shuangdan Oral Liquid on BUN and SCr in DN rats
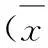
±s)
注:#实验期间死亡的大鼠;*P<0.05,**P<0.01 VS模型组;△P<0.05,△△P<0.01VS胰岛素组。
3.5SDO对DN大鼠血脂的影响由表4可知,与正常组相比,模型组大鼠血总胆固醇、三酰甘油及低密度脂蛋白的含量明显升高,血高密度脂蛋白的含量明显降低(P<0.01);与模型组相比,SDO各剂量组大鼠的血总胆固醇、三酰甘油和低密度脂蛋白的含量明显降低(P<0.01),血高密度脂蛋白含量明显升高(P<0.01)。
表4SDO对DN大鼠血胆固醇、三酰甘油、低密度脂蛋白和高密度脂蛋白的影响
Tab.4 Effects of Shuangdan Oral Liquid on T-CHO,TG,LDL-C and HDL-C in DN rats
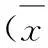
±s)
注:#实验期间死亡的大鼠;*P<0.05,**P<0.01 VS模型组;△P<0.05VS胰岛素组。
3.6SDO对DN大鼠血液流变学的影响表5可知,与正常组相比,模型组大鼠全血黏度明显增加(P<0.01);与模型组相比,SDO各剂量组和胰岛素组大鼠全血黏度明显降低(P<0.01)。
表5SDO对DN大鼠全血黏度的影响
Tab.5 Effect of Shuangdan Oral Liquid on the while blood viscosity in DN rats
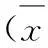
±s)
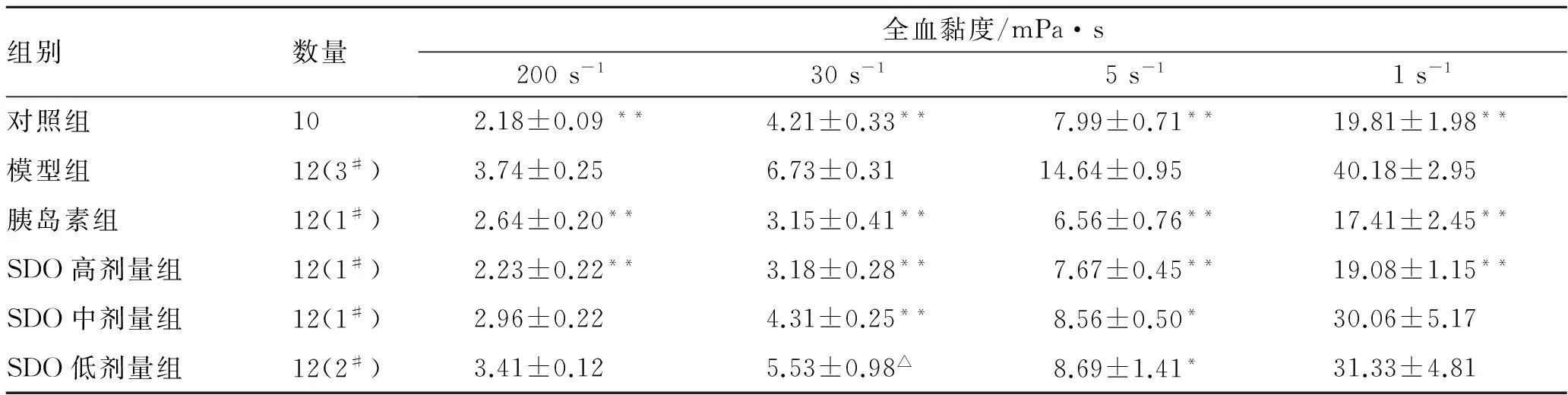
组别数量全血黏度/mPa·s200s-130s-15s-11s-1对照组102.18±0.09**4.21±0.33**7.99±0.71**19.81±1.98**模型组12(3#)3.74±0.256.73±0.3114.64±0.9540.18±2.95胰岛素组12(1#)2.64±0.20**3.15±0.41**6.56±0.76**17.41±2.45**SDO高剂量组12(1#)2.23±0.22**3.18±0.28**7.67±0.45**19.08±1.15**SDO中剂量组12(1#)2.96±0.224.31±0.25**8.56±0.50*30.06±5.17SDO低剂量组12(2#)3.41±0.125.53±0.98△8.69±1.41*31.33±4.81
注:#实验期间死亡的大鼠;*P<0.05,**P<0.01VS模型组;△P<0.05VS胰岛素组。
3.7SDO对DN大鼠T-SOD和T-AOC活力的影响T-SOD和T-AOC是氧化应激反应的常见指标。由图1可知,与正常组相比,模型组大鼠血T-SOD和T-AOC活力明显降低(P<0.01);与模型组相比,SDO各剂量组大鼠血T-SOD和T-AOC活力明显升高(P<0.05)。

A.对DN大鼠T-SOD的影响;B.对DN大鼠血清T-AOC的影响;
Fig.1 The effect of Shuangdan Oral Liquid on vitality of T-SOD and T-AOC in DN rats.
A. the effect on T-SOD;B. the effect on T-AOC.
*P<0.05,**P<0.01 VS model group;△△P<0.01VS insulin
3.8SDO对DN大鼠MDA和NO含量的影响MDA和NO是氧化应激反应的常见指标。由图2可知,与正常组相比,模型组血MDA和NO含量显著升高(P<0.01);与模型组相比,SDO各剂量组大鼠血清MDA和NO含量明显降低(P<0.05)。


A.对DN大鼠血清MDA含量的影响;B.对DN大鼠NO活力的影响
*P<0.05,**P<0.01 VS模型组;△P<0.01 VS胰岛素组
Fig.2 The effect of Shuangdan Oral Liquid on the concentration of MDA and NO in DN rats.
A. the effect on MDA;B. the effect on NO
*P<0.05,**P<0.01 VS model group,△P<0.05 VS insulin
3.9SDO对DN大鼠肾脏组织病理的影响从光镜下(图3)可见,正常组:肾小球体积正常,结构完整,肾小球、肾小管及间质结构正常,未见异常改变;模型组:大鼠肾小球和肾小管肥大,基底膜增厚,系膜区增宽,部分肾小管上皮空泡变性,扩张且形状不规则,部分毛细血管袢受压塌陷。与模型组比较,双丹口服液各组上述病变均有所改善,较模型组明显减轻。
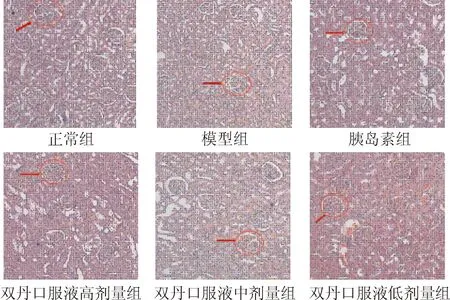
图3SDO对DN大鼠肾组织病理的影响
Fig.3 The effect of Shuangdan Oral Liquid on the morphology change in kidney of DN rats (×200)
4讨论
4.1SDO改善DN肾功能DN患者早期即可出现尿量增多,肾脏肥大,血肌酐及尿素氮升高。本次实验结果显示,SDO可显著降低24 h尿量(与模型组相比,P<0.01),降低DN大鼠的血肌酐及尿素氮水平(与模型组相比,P<0.05)。研究表明,丹参可显著降低DN大鼠肾脏TGF-β1、结缔组织生长因子(CTGF)、纤容酶原激活物抑制剂(PAI1)等细胞因子的水平,减少ECM的沉积,缩小肾小球体积,减少尿白蛋白的排泄,具有较好的肾脏保护作用[12]。
4.2SDO改善血脂代谢紊乱脂代谢紊乱与DN是相互影响的,高血脂促进DN的发生与发展,DN则进一步加重血脂紊乱,形成恶性循环[13]。本研究结果表明,SDO可降低DN大鼠的血总胆固醇、三酰甘油和低密度脂蛋白的含量,升高高密度脂蛋白含量(与模型组相比,P<0.01),证明SDO具有调节DN大鼠血脂的功效。可能与SDO中所含的丹参成分具有的溶血、抗凝作用有关。大量研究证实,SDO中的主要有效成分为丹皮酚、丹参素2种单体。研究表明,丹参素抑制细胞内源性胆固醇(Ch)的合成,降低细胞内总胆固醇(TC)和氧化低密度脂蛋白(Ox-LDL)水平,因此具有保护血管屏障,防止脂质沉积及动脉粥样硬化作用[14]。丹参素还有改善实验大鼠血液流变性,降低血液“浓、黏、聚、凝”状态的作用[15]。丹参可全面调理DN状态时的血液流变情况,延缓肾小球硬化的发生,从而对DN起到保护作用[16]。
4.3SDO增强机体抗氧化应激能力DM的发生、发展及其病变程度,与自由基引发和介导的机体氧化损伤及机体抗氧化防御系统清除自由基能力平衡失调密切相关[17-18]。自由基损伤可造成血管通透性增加和基底膜增厚等病理改变, 并与DM早期肾小球血流动力学变化有关。本次实验结果显示,SDO能够升高血T-AOC及T-SOD活力(与模型组相比,P<0.05),并且能降低血液中NO及MDA的含量(与模型组相比,P<0.05)进而降低机体氧化应激损伤。研究发现,丹参能明显降低血清脂质过氧化物(LPO)含量,提高血清超氧化物歧化酶(SOD)的活性,提示丹参可作为一个良好的外源性氧自由基清除剂[19],减轻自由基代谢紊乱的作用可能是防治DN的重要作用机制。
4.4SDO改善肾脏病理学损伤DN的肾脏在光镜下超微结构表现为肾小球和肾小管肥大,基底膜增厚,肾小球硬化和肾小管间质纤维化。实验中SDO治疗组肾脏光镜下显示肾小球和肾小管肥大程度减轻,基底膜增厚不明显,未见系膜区明显增宽,肾小管上皮空泡变性减少。本次实验结果显示,SDO能够有效改善肾脏病理性损伤。
参考文献:
[1]Pan D, Zhang D, Wu J, et al. A novel proteoglycan fromGanodermalucidumfruiting bodies protects kidney function and ameliorates diabetic nephropathy via its antioxidant activity in C57BL/6 db/db mice[J].Food Chem Toxicol, 2014, 63: 111-118.
[2]孙健,腊岩.丹参及其组分的药理作用以及在肾脏病的最新应用进展[J].中国中西医结合肾病杂志, 2010, 11(1): 89-91.
[3]Klein R, Klein B E, Moss S E.Relation of glycemic control to diabetic microvascular complications in diabetes mellitus[J]. Ann Intern Med, 1996, 124(1 Pt 2): 90-96.
[4]Hu J,Li Y L,Li Z L, et al. Chronic supplementation of paeonol combined with danshensu for the improvement of vascular reactivity in the cerebral basilar artery of diabetic rats[J].Int J Mol Sci, 2012, 13(11): 14565-14578.
[5]Li H,Wang S,Xie Y,et al.Simultaneous determination of danshensu, salvianolic acid B, and paeonol in Shuangdan Oral Liquid by HPLC[J].J AOAC Int, 2013, 96(1): 20-23.
[6]Li H,Wang S W,Zhang B L,et al. Simultaneous quantitative determination of 9 active components in traditional Chinese medicinal preparation Shuangdan Oral Liquid by RP-HPLC coupled with photodiode array detection[J]. J Pharm Biomed Anal, 2011, 56(4): 820-824.
[7]袁恒杰.丹参素药理作用研究新进展[J].中国医院药学杂志, 2006, 26(5): 604-606.
[8]吕兰薰.中药抗凝血作用的研究[J].西北药学杂志, 1986,1(1):59-61.
[9]李骅,王四旺,张邦乐,等.丹参素的药理活性与药物动力学研究进展[J].西北药学杂志, 2011,26(4):310-312.
[10]李后开,戴敏,汪电雷,等.兔动脉粥样硬化模型的建立及丹皮酚药物作用的实验研究[J].中国中医药科技, 2005, 12(3): 129-130.
[11]戴敏,刘青云,顾承刚,等.丹皮酚对脂质过氧化反应及低密度脂蛋白氧化修饰的抑制作用[J].中国中药杂志, 2000, 25(10): 625-627.
[12]柳刚,关广聚,亓同钢,等.丹参对糖尿病大鼠肾脏的保护作用及其机制研究[J].中西医结合学报, 2005, 3(6): 459-462.
[13]Joles J A,Kunter U,Janssen U, et al.Early mechanisms of renal injury in hypercholesterolemic or hypertriglyceridemic rats[J].J Am Soc Nephrol, 2000, 11(4): 669-683.
[14]郑莲星,李萍,程晓曙.丹参素对氧化低密度脂蛋白致血管平滑肌细胞增殖的影响和机制[J].中国病理生理杂志, 2009, 25(10): 2053-2055.
[15]严常开,刘惟莞,敖英,等.丹参素胶囊活血化瘀作用的实验研究[J].中成药, 2003, 25(8): 637-639.
[16]胡波,范红伟,王燕午,等.丹参对糖尿病肾病大鼠肾脏水通道蛋白-2表达的影响[J].时珍国医国药, 2010, 21(5): 1103-1105.
[17]Dewanjee S,Das A K,Sahu R,et al.Antidiabetic activity ofDiospyrosperegrinafruit: effect on hyperglycemia, hyperlipidemia and augmented oxidative stress in experimental type 2 diabetes[J]. Food Chem Toxicol, 2009, 47(10): 2679-2685.
[18]Liu Z, Li J, Zeng Z, et al.The antidiabetic effects of cysteinyl metformin, a newly synthesized agent, in alloxan-and streptozocin-induced diabetic rats[J]. Chem Biol Interact, 2008, 173(1): 68-75.
[19]幸志强,曾旭初,易春涛,等.丹参对冠心病患者血清脂质过氧化物及超氧化物歧化酶的影响[J].中国中西医结合杂志, 1996, 16(5):287-288.
[20]Yin D, Yin J, Yang Y, et al. Renoprotection of Danshen Injection on streptozotocin-induced diabetic rats, associated with tubular function and structure[J]. J Ethnopharmacol, 2014, 151(1): 667-674.
Effectsof Shuangdan Oral Liquid on diabetic nephropathy rat models
CHEN Ying1, LIU Zhuying2, ZHOU Fuxing3,YANG Qian1, LI Hua1, SUN Jiyuan1,WANG Siwang1*(1. Department of Natural Medicine,School of Pharmacy,the Fourth Military Medical University,Xi′an 710032, China; 2.State Key Laboratory of Military Stomatology,Department of Orthodontics,School of Stomatology, the Fourth Military Medical University, Xi′an 710032, China;3.Department of Gynecology and Obstetrics, Xijing Hospital, the Fourth Military Medical University, Xi′an 710032,China)
Abstract:ObjectiveTo investigate the effect of Shuangdan Oral Liquid (SDO) on experimental diabetic nephropathy (DN) and to explore its mechanism. MethodsSD rats were randomly divided into non-diabetic nephropathy control and DN group which were induced by administrating high-glucose-fat diet for four weeks and then intraperitoneal injection of streptozotocin 30 mg·kg-1. The DN rats were randomly assigned to five groups: model group,SDO group with three different doses (10.0,5.0 and 2.5 mL·kg-1,2 times·d-1,respectively) and insulin group (10 μ·kg-1,2 times·d-1). While control group and model group were given saline 5 mL·kg-1,2 times·d-1, the rest groups were treated with corresponding drugs for 8 weeks. At the end of the experiment,serum,urine and kidney were collected for the biochemical,oxidant stress,the whole blood viscosity and pathologic analysis. ResultsSDO could significantly decrease the level of 24 h urine,Scr and BUN and the concentration of T-CHO,TG,LDL,and increase the level of HDL in serum(P<0.05 or P<0.01);it could also increase the activity of T-AOC and T-SOD(P<0.05 or P<0.01),decrease the concentration of NO and MDA but had no effect on the level of FBG and HbA1c(P<0.05 or P<0.01). SDO could improve the whole blood viscosity and renal pathological damage. Conclusion SDO is an effective drug for treating DN, and the possible mechanism may be related to the improvement of metabolic disorders and the improvement of oxidative stress.
Key words:Shuangdan Oral Liquid;diabetic nephropathy model;oxidant stress
收稿日期:(2015-05-06)
通信作者:*王四旺,男,教授,博士生导师
作者简介:陈颖,男,硕士研究生
基金项目:陕西省科学技术研究发展计划项目(编号:2013K12-07-05)
中图分类号:R285.5
文献标识码:A
文章编号:1004-2407(2016)01-0056-06
doi:10.3969/j.issn.1004-2407.2016.01.018
