新型1-(4-氨基苯基)-4-(4-甲氧基苯基)哌嗪衍生物的合成*
2016-01-17闫启东徐俊台州职业技术学院生物与化工学院浙江台州318000
闫启东,徐俊(台州职业技术学院生物与化工学院,浙江台州 318000)
新型1-(4-氨基苯基)-4-(4-甲氧基苯基)哌嗪衍生物的合成*
闫启东,徐俊
(台州职业技术学院生物与化工学院,浙江台州318000)
摘要:以二乙醇胺为原料,经溴化、环合、N-烷基化和还原4步反应制得关键中间体——4-[4-(4-甲氧基苯基)哌嗪-1-基]苯胺(4); 4与酰氯经酰基化反应合成了11个新型的1-(4-氨基苯基)-4-(4-甲氧基苯基)哌嗪衍生物,其结构经1H NMR,FT-IR,ESI-MS和元素分析表征。
关键词:1-(4-氨基苯基)-4-(4-甲氧基苯基)哌嗪;衍生物;合成
1-(4-氨基苯基)-4-(4-甲氧基苯基)哌嗪(Ⅰ)是合成广谱抗真菌药沙柏康的重要中间体,其合成一直是药物合成的热点[1-2]。文献[3-10]报道显示,4-[4-(4-甲氧基苯基)哌嗪-1-基]苯胺(4)可经酰基化反应,合成新的Ⅰ的类似物。该类似物具有5-位羟色胺受体阻断活性,可抑制多种病菌和肿瘤。4的合成为以Ⅰ为中间体的药物合成提供了新思路。
本文以二乙醇胺为原料,经溴化、环合、N-烷基化和还原4步反应制得关键中间体(4); 4与酰氯(5a~5k)经酰基化反应合成了11个新型的1-(4-氨基苯基)-4-(4-甲氧基苯基)哌嗪衍生物(6a~6k,Scheme 1),其结构经1H NMR,FT-IR,ESI-MS和元素分析表征。
1 实验部分
1.1仪器与试剂
X-4型熔点仪(温度未校正); Brucker AC-400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标); FI-IR 8400S型红外光谱仪; LC-20A型高效液相色谱; Agilent 1100 LCQ-Advantage型质谱仪。
所用试剂均为分析纯。
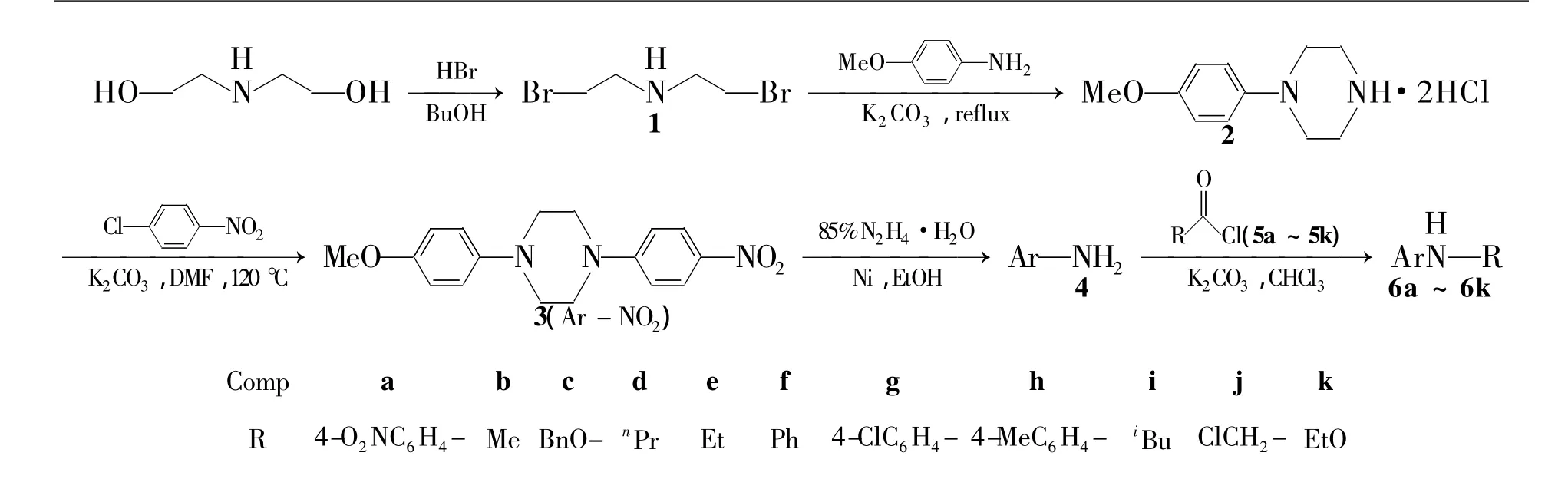
Scheme 1
1.2合成(1)1-(4-甲氧基苯基)哌嗪二盐酸盐(2)的合成
在四口烧瓶中依次加入二乙醇胺21.0 g(0.2 mol)和47%氢溴酸172.2 g(1.0 mol),搅拌下回流(120℃)反应7 h。冷却至室温,蒸馏至无馏分馏出为止。加入正丁醇92 mL,对甲氧基苯胺24.0 g(0.195 mol)和无水碳酸钾22.0 g,回流反应8 h;加入无水碳酸钾18.0 g,反应10 h。冷却至室温,加水80 mL,用40% NaOH溶液调至pH 11~12,静置分层。有机层用饱和食盐水洗涤,用30%盐酸调至pH 5,共沸蒸馏除去水和正丁醇后,冷却,结晶。过滤,滤饼干燥得2 240.5 g,收率78.3%,m.p.≥230℃(240℃[11])。
(2)1-(4-甲氧基苯基)-4-(4-硝基苯基)哌嗪(3)的合成
在三口烧瓶中依次加入2 37.2 g(0.14 mol),DMF 100 mL,对氯硝基苯22.0 g(0.14 mol)和无水碳酸钾32.0 g,搅拌下于120℃反应18 h(TLC检测)。冷却至室温,加水400 mL,搅拌析出固体,过滤,滤饼用水洗涤后用二噁烷重结晶得3 345.8 g,收率75%,m.p.193℃~195℃(收率67%,m.p.195℃[11])。
(3)4的合成
在反应瓶中依次加入3 15.6 g(50 mmol),乙醇120 mL和适量新制活性镍,搅拌下滴加85%水合肼17.0 mL(0.3 mol),滴毕,于65℃~70℃反应至终点(TLC检测)。趁热过滤,滤液冷却至室温,浓缩,残余物用少量甲苯洗涤,干燥得类白色固体4 11.7 g,收率82.4%,m.p.191℃~192 ℃(191.8℃[11])。
(4)6a~6k的合成通法
在三口烧瓶中加入4 0.5 g(1.76 mmol),氯仿10 mL和K2CO3140 mg,冰水浴冷却,搅拌下滴加5a~5k 1.75 mmol的氯仿(15 mL)溶液,滴毕,反应1 h~2 h(TLC检测,展开剂:乙酸乙酯)。反应液用水(2×10 mL)洗涤,减压过滤,滤饼经GF254硅胶薄板层析[洗脱剂:V(DMF)∶V(CHCl3)=8∶2]纯化得6a~6k。
N'-{4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基}-4-硝基苯甲酰胺(6a):暗绿色固体,收率60%,m.p.265℃~270℃;1H NMR δ:10.45(s,1H),8.35~8.33(m,2H),8.19~8.17(m,2H),7.66~7.64(m,2H),7.01~6.99(m,2H),6.97~6.93(m,2H),6.84~6.82(m,2H),3.69(s,3H),3.26~3.24(m,4H),3.16~3.15(m,4H); FT-IR ν:3 309,2 819,1 652,1 514,1 228 cm-1; ESI-MS m/z:433.51{[M + H]+};Anal.calcd for C24H24N4O4:C 66.65,H 5.59,N 12.96; found C 66.60,H 5.54,N 13.01。
N'-{4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基}乙酰胺(6b):灰白色固体,收率53%,m.p.249℃~250℃;1H NMR δ:9.72(s,1H),7.43~7.41(m,2H),6.94~6.90(m,4H),6.83~6.81(m,2H),3.68(s,3H),3.19~3.18(m,4H),3.14~3.13(m,4H),1.99(s,3H); FT-IR ν:3 296,2 829,1 654,1 510,1 317,1 029 cm-1; ESI-MS m/z:326.4{[M + H]+}; Anal.calcd for C19H23N3O2:C 70.13,H 7.12,N 12.91; found C 70.05,H 7.01,N 13.05。
苄基-{ 4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基}苯氨基甲酸酯(6c):淡棕色固体,收率58%,m.p.203℃~205℃;1H NMR δ:7.39~7.24(m,7H),6.97~6.91(m,4H),6.87~6.83(m,2H),6.58(s,1H),5.17(s,2H),3.77(s,3H),3.28~3.22(m,8H); FT-IR ν:3 319,2 823,1 693,1 510,1 228,1 033 cm-1; ESI-MSm/z:418.4{[M + H]+};Anal.calcd for C25H27N3O3:C 71.92,H 6.52,N 10.06; found C 71.81,H 6.44,N 9.99。
N'-{4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基}丁酰胺(6d):灰白色固体,收率50%,m.p.230℃~232℃;1H NMR δ:9.81(s,1H),7.60~7.36(m,4H),7.17~7.96(m,4H),3.75(s,3H),3.60~3.41(m,8H),2.26(t,J=6.4 Hz,2H),1.62~1.57(m,2H),0.91(t,J=6.4 Hz,3H); FT-IR ν:3 228,2 960,2 362,1 681,1 512,1 255,1 193 cm-1; ESI-MS m/z:354.4{[M + H]+};Anal.calcd for C21H27N3O2:C 71.36,H 7.70,N 11.89; found C 71.24,H 7.62,N 11.97。
N'-{4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基}丙酰胺(6e):灰白色固体,收率52%,m.p.241℃~243℃;1H NMR δ:9.73(s,1H),7.50~7.48(m,2H),7.25~6.91(m,6H),3.72(s,3H),3.48~3.27(m,8H),2.80(q,J=7.6 Hz,2H),1.07(t,J=7.6 Hz,3H); FT-IR ν:3 290,2 829,1 683,1 650,1 510,1 247,1 224,1 184,1 029 cm-1; ESI-MS m/z:340.4{[M + H]+};Anal.calcd for C20H25N3O2:C 70.77,H 7.42,N 12.38; found C 70.70,H 7.29,N 12.51。
N'-{4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基}苯甲酰胺(6f):银青色固体,收率73%,m.p.267℃~271℃;1H NMR δ:10.05(s,1H),7.93~7.91(m,2H),7.63~7.61(m,2H),7.55~7.48(m,3H),6.99~6.93(m,4H),6.84~6.82(m,2H),3.69(s,3H),3.24~3.23(m,4H),3.16~3.15(m,4H); FT-IR ν:3 307,2 819,1 639,1 510,1 444,1 321,1 234,1 222,1 151,1 027 cm-1; ESI-MS m/z:388.4{[M +H]+}; Anal.calcd for C24H25N3O2Cl:C 74.39,H 6.50,N 10.84; found C 74.28,H 6.41,N 10.95。
N'-{4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基}-4-氯苯甲酰胺(6g):灰白色固体,收率91%,m.p.284℃~288℃;1H NMR δ:10.31(s,1H),8.00~7.98(m,2H),7.74~7.72(m,4H),7.60~7.58(m,2H),7.22~7.12(m,2H),7.07~7.05(m,2H),3.78(s,3H),3.72~3.61(m,8H); FT-IR ν:3 257,2 831,2 503,2 435,2 362,1 668,1 548,1 508,1 481, 1 323,1 244,827 cm-1; ESI-MS m/z:422.5{[M + H]+};Anal.calcd for C24H24N3O2Cl:C 68.32,H 5.73,N 9.96; found C 68.24,H 5.65,N 10.08。
N'-{4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基}-4-对甲苯甲酰胺(6h):灰白色固体,收率67%,m.p.287℃~290℃;1H NMR δ:10.11(s,1H),7.86~7.60(m,6H),7.32~7.03(m,6H),3.77(s,3H),3.72~3.45(m,8H),2.38(s,3H); FT-IR ν:3 321,2 819,2 358,2 331,1 643,1 512,1 450,1 323,1 226 cm-1; ESI-MS m/z:402.4{[M + H]+};Anal.calcd for C25H27N3O2:C 74.79,H 6.78,N 10.47; found C 74.71,H 6.63,N 10.61。
异丁基-4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基苯氨基甲酸酯(6i):灰色固体,收率78%;1H NMR δ:9.34(s,1H),7.32~7.30(m,2H),6.95~6.90(m,4H),6.85~6.81(m,2H),3.83(d,J=8.0 Hz,2H),3.68(s,3H),3.18~3.16(m,4H),3.14~3.12(m,4H),1.95~1.85(m,1H),0.93(s,3H),0.92(s,3H); FTIR ν:3 328,2 958,1 697,1 589,1 523,1 452,1 294,1 286,1 153,1 066 cm-1; ESI-MS m/z:384.5{[M + H]+};Anal.calcd for C22H29N3O3:C 68.90,H 7.62,N 10.96; found C 68.83,H 7.49,N 11.07。
N'-{4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基}-2-氯乙酰胺(6j):淡红色固体,收率67%,m.p.222℃~226℃;1H NMR δ:10.42(s,1H),7.60~7.58(m,4H),7.15~7.05(m,4H),4.31(s,2H),3.81(s,3H),3.72~3.47(m,8H); FT-IR ν:3 213,3 056,2 839,2 499,2 420,1 685,1 598,1 510,1 448,1 245,1 116,1 024,829 cm-1; ESI-MS m/z:360.4{[M +H]+}; Anal.calcd for C19H22N3O2Cl:C 63.42,H 6.16,N 11.68; found C 63.35,H 6.09,N 11.80。
乙基-4-[4-(4-甲氧基苯基)哌嗪-1-基]苯基苯氨基甲酸酯(6k):亮灰色固体,收率76%,m.p.217℃~221℃;1H NMR δ:7.28~7.26(m,2H),6.96~6.92(m,4H),6.87~6.84(m,2H),6.46(s,1H),4.20(q,J=8.0 Hz,2H),3.77(s,3H),3.28~3.27(m,4H),3.23~3.22(m,4H),1.30(t,J=8.0 Hz,3H); FT-IR ν:3 323,2 974,2 823,1 695,1 523,1 512,1 452,1 323,1 224,1 153,1 033 cm-1; ESI-MS m/z:356.4{[M + H]+};Anal.calcd for C20H25N3O3:C 67.58,H 7.09,N 11.82; found C 67.50,H 7.03,N 11.96。
2 结果与讨论
(1)4的合成
合成4时,用活性镍和水合肼代替文献[11]中通入氢气还原的方法,使反应操作更加简单方便,收率较高(82.4%)。
(2)6的合成
由于5遇酸和水易分解,故需选择合适的缚酸剂和溶剂。以6g的合成为例,考察了缚酸剂和溶剂对6收率的影响,结果分别见表1和表2。
由表1可见,以碳酸钾为缚酸剂,6g产率最高。因此,选用碳酸钾作缚酸剂。
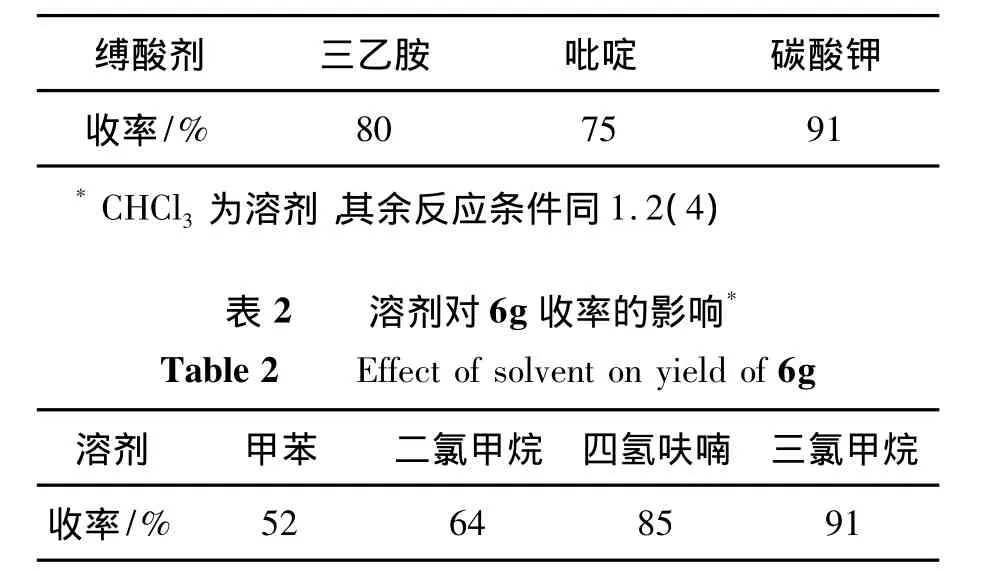
表1 缚酸剂对6g收率的影响*Table 1 Effect of deacid reagent on yield of 6g
由表2可见,以三氯甲烷为溶剂,6g产率最高(91%)。因此,选用三氯甲烷为溶剂。
参考文献
[1]杨济秋,刘丽琳,王小燕,等.抗真菌药酮康唑的合成[J].中国医药工业杂志,1984,15(5):1-4.
[2]林寒芬.1-乙酰-4-(4-羟基苯)哌嗪(酮康唑)合成方法的改进[J].医药工业,1988,19(6):75-76.
[3]苏冰,李晓东,王雅丽.1-(2-甲氧基苯基)哌嗪合成的改进[J].中国现代应用药学,1999,16(6):33-34.
[4]张翠娥,杨淑敏,刘鸿,等.1-(2-甲氧基苯基)哌嗪氢卤酸盐的合成研究[J].应用化工,2002,31(1):32-34.
[5]Nishiyama M,yamamoto T,Keio Y.Synthesis of N-arylpiper-azines from aryl halides and piperazine under a palladium tri-tert-butylphosphinew catalyst[J].Tetrehedron Lett,1998,39(7):617-620.
[6]夏季红,谌伦华,陈安平,等.一种泊沙康唑及其哌嗪中间体的简单制备方法[P].CN 101 824 009 A,2010.
[7]吴琴,王贞超,魏学,等.1-取代-4-[5-(4-取代苯基)-1,3,4-噻二唑-2-磺酰基]哌嗪类衍生物的合成及其抑菌活性[J].合成化学,2014,22(4):429-434.
[8]闫新创,陈平,贺敏,等.泊沙康唑重要中间体的合成与表征[J].广州化工,2014,41(10):107-109.
[9]周丽娜,周惠良,闫龙,等.1-氨基-4-甲基哌嗪并芳香醛类希夫碱的合成与表征[J].化学世界,2002,31(1):113-115.
[10]李娴洁,李海波,田万里,等.1-乙酰基-4-(4-羟基苯基)哌嗪的合成[J].华西药学杂志,2005,20(3):243-244.
[11]童国通,卢孔燎.1-(4-甲氧基苯基)-4-(4-氨基苯基)哌嗪的合成[J].精细化工中间体,2003,33(6):
·研究简报·
Synthesis of Novel 1-(4-Aminophenyl)-4-(4-methoxyphenyl)piperazine Derivatives
YAN Qi-dong,XU Jun
(School of Biological Technology and Chemical Engineering,Taizhou Vocational&Technical College,Taizhou 318000,China)
Abstract:A key intermediate,4-[4-(4-methoxyphenyl)piperazine-1-yl]aniline(4),was prepared by a four-step reaction of bromination,cyclization,N-alkylation and reduction,using diethanolamine as material.Eleven novel 1-(4-aminophenyl)-4-(4-methoxyphenyl)piperazine derivatives were synthesized by acylation reaction of 4 with acyl chloride.The structures were characterized by1H NMR,FT-IR,ESI-MS and elemental analysis.
Keywords:1-(4-aminophenyl)-4-(4-methoxyphenyl)piperazine; derivative; synthesis
作者简介:闫启东(1979-),男,汉族,湖北襄阳人,副教授,主要从事药物合成与分析的研究。Tel.0576-88663356
基金项目:浙江省科技计划高技能人才培养项目(2013R30051)
收稿日期:2014-08-14;
修订日期:2015-04-24
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.06.0518 *
文献标识码:A
中图分类号:O626.4; O623.732
