底物中钙赋存形态对太平洋牡蛎(Crassostrea gigas)幼虫附着的诱导效应*
2016-01-15范瑞良任国平全为民
范瑞良 晁 敏 任国平 全为民①
(1. 中国水产科学研究院东海水产研究所 农业部东海及远洋渔业资源开发利用重点实验室 上海 200090;2. 上海海洋大学海洋科学学院 上海 201306; 3. 山东省莱州市国燕水产育苗场 莱州 261400)
牡蛎礁是一种特殊的海洋生境, 具有净化水体(全为民等, 2007)、维持生物多样性(全为民等, 2012)、提供鱼类栖息地(Coen et al, 1999; Quan et al, 2009,2012, 2013)、防止海岸线侵蚀(Brumbaugh et al, 2009)和碳汇(沈新强等, 2011)等生态功能。由于过度捕捞、环境污染和病害浸染等原因, 过去100多年来全球牡蛎礁分布面积约下降85% (Jackson et al, 2001; Beck et al, 2011)。为恢复牡蛎礁生境及其提供的生态服务价值, 自从20世纪90年代开始, 美国在大西洋及墨西哥湾沿岸陆续开展了一系列的牡蛎礁恢复项目(Mann et al, 2007; Brumbaugh et al, 2009)。实践证明,人工恢复的牡蛎礁发挥了自然牡蛎礁同等的生态功能(Luckenbach et al, 2003; Rodney et al, 2006; Schulte et al, 2009)。牡蛎是生长于硬底物上的双壳类软体动物, 建造适合于牡蛎幼虫附着的底物(礁体)是牡蛎礁恢复的重点。国内外牡蛎礁恢复项目中最常用的底物材料是牡蛎壳, 但由于牡蛎壳数量不足, 筛选适合于牡蛎幼虫附着生长的替代底物成为牡蛎礁恢复中迫切需要解决的关键技术之一(Brumbaugh et al, 2009)。
底物的化学元素组成显著影响着牡蛎幼虫的附着及变态发育, 特别是底物中的钙元素是牡蛎幼虫附着的主要诱因之一, 如自然的含钙底物(石灰石、贻贝壳、蛤蜊壳和石膏)上附着牡蛎稚贝数量显著高于其它底物(如砂石、轮胎、玻璃纤维和不锈钢等)。如Tamburri等(2008)发现: 相对于人工底物(玻璃纤维、PVC 和不锈钢), 近江牡蛎(Crassostrea ariakensis)的幼虫偏好附着于自然底物(贝壳)上。Soniat等(2005)通过野外实验发现: 在相同的环境条件下, 石灰石(主要化学成分为CaCO3)上附着的牡蛎稚贝数量显著高于砂石(主要化学成分为SiO2)。Haywood等(1995)发现: 石灰石、文蛤壳和石膏(主要化学成分为CaSO4)等底物对牡蛎幼虫附着的诱导效果显著高于碎石砂砾、废弃路基碎料和砂石。然而至目前为止, 国际上很少有研究比较不同钙赋存形态对牡蛎幼虫附着的诱导效应。
基上以往的研究结果, 本研究提出如下假设: 碳酸钙对于牡蛎幼虫附着的诱导能力大于硫酸钙和有机钙。据此, 作者通过设计室内实验检验3种钙赋存形态(硫酸钙、有机钙和碳酸钙)实验底物上牡蛎幼虫附着效果, 以此探明牡蛎幼虫对不同赋存形态钙的喜好。本研究对于牡蛎礁恢复中替代底物材料的筛选、以及牡蛎养殖均具有重要的理论和现实意义。
1 材料与方法
1.1 实验材料
本实验于2015年5月24日—7月2日在山东省莱州市国燕水产育苗场(山东莱州虎头崖镇西原村)内完成。实验生物为太平洋牡蛎(Crassostrea gigas)的幼虫, 自受精卵开始培育 20d至具足面盘幼虫(pediveliger)阶段时, 将实验底物置于附苗池中开展附着实验。
1.2 实验设计
本实验采用三因素(海水中牡蛎幼虫丰度、实验底物中钙赋存形态、实验底物中钙含量)随机区组设计, 实验设定 2个牡蛎幼虫丰度处理组(1和7—8ind/mL), 2个钙含量处理组和3个钙赋存形态处理组(表 1), 各种底物类型互为对照, 每个处理组设置10个重复, 总计12个处理组合和120个实验底物。
实验底物为钙材料、河沙和水泥混合的混凝土模块(10cm长×10cm宽×3cm厚) 。其中, 硫酸钙为石膏粉, 有机钙为牛骨粉, 碳酸钙为钙粉。每种原料经粉碎后过80目网筛后备用。
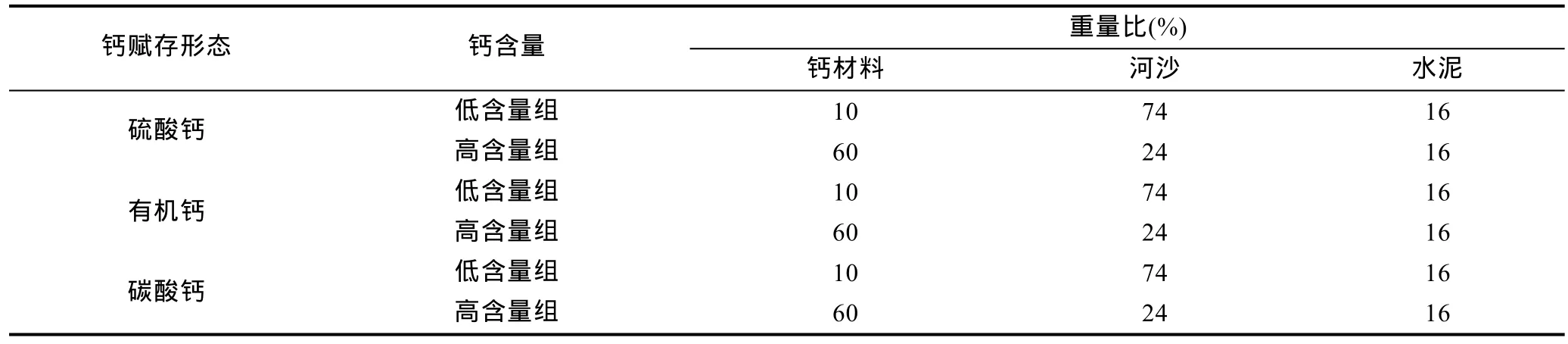
表1 实验底物组成成分Tab.1 The chemical compositions of the experimental substrates
1.3 实验方法
在育苗车间准备高低幼虫丰度附苗池各1个, 每个附苗池6根竹竿, 随机选取 10个实验底物吊挂于竹杆上, 使实验底物位于水面下 50cm处, 相邻实验底物相距 15cm, 相邻竹杆间相距 20cm。实验期间,实验池中的水温约为 24℃、海水盐度约为 27, 每天于1:00, 5:00, 9:00, 13:00, 17:00, 21:00各投饵1次, 投饵量由育苗场管理人员根据幼虫生长状况而定, 饵料为金藻, 每天于7:00和19:00各换水1次, 换水量为附苗池总容量的 1/2, 每天光照时间约为 8h, 强度为普通日光灯的照明强度, 幼虫附着期间充气培养等条件均与育苗车间保持一致。
3d后, 将两个附苗池中实验底物移置养殖池中暂养, 直至附着稚贝清晰可见为止(约半个月), 用单反相机对每个实验底物表面进行拍照, 在电脑上计数, 随机选取20个附着稚贝, 用Photoshop7.0软件测量壳高。自牡蛎受精卵至实验结束共持续 40d左右,实验期间, 每天不定期观察幼虫生长状况。考虑到实验结果的一致性, 仅统计实验底物正面附着稚贝的密度和壳高来显示牡蛎幼虫的附着效果。
1.4 数据处理
将每块实验底物上附着数量换算成稚贝的密度,统计不同实验底物上附着牡蛎稚贝的密度(个/cm2)和平均壳高(mm)。实验数据经过以10为底的对数函数处理后, 采用SPSS 19.0统计软件进行3因子方差分析, 使用LSD进行后检验,P<0.05时差异显著, 采用SigmaPlot 10.0软件绘制折线图。
2 结果
2.1 三因子对附着牡蛎稚贝密度和壳高的影响
3因子方差分析结果表明(表2, 表3): 3因子交互作用、2因子交互作用和底物钙含量对附着稚贝密度和壳高的影响均不显著(表2, 表3,P>0.05), 而底物钙形态和海水中牡蛎幼虫丰度均显著影响着实验底物上附着牡蛎稚贝的密度和壳高(表2, 表3,P<0.05)。
2.2 钙赋存形态及浮游幼虫丰度对附着稚贝密度的影响
钙赋存形态和幼虫丰度对实验底物附着稚贝密度的影响如图1所示, 在相同的浮游牡蛎幼虫丰度情况下, 有机钙底物对牡蛎幼虫附着的诱导效果明显好于碳酸钙与硫酸钙底物(图1,P<0.05), 后两者间差异不显著(图 1,P>0.05)。
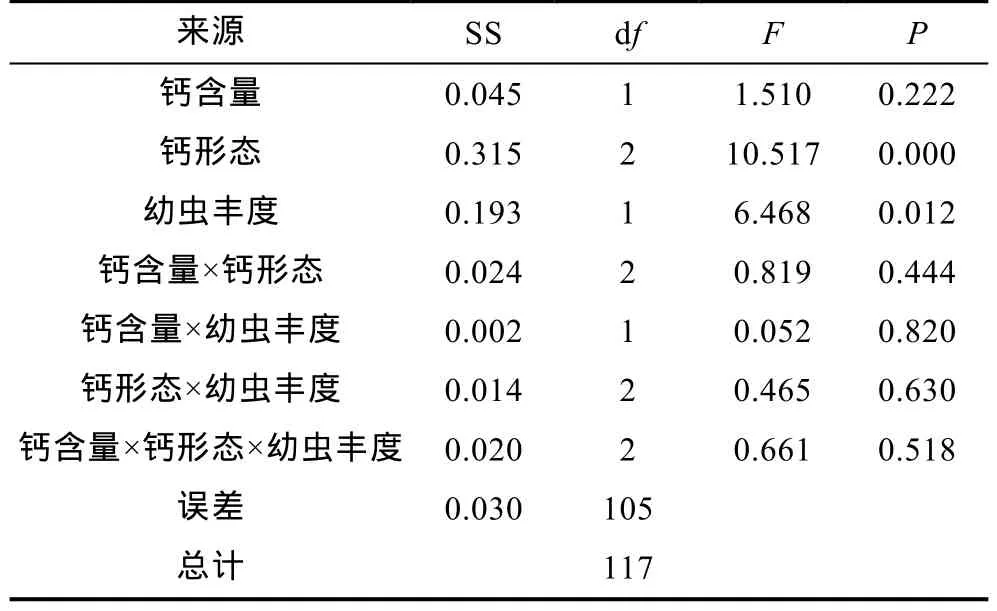
表2 实验底物上附着牡蛎稚贝密度的3因子方差分析结果Tab.2 3-way ANOVA results of density of oyster spat settled on substrates
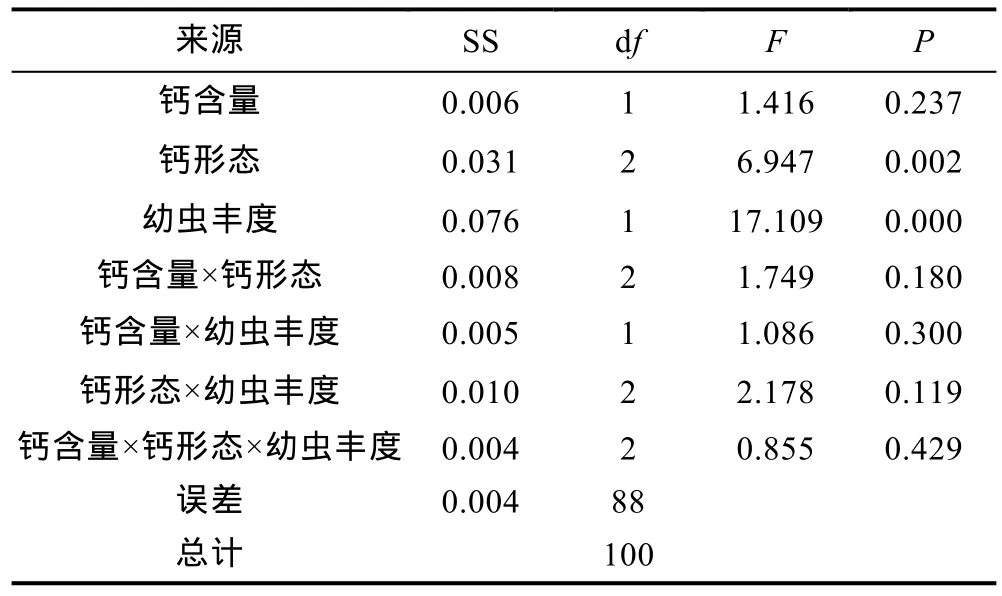
表3 实验底物上附着牡蛎稚贝壳高的3因子方差分析结果Tab.3 3-way ANOVA results of shell height of oyster spat settled on substrates
在低钙含量组中, 高浮游幼虫丰度下实验底物上牡蛎稚贝密度均显著高于低幼虫丰度处理组(表 4,图1a,P<0.05), 但在高钙含量中, 两个幼虫丰度处理组间差异不显著(表5, 图1b,P>0.05)。

表4 低钙含量下, 钙赋存形态及浮游幼虫丰度对实验底物附着稚贝密度的影响Tab.4 Effect of calcium form and planktic larvae abundance on spat density in substrate under low calcium concentration
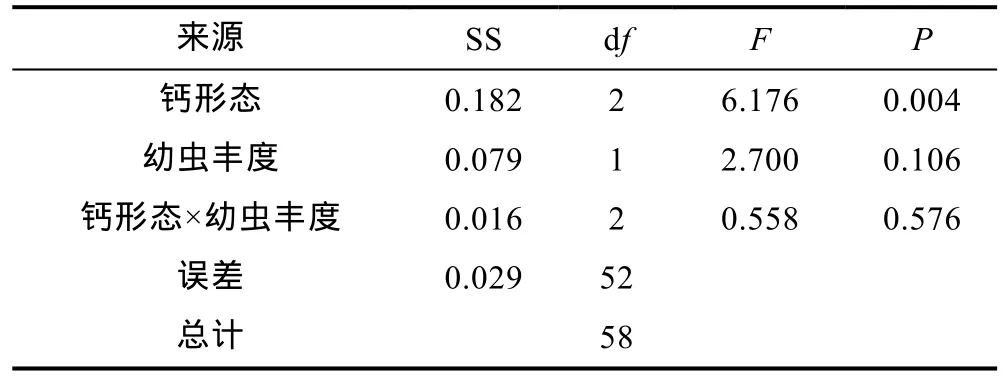
表5 高钙含量下, 钙赋存形态及浮游幼虫丰度对实验底物附着稚贝密度的影响Tab.5 Effect of calcium form and planktic larvae abundance on spat density in substrate under high calcium concentration
2.3 钙赋存形态及浮游幼虫丰度对附着稚贝壳高的影响

图1 低钙(a)和高钙(b)含量下, 钙赋存形态及浮游幼虫丰度对实验底物上附着稚贝密度的影响(n=10)Fig.1 Effect of calcium form and planktic larvae abundance on spat density in the experimental substrates under low (a) and high (b)calcium concentrations (n=10)
钙赋存形态和幼虫丰度对实验底物上附着稚贝壳高的影响如图2所示。其结果与密度恰好相反: 在低钙含量下, 碳酸钙与硫酸钙实验底物上附着稚贝的壳高相似, 没有显著性差异(图 2a,P>0.05), 然而,两个处理组稚贝的平均壳高均显著大于有机钙实验底物(图 2a,P<0.05), 且钙形态和幼虫丰度之间呈现显著的互作效应(表 6,F=3.286,P=0.030); 在高钙含量下, 不同钙形态底物之间稚贝壳高没有显著性差异(表 7, 图 2b,P>0.05)。
在相同钙形态底物中, 高浮游幼虫丰度实验组中附着稚贝的平均壳高均显著小于低幼虫丰度处理组(表 6, 表 7, 图 2,P<0.05)。
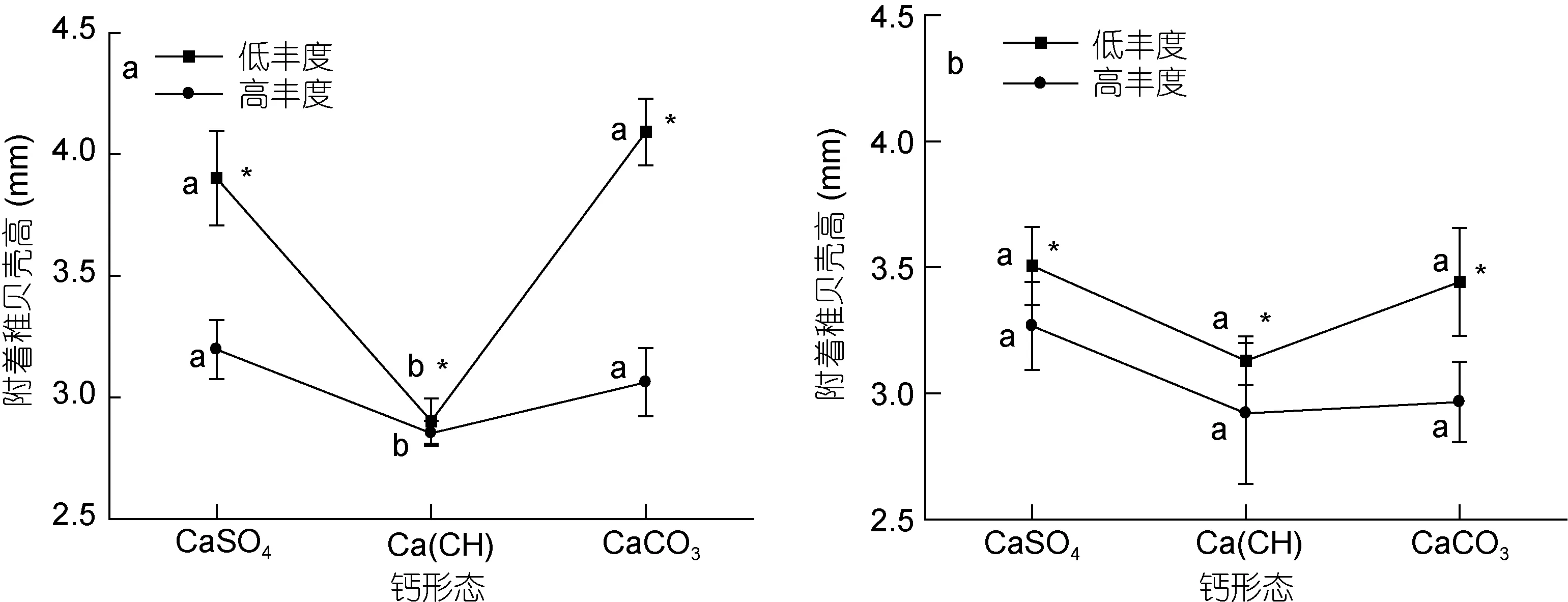
图2 低钙(a)和高钙(b)含量下, 钙形态及浮游幼虫丰度对实验底物上附着稚贝壳高的影响Fig2 Effect of calcium form and planktic larvae abundance on spat shell height under low (a) and high (b) calcium concentrations

表6 低钙含量下, 钙形态及浮游幼虫丰度对实验底物附着稚贝壳高的影响Tab.6 Effect of calcium form and planktic larvae abundance on spat shell height under low calcium concentration

表7 高钙含量下, 钙形态及浮游幼虫丰度对实验底物附着稚贝壳高的影响Tab.7 Effect of calcium form and planktic larvae abundance on spat shell height under high calcium concentration
3 讨论
3.1 钙含量对牡蛎幼虫附着的诱导效应
牡蛎幼虫通常偏好附着于含钙的底物上, 本研究首次发现, 两种钙含量(高钙和低钙含量)实验底物中附着牡蛎稚贝的密度和壳高均没有显著性差异。相当多的研究也发现(Soniatet al, 1991; Brumbaugh,2000; Greeneet al, 2005): 牡蛎壳、其它贝壳(文蛤壳)和石灰石等底物钙含量不同, 但它们对牡蛎幼虫具有相似的诱导能力。底物中钙含量与其对牡蛎幼虫附着的诱导能力之间的关系仍有待进一步研究。国内以前的研究主要探讨海水中钙浓度对贝类幼虫附着的影响。祁剑飞等(2013)发现海水中10—25mmol/L Ca2+浓度中, 浓度为20mmol/L时, Ca2+对葡萄牙牡蛎幼虫附着变态的诱导效果最好。刘文彪(2006)的实验结果也表明5—25mmol/L Ca2+浓度的海水中, Ca2+浓度为20mmol/L时, 西施舌幼虫附着率和变态率最高。基于以上结果, 我们推断底物中也存在一个最适的钙含量, 该浓度下的底物对牡蛎幼虫的诱导能力最大。
3.2 钙赋存形态对牡蛎幼虫附着的诱导效应
本研究发现, 有机钙实验底物上附着牡蛎稚贝的密度显著高于硫酸钙与碳酸钙实验底物, 表明有机钙对牡蛎幼虫的诱导效应显著大于两种无机钙底物。有关其机制可能有两种解释: 一种为直接诱导效应, 即有机钙底物能直接促使牡蛎幼虫的附着; 另一种为间接诱导效应, 即有机钙底物更有利于底物上生物膜(biofilm)的发育, 而生物膜上的细菌群落所释放的有机化合物可加快牡蛎幼虫的附着(Lamet al,2005; 柯才焕等, 2006; 杨金龙等, 2012, 2013)。目前,很难通过实验区分这两种机制的诱导效应。本研究牡蛎幼虫附着的实验周期仅为3天, 而3天时间内生物膜仅处于初步发育阶段, 距离其发育成为成熟的生物膜仍有待时日, 因此我们推断: 有机钙主要通过直接效应(底物化学元素组成)诱导牡蛎幼虫的附着。
碳酸钙与硫酸钙对牡蛎幼虫附着的诱导效果基本相似, 与 Haywood等(1995)和 Soniat等(1991)室内实验中石灰石和石膏两种实验底物对牡蛎幼虫附着诱导效应的结果一致, 却与其野外实验的结果不同,这可能与室内实验可控性强, 而野外海域实验的盐度、温度等实验条件的不可控性有关。
3.3 幼虫丰度对牡蛎稚贝附着量的影响
高霄龙等(2016)发现养殖丰度为8ind/mL的毛蚶幼虫的附着密度显著高于丰度为2ind/mL的处理组。Brumbaugh(2000)发现野外实验中拉菲特河(牡蛎丰度为 328ind/m2)的附着稚贝密度(53ind/m2)高于伊丽莎白河(牡蛎丰度为 149ind/m2)附着稚贝密度(15ind/m2), 这是由于高丰度牡蛎可以提高其受精率,增加附着牡蛎幼虫的丰度, 从而提高附着稚贝密度,与本实验研究结果一致。因此, 海水中牡蛎幼虫丰度显著影响着底物上附着牡蛎稚贝的密度、甚至也影响着牡蛎种群的建立及礁体恢复的成功。
3.4 牡蛎稚贝附着量与其壳高之间的关系
本研究发现, 附着牡蛎稚贝的密度与其平均壳高之间呈现负相关。杜美荣(2009)发现底栖硅藻处理组附着基上栉孔扇贝的附着效果优于常规方法处理组, 但稚贝壳长小于常规方法处理组, 因为随着稚贝附着密度的增大, 食物、空间竞争压力增大, 导致个体生长发育缓慢。陈璐等(2011)对密鳞牡蛎人工繁育实验中3ind/mL和4ind/mL组附着基上稚贝的生长速度明显慢于1ind/mL和2ind/mL组的研究结果也证明了这一点。因此, 在实际的牡蛎礁恢复和牡蛎养殖当中, 需要掌握适宜的附苗量或稚贝密度, 过高的附着量会导致较高的死亡率, 最终会影响牡蛎礁的恢复效果和牡蛎养殖产量。
4 结论与意义
本研究结果表明, 钙赋存形态和海水中牡蛎幼虫丰度显著影响实验底物上牡蛎稚贝附着量, 其中有机钙对牡蛎幼虫附着的诱导效应明显好于碳酸钙和硫酸钙底物; 而钙含量对牡蛎幼虫的附着没有显著性影响。研究结果可为牡蛎礁恢复中的替代底物筛选以及牡蛎养殖提供理论支撑。未来需要进一步从微生物膜细菌群落结构和特征衍生物化合物的角度探讨含钙底物对牡蛎幼虫附着的诱导机制。
致谢 感谢育苗场全体工作人员在实验期间提供的帮助, 杨杰青、唐盟等在论文写作中给予的指导,谨致谢忱。
全为民, 安传光, 马春艳等, 2012. 江苏小庙洪牡蛎礁大型底栖动物多样性及群落结构. 海洋与湖沼, 43(5): 992—1000
全为民, 张锦平, 平仙隐等, 2007. 巨牡蛎对长江口环境的净化功能及其生态服务价值. 应用生态学报, 18(4):871—876
刘文彪, 2006. 西施舌幼虫附着变态影响因子及化学诱导. 福州: 福建师范大学硕士学位论文
祁剑飞, 曾志南, 宋传福等, 2013. 几种阳离子对葡萄牙牡蛎幼虫附着和变态的影响. 福建水产, 35(1): 27—31
杜美荣, 2009. 栉孔扇贝春苗繁育与扇贝幼虫高效附着技术的初步研究. 青岛: 中国海洋大学硕士学位论文
杨金龙, 王 冲, 顾忠旗等, 2012. 微生物膜对海洋无脊椎动物幼体附着变态的影响研究. 海洋科学, 36(8): 116—121
杨金龙, 慎佩晶, 王 冲等, 2013. 微生物膜对厚壳贻贝稚贝附着的影响. 水产学报, 37(6): 904—909
沈新强, 全为民, 袁 骐, 2011. 长江口牡蛎礁恢复及碳汇潜力评估. 农业环境科学学报, 30(10): 2119—2123
陈 璐, 李 琪, 王庆志等, 2011. 密鳞牡蛎的人工繁育. 中国海洋大学学报, 41(3): 43—46, 60
柯才焕, 冯丹青, 2006. 海洋底栖动物浮游幼体附着和变态的研究. 厦门大学学报(自然科学版), 45(S2): 77—82
高霄龙, 李 莉, 孔令锋等, 2016. 养殖密度对毛蚶幼虫生长及存活的影响. 中国水产科学, 23(1): 233—240
Beck M W, Brumbaugh R D, Airoldi L et al, 2011. Oyster reefs at risk and recommendations for conservation, restoration,and management. BioScience, 61(2): 107—116
Brumbaugh R D, 2000. An analysis of limestone marl as a settlement substrate for oysters in Chesapeake Bay. Report to the Virginia Marine Resources Commission. Norfolk,Virginia: Chesapeake Bay Foundation
Brumbaugh R D, Coen L D, 2009. Contemporary approaches for small-scale oyster reef restoration to address substrate versus recruitment limitation: a review and comments relevant for the Olympia oyster, Ostrea lurida Carpenter 1864. J Shellfish Res, 28(1): 147—161
Coen L D, Luckenbach M W, Breitberg D L, 1999. The role of oyster reefs as essential fish habitat: a review of current knowledge and some new perspectives. Am Fish Soc Sym,22: 438—454
Greene J K, Grizzle R E, 2005. Oyster (Crassostrea virginica Gmelin) restoration studies in the Great Bay estuary, New Hampshire. Final Report for NOAA award number:NA03NOS4200060
Haywood III E L, Soniat T M, Broadhurst III R C, 1995.Alternatives to Clam and oyster shell as cultch for eastern oysters. In: Luckenbach M W, Mann R, Wesson J eds.Oyster Reef Habitat Restoration: A Synopsis and synthesis of Approaches. Gloucester Point, VA: VIMS Press,295—304
Jackson J B C, Kirby M X, Berger W H et al, 2001. Historical overfishing and the recent collapse of coastal ecosystems.Science, 293(5530): 629—637
Luckenbach M W, Coen L D, 2003. Oyster reef habitat restoration: a review of restoration approaches and an agenda for the future. J Shellfish Res, 22(1): 341
Lam C, Harder T, Qian P Y, 2005. Induction of larval settlement in the polychaete Hydroides elegans by extracellular polymers of benthic diatoms. Mar Ecol Prog Ser, 286:145—154
Mann R, Powell E N, 2007. Why oyster restoration goals in the Chesapeake Bay are not and probably cannot be achieved. J Shellfish Res, 26(4): 905—917
Quan W M, Humphries A T, Shen X Q et al, 2012. Oyster and associated benthic macrofaunal development on a created intertidal oyster (Crassostrea ariakensis) reef in the Yangtze River estuary, China. J Shellfish Res, 31(3): 599—610
Quan W M, Zheng L, Li B J et al, 2013. Habitat values for artificial oyster (Crassostrea ariakensis) reefs compared with natural shallow-water habitats in Changjiang River estuary. Chin J Oceanol Limnol, 31(5): 957—969
Quan W M, Zhu J X, Ni Y et al, 2009. Faunal utilization of constructed intertidal oyster (Crassostrea rivularis) reef in the Yangtze River estuary, China. Ecol Eng, 35(10): 1466—1475
Rodney W S, Paynter K T, 2006. Comparisons of macrofaunal assemblages on restored and non-restored oyster reefs in mesohaline regions of Chesapeake Bay in Maryland. J Exp Mar Biol Ecol, 335(1): 39—51
Schulte D M, Burke R P, Lipcius R N, 2009. Unprecedented restoration of a native oyster metapopulation. Science,325(5944): 1124—1128
Soniat T M, Broadhurst R C, Haywood III E L, 1991.Alternatives to clamshell as cultch for oysters, and the use of gypsum for the production of cultchless oysters. J Shellfish Res, 10: 405—410
Soniat T M, Burton G M, 2005. A comparison of the effectiveness of sandstone and limestone as cultch for oysters, Crassostrea virginica. J Shellfish Res, 24(2):483—485
Tamburri M N, Luckenbach M W, Breitburg D L et al, 2008.Settlement of Crassostrea ariakensis larvae: effects of substrate, biofilms, sediment and adult chemical cues. J Shellfish Res, 27(3): 601—608
