斑石鲷(Oplegnathus punctatus)雌、雄鱼核型及Ag-NORs带型分析*
2016-01-15刘清华肖志忠王彦丰
薛 蕊 安 皓 刘清华 肖志忠 王彦丰 李 军①
(1. 中国科学院海洋研究所 中国科学院实验海洋生物学重点实验室 青岛 266071; 2. 中国科学院大学 北京100049; 3. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室 青岛 266237)
鱼类染色体及其核型研究是鱼类细胞遗传学的重要组成部分之一, 对研究鱼类变异、分类、系统演化、性别决定、杂交育种以及对环境污染的监测等方面具有重要意义(楼允东, 1997)。我国在 20世纪 70年代才开始对鱼类染色体核型进行较为详尽的研究,80年代后期随着海水养殖业的发展, 海水鱼类核型相关研究领域才得到重视(赵金良, 2000)。
斑石鲷(Oplegnathus punctatus), 俗称斑鲷、花金鼓、黑金鼓等, 隶属鲈形目(Perciformes), 石鲷科(Oplegnathidae), 石鲷属(Oplegnathus), 主要分布于朝鲜、日本、中国台湾以及南海、东海、黄海等海域(孟庆闻等, 1995)。斑石鲷体态优美, 肉质细腻, 素有“刺身绝品”之称, 具有很高的观赏价值和经济价值。对斑石鲷的报道目前主要集中在早期发育(Park et al,2015)、成鱼养殖(The Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, 2015)、杂交育种(Kwun et al, 2010)、以及疾病和免疫(Yanagida et al, 2008; Dong et al, 2010; Shuang et al,2013)等方面, 有关斑石鲷细胞遗传学方面的研究目前尚未见报道。本文对斑石鲷雌、雄鱼染色体核型以及核仁组织者进行了实验研究, 旨在为进一步开展斑石鲷遗传育种等工作奠定基础, 并为鲈形目鱼类细胞遗传学研究提供更多资料。
1 材料与方法
1.1 实验材料
实验用斑石鲷取自烟台市明波水产有限公司,为 15月龄幼鱼, 共计 9尾实验鱼, 体重为 246.2—398.6g, 体长为 22.8—24.6cm。解剖实验鱼性腺制作石蜡切片并染色, 根据显微观察结果判定雌雄。
1.2 染色体标本的制备
采用林义浩(林义浩, 1982)的方法并稍作修改:在室温下按 8—10μg/g的剂量于实验鱼胸鳍基部注射PHA(Solarbio, 北京), 20h后于胸鳍基部注射秋水仙碱(Solarbio, 北京)剂量为 2.5—5μg/g。过 4h用丁香油水门汀麻醉并断尾放血 30min, 之后解剖取头肾, 0.8%生理盐水冲洗后用镊子反复撕拉使其细胞游离, 350目尼龙筛绢过滤收集获得细胞悬液, 在4°C下于 0.075 mol/L KCl溶液中低渗处理 30min,经1000r/m离心10min后去上清, 经1次预固定处理后, 用卡诺氏固定液(甲醇 : 冰醋酸 = 3 : 1, V : V)在–20°C下进行3次固定处理, 每次30min, 之后采用冷片法滴片并空气干燥过夜。过夜干燥后的染色体玻片用10% Giemsa染液染色40min, 蒸馏水冲洗后自然干燥。
1.3 核型分析
雌、雄鱼各选取50个染色体中期分裂相进行染色体计数, 并选出 10个数目完整且分散良好的中期分裂相, 用 Nikon-ES-100及Nikon-DS-Fi1显微拍照系统拍照、放大和测量, 统计染色体实际长度、相对长度以及臂比等数据, 利用Photoshop CS3截取核型图, 染色体的类型按照 Levan等(1964)的标准确定。染色体实际长度根据与拍照时的标志物长度比对获得, 染色体相对长度计算公式为: 染色体相对长度=(单条染色体实际长度/染色体组实际长度总和)×100%, 染色体臂比是指单条染色体长臂与短臂之比。
1.4 染色体Ag-NORs及带型分析
采用Howell等(1980)的快速银染法制片, 向每个样片上滴加2滴2%的明胶溶液和4滴50%的AgNO3溶液, 盖上盖玻片后放到 65°C的水浴锅锅盖上1—2min, 待整张片子呈棕褐色时去掉盖玻片并迅速用流水冲洗, 自然干燥后镜检。
显微镜观察并记录 100个间期细胞的 Ag-NORs个数, 选取 10个染色体数目完整且分散良好的中期分裂相, 用Nikon-ES-100及 Nikon-DS-Fi1显微拍照系统拍照、放大和测量, 确定 Ag-NORs个数、位置及大小, 并用Photoshop CS3经剪贴、重排等操作获取Ag-NORs带型图, 并利用Excel 2007绘制模式图。
2 结果
2.1 斑石鲷核型分析
我们首先通过石蜡切片的方法对实验鱼的性别进行了鉴定, 在9尾斑石鲷中雄鱼4尾, 雌鱼5尾。对分散良好的斑石鲷雌、雄鱼中期分裂相观察显示,雄性斑石鲷具有一条体型巨大的特异的中部着丝粒染色体(图 1a), 可视为雄性斑石鲷的异形性染色体,而雌性斑石鲷不具有这种异形染色体(图1b), 雌、雄鱼均未发现次缢痕和随体的存在。

图1 斑石鲷雄鱼(上)和雌鱼(下)染色体中期分裂相及其核型Fig.1 The metaphase chromosomes and karyotype of O. punctatus图a中箭头所指为斑石鲷雄鱼异形染色体
挑选斑石鲷雌、雄鱼各50个分散良好的中期分裂相进行计数, 统计结果见表 1。雄性斑石鲷中期分裂相染色体众数为47, 占所观察分裂相的66%, 核型为2n=47, 1m+2sm+44t, NF=50; 雌性斑石鲷染色体众数为 48, 比例占到 68%, 核型为 2n=48, 2sm+46t,NF=50。

表1 斑石鲷雌、雄鱼染色体数目统计结果Tab.1 Chromosome number of both sexes in O. punctatus
2.2 斑石鲷染色体相对长度分析
对选取的雌、雄鱼各10个分散良好、数目完整的分裂相进行拍照、放大和测量, 数据统计结果见表2。雄性斑石鲷具有 1条巨大的异形染色体、1对亚中部着丝粒染色体以及 22对端部着丝粒染色体; 雌性斑石鲷具有1对亚中部着丝粒染色体和23对端部着丝粒染色体。雄性斑石鲷染色体实际长度最长为(2.55±0.21)μm, 最短为(0.56±0.08)μm; 而雌性斑石鲷染 色 体 实 际 长 度 范 围 在 (0.59±0.09)μm 与 (1.75±0.11)μm 之间。雄性斑石鲷异形染色体相对长度为(10.33±0.86), 最小染色体的相对长度是(2.28±0.30),异形染色体相对长度达到其它染色体的 2—5倍, 只有1条, 没有其它染色体与之配对; 雌性斑石鲷染色体相对长度最大为(6.87±0.42), 最小为(2.30±0.37)。
2.3 斑石鲷Ag-NORs带型分析
显微观察100个斑石鲷雌、雄鱼中期分裂相, 发现其中具有Ag-NORs位点的占73%。Ag-NORs位点的数目在不同分裂相中呈现多态性, 为 1—2个, 其中具有 2个 Ag-NORs的分裂相比例高达 72.6%, 其Ag-NORs皆位于1对sm染色体短臂端部, 呈短棒状;在具有1个Ag-NORs的分裂相中, Ag-NORs皆位于其中一条sm染色体短臂上(见表3)。
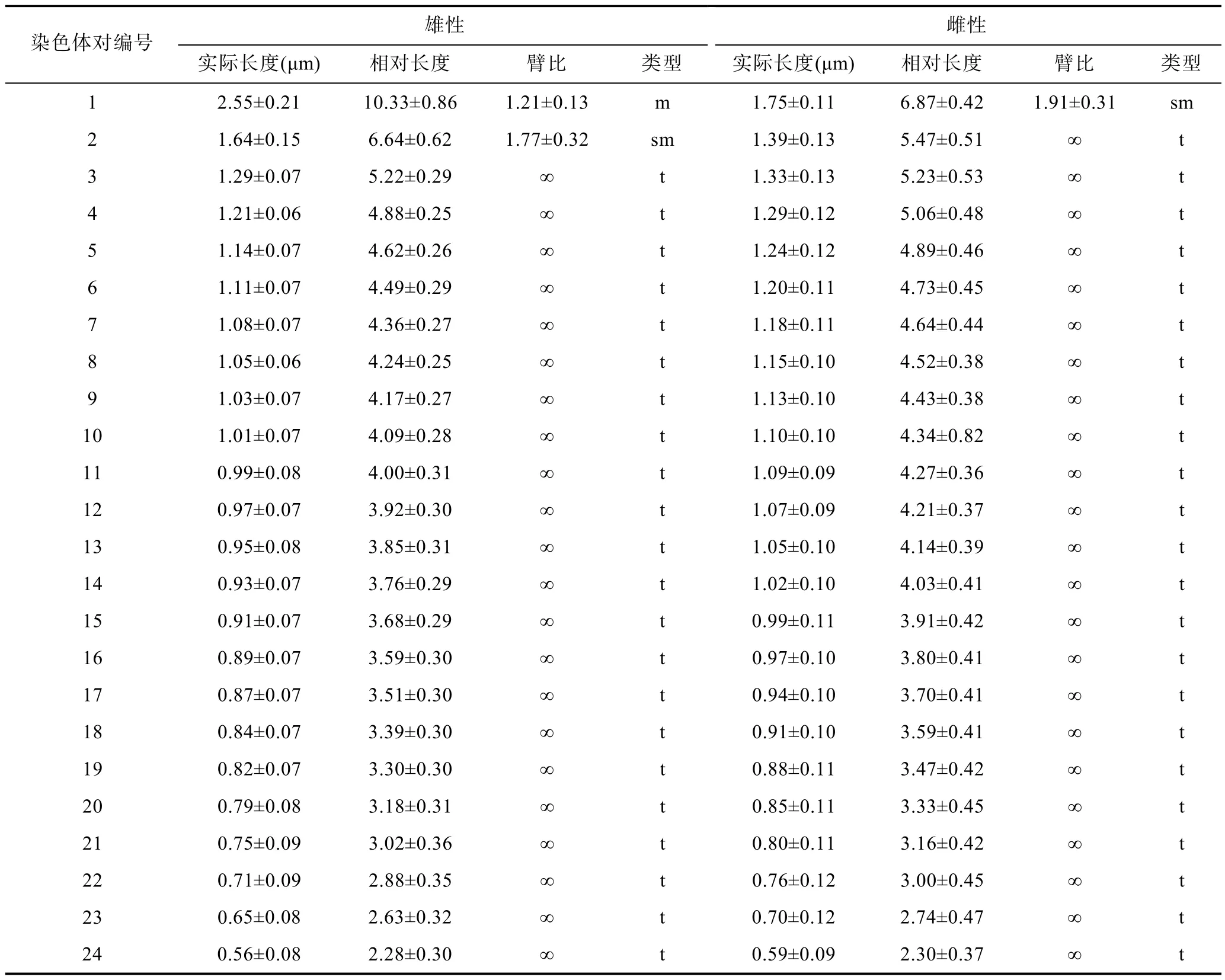
表2 斑石鲷中期染色体实际长度与相对长度Tab.2 Actual length and relative length of metaphase chromosome in O. punctatus
斑石鲷间期细胞核中银染核仁的数目同样呈现多态性, 其数目为1—3个, 其中含有2个核仁的间期细胞核出现频率最高, 为60%, 含有1个和3个核仁的细胞核比例分别为27%和13%, 并且核仁的大小与数目呈反比(见图2和表3)。
因此确定斑石鲷 Ag-NORs数目为 2 , 位于 1对 sm 染色体短臂上, 为端部 Ag-NORs, 斑石鲷Ag-NORs分裂相及其核型见图3, 测量计算银染部位长度并绘制模式图见图4。

图2 斑石鲷间期细胞核Ag-NORsFig.2 The Ag-NORs in nucleus of O. punctatus
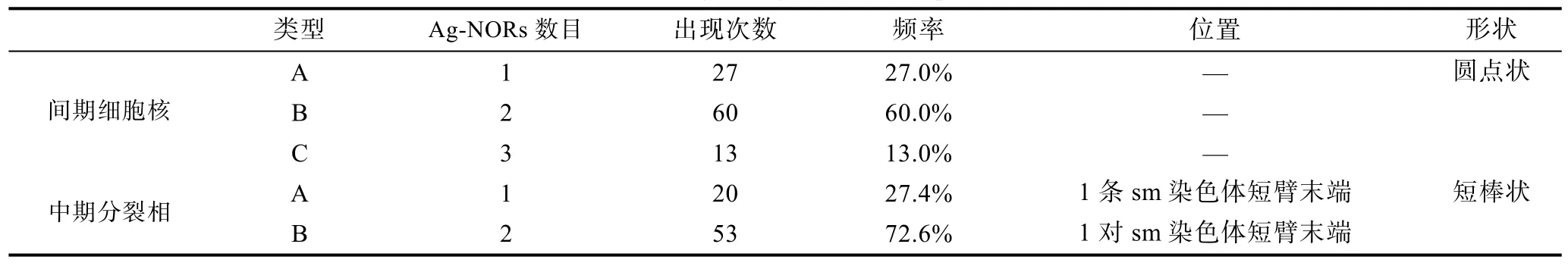
表3 斑石鲷Ag-NORs情况统计Tab.3 Summary of Ag-NORs in O. punctatus

图3 斑石鲷雄鱼(上)和雌鱼(下)Ag-NORs分裂相及其核型Fig.3 The Ag-NORs metaphase chromosomes and karyotype of O. punctatus箭头所指为Ag-NORs位置
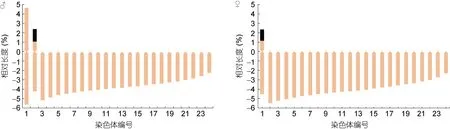
图4 斑石鲷雄鱼(左)和雌鱼(右)Ag-NORs模式图Fig.4 Schema of Ag-NORs in O. punctatus
3 讨论
据不完全统计, 截至 2006 年, 我国已进行核型研究的海水鱼类仅有 77 种, 其中以鲈形目鱼类研究最多(卓孝磊等, 2007)。在已进行研究的鲈形目鱼类中, 绝大多数鱼类的染色体数目为 2n=48, 且不同种鲈形目鱼类的核型公式呈现多样性, 中部、端部、亚中部以及亚端部着丝粒染色体皆有出现, 但极少有雌、雄鱼核型相异以及异形性染色体的报道。本研究的斑石鲷是鲈形目石鲷科石鲷属的一种鱼类, 雌、雄鱼核型相异, 其核型公式为雄性 2n=47,1m+2sm+44t, NF=50; 雌性 2n=48, 2sm+46t, NF=50,且雄鱼具有一条巨大的中部着丝粒异形性染色体,属于雄性配子异形, 可能是性染色体Y。
本研究中斑石鲷除异形性染色体外, 雌、雄鱼染色体的相对长度分别在 (2.30±0.37) — (6.87±0.42)和(2.28±0.30) — (6.64±0.62)之间, 染色体相对长度明显偏小, 这是因为鱼类在脊椎动物分类系统中处于较低位态, 所以染色体数目多且小(卓孝磊等, 2007)。小岛吉雄(1979)在研究染色体时对真骨鱼类进行了划分, 提出了3个演化类群分别为低位类、中位类和高位类, 同时李树深(1981)认为, 在特定的分类阶元中,根据染色体臂数以及端部着丝粒染色体个数的多寡,可以将其分为原始类群、较特化类群以及特化类群。本研究中斑石鲷雌鱼染色体数目为 2n=48, 大多数是端部着丝粒染色体, 染色体臂数少, 因此在不考虑斑石鲷雄性异形染色体的情况下, 可认为其在鱼类演化系统中属于高位类, 是较特化类群。此外, 一般认为鲈形目鱼类中原始类群的核型为2n=48t, NF=48(徐冬冬等, 2012), 其它特化类群的核型是通过罗伯逊易位及其它染色体结构重排方式形成的(赵金良, 2000)。本研究中斑石鲷雌、雄鱼2n=48保持不变, 而NF=50,即染色体臂数比原始类群有所增加, 因此推测是通过除罗伯逊易位之外的染色体重排方式形成的(卓孝磊等, 2007)。本研究中斑石鲷雌、雄鱼染色体个数与其同属近缘种条石鲷(Oplegnathus fasciatus)一致, 但条石鲷中含有一对中部着丝粒染色体(徐冬冬等,2012), 而在斑石鲷相对应的是一对亚中部着丝粒染色体, 这种细微差别有可能来源于实验手段差异或者显微测量造成的误差, 但更大的可能性是来源于这两个近缘物种在进化时间以及染色体结构重排程度等方面的差异。
在已考察核型的鱼类中, 具有异形性染色体的种类不足 10%(常重杰等, 2002), 但其性别决定类型却非常复杂, 几乎囊括了已知脊椎动物的所有类型(Graves et al, 2010), 包括 XX/XY型、ZW/ZZ型、Z0/ZZ型、XX/X0型、X1X1X2X2/X1X2Y型以及常染色体决定型等6个类别, 其中以XX/XY型和ZW/ZZ型最为常见, 而X1X1X2X2/X1X2Y型仅在鱼类中有报道(Graves et al, 2010)。目前我国国内已报道的具有异形性染色体的海水鱼类仅有5种, 分 别是斑尾复 鰕 虎鱼(Synechogobius ommaturus) (王金星等, 1994)、斑头鱼(Agrammus agrammus) (郑家声等, 1997)、半滑舌鳎(Cynoglossus semilaevis) (周丽青等, 2005)、条石鲷(Oplegnathus fasciatus) (徐冬冬等, 2012; Xu et al,2013)以及尖吻(Rhynchopelates oxyrhynchus) (舒琥等, 2013)。国外学者则对鱼类性别染色体研究得更为深入, Kitano等(2009)发现日本海三刺鱼(Gasterosteus aculeatus)群体的雌鱼2n=42, 雄鱼2n=41且具有一条巨大的异形性染色体, 常染色体和性染色体基因的荧光原位杂交显示异形性染色体Y来源于X1X2的融合, 其染色体的性别决定类型为X1X1X2X2/X1X2Y型,认为这种区别于太平洋群体的性别决定机制有可能与 150—200万年前日本海地区地质变化造成的地理隔离有关。此外, 本研究中报道的斑石鲷雌、雄鱼核型与近缘物种条石鲷(徐冬冬等, 2012; Xu et al, 2013)的报道类似, 后者已通过 C-带以及重复序列的荧光原位杂交试验证实Y染色体来源于X1X2的早期融合,确定其性别的染色体决定类型为 X1X1X2X2/X1X2Y型。本研究中斑石鲷雄性具有异形性染色体且染色体数目比雌性少一条, 基本符合X1X1X2X2/X1X2Y型特征, 因此可以初步推测其性别的染色体决定类型为X1X1X2X2/X1X2Y型, 但仍需要通过进一步的细胞遗传学手段来予以证实。
Ag-NORs是鱼类较为成熟的显带技术之一, 其数目、形态以及分布情况是亲缘关系和染色体进化的指标(卓孝磊等, 2007)。本研究发现斑石鲷雌、雄鱼具有单对Ag-NORs, 符合脊椎动物Ag-NORs的原始特征(Schmid, 1978)。另外, 斑石鲷雌、雄鱼的单对Ag-NORs分别位于第1对和第2对亚中部着丝粒染色体的短臂末端, 呈短棒状, 在其它鲈形目鱼类的报道中, Ag-NORs位于近着丝粒或端粒区域: Rocha等(2008)报道了6种笛鲷科鱼类(Perciformes, Lutjanidae)的Ag-NORs, 其中5个物种的单对Ag-NORs位于1对长臂近着丝粒位置处, 而另一物种具有 2对Ag-NORs, 其中之一与上述位置一致, 另外1对则位于1对染色体的端粒位置处; Neto等(2011)报道了鲈形目石鲈科(Perciformes, Haemulidae)2种鱼类的细胞遗传学分析结果, 二者皆具有单对 Ag-NORs, 分别位于 1对染色体的近着丝粒区次缢痕处。Ag-NORs通常分布于染色体的次缢痕和随体区域, 许多报道体现了次缢痕和核仁组织者的对应关系(Neto et al,2011; 范瑞等, 2014)但是在本研究中 Ag-NORs位置并未发现次缢痕或随体的存在, 杨坤等(2013)在对麦穗鱼(Pseudorasbora parva)的研究中也有此类报道,后者推测其染色体上次缢痕的结构可能已然存在,只是还没进化到从细胞学上可辨别的程度。此外, 本研究发现斑石鲷Ag-NORs有时只出现在同源染色体的一条上, 许多学者有类似报道(Caputo et al, 2001;范瑞等, 2014), 认为这是染色体的活性异形现象, 其实质是同源染色体上 rRNA基因转录活性存在差异(范瑞等, 2014)。
王金星, 赵小凡, 1994. 斑尾复虎鱼的染色体研究. 海洋科学, (4): 47—49
刘宝良, 赵奎峰, 王国文等, 2015. 珍珠龙胆石斑鱼和斑石鲷工厂化循环水混合养殖方法. China: CN104396841-A
李树深, 1981. 鱼类细胞分类学. 生物科学动态, (2): 8—15
杨 坤, 祝东梅, 王卫民, 2013. 麦穗鱼鳍条组织培养及染色体Ag-NORs和C-带研究. 南方水产科学, 9(3): 20—25
范 瑞, 姜志强, 李雅娟等, 2014. 太平洋鳕染色体核型及银染分析. 水生生物学报, 38(1): 115—120
林义浩, 1982. 快速获得大量鱼类肾细胞中期分裂相的 PHA体内注射法. 水产学报, 6(3): 201—208
卓孝磊, 邹记兴, 2007. 我国海水鱼类核型及染色体显带研究进展. 热带海洋学报, 26(5): 73—80
周丽青, 杨爱国, 柳学周等, 2005. 半滑舌鳎染色体核型分析.水产学报, 29(3): 417—419
郑家声, 王梅林, 戴继勋, 1997. 斑头鱼的核型及性染色体研究. 遗传, 19(增刊): 61—62
孟庆闻, 苏锦祥, 缪学祖, 1995. 鱼类分类学. 北京: 中国农业出版社, 734—756
赵金良, 2000. 我国海水鱼和咸淡水鱼染色体组型研究概述.上海水产大学学报, 9(4): 344—347
徐冬冬, 尤 锋, 楼 宝等, 2012. 条石鲷雌雄鱼核型及 C-带的比较分析. 水生生物学报, 36(3): 552—557
常重杰, 杜启艳, 2002. 鱼类的性别决定和性染色体. 淡水渔业, 32(2): 56—58
舒 琥, 黄萃莹, 刘 丽等, 2013. 6种科(Teraponidae)经济鱼类的染色体组型研究. 海洋与湖沼, 44(5): 1372—1377
楼允东, 1997. 中国鱼类染色体组型研究的进展. 水产学报,21(增刊): 82—96
小岛吉雄, 1979. 水产生物及遗传育种. 东京: 水交出版社,46—62
Caputo V, Machella N, Nisi-Cerioni P et al, 2001. Cytogenetics of nine species of Mediterranean blennies and additional evidence for an unusual multiple sex-chromosome system in Parablennius tentacularis (Perciformes, Blenniidae).Chromosome Research, 9(1): 3—12
Dong C F, Weng S P, Luo Y W et al, 2010. A new marine megalocytivirus from spotted knifejaw, Oplegnathus punctatus, and its pathogenicity to freshwater mandarinfish,Siniperca chuatsi. Virus Research, 147(1): 98—106
Graves J A M, Peichel C L, 2010. Are homologies in vertebrate sex determination due to shared ancestry or to limited options?. Genome Biology, 11(4): 205
Howell M W, Black D A, 1980. Controlled silver-staining of nucleolus organizer regions with a protective colloidal developer: a 1-step method. Experientia, 36(8): 1014—1015
Kitano J, Ross J A, Mori S et al, 2009. A role for a neo-sex chromosome in stickleback speciation. Nature, 164(7267):1079—1083
Kwun H J, Kim J K, 2010. Occurrence of natural hybrid between Oplegnathus fasciatus and Oplegnathus punctatus from the south sea of Korea. Korean Journal of Ichthyology, 22(3):201—205
Levan A, Fredga K, Sandberg A A, 1964. Nomenclature for centromeric position on chromosomes. Hereditas, 52(2):201—220
Neto C C M, Cioffi M Belo, Bertollo L A C et al, 2011.Molecular cytogenetic analysis of Haemulidae fish(Perciformes): evidence of evolutionary conservation.Journal of Experimental Marine Biology and Ecology,407(1): 97—100
Park J M, Lee S H, Yun S M et al, 2015. Egg development and morphology of larvae and juveniles of spotted knifejaw,Oplegnathus punctatus. Korean Journal of Ichthyology,27(2): 71—77
Rocha É C, Molina W F, 2008. Cytogenetic analysis in western Atlantic snappers (Perciformes, Lutjanidae). Genetics and Molecular Biology, 31(2): 461—467
Schmid M, 1978. Chromosome banding in Amphibia II.Constitutive heterochromatin and nucleolus organizer regions in Ranidae, Microhylidae and Rhacophoridae.Chromosoma, 68(2): 131—148
Shuang F, Luo Y W, Xiong X P et al, 2013. Virions proteins of an RSIV-type megalocytivirus from spotted knifejaw Oplegnathus punctatus (SKIV-ZJ07). Virology, 437(2): 89—99
Xu D D, Lou B, Bertollo L A C et al, 2013. Chromosomal mapping of microsatellite repeats in the rock bream fish Oplegnathus fasciatus, with emphasis of their distribution in the neo-Y chromosome. Molecular Cytogenetics, 6: 12
Yanagida T, Palenzuela O, Hirae T et al, 2008. Myxosporean emaciation disease of cultured red sea bream Pagrus major and spotted knifejaw Oplegnathus punctatus. Fish Pathology,43(1): 45—48
