基于稳定同位素的东太平洋大青鲨(Prionace glauca)营养级研究*
2016-01-15朱江峰戴小杰肖悦悦
王 洁 朱江峰, 戴小杰, 肖悦悦
(1. 上海海洋大学海洋科学学院 上海 201306; 2. 上海海洋大学 大洋渔业资源可持续开发省部共建教育部重点实验室 上海 201306)
鱼类摄食生态是海洋生态系统及渔业资源研究的基础工作, 涉及胃含物分析、营养级估算、营养生境及食物重叠分析、食物链和食物网建模等诸多方面和过程(窦硕增, 1996)。自20世纪60年代证实同位素存在以来, 稳定同位素在生态学领域中的应用日益广泛(李由明等, 2007)。利用稳定同位素可以研究生物的碳源和能量来源, 认识动物的食性、所处的营养级与结构, 并进一步揭示物种之间的复杂营养关系和有机物质的循环路径。鱼类食性研究传统的方法是胃含物分析法, 其局限性是结果往往只反映采集时样本的食性和营养状况, 而借助稳定同位素分析法可以揭示鱼类在长期生活史过程中的食物组成和来源(曾庆飞等, 2008)。目前, 国内外基于稳定同位素的营养生态研究多见于淡水和近海生物及其食物网(如硬骨鱼类、软体动物和浮游生物等), 如崂山水域食物网的营养关系研究(蔡德陵等, 1999)、渤海湾食物网研究(祎万等, 2005)等。
Ménard等(2007)选取印度洋西部黄鳍金枪鱼(Thunnus albacares)和旗鱼(Xiphias gladius)肌肉组织,分析其觅食生态和迁移, 并总结了纬度和季节对黄鳍金枪鱼和旗鱼食物来源的影响, 证实了其在海洋生态系统中的高营养级位置。Estrada等(2005)取大西洋蓝鳍金枪鱼(Thunnus thynnus)鳞片和肌肉, 运用稳定同位素技术分析其摄食状况, 发现与胃含物的研究结果相一致; 在软骨鱼类方面, 众所周知, 脊椎骨是研究鲨鱼年龄与生长的主要硬质, 但其在鲨鱼摄食研究中的价值, 直到近期才开始被认识(Campana et al, 2002)。Estrada等(2006)测定了西北大西洋大白鲨(Carcharodon carcharias)脊椎骨碳、氮稳定同位素比值(δ13C、δ15N), 发现 δ13C、δ15N 总体上有随脊椎骨半径增大而升高的趋势, 因而指出鲨鱼脊椎骨对重建个体营养史具有潜在的应用价值, 这可能是最早利用鲨鱼脊椎骨进行稳定同位素研究的案例。Kerr等(2006)通过脊椎骨的碳、氮稳定同位素分析, 研究了东北太平洋大白鲨的营养级和食物来源, 对海洋洄游鱼类摄食研究给予了启发。
相比近海鱼类, 目前对大洋鱼类的稳定同位素研究还很少。本研究利用脊椎骨, 对东太平洋大青鲨(Prionace glauca)的摄食和营养级进行研究。大青鲨属于大洋性中上层软骨鱼类,广泛分布三大洋热带和温带水域, 是金枪鱼延绳钓渔业的主要兼捕渔获(高春霞等, 2013)。因此, 作为种群动态、资源保护研究的基础, 大青鲨的生物学研究受到较为广泛的关注(Sibert et al, 2006)。近期, Li等(2014)利用肌肉样本,测定了大青鲨和其它几种大洋性鲨鱼的δ13C和δ15N,并估算了营养级。本文比较了大青鲨不同个体大小和性别的δ13C、δ15N差异, 并着重探讨了基线生物的选取对营养级估算的影响, 为相关大洋性鲨鱼的摄食生态研究提供参考。
1 材料与方法
1.1 样品来源
大青鲨样品由2010—2012年我国金枪鱼延绳钓科学观察员海上采集, 观察员对延绳钓捕获的大青鲨逐一记录个体长度、性别等信息, 并随机选取部分大青鲨进行脊椎骨取样。脊椎骨一般取自腮裂上部,每尾6—8节, 清除粘连的肌肉等组织、清洗后冷冻保存(约–20℃), 带回实验室。本研究共采用样品鱼56尾,叉长范围为153—242cm, 捕获位置位于东太平洋公海海域(经纬度范围为 3°—14°S, 130°—163°W)。
1.2 样品处理与实验
本研究进行稳定同位素测定的样品为整节脊椎骨。对采集的脊椎骨样品, 随机切取完整的一节, 进一步剔除表面和结缔组织, 放置于离心管中并作标记。随后将样品冷冻干燥24h (ALPHA 1-4 LD plus),用球磨仪(型号 MM400)磨成粉末后用锡箔纸包取2mg样品, 用于碳、氮稳定同位素测定。稳定同位素测定在国家海洋局第三海洋研究所完成, 同位素比例质谱仪型号为TC/EA-IRMS (Delta V advantage)。载气He流速90mL/min, 反应管温度 960°C, 色谱柱温度 50°C。
1.3 测定数据分析
经同位素质谱仪测定样品中碳、氮稳定同位素丰度, 计算碳、氮稳定同位素比值 δ13C、δ15N。其中, δ13C的计算以PDB(Vienna Peedee Belemnite)国际标准作为参考标准, δ13C按以下公式计算:

式(1)中, R(13C/12CVPDB)为国际标准物VPDB的碳同位素丰度比值。δ13C的精度为±0.2‰。
δ15N以空气中氮气的氮作为参考标准, δ15N值按以下公式计算:

式(2)中, R(15N/14Nair)为空气中氮气的氮同位素丰度比值。δ15N的精度为±0.25‰。
大青鲨营养级(Trophic position, TP)利用如下公式计算(Post, 2002):
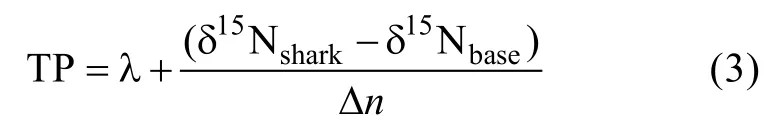
式(3)中, λ为基线生物的营养级, Δn为15N在每一营养级的平均富集度, δ15Nshark为鲨鱼样品的 δ15N 值,δ15Nbase为选取基线生物的δ15N值(Post, 2002)。上述公式表明, 基线生物的选择会影响营养级的计算值。在实践中, 研究对象和基线生物往往难以同步采集,尤其在大洋上。因此, 常以相近区域的基线生物, 作为营养级计算的基础。本文选取三种基线生物进行TP的计算, 并比较结果的差异:
基线生物a: 参照Popp等(2007)在东太平洋海域采集浮游动物测得的 δ15N与纬度拟合的线性模型。选取浮游动物作为基线生物, 其 δ15Nmesozoo值由公式(4)得出:
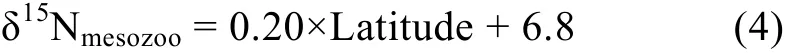
式(4)中, Latitude为样本鱼捕获时纬度(以观察员记录为准), Δn取2.1‰, λ取 2.7。营养级计算值记为:TPa。
基线生物 b: Kerr等(2006)对地域位置相近的东太平洋大白鲨脊椎骨的 δ13C、δ14C和 δ15N研究, 其基线生物的选取参照了 Estrada等(2003)的方法, 即取 Ammodytes americanus的δ15N作为 δ15Nbase值。本文也参照这一方法, δ15Nbase取 10.2, Δn 取 3.4‰, λ取3.0。营养级计算值记为: TPb。
基线生物 c: Torres等(2014)对北大西洋翅鲨(Galeorhinus galeus)的摄食生态进行稳定同位素研究,该研究在纬度上与本研究相似, 故参照其取 Capresaper的 δ15N 作为 δ15Nbase值, δ15Nbase取 8.7, Δn取 3.4‰,λ取3.0。营养级计算值记为: TPc。
2 结果
2.1 碳、氮稳定同位素比值
大青鲨脊椎骨样品的碳、氮稳定同位素比值频率分布见图 1和图 2。其中, δ13C值范围相对集中于–13‰— –16‰之间, 而 δ15N 值分布范围略广, 在10‰—18‰之间。δ13C值极差为2.35‰, δ15N值极差达到7.1‰。样品δ13C值和δ15N值的标准差较大, 特别是δ15N值偏离均值程度较大(表1), 表明大青鲨的食物来源较为复杂。

图1 碳稳定同位素比值频率分布Fig.1 Distribution of stable carbon isotope ratio
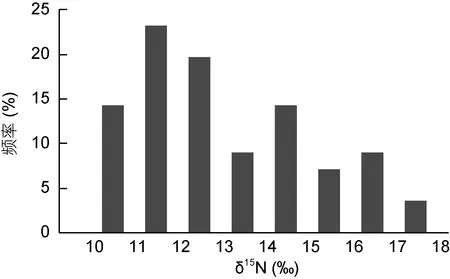
图2 氮稳定同位素比值频率分布Fig.2 Distribution of nitrogen stable isotope ratio
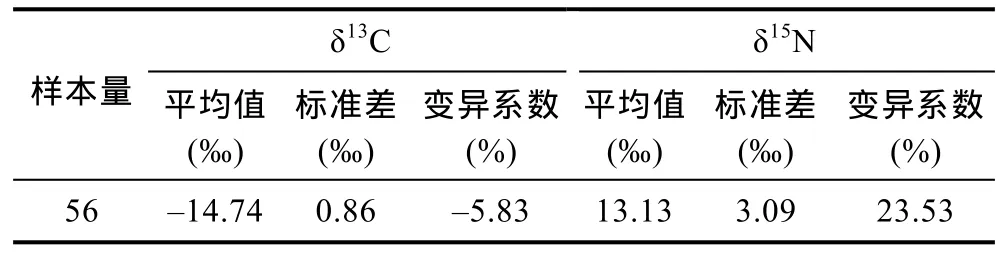
表1 碳、氮稳定同位素比值Tab.1 Carbon and nitrogen stable isotope ratios
2.2 碳、氮稳定同位素比值随体长的变化
为了比较脊椎骨碳、氮稳定同位素比值随大青鲨个体大小的变化情况, 将叉长范围在 153—242cm的样本分为3组, 组距为30cm, 比较δ13C、δ15N值的差异(图3, 图4, 表2)。大青鲨脊椎骨δ13C、δ15N值随着叉长的增长无明显变化趋势(图3, 图4)。各个叉长组的δ13C、δ15N以及碳氮比(C/N)的平均值十分接近,特别是C/N的平均值最大差值仅为0.14(表2)。

图3 δ13C值随叉长变化Fig.3 δ13C values with fork length
图4 δ15N值随叉长变化Fig.4 δ15N values with fork length

表2 大青鲨δ13C、δ15N和碳氮比随叉长的变化Tab.2 Statistics of δ13C, δ15N and the ratio of carbon to nitrogen for blue shark of different sizes
2.3 不同性别间的碳、氮稳定同位素比值
为了比较δ13C、δ15N值在性别间的差异, 分别统计了 11尾雌性的 δ13C 值(均值–14.75‰)和 δ15N 值(均值11.89‰)、32尾雄性的δ13C值(均值–14.92‰)和δ15N值(均值 12.71‰)。利用 K-S独立样本检验, 在 0.01显著性水平下, 雌性和雄性的δ13C (P=0.646>0.01)和δ15N (P=0.221>0.01)分布均无显著性差异, 表明不同性别的大青鲨食物来源几乎接近, 所捕食对象可能没有显著的差异。
2.4 基于不同基线生物的营养级比较
参照a、b、c三种不同的基线生物, 计算得出大青鲨的营养级频率分布如图5。TPa均值(=6.53)与TPb均值(=3.85)、TPa均值与 TPc均值(=4.29)皆存在显著差异(P<0.01, t检验, n=56), 而TPb均值与TPc均值未显示出显著差异(P>0.01, t检验, n=56)。而K-S检验表明, TPa分布与TPb分布、TPa分布与TPc分布、TPb分布与TPc分布皆存在显著差异(P<0.01, n=56)。

图5 根据不同基线生物计算的营养级频率分布Fig.5 Trophic position distribution based on three baseline species
3 讨论
本研究尝试采用整节脊椎骨, 对大青鲨的营养特征进行了研究。碳稳定同位素比值指示了动物的食物来源, 而氮稳定同位素表明了动物的营养级(李云凯, 2014)。大青鲨脊椎骨的 δ13C均值为−14.74‰(标准差0.86‰), δ15N均值为13.13‰(标准差3.09‰), 与Li等(2014)得到的中东太平洋(5°—8°N, 151°—70°W)大青鲨肌肉样品的δ13C值、δ15N值相近(δ13C均值为−18.31‰, 标准差 0.54‰; δ15N 均值为 15.77‰, 标准差1.07‰), δ13C均值相差略大。除了样品本身的随机误差因素外, 作为高度洄游性鱼类, 大青鲨不同个体的食物来源可能存在一定的差异。此外, 鲨鱼不同组织(如肌肉、肝脏)的稳定同位素比值也有所不同, 体现其食物来源和营养的变化(MacNeil et al, 2005)。
鲨鱼的生活史较长, 其营养级可能随生长而变化。Estrada等(2006)发现大白鲨脊椎骨碳、氮稳定同位素比值总体上有随个体增大而升高的趋势。本文的结果未显示大青鲨脊椎骨碳、氮稳定同位素比值随叉长的明显变化, 主要原因可能是延绳钓渔获的大青鲨均为较大个体, 其摄食对象相差不大(表 2)。在今后的研究中, 适当补充幼鱼样品, 可以提供大青鲨营养是否随生长产生明显变化的证据。类似地, 本文的样品碳、氮稳定同位素比值未显示出性别上的差异,表明大青鲨的营养结构无显著的性别间差异。由于未能结合样品的成熟度资料, 本研究未能确定大青鲨的营养结构在成熟期或怀孕期是否有所变化。
确定合适的基线生物是运用稳定同位素方法研究营养结构问题的难点之一(Post, 2002)。在营养级计算上, 理想的基线生物应是与研究对象栖息地相同、营养结构稳定的较低营养级生物。但是对于分布范围广, 栖息地变化较大的高度洄游性鲨鱼而言, 难以选择合适的基线生物进行同步跟踪取样。国外研究者多借助邻近海域的相关研究选择基线生物(Estrada et al,2003; Kerr et al, 2006; Torres et al, 2014)。本研究参照了不同的基线生物, 结果表明不同基线生物对大青鲨营养级计算值有明显的影响(图 5)。选择基线生物a、b、c得到的营养级频率分布两两之间有显著差异(其中a、b均来自东太平洋), 但TPb与TPc的平均值差异不显著, 这是均值检验比较的弱点, 从图5可以明显看出TPb与TPc的差异。此外, 从计算方法看(公式(3)), 营养级的计算值实际受基线生物的营养级(λ)和δ15N值、15N在每一营养级的平均富集度(Δn)三个参数的综合影响, 样品的营养级与其 δ15N值为非线性关系。
Cortés(1999)通过分析胃含物组成估算的大青鲨TP约为4.1, 而Li等(2014)通过肌肉氮稳定同位素测定计算的TP均值为4.17, 与本文采用基线生物c的结果(TP均值=4.29)接近。基线生物a为浮游动物, 其δ15N值估算自与纬度的线性关系, 该线性关系可能随海域的变化较大, 因此导致大青鲨样品的营养级计算值偏高。Post(2002)指出, 如果研究目的是获得研究对象的营养级相对变化, 那么借助邻近海域或栖息地的基线生物, 对结果的影响一般不大。本文的研究表明, 通过整节脊椎骨的稳定同位素测定, 来获得大青鲨的摄食特征信息是可行的。由于基线生物对营养级计算的影响问题难以在短期内解决, 今后可将相对营养级或营养级变化作为研究重点, 包括所在食物网的平均营养级变化, 这也是当前人类活动(如捕捞)对生态系统影响评价的重要课题之一。
万 祎, 胡建英, 安立会等, 2005. 利用稳定氮和碳同位素分析渤海湾食物网主要生物种的营养层次. 科学通报, 50(7):708—712
李云凯, 2014. 稳定同位素技术在鲨鱼摄食和洄游行为研究中的应用. 应用生态学报, 25(9): 2756—2764
李由明, 黄翔鹄, 刘楚吾, 2007. 碳氮稳定同位素技术在动物食性分析中的应用. 广东海洋大学学报, 27(4): 99—103
高春霞, 戴小杰, 吴 峰等, 2013. 北大西洋大青鲨年龄和生长初步研究. 上海海洋大学学报, 22(1): 120—127
曾庆飞, 孔繁翔, 张恩楼等, 2008. 稳定同位素技术应用于水域食物网的方法学研究进展. 湖泊科学, 20(1): 13—20
窦硕增, 1996. 鱼类摄食生态研究的理论及方法. 海洋与湖沼,27(5): 556—561
蔡德陵, 孟 凡, 韩贻兵等, 1999.13C/12C比值作为海洋生态系统食物网示踪剂的研究——崂山湾水体生物食物网的营养关系. 海洋与湖沼, 30(6): 671—678
Campana S E, Natanson L J, Myklevoll S, 2002. Bomb dating and age determination of large pelagic sharks. Canadian Journal of Fisheries and Aquatic Sciences, 59(3): 450—455
Cortés E, 1999. Standardized diet compositions and trophic levels of sharks. ICES Journal of Marine Science, 56(5):707—717
Estrada J A, Lutcavage M, Thorrold S R, 2005. Diet and trophic position of Atlantic bluefin tuna (Thunnus thynnus) inferred from stable carbon and nitrogen isotope analysis. Marine Biology, 147(1): 37—45
Estrada J A, Rice A N, Lutcavage M E et al, 2003. Predicting trophic position in sharks of the north-west Atlantic Ocean using stable isotope anlysis. Journal of the Marine Biological Association of the UK, 83(6): 1347—1350
Estrada J A, Rice A N, Natanson L J et al, 2006. Use of isotopic analysis of vertebrae in reconstructing ontogenetic feeding ecology in white sharks. Ecology, 87(4): 829—834
Kerr L A, Andrews A H, Cailliet G M et al, 2006. Investigations of Δ14C, δ13C, and δ15N in vertebrae of white shark(Carcharodon carcharias) from the eastern North Pacific Ocean. Environmental Biology of Fishes, 77(3): 337—353
Li Y K, Gong Y, Chen X J et al, 2014. Trophic ecology of sharks in the mid-east Pacific Ocean inferred from stable isotopes.Journal of Ocean University of China, 13(2): 278—282
MacNeil M A, Skomal G B, Fisk A T, 2005. Stable isotopes from multiple tissues reveal diet switching in sharks. Marine Ecology Progress Series, 302(1): 199—206
Ménard F, Lorrain A, Potier M et al, 2007. Isotopic evidence of distinct foraging ecology and movement pattern in two migratory predators (yellowfin tuna and swordfish) of the western Indian Ocean. Marine Biology, 153(2): 141—152
Popp B N, Graham B S, Olson R J et al, 2007. Insight into the trophic ecology of yellowfin tuna, Thunnus albacares, from compound-specific nitrogen isotope analysis of proteinaceous amino acids. Terrestrial Ecology, 1(7):173—190
Post D M, 2002. Using stable isotopes to estimate trophic position: Models, methods, and assumptions. Ecology, 83(3):703—718
Sibert J, Hampton J, Kleiber P et al, 2006. Biomass, size, and trophic status of top predators in the Pacific Ocean. Science,314(5806): 1773—1776
Torres P, da Cunha R T, Maia R et al, 2014. Trophic ecology and bioindicator potential of the North Atlantic tope shark.Science of the Total Environment, 481(10): 574—581
