南极独角雪冰鱼(Chionodraco hamatus)miR-7132对红细胞发生的作用研究*
2016-01-15胡星星王丛丛产久林许强华
胡星星 王丛丛, 产久林 许强华,,
(1. 上海海洋大学海洋科学学院 上海 201306; 2. 大洋渔业资源可持续开发省部共建教育部重点实验室 上海 201306;3. 国家远洋渔业工程技术研究中心 上海 201306; 4. 远洋渔业协同创新中心 上海 201306)
微 RNA(microRNA, miRNA)是在真核生物中存在的一类长度为22—24个核苷酸的非编码RNA, 主要通过与靶基因的非翻译区(3´ Untranslated Regions,3´UTR)结合, 在转录后水平调控基因的表达(Ambros,2001)。自1993年第一个非编码小RNA——(lin-4)被证实(Lee et al, 1993), 越来越多的microRNA被发现并得到研究。目前为止, 在人类基因组中已经鉴定出超过1000种microRNA, 并且这些microRNA调控了约 50%基因组的活性(Hartmann et al, 2011)。microRNA在脊椎动物中高度保守, 调控一系列重要的生物过程, 同时也参与一些疾病的发生, 如癌症、病毒性疾病、传染性疾病等(Shen et al, 2010)。迄今为止, 也有不少关于microRNA对红细胞发生调控的研究报道。Felli等(2005)发现, miR-221与 miR-222过表达损害红系祖细胞的正常增殖与分化, 它们主要通过抑制Kit受体蛋白的表达影响正常红细胞的发生。研究表明, 在CD34+祖细胞中强制性表达miR-223,对红系分化重要蛋白 LMO2的表达有明显的抑制作用, 从而扰乱红系的分化进程(Felli et al, 2009)。
生物的造血分化是一个动态且复杂的过程, 发生在生物的整个生活史中。造血过程主要由造血干细胞分化产生各种血细胞, 包括红细胞、白细胞、淋巴细胞等(Ge et al, 2014)。其中, 红细胞生成是脊椎动物造血过程中最重要的部分之一。红细胞的正常发育涉及很多转录因子的参与和调控(Tsiftsoglou et al,2009), 包括锌指蛋白 GATA家族成员(Dore et al,2008), 血红素生物合成的限速酶(5´-aminolevulinate synthase 2, ALAS2)等的参与(Harigae et al, 1998)。亚铁血红素作为血红蛋白的色素部分, 由铁原子及原卟啉区组成。亚铁血红素的正常生物合成需要8种酶的辅助, 为了防止此生物合成过程中有毒中间产物的积累, 需要第一限速酶 ALAS(5-氨基乙酰丙酸合酶)的调节。ALAS包含两种同工酶ALAS1和ALAS2, ALAS1在生物体内很多组织都有表达, ALAS2只在红系祖细胞中表达, 为特异调节红系发育的限速酶。ALAS2突变会造成原卟啉合成减少, 从而导致亚铁血红素合成不足引发血红细胞性贫血症(Fujiwara et al, 2015)。
血红细胞的产生几乎成为脊椎动物的独有特征。然而, 有一类生活在极端寒冷的南极海域的脊椎动物——南极冰鱼, 隶属于南极鱼亚目(Notothenioidei), 在长期的适应性进化中逐渐丢失血红细胞, 是目前已知的唯一缺乏具有功能性血红细胞的脊椎动物, 它们主要依靠皮肤和鳃吸收溶解在水中的氧气(许强华等, 2014)。
在本项目的前期研究中, 以南极独角雪冰鱼(Chionodraco hamatus)为研究对象, 通过对血液发生主要组织头肾的microRNA组分分析发现, 冰鱼头肾中存在大量高表达的 microRNAs, 这些高表达的microRNAs可能抑制着冰鱼红血球的发生(Xu et al,2015)。在此基础上, 本研究针对独角雪冰鱼头肾中异常高表达的 miR-7132, 利用转基因斑马鱼和细胞转染实验, 首次研究了该microRNA在红细胞生成过程中的功能及作用机制。本研究为揭示miR-7132在南极冰鱼体内造血的影响机制提供了理论依据, 并为进一步探讨极端低温环境条件下microRNA的造血作用机制与进化研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 样本采集 独角雪冰鱼样本由第31次南极考察队乘“雪龙”号作业采集于南极埃默里冰架。活体迅速冻存于-80°C超低温冰箱。冻存样本用锡箔纸包裹后放液氮中带回上海海洋大学海洋科学学院保护遗传学实验室, -80°C保存备用。
1.1.2 实验动物与细胞 293T细胞系(人肾上皮细胞)作为细胞转染实验的常用细胞系, 其转染效率高, 可便捷地获得转染后细胞内外蛋白(Meissner et al, 2001)。本实验中293T细胞培养于完全培养基中,完全培养基由 DMEM(改良 Eagle培养基)、10%FBS(胎牛血清)和双抗(100U 青霉素, 100μg链霉素)组成, 培养条件为5%CO2, 培养温度为37°C。显微注射所用一细胞期斑马鱼胚胎来自本实验室饲养野生型斑马鱼, 由达到性成熟的健康野生型斑马鱼繁殖所得。
1.1.3 主要试剂 Trizol试剂(Life Technologies)、酚氯仿异戊醇(25:24:1)、异丙醇、1×TAE缓冲液、琼脂糖、乙醇、过氧化氢 30%溶液、Trypsin-EDTA Solution(上海生工生物工程公司); primer 2X MIX(北京全式金生物技术公司)、DNA胶回收试剂盒(Axygen Biosciences, USA)、反转录试剂盒、PMD18-T载体(TaKaRa, Japan)、DNA Marker、DH5α 感受态细胞(TaKaRa, Japan); O-Dianisidine (SIGMA, USA)。
1.2 方法
1.2.1 总RNA提取与cDNA合成 取独角雪冰鱼的肌肉组织, 依照Trizol法(Life Technologies)步骤提取总RNA, 经琼脂糖凝胶电泳检测RNA质量与完整性, 分光光度法(Thermo)测定总 RNA 的浓度; 采用反转录试剂盒(TaKaRa)合成cDNA, 保存于-20°C备用。
1.2.2 独角雪冰鱼头肾小RNA组分分析 提取独角雪冰鱼头肾总RNA, 经Hi-seq2000 Small RNA测序仪对 RNA组分进行分析, 对测序后的初始数据进行去重处理, 并与miRNA数据库中已知miRNA进行序列比对, 鉴定miRNA类别。
1.2.3 引物设计与合成 根据本实验室对独角雪冰鱼转录组测序所得的 ALAS2的序列, 通过比对本实验室自行完成的独角雪冰鱼的全基因组序列(未发表), 获得ALAS2的3´UTR序列。根据获得的ALAS2的3´UTR序列, 由Primer5.0软件设计得到特异性引物序列, 同时选取适合的酶切位点, 拟扩增 ALAS2的 3´UTR 序列(表 1)。
1.2.4 ALAS2的3´UTR片段克隆 PCR反应扩增得到ALAS2 3´UTR片段, 反应体系25µL: primer 2X MIX(北京全式金生物技术公司)13µL, 上下游引物各1µL, cDNA模板1.5µL, 加水至25µL。反应条件: 95°C预变性5min, 94°C变性45s, 58°C退火45s, 72°C延伸90s, 4°C保存。胶回收反应试剂盒(上海生工生物工程公司)回收PCR反应产物, 回收产物连接至pMD18-T载体上, 转化并筛选阳性克隆(北京天根生化科技公司), 菌液PCR产物送上海生工测序。
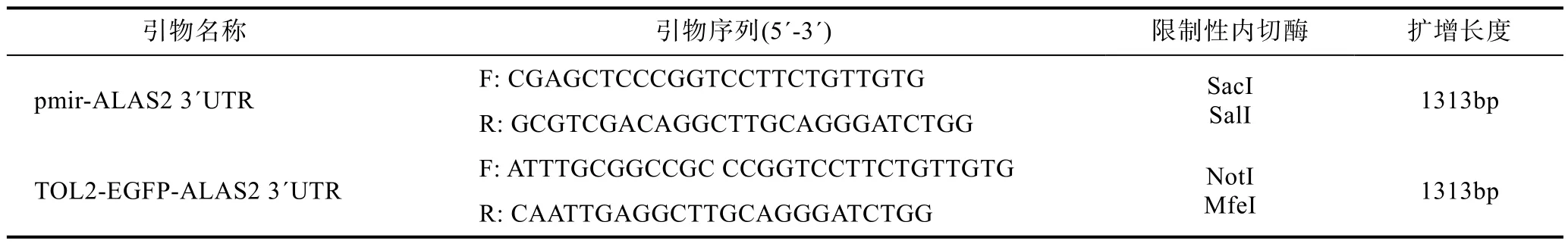
表1 引物序列与限制性内切酶Tab.1 Primer sequence and restriction enzyme
1.2.5 固蓝染色 对受精后一细胞期的斑马鱼胚胎进行显微注射, miR-7132(苏州吉玛基因公司)的注射浓度为 50µm。36h后通过固蓝染色固定胚胎体内血红蛋白, 固蓝染液主要成分为: O-dianisdine(1.5g/L)、醋酸钠(0.1mol/L, pH4.5)、30%过氧化氢溶液、无水乙醇。经4%多聚甲醛固定胚胎6h以上, 加入磷酸盐缓冲液(1×PBS)洗去胚胎表面残余的多聚甲醛与杂质, 加入适量的固蓝染液于摇床上避光染色20min, 弃去染液加入甘油, 于显微镜下成像。应用图像处理软件Image J对图片中所固定的血红蛋白的区域进行统计。
1.2.6 细胞转染 转染前一天将状态良好的 293T细胞接种于6孔培养板中, 于完全培养基中培养。次日, 观察到细胞密度约70%时可进行转染, 按照转染试剂 Attractene Transfection(QIAGEN)说明书步骤,用不含血清的培养基进行 miR-7132与 pmir-ALAS2 3´UTR质粒共同转染, 同时以共同转染 NC(negative control, 5´ UUCUCCGAACGUGUCACGUTT 3´)与pmir-ALAS2 3´UTR质粒作为阴性对照组, 以只转染pmir-ALAS2 3´UTR质粒作为空白对照组, 转染后6h更换为完全培养基, 继续培养至 24h。收集此时的细胞, 采用 Dual-Luciferase®报告基因检测试剂盒(Promega, USA)检测荧光素酶活性, 依据实验数据,计算萤火虫荧光素酶/海肾荧光素酶(Firefly Luc/Renilla Luc)活性的比值。
1.2.7 斑马鱼显微注射 将上述构建的 Tol2-EGFP-ALAS2 3´UTR(100ng/µL)与 miR-7132(50µm)共同注射入处于第一细胞期的斑马鱼胚胎。24h后荧光显微镜下观察并提取胚胎总蛋白, 进行蛋白质免疫印迹(Western Blot)实验。
2 结果与分析
2.1 独角雪冰鱼ALAS2 3´UTR表达质粒构建
将扩增得到的ALAS2 3´UTR连接至PMD18-T载体上, 分别进行双酶切。如图1所示, 得到酶切产物片段长度为 1313bp, 将酶切产物连接至 pmir-GLO (SacⅠ, SalⅠ)与 Tol2-EGFP (MfeⅠ, NotⅠ)表达质粒中。
2.2 miR-7132对血红蛋白表达的影响
显微注射miR-7132的斑马鱼胚胎, ALAS2蛋白的表达水平明显下降(图2a)。这表明: ALAS2可能是miR-7132的靶基因。应用图像分析软件Image J对固蓝染色后的结果进行分析, 统计斑马鱼胚胎血红蛋白区域的大小, 进行显著性分析。固蓝染色结果显示(图 2b), 显微注射 miR-7132的斑马鱼胚胎体内血红蛋白的含量显著低于注射 Negative Control(NC)对照组与空白(WT)对照组, 说明miR-7132在一定程度上对血红蛋白的表达起到抑制作用。

图1 表达质粒构建电泳图Fig.1 Electrophoresis of expression plasmids construction

图2 过表达miR-7132降低斑马鱼胚胎ALAS2和血红蛋白的表达水平Fig.2 Overexpression of the miR-7132 reduced the level of hemoglobin and ALAS2 in zebrafish embryo
2.3 miR-7132过表达对红系分化基因 ALAS2表达的影响
前期的研究中, 通过对独角雪冰鱼造血组织头肾中小RNA的组分进行分析, 发现miR-7132在独角雪冰鱼头肾组织中显著高表达(Xu et al, 2015)。因此,对miR-7132可能作用的靶基因进行生物学信息预测,预测结果表明(图3a), ALAS2基因可能是miR-7132的靶基因, 通过3´UTR区域与miR-7132进行互补配对。
为确定 miR-7132对红系分化相关基因 ALAS2的作用, 将ALAS2的3´UTR靶位点附近1313bp片段连接至 pmirGLO双荧光素酶报告质粒中, 构建得到pmi-CH ALAS2 3´UTR质粒。将 miR-7132与 pmi-CH ALAS2 3´UTR质粒共同转染293T细胞, 24h收集细胞检测荧光素酶与海肾荧光素酶活性。结果显示, 共转染miR-7132与pmi-CH ALAS2 3´ UTR质粒组的萤火虫荧光素酶的相对活性显著低于共转染 NC与pmi-CH ALAS2 3´ UTR 质 粒组(图 3b), 表 明miR-7132在体外水平对ALAS2的表达具有显著抑制作用。
2.4 体内过表达miR-7132对独角雪冰鱼ALAS2基因表达的影响
为进一步验证miR-7132对ALAS2基因的作用,构建了可在体内表达 GFP绿色荧光蛋白基因的表达质粒, 将ALAS2 3´UTR连接至GFP荧光蛋白下游组成Tol2-GFP-CH ALAS2 3´ UTR表达质粒。
以 miR-7132终浓度为 50µm、质粒终浓度为100ng/µL的注射量以一定比例混合后显微注射斑马鱼第一细胞期胚胎, 24h后观察胚胎荧光强度变化情况。同时, 提取斑马鱼胚胎总蛋白进行 Western blot检测GFP荧光蛋白的表达。结果显示, 注射miR-7132后, 斑马鱼胚胎体内所表达的 GFP荧光强度显著低于注射 NC的阴性对照组与空白对照组(图 4a, b)。Western blot结果显示, 注射 miR-7132的实验组的GFP蛋白表达显著低于注射NC的阴性对照组与空白对照组(图 4c), 表明 miR-7132可在体内显著抑制ALAS2基因的表达。
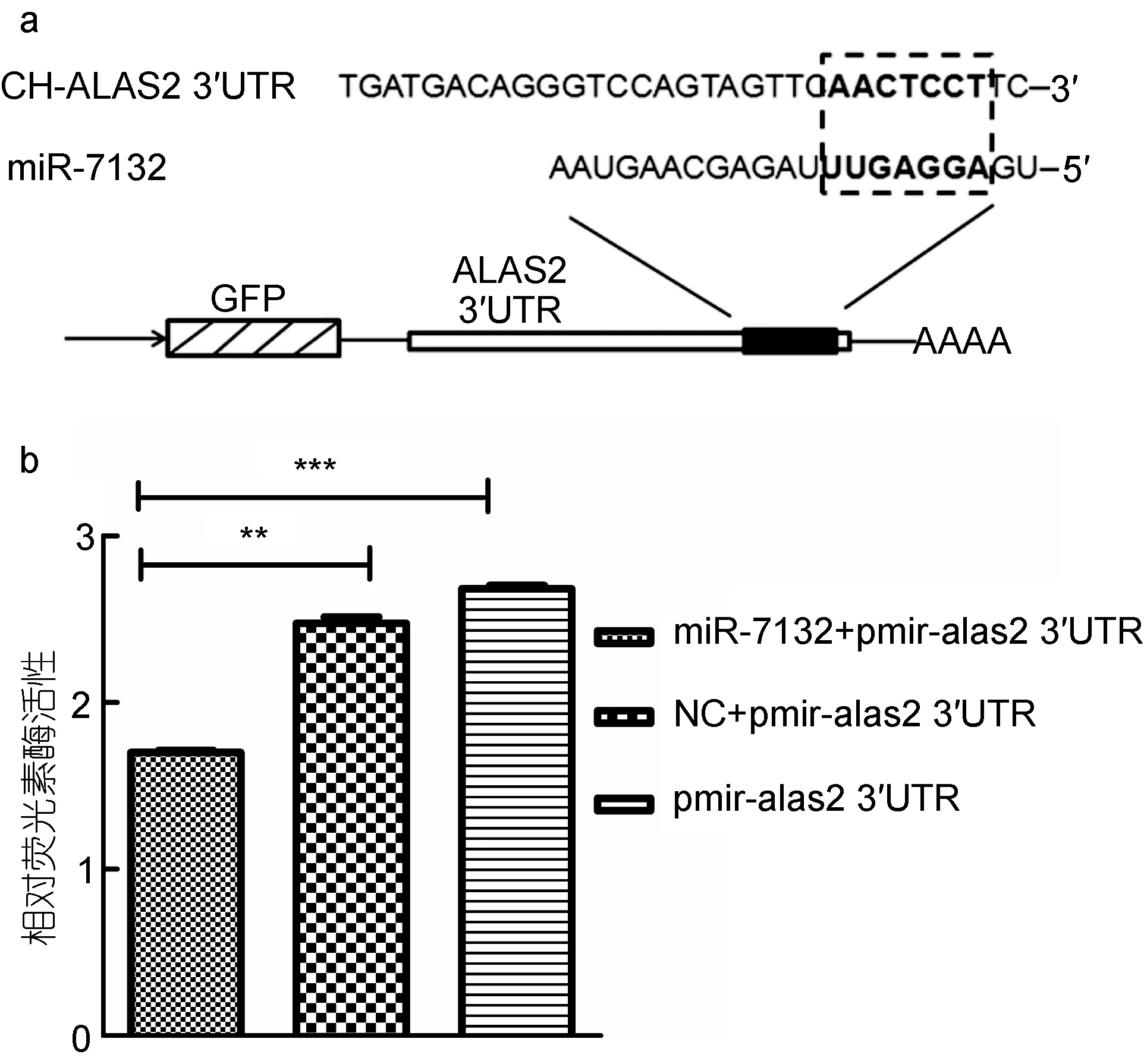
图3 293T细胞转染鉴定miR-7132对ALAS2的抑制作用Fig.3 Identify the inhibition of miR-7132 on ALAS2 by the 293T cells transfection
3 讨论
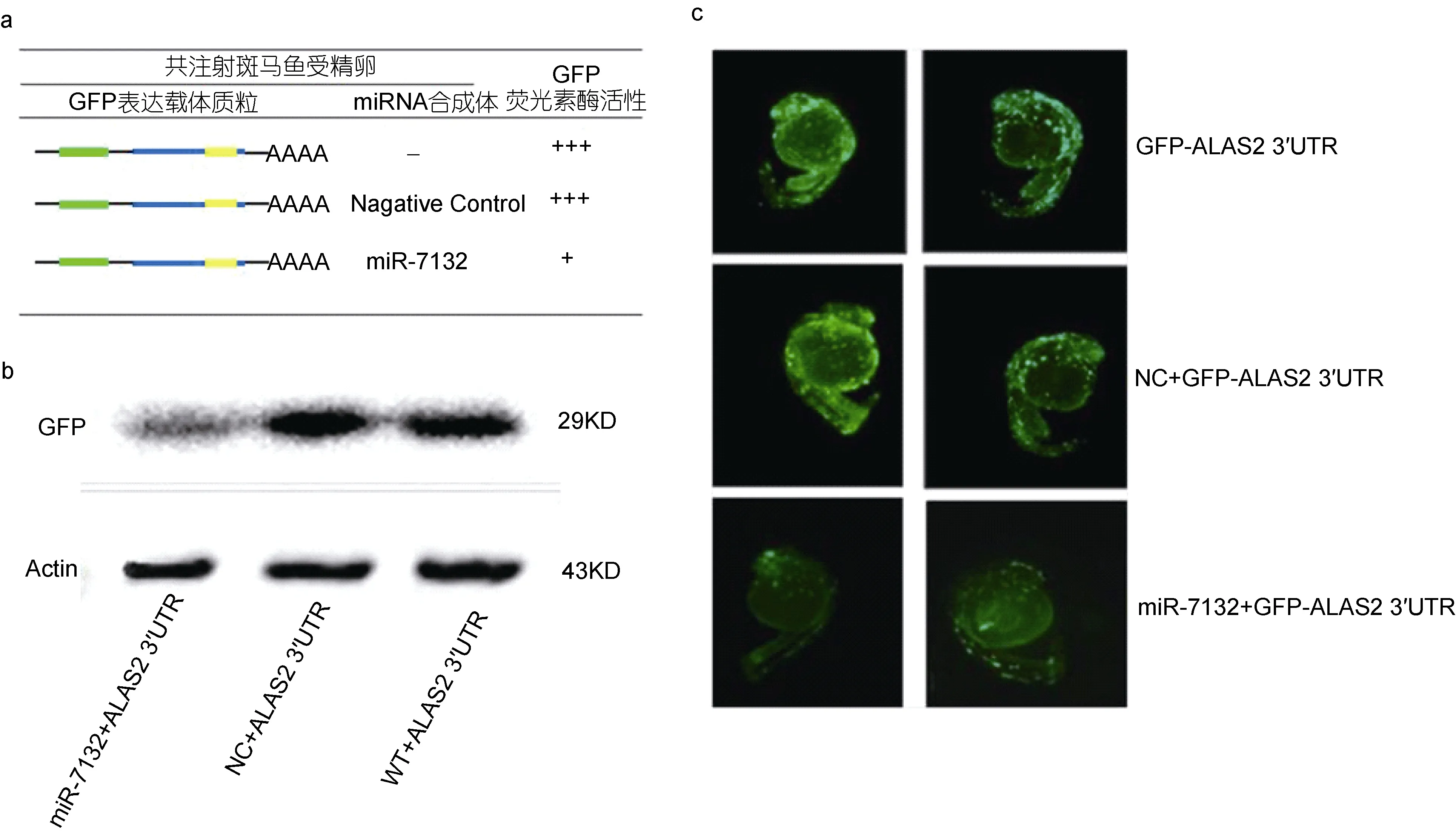
图4 体内注射miR-7132检测GFP的表达Fig.4 Detect the expression of GFP protein by injecting miR-7132 in vivo
红细胞的生成对于脊椎动物的造血活动是非常重要的, 红细胞数量的异常增多或减少都会导致疾病的发生, 例如异常红血球生成性贫血, 骨髓增生异常综合征等(Ge et al, 2014)。因此, 对红细胞生成机制的深入研究有利于血液疾病的检测与治疗(Kim et al,2007)。血红蛋白是红细胞的重要组成部分, 是由亚铁血红素与球蛋白组成, 在生物体内负责携带氧气至全身各处以维持生命活动的正常进行(Fujiwara et al,2006)。生物体内约 85%的亚铁血红素由红细胞负责合成, 亚铁血红素在红细胞中合成的第一步则需要ALAS2酶的催化, ALAS2是血红素生物合成过程中最重要的限速酶之一(Barman-Aksözen et al, 2015)。已有研究表明, ALAS2作为重要的造血相关转录因子参与血细胞的生成, 例如 ALAS2缺失的鼠胚胎干细胞分化产生的红细胞亚铁血红素含量严重不足。作为红细胞的组成成分, 亚铁血红素缺乏时, 会导致异常的红细胞发生并且引发血液疾病(Harigae et al, 2003)。
随着对microRNA研究的不断深入, 研究者发现microRNA调控生物体内多种生物过程。microRNA参与红细胞发生的研究也逐渐得到关注。调控红细胞生成的网络是错综复杂的, 同一个转录因子可能由多个miRNA对其发挥作用, 同时, 某一个miRNA也可能作用于多个转录因子, 且多个转录因子之间往往存在着相互作用(Kaufman et al, 2001)。孙红英等(2013)研究证明了 miR-218调控 ALAS2在红细胞分化中的作用及机制。miR-218可以作用于 ALAS2的3´UTR区域, 过表达miR-218使ALAS2的表达显著下调, ALAS2是参与铁代谢与红细胞分化的关键基因(Ajioka et al, 2006), 体内缺乏ALAS2将引发铁粒幼细胞性贫血等血液疾病(Astner et al, 2005)。同时,ALAS2表达的减少还会导致其下游基因珠蛋白表达的降低(孙红英, 2013)。Xu等(2015)研究中, 通过对多个在南极冰鱼头肾组织中高表达的miRNA进行靶基因预测, 发现有91个miRNA作用于已知的5个红细胞生成标志基因, 其中, ALAS2作为靶基因被最多数量的miRNA所作用。本研究中miR-7132对ALAS2的靶向调控作用与Xu等研究相吻合。
近年来, 有研究表明 miR-7132可能与鲤鱼免疫系统的发育及免疫应答相关(Thai et al, 2007)。作者通过Solexa测序技术(Solexa公司第二代测序技术)并结合生物信息学分析成功从鲤鱼的脾脏组织中鉴定出192种保守性较高的miRNA, 其中miR-7132在鲤鱼脾脏中特异性表达, 由此作者推测 miR-7132可能作用于一个或多个转录因子而参与免疫过程(陈功义等,2015)。但是, 关于miR-7132参与血红细胞发生的研究鲜有报道。
斑马鱼胚胎透明, 可随时进行活体观察, 受精后24小时心血管系统已基本形成, 便于研究心血管系统的发育和功能。此外, 通过显微注射技术可将外源基因或含标记基因的质粒高效率整合至斑马鱼基因组中, 同时结合荧光显微镜观察、胚胎染色等实验方法对基因功能进行分析(Fu et al, 2009; Grabher et al,2011)。在 Su等研究中, 生物信息学分析结果显示meis1为miR-144的靶基因, 作者运用斑马鱼胚胎显微注射技术, 向斑马鱼胚胎共注射 miR-144与GFP-meis1 3´UTR的复合体并通过Western blot检测GFP蛋白表达, 成功验证了miR-144对斑马鱼造血过程的影响机制(Su et al, 2014)。在本研究中, 由于没有南极冰鱼的胚胎, 再加上microRNA在不同物种中均比较保守, 所以借助斑马鱼显微注射来研究miR-7132的功能, 这也是目前非模式鱼类物种功能基因验证的主要手段之一。事实上, 在注射miR-7132后, 我们确实发现miR-7132可以降低ALAS2蛋白的表达(图2a)。这进一步提示, 利用斑马鱼显微镜注射来研究miR-7132的功能是可行的。
4 结论
本研究中, 通过 Hi-Seq转录组测序技术在南极冰鱼头肾组织中首次分离并鉴定得到南极冰鱼miR-7132的序列, 通过生物信息学软件(miRBase数据库, TargetScan靶基因预测, PicTar靶基因预测等)预测 miR-7132潜在的靶基因。同时, 以斑马鱼作为模型进行体内实验验证, 并结合细胞转染技术(细胞内过表达miRNA及靶蛋白)、荧光素酶报告系统、胚胎显微注射技术等实验手段综合验证了miR-7132通过调节 ALAS2的表达参与南极冰鱼红细胞生成过程。在本研究之前, 并未有 miR-7132对红细胞生成作用的研究报道。本实验将在后续研究中, 拟对miR-7132进行体内敲除, 更好地研究miR-7132对红细胞发生的作用机制。
许强华, 吴智超, 陈良标, 2014. 南极鱼类多样性和适应性进化研究进展. 生物多样性, 22(1): 80—87
孙红英, 2013. Has-miR-218调控ALAS2在红细胞分化中的作用和机制研究. 北京: 中国科学院大学硕士学位论文,6—10
陈功义, 赵银丽, 李国喜等, 2015. 鲤鱼脾脏中保守miRNA的鉴定. 中国生物化学与分子生物学报, 31(6): 636—644
Ajioka R S, Phillips J D, Kushner J P, 2006. Biosynthesis of heme in mammals. Biochimica et Biophysica Acta, 1763(7):723—736
Ambros V, 2001. microRNAs: tiny regulators with great potential.Cell, 107(7): 823—826
Astner L, Schulze J O, van den Heuvel J et al, 2005. Crystal structure of 5-aminolevulinate synthase, the first enzyme of heme biosynthesis, and its link to XLSA in humans. The EMBO Journal, 24(18): 3166—3177
Barman-Aksözen J, Minder E I, Schubiger C et al, 2015. In ferrochelatase-def i cient protoporphyria patients, ALAS2 expression is enhanced and erythrocytic protoporphyrin concentration correlates with iron availability. Blood Cells,Molecules, and Diseases, 54(1): 71—77
Dore L C, Amigo J D, dos Santos C O et al, 2008. A GATA-1-regulated microRNA locus essential for erythropoiesis. Proceedings of the National Academy of Sciences of the United States of America, 105(9):3333—3338
Felli N, Fontana L, Pelosi E et al, 2005. MicroRNAs 221 and 222 inhibit normal erythropoiesis and erythroleukemic cell growth via kit receptor down-modulation. Proceedings of the National Academy of Sciences of the United States of America, 102(50): 18081—18086
Felli N, Pedini F, Romania P et al, 2009. MicroRNA 223-dependent expression of LMO2 regulates normal erythropoiesis. Haematologica, 94(4): 479—486
Fu Y F, Du T T, Dong M et al, 2009. Mir-144 selectively regulates embryonic α-hemoglobin synthesis during primitive erythropoiesis. Blood, 113(6): 1340—1349
Fujiwara T, Harigae H, Takahashi S et al, 2006. Differential gene expression prof i ling between wild-type and ALAS2-null erythroblasts: Identif i cation of novel heme-regulated genes.Biochemical and Biophysical Research Communications,340(1): 105—110
Fujiwara T, Harigae H, 2015. Biology of heme in mammalian erythroid cells and related disorders. BioMed Research International, 2015: 278536
Ge L, Zhang R P, Wan F et al, 2014. TET2 plays an essential role in erythropoiesis by regulating lineage-specif i c genes via DNA oxidative demethylation in a zebraf i sh model.Molecular and Cellular Biology, 34(6): 989—1002
Grabher C, Payne E M, Johnston A B et al, 2011. Zebrafish microRNA-126 determines hematopoietic cell fate through c-Myb. Leukemia, 25(3): 506—514
Harigae H, Nakajima O, Suwabe N et al, 2003. Aberrant iron accumulation and oxidized status of erythroid-specif i c δ-aminolevulinate synthase (ALAS2)-def i cient def i nitive erythroblasts. Blood, 101(3): 1188—1193
Harigae H, Suwabe N, Weinstock P H et al, 1998. Deficient heme and globin synthesis in embryonic stem cells lacking the erythroid-specif i c δ-aminolevulinate synthase gene. Blood,91(3): 798—805
Hartmann D, Thum T, 2011. MicroRNAs and vascular (dys)function. Vascular Pharmacology, 55(4): 92—105
Kaufman D S, Hanson E T, Lewis R L et al, 2001. Hematopoietic colony-forming cells derived from human embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America, 98(19): 10716—10721
Kim S I, Bresnick E H, 2007. Transcriptional control of erythropoiesis: emerging mechanisms and principles.Oncogene, 26(47): 6777—6794
Lee R C, Feinbaum R L, Ambros V, 1993. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell, 75(5): 843—854
Meissner P, Pick H, Kulangara A et al, 2001. Transient gene expression: recombinant protein production with suspension-adapted HEK293-EBNA cells. Biotechnology and Bioengineering, 75(2): 197—203
Shen E, Diao X H, Wei C et al, 2010. MicroRNAs target gene and signaling pathway by bioinformatics analysis in the cardiac hypertrophy. Biochemical and Biophysical Research Communications, 397(3): 380—385
Su Z H, Si W X, Li L et al, 2014. MiR-144 regulates hematopoiesis and vascular development by targeting meis1 during zebraf i sh development. The International Journal of Biochemistry & Cell Biology, 49: 53—63
Thai T H, Calado D P, Casola S et al, 2007. Regulation of the germinal center response by microRNA-155. Science,316(5824): 604—608
Tsiftsoglou A S, Vizirianakis I S, Strouboulis J, 2009.Erythropoiesis: model systems, molecular regulators, and developmental programs. IUBMB Life, 61(8): 800—830
Xu Q H, Cai C, Hu X X et al, 2015. Evolutionary suppression of erythropoiesis via the modulation of TGF-β signalling in an Antarctic icefish. Molecular Ecology, 24(18): 4664—4678
