miR-150对结直肠癌患者肿瘤细胞侵袭与转移能力的影响
2016-01-15杜晓阳王连涛董功航
杜晓阳 王连涛 董功航
MicroRNAs是一段由18~24个核苷酸组成的小片段RNA,它能够结合到靶基因上,抑制或降解靶基因,在转录后调控靶基因的表达。研究发现,MicroRNAs会参与到细胞的增殖、分化、凋亡、侵袭、迁移等生理活动中[1, 2]。近年来,随着对miR-150等microRNAs研究的逐渐深入,越来越多的研究成果证实其可参与到肿瘤的形成、进展与对化疗发生耐药的过程中[3-5]。但是,目前miR-150在结直肠癌细胞中发挥的作用尚不明确。为了探索miR-150对结直肠癌患者肿瘤细胞侵袭与转移能力的影响,我们采集7例结直肠癌患者的肿瘤组织样本进行细胞培养、RNA提取及miR-150表达水平的检测,探索过表达的miR-150对肿瘤细胞产生的影响,现报告如下。
1 材料和方法
1.1 材料
本研究中7例结直肠癌患者的样本均采集于我院及中山大学附属第六医院收治的患者,结直肠癌细胞系CACO2,HCT-116,HT-29,SW620均购自中科院上海细胞生物研究所。
1.2 主要试剂及仪器
1.2.1 主要试剂 TRNzol RNA提取试剂, miR-150特异引物、microRNAs RT-qPCR试剂盒、RNA酶抑制剂,micrON ™ hsa-miR-150-5p mimic、micrON ™ hsa-miR-NC mimic、riboFECT ™ CP,Lipofectamine 2000。
1.2.2 主要仪器 PCR 扩增仪,ABI 7500 Real-Time PCR system,倒置荧光显微镜,细胞计数器,电子显微镜,BD侵袭小室。
2 主要方法及步骤
2.1 细胞培养
取适量的完全培养基重悬细胞,接种于培养皿中,在5%CO2、37℃的恒温箱中进行培养,每两天换液一次。在六孔板上按照适当的密度接种CACO2,HCT-116,HT-29,SW620各一孔,在细胞培养箱中进行培养,当其密度达到80%-90%时对其RNA进行消化提取。
2.2 RNA的提取及miR-150的表达检测
2.2.1 RNA的提取 将在对7例结直肠癌患者施行手术的过程中采集的肿瘤组织标本打碎至呈匀浆状。将氯仿(每使用1毫升的TRNzol试剂应加入0.2ml的氯仿)加入此匀浆中进行震荡,在4℃的低温下进行离心操作,提取上层的上清液。将异丙醇(每使用1毫升的TRNzol试剂应加入0.5ml的异丙醇)加入到此上清液中进行震荡,在4℃的低温下进行离心操作。将此上清液倒出后,将浓度为75%的酒精(每使用1毫升的TRNzol试剂应加入1ml浓度为75%的酒精,并用已脱酶水进行配制)加入管中洗涤沉淀,进行震荡,在4℃的低温下进行离心操作。弃去上清液,在真空抽干机中将剩余的酒精除去,加入40-60ml的 DEPC水,在水浴器(55-60℃)中放置 10min,以溶解RNA。用分光光度计检测RNA的质量及浓度。提取贴壁细胞RNA的方法大致同上。
2.2.2 MiR-150的表达水平检测 RT:配制逆转录工作液,在每个样品中提取2-3ul的RNA溶液,置于离心管中,依次加入逆转录体系中必须的试剂(总体系为25ul)进行震荡与离心操作,然后置于PCR仪上,设定仪器的运行条件为37℃ 60min-85℃ 5min。qPCR:配制qPCR工作液,在使用cDNA前需用DEPC水将其稀释20-100倍,按照All-in-One miRNA qRT-PCR Detection Kit (Gene Copoeia)试剂盒的说明书配制qPCR的工作体系,使最终体系达到20ul,用配好的八连管进行震荡与离心操作,将qPCR工作液置于7500 real-time PCR system上,设定条件为95℃10min-95℃ 10 seconds-60℃ 1min,进行40个循环。从7500 Software v2.0.6 中获得相关的数据。
2.3 miR-150转染细胞
2.3.1 细胞的准备 在进行miR-150转染前一天将HCT-116细胞(0.25×106/孔)和 HT-29细胞(0.4×106/孔)接到6孔板上,当细胞的密度增长到50%时对其进行转染。
2.3.2 配制转染工作液 将250ul/孔 的OPTI-MEM和5ul的 miR-150 mimic、250ul/孔 的 OPTI-MEM 和 5ul的Lipofacetime 2000同时进行混合,并进行轻轻吹打,在放置5分钟后将这两种预混液混合在一起,在放置20分钟后再加入到需进行转染的细胞中。
2.3.3 转染 去除原来的培养液,把已配好的转染混合液加入到生长密度达到70%的细胞中,再以1.5ml/孔的1640完全培养基补齐培养混合液,在二氧化碳恒温箱中培养5个小时后更换新鲜不含抗生素的完全培养基,继续培养24个小时。
2.4 细胞侵袭试验
2.4.1 侵袭试验 在将细胞转染后进行一天的培养,制作细胞悬液,将细胞的密度调整为5×105/ml,取细胞悬液100µl加入到已解冻的Transwell上室,并在其下室加入600µl含10%PBS的培养基,在对照孔的下室加入不含血清的培养基,在5%CO2、37℃的细胞培养箱中培养48个小时。
2.4.2 细胞计数 在将细胞培养48个小时后,取出Transwell小室,弃去孔中的培养液,用PBS洗2遍,用4%的多聚甲醛固定15~30分钟,将小室适当风干,用0.1%的结晶紫染色15~20 min,用棉签轻轻擦掉上层未迁移的细胞,用PBS洗3遍。在200倍或400倍的显微镜下随机选择5~10个视野观察细胞并进行计数。
3 统计学处理
采用SPSS 18.0 软件进行统计学分析,用GraphPad Prism 5.0 软件进行绘图分析,本研究中的数据均用均数±标准差(mean±SD)表示,组间差异用独立样品T检验进行分析,P<0.05表示差异有统计学意义。
4 结果
4.1 MiR-150在本组7例结直肠癌患者的癌组织与癌旁组织及细胞系中表达的水平
本组7例结直肠癌患者的癌组织与癌旁组织中miR-150的表达水平见图1A。与在癌组织中表达的水平相比,miR-150在本组患者癌旁组织中表达的水平有不同程度的升高,最高达167倍。将本组患者各结直肠癌细胞系按照MiR-150的表达水平(从高到低)进行排序的情况是:HT-29,HCT-116,SW620,CACO2。详情见图1B。
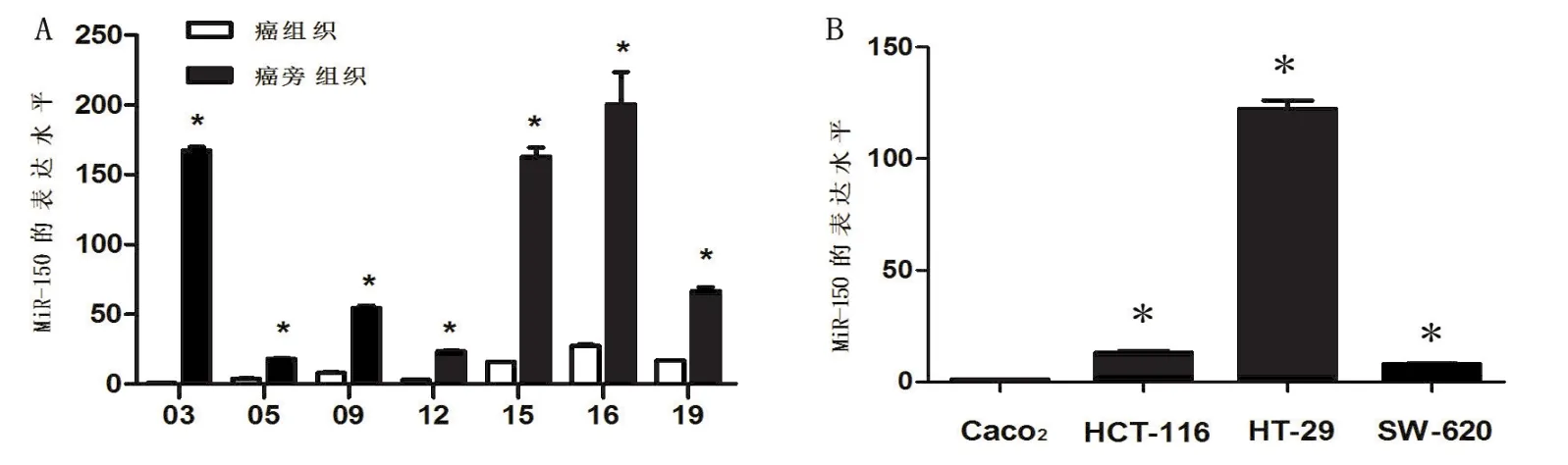
图1 A:miR-150在7例患者的癌组织与癌旁组织中的表达水平的比较图1B:miR-150在CACO2、HCT-116、HT-29和SW620的表达水平的曲线
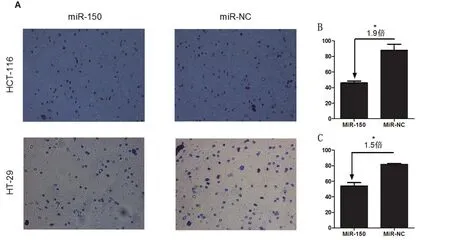
图2 :在HCT-116和HT-29中过表达的MiR-150对肿瘤细胞侵袭、迁移能力的影响
4.2 在结直肠癌细胞系中过表达的miR-150对肿瘤细胞侵袭、转移能力的影响
在结直肠癌细胞系HCT-116和HT29中存在过表达的miR-150,构建过表达miR-150的结直肠肿瘤细胞系进行分析,结果显示,存在miR-150过表达的HCT-116和HT29肿瘤细胞穿过屏障被染色的5个显微镜高倍视野的均数为46与54,其侵袭力分别降低1.9倍和1.5倍,可见过表达的miR-150能够明显降低肿瘤细胞的侵袭与转移能力。详情见图2。
5 讨论
据报道,miR-150的异常表达与结直肠癌细胞的恶性程度、此病患者的临床疗效及预后密切相关[6],但其具体调控的分子通路及机制目前仍不明确。我们对7例结直肠癌患者的7对癌组织及癌旁组织进行了miR-150表达水平的定量分析,结果显示,miR-150在癌旁组织中表达的水平普遍高于其在癌组织中表达的水平。我们在对结直肠癌细胞系中过表达的miR-150进行分析后发现,过表达的miR-150能够明显降低结直肠癌细胞的侵袭与转移能力。这一研究结果与秦教授和马博士的研究结果相一致[6]。该研究对比分析了大样本量的正常组织、腺瘤组织与癌组织中miR-150的表达水平,并研究了对肿瘤患者进行随访的资料,结果发现,随着肿瘤组织恶性程度的升高,其中miR-150的表达水平会相应下降。可见,miR-150的表达水平与肿瘤的恶性程度、肿瘤患者对化疗的敏感性及其预后有关。miR-150的表达水平越低,肿瘤患者对化疗的敏感度越低,其预后越差。我们猜测,miR-150的表达水平在癌旁组织中较高的主要原因可能是,癌旁组织中细胞的自我保护机制可被激活,使miR-150在癌旁组织中的反应性增高,并抑制肿瘤细胞的侵袭及转移,进而可抑制肿瘤细胞的生长。有文献指出,在肺癌[7]及胃癌[8]组织中,miR-150能抑制肿瘤细胞的凋亡及促进其增殖,对肿瘤的发生、进展有促进的作用。在我们的研究中,miR-150在癌旁组织中呈高表达,可作为抑癌因子抑制肿瘤的生长。
MicroRNAs对生命过程的调控主要是通过调控其靶基因的表达来完成的。采用生物信息学的方法进行分析,我们预测miR-150可调控几百个靶基因,但目前在肿瘤细胞中发现的靶基因较少。MUC4及ZEB1基因分别在胰腺癌及食管癌细胞中得到确认。MUC4是广泛存在于人体组织中的跨黏膜蛋白。Sanjeev K.Srivastava在其研究中证实,MUC4在胰腺恶性腺瘤及其肿瘤细胞系中的表达量比在正常胰腺组织中的表达量更高。在其他的恶性肿瘤中,MUC4的表达量也可发生异常的改变。MUC4具有促进胰腺癌肿瘤细胞的生长、侵袭和转移的作用。MUC4的3‵端非编码序列中含有miR-150能结合的高度保守序列。研究证实,miR-150能够直接与MUC4结合,下调MUC4表达的水平,抑制肿瘤细胞的生长、克隆形成、迁移及侵袭,加强细胞间的粘附作用,抑制肿瘤的进展。我们运用荧光定量PCR法检测7例结直肠癌患者的癌及癌旁组织中miR-150的表达水平,结果发现其癌旁组织中miR-150的表达水平明显高于其癌组织中miR-150的表达水平。关于miR-150细胞功能的实验结果显示,在结直肠癌细胞系过表达的miR-150能够抑制肿瘤细胞的侵袭及转移。可见,miR-150在恶性肿瘤组织中可下调MUC4的表达,抑制肿瘤的生长、集落形成、迁移与侵袭,增强PC细胞间的粘附能力[2],进而起到抑制肿瘤生长的作用。
Epithelial-to-mesenchymal transition (EMT)能 够 增强肿瘤细胞的迁移及侵袭能力[9]。已有研究成果证实,ZEB1,ZEB2与EMT的发生有直接的关系[10]。化疗增敏因子 TNF-α 在对肿瘤进行化疗的过程中可起到重要的作用。EMT能够诱导TNF-α抵抗的产生,在肿瘤的发展中可被异常激活,使肿瘤细胞的侵袭力增强,增加肿瘤的转移率与治愈后的复发率,并可导致肿瘤细胞耐药。Takehiko Yokobori在其研究中证实,miR-150能够下调ZEB1的表达水平,抑制EMT、肿瘤细胞的转移及耐药性的发生。ZEB1在结直肠癌侵袭与转移的过程中扮演着至关重要的角色。在将来的工作中,我们会构建稳定表达miR-150的细胞系,再一次验证miR-150的功能,验证MUC4及ZEB1在结直肠癌细胞系中为miR-150直接靶基因的理论。
本研究的结果证实,miR-150在结直肠肿瘤细胞中的高表达能明显降低其侵袭及转移的能力,抑制其生长。我们有理由相信,miR-150能够通过抑制MUC4及ZEB1基因的表达来抑制肿瘤细胞的侵袭及转移,进而可控制肿瘤的发展。随着对MiR-150在结直肠癌中发挥作用的深入了解,我们深信其有可能成为将来治疗结直肠癌的潜在靶点,上调其在结直肠癌患者体内表达的水平可抑制肿瘤的生长,增加患者对化疗的敏感性,提高患者的临床疗效,改善患者的预后。
[1] Karaayvaz M, Zhai H, Ju J. miR-129 promotes apoptosis and enhances chemosensitivity to 5-fluorouracil in colo rectal cancer.[J]. Cell Death Dis,2013,4:e659.
[2] Srivastava S K, Bhardwaj A, Singh S, et al. MicroRNA-150 directly targets MUC4 and suppresses growth and maligna nt behavior of pancreatic cancer cells.[J]. Carcinogenes is,2011,32(12):1832-1839.
[3] Esquela-Kerscher A, Slack F J. Oncomirs - microRNAs with a role in cancer.[J]. Nat Rev Cancer,2006,6(4):259-269.
[4] Cho W C. OncomiRs: the discovery and progress of micro RNAs in cancers.[J]. Mol Cancer,2007,6:60.
[5] Garofalo M, Croce C M. MicroRNAs as therapeutic targets in chemoresistance.[J]. Drug Resist Updat,2013.
[6] Ma Y, Zhang P, Wang F, et al. miR-150 as a potential bio marker associated with prognosis and therapeutic outco me in colorectal cancer.[J]. Gut,2012,61(10):1447-1453.
[7] Zhang N, Wei X, Xu L. miR-150 promotes the proliferation of lung cancer cells by targeting P53.[J]. FEBS Lett,2013,587(15):2346-2351.
[8] Wu Q, Jin H, Yang Z, et al. MiR-150 promotes gastric can cer proliferation by negatively regulating the pro-apop totic gene EGR2.[J]. Biochem Biophys Res Commun,2010,392(3):340-345.
[9] Zhou C, Nitschke A M, Xiong W, et al. Proteomic analysis of tumor necrosis factor-alpha resistant human breast cancer cells reveals a MEK5/Erk5-mediated epithelial-me senchymal transition phenotype.[J]. Breast Cancer Res,2008,10(6):R105.
[10] Casas, E., et al.. Snail2 is an essential mediator of Twi st1-induced epithelial mesenchymal transition and meta stasis. Cancer Res 71, 245-254 (2011).
