丹龙醒脑方对脑缺血再灌注大鼠侧脑室室管膜下区神经干细胞增殖及Hes1、Hes5表达的影响
2016-01-11陈娉婷周小青刘旺华曹泽标陈昱文李花
陈娉婷 周小青 刘旺华 曹泽标 陈昱文 李花

摘要:目的 观察丹龙醒脑方对脑缺血再灌注模型大鼠侧脑室室管膜下区(SVZ)神经干细胞(NSCs)增殖与Hes1、Hes5表达的影响,探讨其促进内源性NSCs增殖的作用机制。方法 将80只雄性SD大鼠随机分为假手术组、模型组、依达拉奉组(依达组)、丹龙醒脑方组(丹龙组)。采用线栓法制备局灶性脑缺血再灌注模型,再灌注7 d后取缺血侧SVZ脑组织。Brdu免疫荧光法检测SVZ NSCs增殖,RT-qPCR、Western blot分别检测Hes1、Hes5 mRNA和蛋白的表达。结果 与假手术组比较,其余各组Brdu阳性细胞率增加,Hes1、Hes5 mRNA及蛋白表达明显升高(P<0.01);与模型组比较,依达组、丹龙组Brdu阳性细胞率明显增加,Hes1、Hes5 mRNA及蛋白表达水平明显增强(P<0.01);丹龙组Hes1 mRNA表达水平优于依达组(P<0.01),其余指标均无明显差异。结论 丹龙醒脑方可促进脑缺血再灌注后大鼠SVZ NSCs增殖,并上调Hes1、Hes5表达水平,其机制可能与激活Notch信号通路有关。
关键词:丹龙醒脑方;室管膜下区;神经干细胞;增殖;Hes1;Hes5;大鼠
DOI:10.3969/j.issn.1005-5304.2016.01.016
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)01-0069-05
Effects of Danlong Xingnao Formula on Proliferation of Neural Stem Cells in Sub Ventricular Zone and Expressions of Hes1 and Hes5 in Cerebral Ischemia-Reperfusion Injury Model Rats CHEN Ping-ting1,2, ZHOU Xiao-qing1,2,3, LIU Wang-hua1,2,3, CAO Ze-biao1,2, CHEN Yu-wen1,2, LI Hua1,2,3 (1. Institute of Diagnostics Traditional Chinese Medicine, Hunan University of Chinese Medicine, Changsha 410208, China; 2. The Key Laboratory of Diagnostics of Chinese Medicine in Hunan Province, Hunan University of Chinese Medicine, Changsha 410007, China; 3. Collaborative Center for Research and Innovation of Digital Chinese Medicine, Hunan University of Chinese Medicine, Changsha 410208, China)
Abstract: Objective To study effects of Danlong Xingnao Formula (DLXNF) on proliferation of neural stem cells (NSCs) and the expressions of Hes1 and Hes5 in sub ventricular zone (SVZ) in cerebral ischemia-reperfusion injury model rats; To explore the mechanism of promoting the proliferation of NSCs Methods Eighty male SD rats were randomly divided into sham-operation group, model group, edaravone group and DLXNF group. The focal cerebral ischemia reperfusion injury models were prepared by suture method, and 7 d after reperfusion, the SVZ brain tissue of ischemia side was taken. The proliferation of cells was detected by Brdu labeling fluorescence immunocytochemistry; Hes1, Hes5 mRNA and protein expressions were detected by fluorescence real-time quantitative PCR and Western blot method in each group. Results Compared with the sham-operation group, Brdu positive cell rate in other groups increased more obviously, and the expressions of Hes1, Hes5 mRNA and protein also increased significantly (P<0.01). Compared with the model group, Brdu positive cell rate increased significantly in edaravone group and DLXNF group, and the expressions of Hes1, Hes5 mRNA and protein increased significantly
(P<0.01). The expression of Hes1 mRNA in DLXNF group was superior to that in edaravone group (P<0.01), and other indexes had no significant difference. Conclusion DLXNF can promote the proliferation of NSCs in SVZ in cerebral ischemia-reperfusion injury model rats, and up-regulate the expressions of Hes1 and Hes5, whose mechanism may be related to the activation of Notch signaling pathway.
Key words: Danlong Xingnao Formula; sub ventricular zone; neural stem cell; proliferation; Hes1; Hes5; rats
脑卒中已成为当前威胁人类健康的第二大病因,其中缺血性脑卒中的发病率约占全部脑卒中2/3[1],具有发病率、病死率和致残率“三高”的特点。脑缺血后,神经元大量丢失导致脑功能障碍,遗留不同程度的神经功能缺损症状甚至肢体瘫痪。神经干细胞(neural stem cells,NSCs)的发现使之成为脑缺血后神经再生研究的新靶点。目前研究表明,脑缺血损伤能促使脑内NSCs激活后增殖、迁移和分化,参与神经再生和脑组织功能的恢复[2]。同时该过程受多种细胞信号通路和因子的调控,在中枢神经系统中,Wnt与Notch信号通路是NSCs增殖作用机制的研究热点[3]。丹龙醒脑方是湖南中医药大学周小青教授治疗缺血性脑血管病有效复方,功擅活血通络、化痰开窍、补肾生髓。前期实验研究显示,本方能干预脑缺血后级联反应多环节,保护脑功能以促进神经恢复[4],促进神经营养因子及干细胞增殖,并且可能与激活Wnt/β-catenin信号通路有关[5-6]。本实验采用线栓法制备脑缺血再灌注大鼠模型,观察再灌注7 d后大鼠侧脑室室管膜下区(sub ventricular zone,SVZ)NSCs增殖,以及对Notch信号通路的重要效应分子Hes1、Hes5表达的影响,进一步探讨本方对脑缺血后促进内源性NSCs增殖的作用机制。
1 实验材料
1.1 动物
雄性2月龄清洁级SD大鼠120只,体质量250~300 g,湖南斯莱克景达动物实验公司提供,许可证号SCXK(湘)2013-0005。适应性喂养7 d后开始造模。
1.2 药物
丹龙醒脑方由丹参15 g、三七12 g、地龙6 g、远志15 g、石菖蒲12 g、淫羊藿10 g、菟丝子12 g组成,饮片购自湖南中医药大学第一附属医院。浸泡30 min,首煎加6倍水,水沸后文火煎60 min,第2煎加3倍水,水沸后文火煎30 min,2次药汁混合,过滤,于水浴锅内蒸发浓缩为含原药材1.6 g/mL,灭菌分装,4 ℃冰箱冷藏。依达拉奉注射液,国瑞药业有限公司,批号80-140118。
1.3 主要试剂与仪器
5-溴脱氧尿嘧啶核苷(Brdu),Sigma;Brdu抗体(ab6326)、Hes1兔源性多克隆抗体(2922-1),EPI;Hes5兔源性多克隆抗体(194111),abcam;荧光二抗CY3-山羊抗小鼠抗体(115-165-003)、HRP标记山羊抗兔抗体(GB23303)、Actin兔源性多克隆抗体(GB13001-1),武汉谷歌生物科技公司;RevertAid First Strand cDNA Synthesis Kit(#K1622),Thermo;引物(Invitrogen Biotechnology Co,LTD);Trizol试剂盒(15596-026),Invitrogen Life Technologies。7300型荧光定量PCR仪(ABI),倒置荧光显微镜及彩色图像分析系统(NIKON),AlphaEase FC专业灰度分析软件(Innotech),线身直径为0.28 mm成品MCAO线栓若干(北京西浓科技有限公司)。
2 实验方法
2.1 分组
80只大鼠被毛染色法编号,按随机数字表法随机分为假手术组12只和模型制备组68只。因本实验模型存在一定死亡率,模型制备组于造模后,根据神经功能评分等级采取分层抽样的形式均分为模型组、依达拉奉组(依达组)、丹龙醒脑方组(丹龙组),每组12只。
2.2 局灶性脑缺血再灌注模型制备及评价
参考文献[7]方法,复制局灶性脑缺血再灌注大鼠模型。10%水合氯醛350 mg/kg腹腔注射麻醉,仰卧位固定于实验台上,颈部常规备皮消毒,颈正中切口,分离左侧颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA)。结扎CCA近心端及ECA,在CCA结扎上近心端约0.5 cm处剪一切口,将线栓蘸取肝素后,由切口向颈内动脉缓慢插入ICA,向入颅方向推进,至有轻微阻力感停止[(18.0±0.5)mm],扎紧并固定线栓,缝合皮下组织和皮肤。记录插线时间,插线2 h后再次将大鼠麻醉,用直头镊夹住露出皮肤的栓线尾部柔和缓慢抽出,当栓线球前端遇到颈内动脉结扎线时会有阻力,即停止拔线,剪除栓线的残余末端。假手术组仅分离动脉,不插线栓,全过程同其余组。术后再灌注24 h动物完全清醒后,采用Zea-Longa等5分制评分标准进行神经功能缺损评分并记录[7],评分为1~3者为成功模型,评分后按前述要求进行分组。
2.3 给药及取材
大鼠再灌注24 h后开始给药,每日1次,连续给药7 d。丹龙组每日给药剂量按70 kg成人每日服用82 g原药材剂量进行换算[8],得出每日原药材剂量约为7.4 g/kg。依达组每日给药剂量约为3.2 mg/kg,用0.9%氯化钠溶液配制腹腔注射给药。假手术组和模型组予等体积蒸馏水灌胃。每组取6只于第7日给药2 h后,10%水合氯醛麻醉,颈动脉处死后迅速断头取脑,冰上快速分离缺血侧SVZ脑组织,行实时荧光定量PCR(RT-qPCR)、Western blot检测。其余大鼠于术后24 h给予腹腔注射Brdu 100 mg/kg,1次/d,连续7 d。于第7日注射药物2 h后,麻醉,常规生理盐水、4%多聚甲醛心脏灌流至肝脏变硬后断头,迅速取缺血侧SVZ脑组织,放入4%多聚甲醛固定液中,脱水、透明、浸蜡,在视交叉前后连续制作厚度为5 ?m脑部冠状切片,用于免疫荧光法检测。
2.4 指标检测
2.4.1 免疫荧光法检测室管膜下区神经干细胞增殖 常规脱蜡至水,3%H2O2-甲醇室温孵育30 min,微波修复,10%羊血清湿盒内37 ℃孵育30 min,一抗Brdu抗体1∶100稀释,湿盒内4 ℃孵育过夜,二抗CY3-羊抗兔IgG 1∶300稀释,湿盒内37 ℃孵育45 min,DAPI复染细胞核。各步均用PBS震荡漂洗3次,防淬灭剂封片,倒置荧光显微镜下观察并采集图像。细胞核染色为蓝色,细胞核出现红色荧光者为Brdu阳性细胞,随机观察5个不重叠高倍视野,计数阳性细胞数及总细胞数,计算阳性细胞百分率(阳性细胞数÷总细胞数×100%)。阳性细胞百分率越高表示增殖细胞越多。
2.4.2 PCR检测室管膜下区Hes1、Hes5 mRNA表达 分离0.1 g SVZ脑组织,应用Trizol试剂盒提取总RNA,以紫外分光光度计A280、A260定量测定浓度;将总RNA经琼脂糖凝胶电泳鉴定,可见明显的2条区带(28 s、18 s),证明其完整性。以组织总mRNA,反转录合成cDNA,60 ℃退火,用SYBR法进行RT-qCR。Taq酶催化,95 ℃预热10 min后,40个PCR循环。采用2-ΔΔCt法,以2-ΔΔCt值反映目的基因表达水平,其数值越大,基因表达越强。各基因引物序列见表1。
2.4.3 Western blot检测室管膜下区Hes1、Hes5蛋白表达 SVZ脑组织经蛋白质抽提剂提取蛋白,行SDS-PAGE电泳,转膜2 h,5%脱脂奶粉封闭1 h。一抗4 ℃过夜,Hes1及β-actin稀释比例均为1∶1000,Hes5稀释比例为1∶2000;洗膜后加入HRP标记的二抗山羊抗兔抗体,稀释比例为1∶3000,室温孵育1 h,加ECL胶片曝光后用AlphaEase FC软件分析自身灰度值,以目的蛋白条带灰度与管家蛋白β-actin条带灰度的比值表示蛋白表达水平。
3 统计学方法
采用SPSS19.0统计软件进行分析。实验数据以—x±s表示。多组间比较采用方差分析,方差齐时选用LSD法,方差不齐时采用Tamhane's T2检验法。P<0.05表示差异有统计学意义。
4 结果
4.1 丹龙醒脑方对大鼠室管膜下区神经干细胞增殖的影响
与假手术组比较,其余各组SVZ Brdu阳性细胞率明显增加(P<0.01);与模型组比较,依达组、丹龙组Brdu阳性细胞率明显增加(P<0.01);丹龙组与依达组比较差异无统计学意义,见图1、表2。
4.2 丹龙醒脑方对大鼠室管膜下区Hes1、Hes5 mRNA表达的影响
与假手术组比较,其余各组Hes1、Hes5 mRNA表达明显增强(P<0.01);与模型组比较,依达组、丹龙组Hes1、Hes5 mRNA表达明显增强(P<0.01);依达组与丹龙组比较,Hes1 mRNA表达差异有统计学意义(P<0.01),而Hes5 mRNA表达差异无统计学意义,见表3。
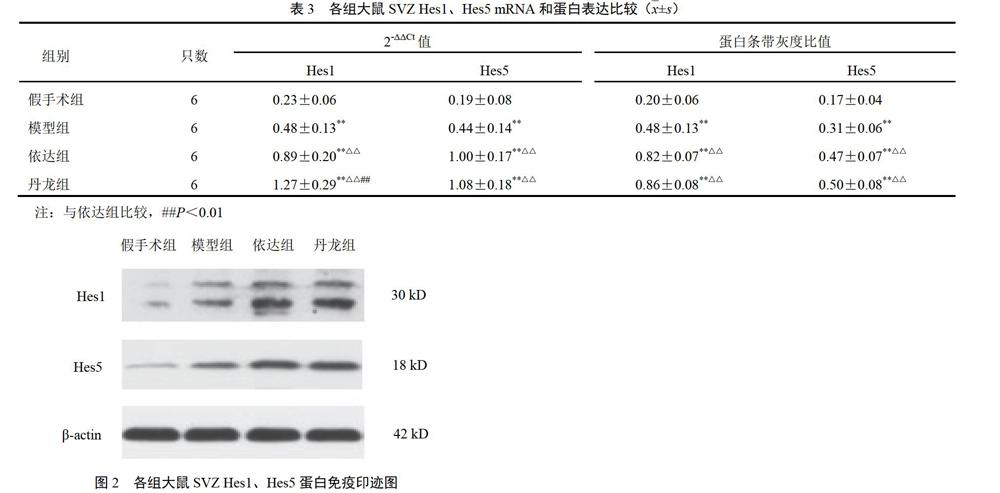
4.3 丹龙醒脑方对大鼠室管膜下区Hes1、Hes5蛋白表达的影响
与假手术组比较,其余各组Hes1、Hes5蛋白表达明显增强(P<0.01);与模型组比较,依达组、丹龙组Hes1、Hes5蛋白表达明显增强(P<0.01);依达组与丹龙组比较差异无统计学意义,见表3、图2。
5 讨论
NSCs广泛存在于神经系统,在成年哺乳动物中枢神经系统存在2个聚集区:海马齿状回的颗粒下层和SVZ[9]。NSCs生理状态下多处于“静息”状态,在缺血或创伤性损伤刺激下,NSCs可被激活,通过对称或不对称分裂增殖,进一步分化成熟为神经元、胶质细胞或少突胶质细胞,并迁移到大脑皮质的颗粒层,最终整合到神经元网络中修复神经损伤,即神经再生。然而内源性NSCs的增殖数量有限,不足以进行自我代偿和修复。因此,促进内源性NSCs活化,恢复和重建神经功能成为目前神经科学研究的热点。研究表明,脑缺血后的神经再生受多种调节因子和信号通路的调控,主要有Notch、Wnt、Shh信号通路等。各信号通络之间并非孤立的,而是相互紧密联系,共同构成了一个影响神经再生的精密网络调控系统[3]。Notch信号通路是通过相邻细胞4种Notch受体(Notch1~4)与5种配体(Jagged1、2和Delta1、3、4)的结合,引起受体多次水解后释放其胞内域(NICD)而活化,NICD与CLS DNA结合蛋白结合后激活下游的效应分子,主要是Hes等靶基因[10]。Hes属于碱性螺旋-环-螺旋转录因子家族,包括Hes1~7共7个同源基因,其中Hes1/5是Notch信号通路的重要效应分子,在干细胞的增殖、分化过程中扮演重要角色。上调Hes1表达可抑制NSCs分化为神经元,促进增殖,若Hes1基因的缺失,可见神经元的分化明显增加[11]。Hes5也是各调控因子调控NSCs增殖的目的基因。如果敲除Notch的效应分子Hes1、Hes5,可明显观察到中枢神经系统内几乎所有的NSCs都过早地分化为神经元[12]。因此,Hes1、Hes5对调控NSCs增殖具有重要作用,能反映Notch通路的激活状态。
有研究显示,成年大鼠脑缺血后NSCs增殖在7~10 d达高峰[13],之后逐渐回落。Notch信号通路在正常情况下低表达,而脑缺血后可促进其通路组分的表达[14]。本研究采用线栓法成功建立MCAO/R大鼠模型,通过Brdu免疫荧光法观察脑缺血再灌注7 d后丹龙醒脑方对大鼠SVZ NSCs增殖,并检测Hes1、Hes5 mRNA和蛋白表达,探讨Notch信号通路在其中的调控作用。实验结果显示,丹龙醒脑方干预后在缺血后SVZ NSCs增殖明显增多,即阳性细胞率增加,与之前研究结果一致[6];与假手术组、模型组比较,丹龙组和依达组Brdu阳性细胞率明显增加,同时Hes1、Hes5蛋白及mRNA的表达明显增强,且不同分子水平其趋势基本一致,提示丹龙醒脑方可上调SVZ Hes1、Hes5表达水平,促进NSCs增殖的机制可能与调控Notch信号通路有关。此外,各条信号通路之间存在复杂网络联系,已知Hes1、Hes5是Notch信号通路主要靶基因,而其他信号通路也可能通过交叉网络间接发挥作用。比如Notch通路与Wnt、Shh等信号通路存在的“crosstalk”(串话)[3],Notch与Wnt两通路之间关系复杂,既相互制约又相互促进,Wnt途径的激活减少Notch信号通路下游靶基因Hes1、Hes5的表达;Notch的激活又降低β-catenin积累,通过内吞接头蛋白Numb抑制Wnt通路[15]。Shh信号通路可以通过Smo调控Hes1的表达,Hes1是联系Notch及Shh信号通路的一个重要网络节点[16]。因此,有待下一步探讨本方对Notch信号通路上的受体、配体及其他相关分子的表达水平,进一步验证是否激活Notch信号通路。
丹龙醒脑方中丹参为君,田七、远志、石菖蒲为臣,佐以地龙、淫羊藿、菟丝子。全方通补兼施,以通为主,共奏活血通络、化痰开窍、补肾生髓之功。孟氏等[17]研究显示,益气活血方和补肾生髓方能通过增强缺血侧额顶叶皮质Hes1和Hes5的表达,调节Notch信号转导通路,促进内源性NSCs增殖,与本实验结果一致。另外,现代药理研究表明,大鼠脑缺血后应用丹参酮[18]、三七总皂苷[19]、淫羊藿及其提取物[20]等均能促进NSCs增殖。
综上所述,丹龙醒脑方能促进脑缺血后SVZ NSCs增殖,其机制与通过上调Hes1、Hes5水平有关,可能通过激活Notch信号通路来实现。但由于γ-分泌肽酶抑制剂DAPT(Notch通路阻滞剂)有明显肠道毒性,且参与体内多个信号系统的调节,其应用造成如痴呆样的不良反应,严重干扰实验的观察。因此,本研究未设置Notch通路抑制剂对照组,有待今后体外研究进一步验证。该通路上游的配体和受体等其他组成成分表达情况未进行观察,与Notch通路直接相关及相关的程度也有待今后进一步研究。
参考文献:
[1] ROGER V L, GO A S, LLOYD-JONES D M, et al. Heart disease and stroke statistics-2011 update:a report from the American Heart Association[J]. Circulation,2011,123(4):e18-e29.
[2] 袁志俊,李小刚.干细胞治疗缺血性脑卒中的研究进展[J].中国组织工程研究,2013,17(45):7954-7960.
[3] 庄述娟,陈小玉,刘庆山.神经干细胞增殖的分子机制及中药干预研究进展[J].中国实验方剂学杂志,2013,19(3):341-344.
[4] 曹泽标,周小青,张利美,等.丹龙醒脑方抗缺血性脑损伤机制的实验研究进展[J].湖南中医药大学学报,2015,35(4):59-62.
[5] 刘旺华,雷丽萍,李花,等.丹龙醒脑方促进大鼠神经干细胞增殖及其机制的研究[J].中华老年心脑血管病杂志,2014,16(10):1090-1093.
[6] 张利美,周小青,刘旺华,等.丹龙醒脑方促进脑缺血再灌注损伤大鼠神经干细胞增殖与β-catenin、Wnt-3a表达及其机制的研究[J].湖南中医药大学学报,2015,35(1):7-10.
[7] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without cranietomy in rats[J]. Stroke, 1989,20(1):84-91.
[8] 翁维良.中药临床药理学[M].北京:人民卫生出版社,2002:40.
[9] FUENTEALBA L C, OBERNIER K, ALVAREZ-BUYLLA A. Adult neural stem cells bridge their niche[J]. Cell Stem Cell,2012,10(6):698-708.
[10] ZHU S, WILDONGER J, BARSHOW S, et al. The bHLH repressor Deadpan regulates the self-renewal and specification of Drosophila larval neural stem cells independently of Notch[J]. PLoS One,2012,7(10):e46724.
[11] MURATA K,HATTORI M,HIRAI N, et al. HES1 directly controls cell proliferation through the transcriptional repression of p27kip1[J]. Mol Cell Biol,2005,25(10):4262-4271.
[12] 王春华,郑志竑,杨卫忠,等.Notch1和Hes1、Hes5在星形细胞瘤中的表达及其相关性研究[J].福建医科大学学报,2009,43(3):207-210.
[13] LIU J, SOLWAY K, MESSING R O, et al. Increased neurogenesis in the dentate gyrus after transient global ischemia in gerbils[J]. Journal of Neuroscience:the official Journal of the Society for Neuroscience,1998,18(19):7768-7778.
[14] 黄璐雯,魏本,郭富强.Notch信号通路与脑缺血[J].国际脑血管病杂志,2013,21(7):550-553.
[15] 刘庆山,庄述娟,李克琴,等.神经干细胞增殖信号通路网络分析[J]. 中国中药杂志,2014,39(3):407-411.
[16] INGRAM W J, MCCUE K I, TRAN T H, et al. Sonic Hedgehog regulates Hes1 through a novel mechanism that is independent of canonical Notch pathway signalling[J]. Oncogene,2008,27(10):1489-1500.
[17] 孟庆萍,胡建鹏,王键,等.两种中药复方对局灶性脑缺血再灌注大鼠脑组织Hes-1、Hes-5表达的动态影响[J].安徽中医药大学学报,2009, 28(5):52-55.
[18] 陈岩,李志伟,杨谦.丹参酮对大鼠脑缺血后神经干细胞增殖影响的研究[J].陕西医学,2011,40(7):774-775.
[19] 程龙,朱培纯,司银楚,等.三七总皂甙对去大脑皮层血管后成年大鼠前脑侧脑室室管膜下层Nestin和bFGF表达的作用[J].北京中医药大学学报,2003,26(3):18-20.
[20] 沈自尹,黄建华,吴斌,等.淫羊藿激活内源性干细胞及其机制研究[J].中国中西医结合杂志,2009,29(3):251-254.
(收稿日期:2015-08-10;编辑:华强)
