持续偏热环境对肉鸡生长性能、糖脂代谢及解偶联蛋白mRNA表达的影响
2016-01-08龙石玉祥张敏红冯京海张少帅彭骞骞河北工程大学农学院邯郸05601中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室北京100193
甄 龙石玉祥张敏红冯京海张少帅彭骞骞(1.河北工程大学农学院,邯郸05601;.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193)
持续偏热环境对肉鸡生长性能、糖脂代谢及解偶联蛋白mRNA表达的影响
甄 龙1,2石玉祥1∗张敏红2∗∗冯京海2张少帅2彭骞骞1,2
(1.河北工程大学农学院,邯郸056021;2.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193)
摘 要:本试验研究了持续不同温度处理(21、26和31℃)对肉鸡生长性能、血清糖脂代谢相关指标、胸肌和肝脏解偶联蛋白(avUCP)mRNA表达的影响。试验选取22日龄爱拔益加(AA)肉鸡144只转入环境控制舱,随机分成3组,每组6个重复,每个重复8只鸡(公母各4只)。适应期7 d,温度21℃,相对湿度60%。29日龄时,试验温度分别调整到21、26和31℃,相对湿度60%,直至试验结束,共14 d。结果表明:1)31℃组肉鸡平均日增重(ADG)、平均日采食量(ADFI)极显著低于21、26℃组(P<0.01),料重比(F/G)显著高于21、26℃组(P<0.05);26℃组肉鸡ADG、ADFI显著低于21℃组(P<0.05),F/G和21℃组无显著差异(P>0.05)。2)31℃组肉鸡血清葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TG)、游离脂肪酸(FFA)含量显著高于21℃组(P<0.05);26℃组血清生化指标与21℃组无显著差异(P>0.05)。3)31℃组肉鸡血清甲状腺素(T4)、瘦素(LEP)、皮质酮(CORT)含量显著高于21℃组(P<0.05);除T4含量外(P<0.05),26℃与21℃组之间血清激素指标无显著差异(P>0.05)。4)试验第7天,31℃组胸肌avUCP mRNA表达显著低于21、26℃组(P<0.05);第14天,26、31℃组胸肌avUCP mRNA表达极显著低于21℃组(P<0.01);试验第7、14天,31℃组肉鸡肝脏avUCP mRNA表达极显著高于21、26℃组(P<0.01)。综上,与21℃相比,持续偏热处理(26、31℃)影响肉鸡糖脂代谢及avUCP mRNA的表达,并显著降低生长性能,且不同偏热程度对肉鸡影响程度不同。
关键词:偏热环境;肉鸡;生长性能;糖脂代谢;解偶联蛋白
∗同等贡献作者
∗∗通信作者:张敏红,研究员,博士生导师,E⁃mail:zmh66@163.com
在肉鸡养殖生产中,环境高温会影响肉鸡生长性能和糖脂代谢水平。长期暴露于高温环境会降低肉鸡采食量、日增重和饲料效率[1-2]。糖类和脂类是机体重要的能量来源,高温环境下肉鸡糖脂代谢水平加强,为抵抗热应激准备充足能量[3]。通常认为,21~26℃是鸡的舒适温度范围,26~32℃是鸡不太舒适但能维持正常生理功能的温度范围,高于32℃是鸡生理功能趋于紊乱的热应激温度范围[4]。目前为止,关于环境高温对肉鸡生长性能及糖脂代谢的研究较多,但多数研究集中在高温32℃以上热应激环境[2-3,5-6],有关30℃左右及低于30℃偏热环境的研究报道较少。
此外,禽类解偶联蛋白(avUCP)作为UCP家族的一员,于2001年被首次发现[7],其位于线粒体内膜,作为质子转运体将内膜外侧H+运回膜内侧,降低物质氧化过程形成的H+电化学梯度,决定氧化磷酸化反应生成ATP还是产生热能散失,对维持冷热环境下禽类体热平衡有重要意义。迄今,有关环境温度对肉鸡avUCP mRNA表达的研究多集中在冷应激[8-9]和急性热应激条件[10-11],且主要研究冷热应激对禽类骨骼肌avUCP mRNA表达影响,有关持续偏热环境对肉鸡avUCP表达研究较少,及热处理对肉鸡肝脏avUCP表达的影响尚未见报道。因此,本试验以肉鸡为对象,研究持续不同温度环境(21、26和31℃)对肉鸡生长性能、糖脂代谢相关指标及胸肌和肝脏avUCP mRNA的表达的影响,探讨持续偏热环境对肉鸡生长性能及糖脂代谢的影响,为探索肉鸡热适应性及提高肉鸡抗热能力提供理论依据。
1 材料与方法
1.1 试验动物与试验设计
选取同一批出雏、饲养管理一致、体质健壮的22日龄爱拔益加(AA)肉鸡144只,体重(745± 24)g,随机分成3组,每组6个重复,每个重复8只鸡(公母各4只)。分别转入3个环境控制舱,适应期7 d,21℃,相对湿度60%。29日龄时,试验温度分别调整到21、26和31℃,相对湿度60%,直至试验结束,共14 d。
1.2 饲养管理
试验在环境控制舱内进行,温度、湿度自动控制(精度±1℃、±7%),无风、24 h光照。试验肉鸡采用平养,所用笼具为本实验室研发的单层平养笼具[12],每8只试验肉鸡饲养面积为0.64 m2。试验动物所用饲粮参照NRC(1994)配制(表1)。试验期间,肉鸡自由采食与饮水。
1.3 测定指标与方法
1.3.1 生长性能
以重复为单位,分别对第29、35和42日龄肉鸡进行空腹称重,计算试验期间平均日增重(ADG);分别统计每日采食量,计算平均日采食量(ADFI)、料重比(F/G)。1.3.2 血样采集与分析
分别于试验第7、14天末,每组随机选取6只(公母各3只;每重复选1只)肉鸡翅静脉采血,3 000 r/min离心10 min取上清液,-80℃冷冻保存,待测。
血清葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TG)试剂盒购于中生北控股份有限公司,游离脂肪酸(FFA)试剂盒购于北京华英生物科技研究所,采用比色法,具体操作按说明书进行,所用仪器为日本日立7160全自动生化分析仪;血清胰岛素(INS)试剂盒购于北京华英生物科技研究所,采用放免法,具体操作按说明书进行,所用仪器为r-911全自动放免计数仪。血清三碘甲腺原氨酸(T3)、甲状腺素(T4)、瘦素(LEP)、皮质酮(CORT)试剂盒购于南京建成生物工程研究所,采用酶联免疫吸附测定(ELISA)法,具体操作按说明书进行,所用仪器为美国Power Wave XS2酶标仪。
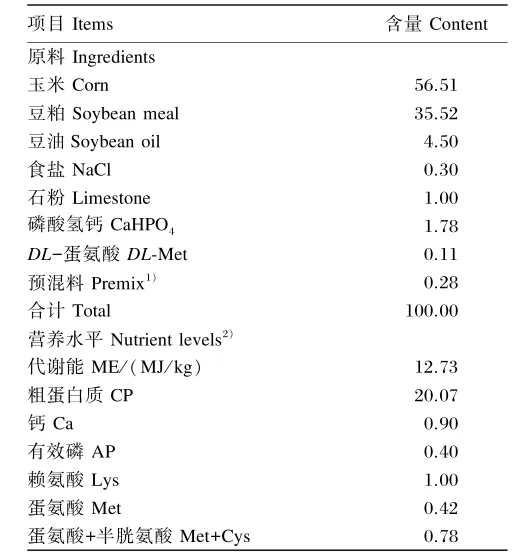
表1 基础饲粮组成及营养水平(饲喂基础)Table 1 Composition and nutrient levels of the basal diet(as⁃fed basis) %
1.3.3 avUCP mRNA样品采集与分析
分别于试验第7、14天末,每组随机选取6只(公母各3只;每重复选1只)肉鸡颈静脉放血处死,迅速采集胸肌和肝脏样品,用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)冲洗后立即放入液氮保存,待测。
组织avUCP mRNA表达量测定步骤:1)总RNA提取,用RNA提取试剂盒(TRIzol Reagent,Ambion)提取总RNA,所得RNA样品在浓度测定仪上测定260与280 nm处吸光度比值(OD260 nm/OD280 nm),用以检测总RNA浓度、纯度及完整性。2)反转录,以提取的总RNA为模板,用反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA E⁃raser,RR047A,日本TaKaRa)制备cDNA,具体操作按说明书进行。3)实时定量PCR(real⁃time PCR),以甘油醛-3-磷酸脱氢酶(GAPDH)基因为内参基因,采用real⁃time PCR进行相对定量,所用试剂盒为(SYBRPremix EX TaqTM,RR420A,日本TaKaRa)。引物设计如下:
目的基因avUCP引物:上游为5′-ATCGGGCTCTACGACTCTGT-3′;下游为5′-TGTGTCCTTGATGAGGTCGT-3′;扩增片段长度为327 bp。
内参基因GAPDH引物:上游为5′-AACTTT⁃GGCATTGTGGAGGG-3′;下游为5′-ACGCTGG⁃GATGATGTTCTGG-3′;扩增片段长度为130 bp。
1.4 数据处理
采用SAS 9.1统计软件,对各组使用单因素方差分析(one⁃way ANOVA),采用Duncan氏法多重比较,试验数据用平均值±标准差表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 持续偏热环境对肉鸡生长性能的影响
由表2可知,试验全期(1~7 d、8~14 d、1~14 d)内,温度处理对肉鸡ADG有极显著影响(P<0.01);试验1~7 d,3组间ADG均有极显著差异(P<0.01);试验8~14 d,31℃组与21、26℃组ADG有极显著差异(P<0.01),21℃组和26℃组间无显著差异(P>0.05);试验1~14 d,3组间ADG均有显著差异(P<0.05)。试验全期(1~7 d、8~14 d、1~14 d)内,温度处理对肉鸡ADFI有极显著影响(P<0.01);试验1~7 d,3组间ADFI均有显著差异(P<0.05);试验8~14 d,31℃组与21和26℃组ADFI有极显著差异(P<0.01),21℃组和26℃组间无显著差异(P>0.05);试验8~14 d,3组间ADFI均有极显著差异(P<0.01)。试验1~7 d、1~14 d,温度处理对肉鸡F/G有极显著影响(P<0.01),试验8~14 d,温度处理对肉鸡F/G有显著影响(P<0.05);试验1~7 d、1~14 d,31℃组与21、26℃组F/G有极显著差异(P<0.01);试验全期(1~7 d、8~14 d、1~14 d)内,21℃组和26℃组间F/G无显著差异(P>0.05)。结果表明,与21℃组相比,持续31℃(1~7 d、8~14 d、1~14 d)造成肉鸡生长性能下降;持续26℃,前期(1~7 d)造成肉鸡生长性能下降,后期(8~14 d)无显著差异,全期(1~14 d)造成生长性能下降。
2.2 持续偏热环境对肉鸡糖脂代谢相关血清生化指标的影响
由表3可知,试验第7天,温度处理对肉鸡血清GLU、TC、FFA含量有显著影响(P<0.05),有升高血清TG含量趋势(P<0.10);试验第7天,31℃组血清GLU含量极显著高于21、26℃组(P<0.01),31℃组血清TC、FFA含量显著高于21、26℃组(P<0.05),31℃组血清TG含量显著高于21℃组(P<0.05);试验第7天,21、26℃组血清GLU、TC、TG、FFA含量无显著差异(P>0.05)。试验第14天,温度处理对肉鸡血清GLU、TC、TG、FFA含量无显著影响(P>0.05)。结果表明,31℃组第7天造成肉鸡糖脂代谢相关血清生化指标升高,对第14天生化指标无显著影响;26℃组对第7、14天肉鸡糖脂代谢相关血清生化指标无显著影响。
2.3 持续偏热环境对肉鸡糖脂代谢相关血清激素指标的影响
由表4可知,试验第7天,温度处理对肉鸡血清T4、LEP、CORT含量有显著影响(P<0.05);31℃组血清T4含量极显著高于21℃组(P<0.01),血清LEP、CORT含量显著高于21℃组(P<0.05);26℃和31℃组血清T3、T4、LEP、CORT、INS含量无显著差异(P>0.05)。试验第14天,温度处理对肉鸡血清T4含量有显著影响(P<0.05),31℃组血清T4含量极显著高于21℃组(P<0.01),显著高于26℃组(P<0.05),21℃和26℃组无显著差异(P>0.05)。结果表明,31℃组造成肉鸡糖脂代谢相关血清激素含量升高;除血清T4指标外,26℃组对肉鸡糖脂代谢相关激素指标无显著影响。
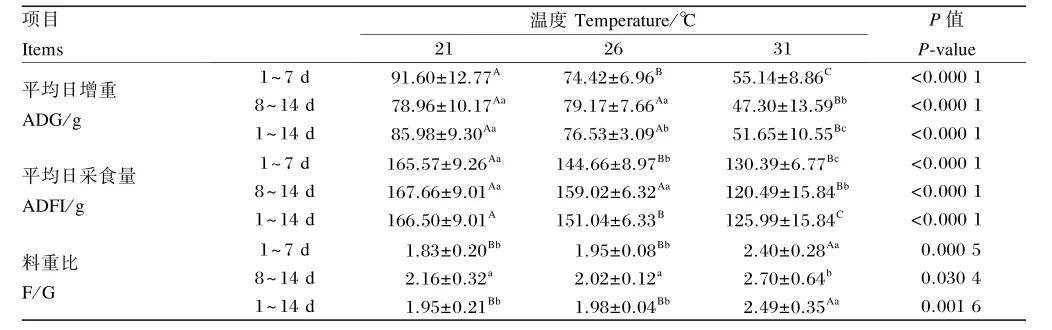
表2 持续偏热环境对肉鸡生长性能的影响Table 2 Effects of prolonged moderate ambient temperatures on performance of broilers

表3 持续偏热环境对肉鸡糖脂代谢相关血清生化指标的影响Table 3 Effects of prolonged moderate ambient temperatures on serum biochemical indices related in glucose and lipid metabolism of broilers

表4 持续偏热环境对肉鸡糖脂代谢相关血清激素指标的影响Table 4 Effects of prolonged moderate ambient temperatures on serum hormone levels related in glucose and lipid metabolism of broilers
2.4 持续偏热环境对肉鸡胸肌和肝脏avUCP mRNA相对表达量的影响
由图1和图2可知,温度处理对肉鸡胸肌和肝脏avUCP mRNA表达有极显著影响(P<0.01)。试验第7天,31℃组胸肌avUCP mRNA表达显著低于26℃组(P<0.05),极显著低于21℃组(P<0.01);试验第14天,26、31℃组胸肌avUCP mRNA表达极显著低于21℃组(P<0.01)。试验全期(7、14 d),31℃组肉鸡肝脏avUCP mRNA表达极显著高于21、26℃组(P<0.01)。结果表明,持续31℃组第7、14天均降低肉鸡胸肌avUCP mRNA表达,并升高肝脏avUCP mRNA表达;持续26℃组第14天降低肉鸡胸肌avUCP mRNA表达。
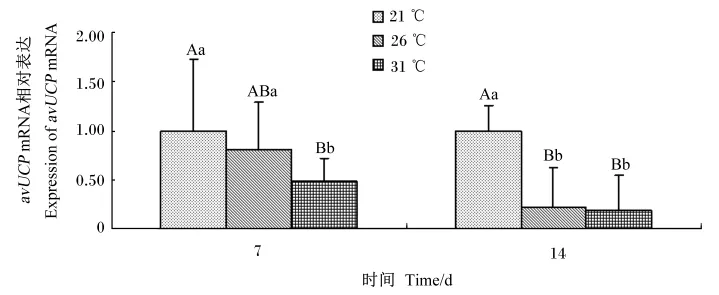
图1 持续偏热环境对肉鸡胸肌avUCP mRNA相对表达量的影响Fig.1 Effects of prolonged moderate ambient temperatures on expression of avUCP mRNA in pectoral muscle of broilers
数据柱形标注不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。图2同。
Data columns with different small letters mean significant difference(P<0.05),and with different capital letters mean signif⁃icant difference(P<0.01),while with the same or no letters mean no significant difference(P>0.05).The same as Fig.2.
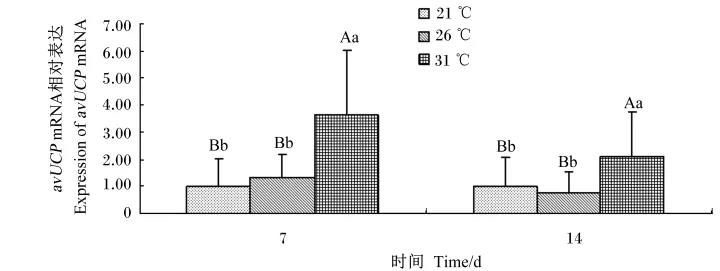
图2 持续偏热环境对肉鸡肝脏avUCP mRNA相对表达量的影响Fig.2 Effects of prolonged moderate ambient temperatures on expression of avUCP mRNA in liver of broilers
3 讨 论
3.1 持续偏热环境对肉鸡生长性能的影响
关于环境高温对肉鸡生长性能的研究已有大量报道。高温环境下,肉鸡为维持体热平衡,减少体内产热,降低采食量,同时,环境高温降低肉鸡饲料效率,最终减缓日增重。刘梅等[5]研究报道,35℃急性热应激7 d,肉鸡ADFI降低33.84%,ADG降低65.01%,F/G升高89.14%。Sohail等[2]研究发现,持续35℃热暴露21 d,肉鸡ADFI减少16.4%,ADG减少32.6%,F/G增加25.6%。随着夏季鸡舍降温技术的进步,实际生产中肉鸡长期遭受32℃以上热应激情况越来越少,因此,本试验研究了持续26、31℃环境对肉鸡生长性能的影响。Harris等[13]报道,与23.9℃恒温对照组相比,日循环23.9~29.4℃偏热处理显著降低肉鸡ADG、ADFI,对饲料效率无显著影响。Donkoh等[14]研究发现,将21~49日龄肉鸡饲养于与20、25和30℃环境下,30℃组肉鸡生长性能显著降低,而25℃和20℃组间无显著差异。本试验结果发现,与21℃相比,31℃持续处理14 d极显著降低肉鸡ADFI、ADG,极显著升高F/G;26℃持续处理14 d显著降低肉鸡ADFI、ADG,对F/G无显著影响。这与苏红光等[15]研究报道,与22℃相比,26、30℃持续处理14 d降低肉鸡生长性能的结果一致。由此可见,从生长性能结果来看,26、31℃对肉鸡而言已属偏热环境。同时,甄龙等[16]在另一篇文章中已报道,相比21℃,26、31℃持续处理会升高肉鸡体核温度、呼吸频率及水料比等热舒适评价指标,指出从体热调节角度讲,26、31℃对肉鸡而言也已属偏热环境。
本试验结果还发现,31℃处理使肉鸡1~7 d F/G极显著升高31%,8~14 d F/G显著升高25%;26℃处理极显著降低1~7 d肉鸡ADFI、ADG,对8~14 d ADFI、ADG无显著差异。可见,持续处理后期(7~14 d),26、31℃环境对肉鸡生长性能的影响有降低趋势。这与前人研究热处理对肉鸡生长性能的结果不同,Geraert等[6]曾研究报道,32℃持续处理前2周(3~4周龄)肉鸡采食量降低14%、日增重降低18%、F/G无显著差异,后2周(5~6周龄)肉鸡采食量降低24%、日增重降低41%、F/G升高38%,这表明32℃持续处理对肉鸡生长性能的影响有增加趋势。这种差异可能跟肉鸡日龄有关,随着日龄的增大肉鸡最适宜饲养温度降低;也可能跟高温强度有关,肉鸡对偏热温度及热应激温度的适应能力不同,导致持续处理后期对肉鸡生长性能的影响不同。
3.2 持续偏热环境对肉鸡糖脂代谢相关血清生化指标的影响
糖是机体内重要的能源物质,脂肪是体内重要的储能物质,两者协调共同为机体提供70%以上的能量来源[17]。高温环境下肉鸡一方面为维持体热平衡降低机体产热,另一方面也积极动员储备能量,提高机体抗热应激能力,血清葡萄糖含量一定程度上反映了机体能量代谢水平。有关环境高温对肉鸡血清葡萄糖含量的研究较多,但报道不一。唐丽[3]报道,急性35℃热应激第1、3天肉鸡血清葡萄糖含量显著升高,王启军[18]发现持续34℃热应激21 d对肉鸡血清葡萄糖含量无显著影响,而Vecerek等[19]认为,肉鸡血清葡萄糖含量随环境温度升高而显著降低,周杰等[20]却发现,34.5℃处理2 d对肉鸡血清葡萄糖含量无显著差异,处理21 d造成血清葡萄糖含量显著下降。本试验结果发现,26℃处理对第7、14天肉鸡血清葡萄糖含量无显著差异;而31℃处理显著升高肉鸡第7天血清葡萄糖含量,对第14天血清葡萄糖含量无显著差异,这与李军桥[21]报道28.8~36.5℃处理前期(第1、2周)显著升高肉鸡血清葡萄糖含量,对后期(第3周)血清葡萄糖含量无显著影响的结果一致。可见,在本试验中,偏热程度(26、31℃)及处理时间(7、14 d)都会影响肉鸡血清葡萄糖含量。血清脂肪含量是反映机体能量代谢的另一个重要指标。刘梅等[5]报道,急性35℃热处理7 d,肉鸡血清TG含量显著升高。李军桥[21]指出日变高温28.8~36.5℃处理,肉鸡前2周血清TG含量无显著差异,第3周TG含量显著降低。Kouba等[22]研究发现,31℃持续处理使育肥猪血液TG含量极显著升高。卢庆萍[23]报道,34℃处理21 d北京油鸡血清FFA含量显著升高。本试验结果发现,26℃处理对血清脂肪含量无显著影响;31℃处理升高第7天肉鸡血清脂肪含量,对第14天血清脂肪含量无显著影响,这与血清葡萄糖含量的结果基本一致,偏热程度(26、31℃)及处理时间(7、14 d)也影响肉鸡的血清脂肪含量。尽管不同报道对高温影响血液糖脂含量有不同看法,但热处理能引起包括糖类、脂类在内的三大营养物质发生变化是肯定的,且普遍认为高温强度和处理时间是影响血液糖脂含量的一个重要因素,本试验结果也支持这一观点。
3.3 持续偏热环境对肉鸡糖脂代谢相关血清激素指标的影响
甲状腺激素是动物调节产热维持体热平衡的重要激素,有加强糖异生,促进血清葡萄糖升高的作用。Tao等[24]报道,在5 d的热暴露时间内,肉鸡血清T3、T4含量持续降低。顾宪红等[25]研究发现,蛋鸡T3含量随环境温度升高呈先下降后恢复趋势。而刘思当等[26]和刘凤华等[27]认为,T3、T4在热应激初期升高,随着处理时间的延长逐渐恢复正常。本试验发现,26、31℃持续处理显著升高血清T4含量,对T3无显著影响。CORT作为家禽主要的糖皮质激素,参与动员体内储存的能量,为动物抵抗不良应激做准备。多数研究认为热处理对禽类血清CORT含量有升高趋势[28-30],但也有研究发现热处理对血清CORT含量有先下降后恢复[25]和无显著差异[31]等不同结果。本试验发现,31℃处理前7 d使肉鸡血清CORT含量显著升高,处理14 d血清CORT含量无显著影响。血液INS参与机体糖脂代谢,有降低血清葡萄糖,促进脂质合成、抑制脂肪分解的作用。本试验显示,偏热处理对肉鸡血清INS含量无显著影响,这与卢庆萍[23]报道持续34℃热应激对AA肉鸡INS含量无显著影响结果一致。LEP作为一种脂肪组织分泌的细胞因子,有抑制采食、增加能量消耗的作用,同时促进脂肪分解、抑制脂肪合成。郝靖宇[32]报道持续高温处理12 d,显著升高雌性肉鸡血浆LEP含量,处理23 d对LEP含量无显著影响。这与本试验结果一致,31℃处理显著升高第7天肉鸡血清LEP含量,对第14天血清LEP含量无显著差异。较高的LEP含量可降低肉鸡采食量,促进脂肪分解、抑制脂肪合成,使血清脂肪含量升高。有关高温对肉鸡糖脂代谢相关激素的报道较多,但结论并不统一,可能跟激素本身存在昼夜节律性变化有关;其次,试验动物日龄、高温强度、处理时间甚至采血应激都会对试验结果产生影响。
本试验结果发现,31℃处理升高第7天肉鸡血清T4、LEP和CORT含量;除T4指标外,对第14天相关激素含量均无显著差异,这一结果与血清生化指标变化基本吻合。31℃组热处理前7 d,肉鸡血清糖脂代谢相关生化指标及相关激素指标同时升高,表明糖脂代谢加强,机体处于抵抗热应激状态;热处理后7 d,血清生化及激素指标均无显著差异,可能跟肉鸡对持续偏热处理产生的热适应有关,使糖脂代谢恢复到正常水平。试验结果还发现,31℃处理造成肉鸡血清生化指标和激素指标同时升高,而26℃处理对两者均无显著影响。可见,在本试验条件下,无论偏热程度高低,还是处理时间长短,肉鸡血清糖脂代谢相关生化指标与激素指标的变化规律保持一致。
3.4 持续偏热环境对肉鸡胸肌和肝脏avUCP mRNA相对表达量的影响
线粒体是细胞内物质氧化代谢的主要场所,肉鸡avUCP作为一种线粒体阴离子载体蛋白,参与线粒体膜内与膜外H+的转运,使物质氧化过程与ADP磷酸化过程脱偶联,能量不储存在ATP而以热能形式散失,对维持动物体热平衡有重要作用。环境温度是影响肉鸡avUCP mRNA表达的一个重要因素。Wang等[8]研究表明,急性和慢性12℃冷应激均造成肉鸡腓肠肌avUCP mRNA表达升高,且随着处理时间的延长呈升高趋势。Toyomizu等[33]研究发现,持续4~6℃冷应激12 d显著升高白来航鸡胸肌avUCP mRNA表达。Mu⁃jahid等[10]报道,34℃急性热应激18 h,肉鸡胸肌avUCP mRNA降低72%。苏红光等[15]研究发现,持续30℃热处理显著降低肉鸡胸肌avUCP mRNA表达。本试验结果表明,26、31℃持续热处理使肉鸡胸肌avUCP mRNA表达极显著降低,且随着处理时间的延长avUCP mRNA表达呈下降趋势,这跟前人研究结果一致。骨骼肌是禽类重要的产热部位,热处理使肉鸡骨骼肌avUCP mRNA表达降低,减少氧化过程与ADP磷酸化过程的脱偶联作用,使更多的能量不以热能形式释放,对维持热环境下肉鸡体热平衡有重要意义。
Gasparino等[34]研究报道,34℃热处理24 h对鹌鹑胸肌和肝脏avUCP mRNA表达均无显著差异。本试验结果却发现,持续31℃热处理造成肉鸡肝脏avUCP mRNA表达极显著升高,这与前人关于热处理对禽类肝脏avUCP mRNA表达结果不同,这可能跟试验动物品种有关,在Gasparino等[34]试验中,热处理对鹌鹑胸肌avUCP mRNA表达结果与多数家禽试验结果也不一致。Evock等[35]研究发现,avUCP基因除了主要在骨骼肌表达外,在8周龄鸡的心脏、肝脏、脾脏、肺脏、肾脏、脑和脂肪组织广泛存在并表达,Dridi等[36]由此指出,avUCP在各器官、组织的广泛存在可能除了跟调节产热有关外,还发挥着其他重要的作用。本试验发现偏热处理对肉鸡胸肌和肝脏avUCP mR⁃NA表达的影响截然相反,可能预示着不同组织内avUCP的主要功能存在差异,这跟Dridi的想法一致。26、31℃处理使肝脏avUCP mRNA表达升高,解偶联作用加强,会使更多的能量以热能形式释放,不利于肉鸡在热环境维持体热平衡,这一矛盾可能说明肝脏avUCP主要功能不是调节体内产热、维持体热平衡,而是有其他重要作用。血液TG、INS、LEP含量可促进avUCP mRNA的表达[35]及T3、CORT含量[37]影响哺乳动物UCP3的表达(UCP3与avUCP同源性较高,生理作用相似),肝脏是脂肪合成与分解代谢的主要场所,而血液TG含量及相关激素含量与脂肪代谢密切相关,因此,推测肉鸡肝脏avUCP的主要功能可能是参与调控肝脏内的脂肪代谢,这或许是热处理升高肝脏avUCP mRNA表达的一个原因,但具体原因有待进一步探究。
4 结 论
①与21℃相比,26℃持续处理显著降低肉鸡ADG、ADFI,对F/G无显著影响,对糖脂代谢相关血清生化及激素指标无显著影响,显著降低胸肌avUCP mRNA表达,对肝脏avUCP mRNA表达无显著影响。
②与21℃相比,31℃持续处理显著降低肉鸡ADG、ADFI,升高F/G,升高血清糖脂含量并影响相关激素含量,极显著降低胸肌并升高肝脏内avUCP mRNA表达。
③从本文持续26、31℃处理对肉鸡糖脂代谢相关生化、激素指标及avUCP mRNA表达的影响,结合生长性能的结果来看,26、31℃对AA肉鸡而言已属偏热环境,且温度越高,对肉鸡的影响程度越大。
参考文献:
[1] AL⁃FATAFTAH A A,ABU⁃DIEYEH Z H M.Effect of chronic heat stress on broiler performance in Jordan [J].International Journal of Poultry Science,2007,6 (1):64-70.
[2] SOHAIL M U,HUME M E,BYRD J A,et al.Effect of supplementation of prebiotic mannan⁃oligosaccha⁃rides and probiotic mixture on growth performance of broilers subjected to chronic heat stress[J].Poultry Science,2012,91(9):2235-2240.
[3] 唐丽.热应激对肉种母鸡繁殖性能、相关生理生化和分子指标的影响[D].硕士学位论文.北京:中国农业科学院,2013.
[4] 罗庆斌,何丹林.鸡热应激研究概述[J].养禽与禽病防治,2005(4):2-5.
[5] 刘梅.急性热应激对肉仔鸡生长性能及脂肪代谢的影响[J].动物营养学报,2011,23(5):862-868.
[6] GERAERT P A,PADILHA J C F,GUILAUMIN S.Metabolic and endocrine changes induced by chronic heat exposure in broiler chickens:growth perform⁃ance,body composition and energy retention[J].British Journal of Nutrition,1996,75(2):195-204.
[7] RAIMBAULT S,DRIDI S,DENJEAN F,et al.An un⁃coupling protein homologue putatively involved in fac⁃ultative muscle thermogenesis in birds[J].Biochemi⁃cal Journal,2001,353:441-444.
[8] WANG J T,ZHANG X J,XU S W.Effects of cold stress on energy metabolism in the chicken[J].Chi⁃nese Journal of Applied Physiology,2009,25(2):172-176.
[9] ROUSSEL D,ROUANET J L,DUCHAMP C,et al.Effects of cold acclimation and palmitate on energy coupling in duckling skeletal muscle mitochondria[J].FEBS Letters,1998,439(3):258-262.
[10] MUJAHID A,SATO K,AKIBA Y,et al.Acute heat stress stimulates mitochondrial superoxide production in broiler skeletal muscle,possibly via downregulation of uncoupling protein content[J].Poultry Science,2006,85(7):1259-1265.
[11] TAOUIS M,DE BASILIO V,MIGNON⁃GRASTEAU S,et al.Early⁃age thermal conditioning reduces un⁃coupling protein messenger RNA expression in pecto⁃ral muscle of broiler chicks at seven days of age[J].Poultry Science,2002,81(11):1640-1643.
[12] 张敏红,苏红光,冯京海,等.采集用于建立肉鸡生活环境舒适性评价模型数据的方法和专用装置:中国,CN103404447A[P/OL].2013-11-27.
[13] HARRIS G C,Jr,DODGEN W H,NELSON G S.Effects of diurnal cyclic growing temperatures on broiler performance[J].Poultry Science,1974,53 (6):2204-2208.
[14] DONKOH A.Ambient temperature:a factor affecting performance and physiological response of broiler chickens[J].International Journal of Biometeorolo⁃gy,1989,33(4):259-265.
[15] 苏红光,张敏红,冯京海,等.持续冷热环境对肉鸡生长性能、糖代谢和解偶联蛋白mRNA表达的影响[J].动物营养学报,2014,26(11):3276-3283.
[16] 甄龙,张少帅,石玉祥,等.水料比作为偏热环境肉鸡热舒适评价指标研究[J].动物营养学报,2015,27 (6):1750-1758.
[17] 王玢,左明雪.人体及动物生理学[M].2版.北京:高等教育出版社,2001.
[18] 王启军.高温环境对不同生长阶段北京油鸡脂肪沉积及脂质代谢的影响[D].硕士学位论文.杨凌:西北农林科技大学,2006.
[19] VECEREK V.Influence of high environmental temper⁃ature on production and haematological and biochemi⁃cal indexes in broiler chickens[J].Czech Journal of Animal Science,2002,47(5):176-182.
[20] 周杰,骆先虎,檀其梅,等.高温对肉用仔鸡生产性能和某些血清生化指标的影响[J].畜牧与兽医,1997,29(2):57-59.
[21] 李军桥.高温环境对肉鸡血液生化指标、热应激蛋白(HSP72)转录及肉品质的影响[D].硕士学位论文.保定:河北农业大学,2004.
[22] KOUBA M,HERMIER D,LE DIVIDICH J.Influence of a high ambient temperature on lipid metabolism [J].Journal of Animal Science,2001,79(1):81-87.
[23] 卢庆萍.高温环境下不同基因型肉鸡肉质性状及脂肪沉积规律的研究[D].博士学位论文.北京:中国农业科学院,2007.
[24] TAO X,ZHANG Z Y,DONG H,et al.Responses of thyroid hormones of market⁃size broilers to thermo⁃neutral constant and warm cyclic temperatures[J].Poultry Science,2006,85(9):1520-1528.
[25] 顾宪红,王新谋.高温对蛋鸡生产性能和血浆皮质酮,甲状腺素,孕酮水平的影响[J].畜牧兽医学报,1995,26(2):109-1115.
[26] 刘思当,宁章勇,谭勋.热应激对肉仔鸡血液生化指标影响的观察[J].中国兽医杂志,2003,39(9):20-23.
[27] 刘凤华,吴国娟,王占贺,等.热应激中仔鸡血液生化指标及T细胞变化规律[J].中国兽医杂志,2004,40(6):11-13.
[28] 杜荣,顾宪红.环境温度和日粮能量水平对鸡血浆皮质酮水平的影响[J].畜牧兽医学报,1997,28(2):126-129.
[29] DEYHIM F,TEETER R G.Research note:sodium and potassium chloride drinking water supplementation effects on acid⁃base balance and plasma corticosterone in broilers reared in thermoneutral and heat⁃distressed environments[J].Poultry Science,1991,70(12):2551-2553.
[30] GERAERT P A,PADILHA J C F,GUILLAUMIN S.Metabolic and endocrine changes induced by chronic heat exposure in broiler chickens:biological and endo⁃crinological variables[J].British Journal of Nutrition,1996,75(2):205-216.
[31] BREUNER C W,SPRAGUE R S,PATTERSON S H,et al.Environment,behavior and physiology:do birds use barometric pressure to predict storms?[J].The Journal of Experimental Biology,2013,216 (Pt11):1982-1990.
[32] 郝靖宇.持续高温对不同性别北京油鸡脂肪沉积和脂肪代谢的影响[D].硕士学位论文.北京:中国农业科学院,2011.
[33] TOYOMIZU M,UEDA M,SATO S,et al.Cold⁃in⁃duced mitochondrial uncoupling and expression of chicken UCP and ANT mRNA in chicken skeletal muscle[J].FEBS Letters,2002,529(2/3):313-318.
[34] GASPARINO E,DEL VESCO A P,VOLTOLINI D M,et al.The effect of heat stress on GHR,IGF⁃Ⅰ,ANT,UCP and COXⅢmRNA expression in the liver and muscle of high and low feed efficiency female quail[J].British Poultry Science,2014,55(4):466-473.
[35] EVOCK⁃CLOVER C M,POCH A M,RICHARDS M P,et al.Expression of an uncoupling protein gene homolog in chickens[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physi⁃ology,2002,133(2):345-358.
[36] DRIDI S,ONAGBESAN O,SWENNEN Q,et al.Gene expression,tissue distribution and potential phys⁃iological role of uncoupling protein in avian specees [J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2004,139 (3):273-283.
[37] LARKIN S,MULL E,MIAO W,et al.Regulation of the third member of the uncoupling protein family,UCP3,by cold and thyroid hormone[J].Biochemical and Biophysical Research Communications,1997,240 (1):222-227.
Effects of Constant Moderate Temperatures on Performance,Glucose and Lipid Metabolism,Expression of Uncoupling Protein of broilers
ZHEN Long
1,2
SHI Yuxiang
1∗
ZHANG Minhong
2∗∗
FENG Jinghai
2
ZHANG Shaoshuai
2
PENG Qianqian
1,2
(责任编辑 陈 燕)
(1.College of Agriculture HeBei University of Engineering,Handan 056021,China;2.State Key Laboratory of Animal Nutrition,Institute of Animal Sciences,Chinese Academy of Agricultural Sciences,Beijing 100193,China)
∗Contributed equally
∗∗Corresponding author,professor,E⁃mail:zmh66@163.com
Abstract:This experiment was conducted to study the effects of three different constant ambient temperatures (21,26 and 31℃)on performance,serum biochemical and hormone indices related in glucose and lipid me⁃tabolism,and expression of uncoupling protein in pectoralis muscle and liver of broilers.One hundred and for⁃ty⁃four 22⁃day⁃old Arbor Acres(AA)broilers were assigned to three environment chambers,each chamber contained six cages with eight birds per cage(with four males and four females),and each cage as a replicate.The pre⁃test period lasted for 7 days and broilers were kept at 21℃and 60%relative humidity.When broilers were 29⁃day⁃old,the temperatures of each environmental chamber were gradually regulated to 21,26 and 31℃,respectively,while maintaining the relative humidity at 60%and both kept constant until the end of the experiment.The trial period lasted for 14 days.The results showed as follows:1)average daily gain(ADG),average daily food intake(ADFI)and food to gain ratio(F/G)in 31℃group showed highly significant(P<0.01)depression than that in 21 and 26℃groups;ADG and ADFI in 26℃group were significant(P<0.05)lower than that in 21℃group,with no significant difference(P>0.05)in F/G was found between the two groups.2)serum glucose(GLU),total cholesterol(TC),total triglyceride(TG)and nonestesterified fatty acid(FFA)in 31℃were significant(P<0.05)higher than that in 21℃group,with no significant difference (P>0.05)was found between 21 and 26℃groups.3)serum thyroxine(T4),leptin(LEP)and corticoster⁃one(CORT)in 31℃were significant(P<0.05)higher than that in 21℃group,with no significant differ⁃ence(P>0.05)was found between 21 and 26℃groups except for T4.4)expression of avian uncoupling pro⁃tein(avUCP)mRNA in pectoral muscle of broilers in 31℃group showed highly significant(P<0.01)de⁃pression than that in 21 and 26℃groups at the seventh day,with highly significant(P<0.01)depression in 26 and 31℃groups than 21℃at the fourteenth day;throughout the trial period,expression of avUCP mRNA in liver of broilers in 31℃group was highly significant(P<0.01)higher than that in 21 and 26℃groups.In conclusion,compared with 21℃group,the constant moderate heat stress(26 and 31℃)can the perform⁃ance,glucose and lipid metabolism,and expression of uncoupling protein of broilers.And the different extent moderate heat stress would produce different effects on that.[Chinese Journal of Animal Nutrition,2015,27 (7):2060⁃2069]
Key words:moderate temperature;broiler;performance;glucose and lipid metabolism;avian uncoupling protein
作者简介:甄 龙(1988—),男,河北石家庄人,硕士研究生,畜牧学专业。E⁃mail:zl15188833639@163.com
基金项目:国家科技支撑计划课题“畜禽健康养殖环境控制关键技术研究与集成”(2012BAD39B02);中国农业科学院科技创新团队项目(ASTIP⁃IAS07)
收稿日期:2015-02-16
doi:10.3969/j.issn.1006⁃267x.2015.07.011
文章编号:1006⁃267X(2015)07⁃2060⁃10
文献标识码:A
中图分类号:S815.5
