基于生物信号采集系统建立氨水引咳实验模型 *
2016-01-07邓遇元,张刘凡,颜晓燕等
基于生物信号采集系统建立氨水引咳实验模型*
邓遇元1,2张刘凡1颜晓燕1陈久燕1顾军1陆益炯1邵玉梅1
(1.成都医学院药学院, 四川 成都 610083;2.解放军第198医院, 湖南 郴州 423000)
【摘要】目的基于生物信号采集系统建立客观、准确记录氨水引咳模型中小鼠咳嗽次数的实验方法。方法将自制体积描记装置通过传感器与美国BIOPAC公司的生物信号采集器相连,用12.5%的氨水引咳小鼠,采用经典传统方法记录各组小鼠咳嗽(即氨水引咳后小鼠发生腹部剧烈收缩伴张大嘴的动作)的次数,检测信号计为动作信号;观察记录小鼠动作信号同时,记录小鼠的咳嗽声音,记录小鼠同时发生动作信号与声音信号的次数,检测信号计为声动信号;同一时间点,通过特定电信号记录各组小鼠咳嗽次数,检测信号计为电信号。实验结束后,以声动信号作为标准,将三种记录方法所得各组数据进行秩相关分析。结果电信号与声动信号之间,相关系数为(0.991±0.007),相关性好,而动作信号与声动信号之间,相关系数在(0.429±0.152)与(0.495±0.221)之间,相关性较差,数据波动较大,且不同动作信号观察者观察的结果差距大。结论基于生物信号采集系统检测氨水引咳后小鼠的咳嗽次数的方法可靠,且较传统的肉眼观察的方法更客观准确。
【关键词】小鼠; 镇咳实验; 生物信号采集系统
【中图分类号】R 562
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2015.10.007
Abstract【】ObjectiveTo establish the objective and accurate experiment method recording the number of cough based on biological signal acquisition system in ammonia-induced mice cough experiment model. MethodsThe homemade device of painting and recording volume with BIOPAC biological signal harvester were connected by sensor. Ammonia induced cough in mice. The times of cough marked by abdomen contracted and mouth open in mice after stimulated by ammonia were recorded with classic traditional methods in each group. The signal was counted as action signal. The action signal was recorded when whooper was detected and the action signal with whooper was counted as sound-action signal. At the same time, the cough times of mice in each group were recorded through special electrical signal and the signal was counted as electrical signal. At the end of experiment, taking the sound-action signal as standard, the data recorded by three ways in each group was analyzed by rank correlation. ResultsCorrelation coefficient between the number of electrical signals detected by biological signal acquisition system in each group and the number of sound-action signals detected by the observer was 0.991±0.007. While the correlation coefficient between the number of action signals detected by observer and the number of sound-action signals detected by the observer were among 0.429±0.152 and 0.495±0.221 and were poor. And the volatility of correlation coefficient is large. ConclusionThe method based on biological signal acquisition system to detect the number of cough in mice after stimulated by ammonia is reliable and more objective and accurate compared with the traditional macroscopic observation method.
基金项目:成都医学院大学生综合性、设计性实验项目(ZH201103)
通讯作者:颜晓燕,副教授,博士,E-mail: 171756035 @qq.com
收稿日期:( 2014-09-15; 编辑: 陈舟贵)
Establishment of ammonia-induced mice cough experiment model based on biological signal acquisition systemDENG Yuyuan1,2, ZHANG Liufan1, YAN Xiaoyan1,etal
(1.PharmacySchoolofChengduMedicalCollege,Chengdu610083,China;
2.The198thHospitalofPLA,Chenzhou423000,Hunan,China)
【Key words】mice; Antitussive experiments; Biological signal acquisition system

小鼠氨水引咳实验法操作相对简单,且实验成本较低,常在镇咳药效实验中作为初筛方法而得到广泛应用[1~5]。对于小鼠的咳嗽,目前多数文献都是以观察小鼠腹部收缩,同时伴有张大嘴的动作作为评判标准[6],但实际操作过程中,小鼠咳嗽动作有时并不典型,且由于小鼠在容器中不停移动,不便于观察,因此,造成数据难于准确记录,且波动较大。也有文献[7]提示用听诊器辅助记录小鼠咳嗽的声音,能够获得客观、准确的实验数据,但是,实验需要十分安静的外界条件和观察者在观察过程中精神高度集中。为设计既能获得客观、准确实验数据,又操作简便、易行的实验方法,本实验基于机体咳嗽时会伴有瞬间气流的变化,这种变化在一个密闭的空间中会带来瞬间压力变化的原理,将实验小鼠置于自制的体积描记箱中,利用压差传感器检测压差信号,并通过BIOPAC生物信号采集系统进行记录,可以准确记录小鼠咳嗽次数,且较传统方法对外界环境及观察者要求更低。现报告如下。
1材料与方法
1.1材料药品:磷酸可待因(青海制药厂有限公司,批号20100514)。试剂:浓氨水(成都市科龙化工试剂厂,批号20110125)。仪器:MP150生物信号采集处理系统、TSD160A压力换能器、TSD137C小型动物呼吸流量探头、DA100C通用放大器(美国BIOPAC公司);980-A超声雾化器(上海新天缘医药股份有限公司);Statorius电子天平(北京赛多利斯仪器系统有限公司)。动物:KM小鼠,雌雄各半,体重(20±2)g,健康状况良好,四川大学华西医院实验动物中心提供,实验动物使用许可证号(SYXK(川)2009-045)。
1.2方法
1.2.1检测装置制备取适当容积的广口瓶,橡胶塞封口使之成为密闭容器,并在橡胶塞上开两个小孔,一个孔用于与压力传感器相连,并通过传感器与放大器与MP150主机相连,另一个孔与听诊器相连,装置见图1。
1.2.2分组及给药根据体重随机分为空白对照组、模型对照组、阴性对照组和磷酸可待因高、低剂量组。其中低剂量组(15mg/kg)、高剂量组(30mg/kg)和阴性对照组(等容量生理盐水)均腹腔给药,给药后30min用12.5%氨水喷雾引咳;模型组未做给药处理,仍以12.5%氨水喷雾引咳,空白对照组小鼠未做给药处理,且用蒸馏水喷雾刺激。喷雾刺激时间为15s。
1.2.3观察指标喷雾刺激结束后,迅速将小鼠从玻璃钟罩中取出,转移至体积描记装置中,观察并记录小鼠3min内的信号次数。 动作信号的记录,观察小鼠的动作,以每出现一次腹部剧烈收缩伴有张大嘴的动作为一次动作信号。电信号的记录,通过生物信号采集系统采集电信号。声动信号的记录,观察者观察小鼠的动作并用听诊器监测咳嗽声音,以每出现一次腹部剧烈收缩伴有张大嘴的动作,同时伴有咳嗽声音为一次声动信号。记录者在记录声动信号的同时,向负责电信号采集的记录者发出指令,由负责电信号的记录者适时在图像上进行标记,见图2。
1.3统计学分析用SPSS 13.0对各组三种数据结果进行秩相关分析。P<0.05为差异有统计学意义。
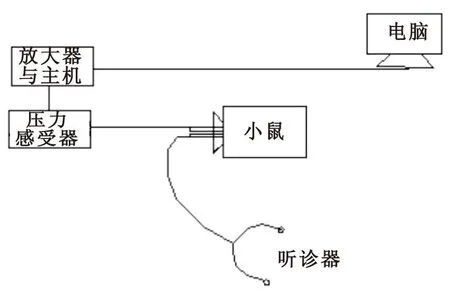
图1实验装置图
Figure.1Experimental set-up

图2生物信号采集系统采集的咳嗽电信号
Figure.2Electrical signals of cough collected by biological signal acquisition system
注:①咳嗽电信号
2结果
2.1资料显示,生物信号采集系统采集到的咳嗽电信号是以基线为中心分布的向下的吸气峰和向上呼气峰构成的对称的尖峰信号,同时,声动信号与电信号一致性较好,且出现的时值基本同步,见图2。
2.2各组小鼠的声动信号、电信号和动作信号的比较磷酸可待因对氨水刺激的小鼠咳嗽具有显著的镇咳作用。动作信号Ⅱ观察者观察记录的数据以及电信号数据统计结果与声动信号数据统计结果完全一致,动作信号Ⅰ和Ⅲ观察者记录到的数据统计结果与声动信号数据统计结果不完全一致。电信号与声动信号之间,相关系数为(0.991±0.007),相关性好。动作信号与声动信号之间,相关系数在(0.429±0.152)与(0.495±0.221)之间,数据波动较大,相关性较差,见表1、2。

表1 采用三种信号观察各组小鼠咳嗽次数比较 ± s)
注:与空白组比较,①P<0.05;与阴性组比较,②P<0.05

表2 电信号和动作信号分别与声动信号秩相关分析 ± s)
注:与声动信号呈正相关①P<0.01;②P<0.05
3讨论
小鼠氨水引咳实验作为一种镇咳药效实验评价的筛选方法,数据的真实、可靠性对实验结果的判定至关重要。现有文献多数以动作作为小鼠咳嗽的评判标准,可能是由于小鼠体型小,其咳嗽声音非常微弱,很难准确记录,因此,采用记录其腹部剧烈收缩同时伴有张嘴动作为准。而实际上仅凭其动作判断小鼠的咳嗽存在较大误差,一方面,诱发小鼠收腹、张嘴的动作因素较多,且小鼠的自主活动易对观察造成干扰;另一方面,不同观察者对实验标准的掌握存在差异。因此,该方法仅作为一种镇咳实验的初筛方法被使用[8,9]。
为改进氨水引咳实验法,少数文献提到用听诊器监测咳嗽声音作为辅助判断标准,能够客观、准确的记录小鼠的咳嗽次数。关于以声音作为判断咳嗽的标准,中医内科学中对咳嗽的定义是“……咳,指有声无痰;……嗽,指有痰无声。临床上一般痰声并见,故合称“咳嗽”[10],而同样作为镇咳药效实验筛选模型的豚鼠枸橼酸引咳实验法,豚鼠咳嗽的判断,则是以咳嗽声音作为评判标准[6,11~15]。因此,我们认为,咳嗽的判断应该以听到声音为准。为了能准确监测小鼠微弱的咳嗽声音,课题组经过摸索发现将小鼠置于合适的密闭容器中,插入听诊器能清晰地监测小鼠咳嗽的声音。能够得到相对客观、准确的实验结果,但仍需要十分安静的外界条件,同时,对观察者要求较高,需要观察者通过多次训练,准备把握记录标准,同时,在观察记录过程中要求观察者长时间保持精神高度集中的状态,不利于广泛应用。
药理实验方法学中提到:“咳嗽反射开始有吸气动作,接着紧闭声门,并发生强烈呼气,提高胸内压(可出现正压),气道可受压缩而变窄,肺内压也大大升高,然后声门突然开启,由于压力差,肺泡与呼吸道内气体以极高速度咳出体外,形成咳嗽动作。”[6]该反射能产生压力的瞬间变化。课题组利用生物信号采集系统中灵敏的压力感受器将微小的压力变化放大、转变成直观、准确的电信号图,装置见图1。经预实验得出,为获得清晰的电信号图,又能为小鼠呼吸提供足够的氧气,且方便实验操作,选择容积在200~300ml密闭容器较佳;压力传输管径选择与压力感受器匹配的最佳,采集的信号图如图2所示,图中以基线为中心分布的向下的吸气峰和向上呼气峰构成的对称的尖峰信号为一次电信号。
为验证采集的咳嗽电信号,实验采用三种方法同时对咳嗽进行计数,即检测压力变化方法、观察咳嗽动作方法、观察动作同时监测声音方法,并分别将结果记作电信号、动作信号、声动信号。以数据灵敏、客观的声动信号作为比较依据,分别对电信号、动作信号与声动信号进行秩相关分析。
实验结果显示,电信号与声动信号相关系数的均数标准差为(0.991±0.007),数据相关性较高,波动较小,且两者之间吻合性较高;动作信号与声动信号相关系数均数标准差在(0.429±0.152)与(0.495±0.221)之间,数据相关性较小,波动较大,且对于同一只小鼠,不同的观察者观察到的动作信号差别较大。
4结论
本文资料显示,基于生物信号采集系统采集的咳嗽电信号数据较可靠,比传统肉眼观察咳嗽动作获得的动作信号更客观、准确,且比改进后观察动作同时监测声音的方法操作更方便、简单,适合推广使用。
【参考文献】
[1]颜晓燕,童志远,彭成,等.暗紫贝母、栽培瓦布贝母及浙贝母药效学比较[J].中国实验方剂学杂志,2012,18(17):244-248.
[2]马莹,沈祥春,茅向军.宝铎草的止咳、祛痰作用研究[J].中国实验方剂学杂志,2012,18(19):261-263.
[3]叶广亿,李书渊,陈艳芬,等.枇杷叶不同提取物的止咳化痰平喘作用比较研究[J].中药药理与临床,2013,29(2):100-102.
[4]凌珊,易炳学,龚千锋,等.生品和蜜炙款冬花不同提取物的镇咳祛痰作用[J].中国实验方剂学杂志,2013,19(11):187-190.
[5]王海青,阚红卫,靳康,等.浙贝止咳颗粒镇咳祛痰及抗菌作用研究[J].中国实验方剂学杂志,2011,17(16):207-210.
[6]徐叔云,卞如濂,陈修.药理实验方法学[M]. 第3版.北京:人民卫生出版社,2001:1363-1364,1262.
[7]刘凤云,康胜利.小鼠镇咳实验装置的改进[J].青海医学院学报,2001,22(2):68-69.
[8]柯昌毅.半夏5种不同溶剂提取物对小鼠祛痰镇咳作用的研究[J].中国药房,2012,23(39):3652.
[9]陈晓芳,张倩,吴文倩,等.枇杷花醇提物止咳化痰作用实验研究[J].中成药,2013,35(1):167-169.
[10] 王永炎,鲁兆麟.中医内科学[M]. 第2版. 北京:人民卫生出版,2011: 144.
[11] 刘波,李祚勇,徐国良,等.麻杏石甘汤对枸橼酸致豚鼠咳嗽的影响[J].中国实验方剂杂志,2011,17(23):105-108.
[12] 程艳芹,王英姿,李明春.甘草5种方法提取液主要药效学及急性毒性比较[J].中国医院药学杂志,2013,33(6):435-439.
[13] 冯承恩,黄庆芳,房志坚,等.金钮扣止咳、化痰及平喘作用的研究[J].中药材,2012,35(5):783-785.
[14] 邓元荣,刘诗洪,谢振家.喘息灵胶囊原方与去除马兜铃新方的止咳功效比较[J].中药药理与临床,2012,28(4):102-104.
[15] 王静波,杨必坤,张宏,等.枇杷花提取物止咳作用研究[J].中草药,2009,40(7):1106-1109.

