AtbZIP19和AtbZIP23蛋白的原核表达
2016-01-04孙成磊,董万春,韩娇等
曹树青(1966-),男,安徽池州人,博士,合肥工业大学教授,博士生导师.
AtbZIP19和AtbZIP23蛋白的原核表达
孙成磊,董万春,韩娇,管灵霞,阳立波,曹树青
(合肥工业大学 生物与食品工程学院,安徽 合肥230009)
摘要:bZIP类转录因子参与调控多种生物学过程,包括植物生长、花的发育、种子的成熟、衰老、光信号传导、损伤修复、病菌防御以及对各种环境胁迫的响应等。文章构建AtbZIP19和AtbZIP23基因的原核表达载体,并在大肠杆菌BL21(DE3)中进行了蛋白表达;提取拟南芥植株总RNA,通过RT-PCR克隆AtbZIP19与AtbZIP23基因cDNA 全长;将pET-32a+载体和聚合酶链反应(PCR)产物进行双酶切,通过DNA连接反应将2个基因定向克隆到pET-32a+质粒中;经菌液PCR和测序鉴定获得阳性克隆后,将重组质粒转化至大肠杆菌原核表达菌株BL21(DE3),经异丙基硫代半乳糖苷(IPTG)诱导后表达得到目的蛋白。
关键词:拟南芥;AtbZIP19蛋白;AtbZIP23蛋白;原核表达
收稿日期:2014-02-17;修回日期:2014-04-16
基金项目:高等学校博士学科点专项科研基金资助项目(20120111110009);中国博士后科学基金资助项目(2012M521213)和安徽省自然科学青年基金资助项目(1308085QC56)
作者简介:孙成磊(1988-),男,山东郓城人,合肥工业大学硕士生;
doi:10.3969/j.issn.1003-5060.2015.01.024
中图分类号:Q753文献标识码:A
ProkaryoticexpressionofAtbZIP19andAtbZIP23proteins
SUNCheng-lei,DONGWan-chun,HANJiao,GUANLing-xia,YANGLi-bo,CAOShu-qing
(SchoolofBiotechnologyandFoodEngineering,HefeiUniversityofTechnology,Hefei230009,China)
Abstract:Basic leucine zipper(bZIP) transcription factors are involved in various biological functions such as plant growth regulation, flower development, seed maturation, senescence, light signal transduction, wounding responses, pathogen defence and responses to various environment stresses. To construct the eukaryotic expression plasmids of AtbZIP19 and AtbZIP23, total RNA was extracted from Arabidopsis seedlings, and cDNA fragments of AtbZIP19 and AtbZIP23 were PCR-amplified through reverse-transcription polymerase chain reaction(RT-PCR) and inserted into the pET-32a+ vector to build up constructions of pET-32a-bZIP19 and pET-32a-bZIP23. These plasmids were identified by DNA sequencing. The recombinant plasmids were transfected into BL21(DE3) and expressed through sodium dodecyl sulfate polyacrylamide gelelectrophoresis, and the AtbZIP19 and AtbZIP23 proteins were detected to be prokaryotic.
Keywords:Arabidopsis thaliana;AtbZIP19protein;AtbZIP23protein;prokaryoticexpression
转录因子(transcriptionfactor)是一类能与真核基因启动子区域中顺式作用元件发生特异性相互作用的DNA结合蛋白。而碱性亮氨酸拉链(basicleucinezipper,bZIP)蛋白是真核生物转录因子中分布广泛而且最保守的类型之一[1],从高等植物到哺乳动物中都发现了bZIP蛋白的存在[2]。根据碱性结构域以及其他保守的结构域[3],将拟南芥的75个bZIP类转录因子基因家族成员分为A、B、C、D、E、F、G、H、I和S类10个亚家族。植物bZIP转录因子参与多种生物学过程,包括器官和组织分化、细胞生长、碳氮能量代谢、折叠蛋白响应、种子储藏蛋白基因调节、糖代谢、生物和非生物胁迫等[4]。在大自然中生存的植物均面临各种各样的逆境胁迫,主要分为生物胁迫(如病虫害)和非生物胁迫(如低温、干旱及高盐等)2类。
近年来,越来越多的研究发现,bZIP转录因子在抵抗这些逆境胁迫时起着关键作用。有研究表明,AtbZIP19和AtbZIP23基因对拟南芥在低锌胁迫环境下的正常生长至关重要[5]。而文献[6]发现bZIP23转录因子还可以通过ABA依赖途径调节植物的生长发育和对非生物胁迫的耐性有着明显的作用,尤其是对抵抗干旱胁迫。本文克隆了AtbZIP19和AtbZIP23基因的cDNA,构建了2个基因的原核表达载体,对2种蛋白进行了诱导表达,为后续对这2个转录因子之间的相互作用及其对下游基因的调控研究奠定了基础。
1材料与方法
1.1 材料
1.1.1 实验材料
拟南芥(Arabidopsis thaliana)哥伦比亚野生型(Col-0), 购于美国拟南芥种质资源中心,由本实验室繁衍保存。
1.1.2 主要试剂
RevertAidFirstStrandcDNASynthesisKit反转录试剂盒、RNAisoPlus总RNA抽提试剂盒、限制性内切酶KpnⅠ 、HindⅢ和EcoRⅠ 、PrimeSTARMaxDNAPolymerase均购于Takara公司;T4DNA连接酶、EasyTaq、BL21(DE3)plysSChemicallyCompetentCell均购于北京TransGen公司;普通DNA产物纯化试剂盒、普通琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒均购于天根公司。
1.1.3 宿主菌和载体
感受态细胞Trans1-T1ChemicallyCompetentCell, 原核表达大肠杆菌菌株BL21(DE3)plysSChemicallyCompetentCell,原核表达载体pET-32a+。
1.2 方法
1.2.1 拟南芥植株培养
将Col-0用0.1%的氯化汞溶液消毒后点于MS固体培养基上,于4 ℃春化3d,最后置于光强度为 100μmol/(m2·s)、光周期为16/8 h、培养温度为23 ℃的条件下培养21 d[7]。
1.2.2 AtbZIP19、 AtbZIP23基因克隆
RNAisoPlus总RNA抽提试剂盒抽提组织中总RNA,详细方法见Takara试剂说明书。以总RNA为模板,用RevertAidFirstStrandcDNASynthesisKit反转录试剂盒合成cDNA。根据拟南芥信息资源网站(TAIR)中提供的基因cDNA序列,利用PrimerPremier5.0 软件设计引物,并正向和反向引物的5′端加上所需的酶切位点与保护碱基,即
AtbZIP19Fp:5′-NNNGAATTCATGGAAGACGGTGAGCTTGA-3′EcoRⅠ
AtbZIP19Rp:5′-NNNAAGCTTAACTGCTCTTGATGCACGATG-3′HindⅢ
AtbZIP23Fp:5′-NNNGGTACCATGGACGACGGTGAGCTTGA-3′KpnⅠ
AtbZIP23Rp:5′-NNNAAGCTTAACTGCTTTCGCTGCTCG-3′HindⅢ
以cDNA为模板用PrimeSTARMaxDNAPolymerase高保真扩增酶进行聚合酶链反应(PCR)扩增,程序如下:98 ℃预变性5min,98 ℃变性15s,58 ℃退火30s,72 ℃延伸45s,共30个循环,72 ℃延伸10min,4 ℃保存。PCR产物用1%琼脂糖凝胶进行电泳检测,并回收纯化目的条带。
1.2.3 原核表达载体的构建
载体与目的基因用相应的限制性内切酶进行双酶切,电泳检测并回收酶切产物。将回收后的载体与目的基因连接,连接产物转化至E.coliDH5α中,用含100μg/mL氨苄青霉素(Amp)的LB固体培养基筛选阳性克隆。
挑取单菌落于含100μg/mLAmp的LB液体培养基37 ℃培养8h,通过菌液PCR及测序验证正确后载体构建成功。
1.2.4 重组原核表达载体转入表达菌株
将重组质粒转入表达菌株BL21(DE3)plysSChemicallyCompetentCell,用含有100μg/mL氨苄青霉素(Amp)和20μg/mL氯霉素(Chl)的LB固体双抗培养基筛选阳性克隆。挑取单菌落,置于100μg/mLAmp-LB、20μg/mLChl双抗液体培养基,37 ℃、O/N培养。菌液PCR验证。
1.2.5 蛋白诱导表达及 SDS- PAGE电泳检测
将转入表达载体的BL21菌株接种于含100μg/mLAmp的LB液体培养基在37 ℃、O/N培养,然后加入异丙基硫代半乳糖苷(IPTG),30 ℃继续培养2~3h,诱导表达目的蛋白。取少量100μL菌液,5 000r/min离心,去上清,用上样缓冲液重悬菌体,沸水浴10min。制胶上样,50V浓缩30min,然后100V分离1h。考马斯亮蓝(R250)染料染色10min后脱色液脱色,置于脱色摇床上过夜脱色,根据脱色情况更换脱色液[8]。
2结果与分析
2.1 PCR扩增目的基因
提取野生型拟南芥植株总RNA,用反转录试剂盒反转录为cDNA,以cDNA为模板扩增AtbZIP19和AtbZIP23基因。AtbZIP19基因如图1a所示,CDS长度为786bp,AtbZIP23基因如图1b所示,CDS全长为750bp。
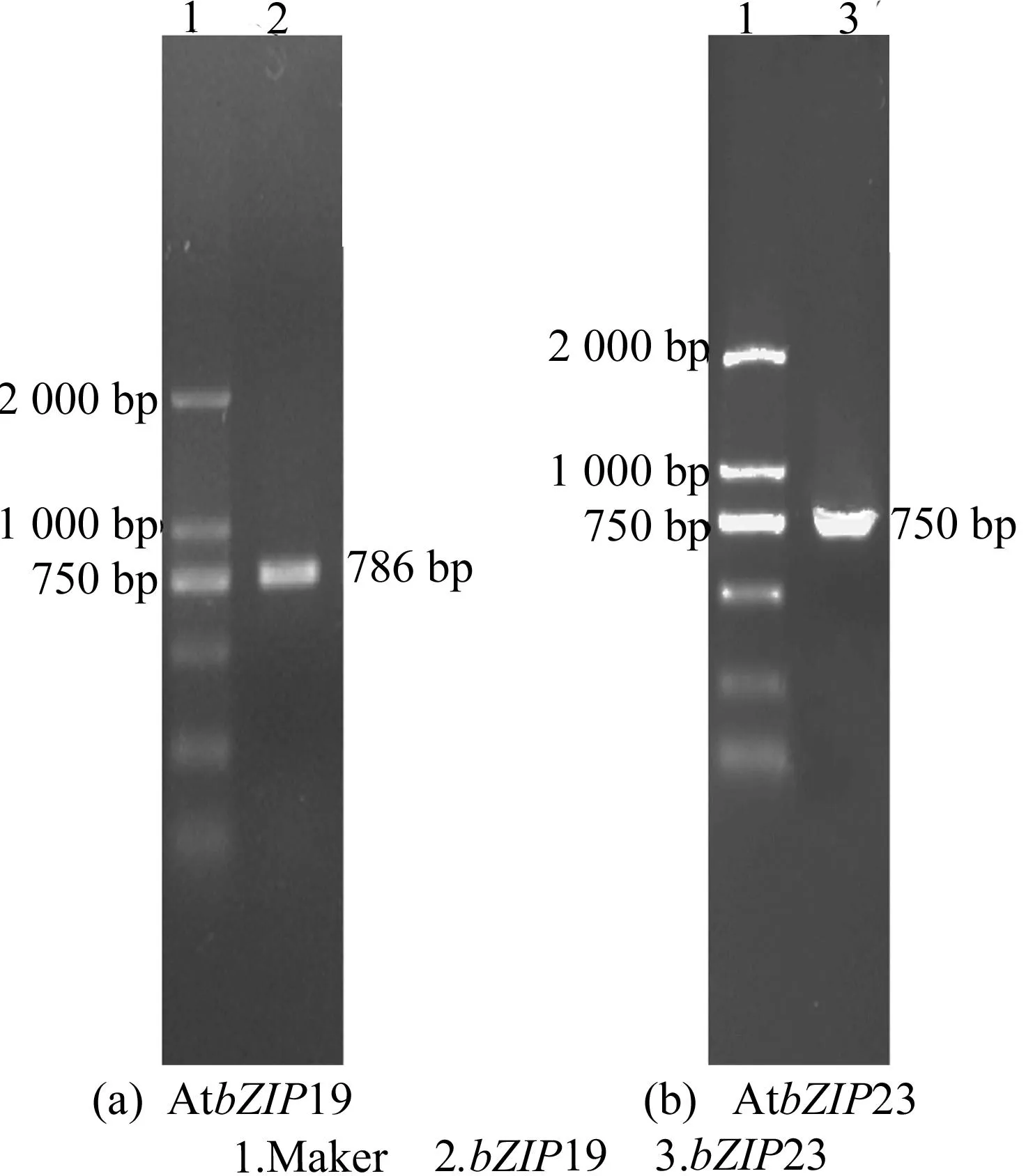
图1 电泳检测 PCR扩增目的片段
2.2 目的基因与 pET-32 a +进行双酶切
用EcoRⅠ、HindⅢ组合和KpnⅠ、HindⅢ组合分别完全双酶切pET-32a+载体,酶切后的pET-32a+载体如图2所示。

图2 质粒与目的基因的双酶切结果
由图2可知,载体约为5 900bp。用EcoRⅠ、HindⅢ组合完全双酶切AtbZIP19,用KpnⅠ、HindⅢ组合完全双酶切AtbZIP23,酶切后电泳条带如图2所示。
2.3 目的基因连接转化与菌液 PCR验证
将双酶回收所得的含有黏性末端的目的基因片段和酶切回收后含有黏性末端的原核表达载体相连[9],用T4DNA连接酶于25 ℃连接10min,然后立即转化Trans1-T1感受态细胞,经活化后涂布于含有Amp(100μg/mL) 抗性的LB平板上,阳性菌落可在10~12h后长出。挑取单菌落,置于100μg/mLAmp-LB液体培养基,37 ℃、O/N培养。挑取单菌落于LB中扩培,以菌液为模板进行菌落PCR,电泳检测分析。AtbZIP19和AtbZIP23的菌液PCR结果如图3所示,均为阳性克隆。

图3 重组质粒菌液 PCR电泳图
2.4 目的蛋白的表达
将重组质粒转入大肠杆菌BL21(DE3) 中,经1mmol/LIPTG诱导蛋白表达,结果如图4所示。

图4 目的蛋白诱导表达结果
SDS-PAGE结果显示,经IPTG诱导4h后,与空质粒相比,含重组质粒的菌液出现45.0kDa左右的蛋白条带,与目的蛋白大小47.1kDa和45.8kDa理论值一致,表明目的蛋白在大肠杆菌中表达成功。
3讨论
植物bZIP转录因子在植物的生命过程中具有非常重要的作用,bZIP不仅参与调控植物的生长发育过程,还参与调控植物抵抗恶劣的自然环境, 诸如重金属胁迫、病原菌的入侵、高盐、干旱、寒冷等不利条件[10]。AtbZIP19和AtbZIP23基因参与了植物对逆境胁迫的应答调节,为了更进一步地探索这2个转录因子参与了哪一个信号通路,则需要找到它们作用的下游靶基因。AtbZIP19和AtbZIP23在bZIP家族中有很近的亲缘关系[11],所以可能会形成二聚体来增强对下游靶基因的调控作用。
本研究获得目的基因后,构建原核表达重组质粒,并在大肠杆菌中成功诱导表达,为后续的凝胶迁移或电泳迁移率实验及蛋白相互作用实验做了基础工作。同时该研究也为探索AtbZIP19和AtbZIP23转录因子参与调控植物抵抗逆境胁迫时介导的信号途径打下了基础。
[参考文献]
[1]NiuXiping,Renshaw-GeggL,MillerL.BipartitedeterminantsofDNA-bindingspecificityofplantbasicleucinezipperprotein[J].PlantMolecularBiology,1999,41(1):1-13.
[2]LambP,McKnightSL.Diversityandspecificityintranscriptionalregulation:thebenefitsofheterotypicdimerization[J].TrendsinBiochemSci,1991,16(11):417-422.
[4]WangJizhou,ZhouJunxia,ZhangBaolan,etal.Genome-wideexpansionandexpressiondivergenceofthebasicleucinezippertranscriptionfactorsinhigherplantswithanemphasisonsorghum[J].JournalofIntegrativePlantBiology,2011,53(3):212-231.

[6]FukaoT,LiZX.Geneticmechanismsconferringadaptationtosubmergenceanddroughtinrice:simpleorcomplex?[J].CurrentOpinioninPlantBiology,2013,16(2):196-204.
[7]高英杰,张玮,赵军锋.拟南芥的室内培养技术进展[J].新乡学院学报,2008,25(4):45-48.
[8]SambrookJ,RussellDW.分子克隆实验指南[M].第3版.黄培堂,王嘉玺,朱厚础,等,译.北京:科学出版社,2002:26-395.
[9]吕申超,王海涛,鱼斌,等.拟南芥HIS1-3基因克隆及表达载体构建[J].合肥工业大学学报:自然科学版,2012,35(1):120-123.
[10]LiuLiansen,WhiteMJ,MacRaeTH.Transcriptionfactorsandtheirgenesinhigherplants[J].EurJBiochem,1999,262(2):247-257.
(责任编辑闫杏丽)

《合肥工业大学学报(自然科学版)》重要启事
《合肥工业大学学报(自然科学版)》的在线投稿网址为http://xbzk.hfut.edu.cn,这是本刊唯一网址,敬请广大作者使用该网址投稿。
2014年下半年以来,在互联网上出现的所谓“《合肥工业大学学报》官方首页”“合肥工业大学学报(自然科学版)杂志社官方网站”等类似信息网站均不是本刊网址。
