急性持续热应激对兔血浆补体C3、溶菌酶含量及抗菌活性的影响
2015-12-31黄光远熊权鑫杨晓炼黄庆洲
赵 川,黄光远,熊权鑫,杨晓炼,黄庆洲
(西南大学荣昌校区动物医学系,重庆 荣昌 402460)
为探讨急性持续热应激对肉兔抗病机能的影响,本试验观察了急性持续高温对肉兔血浆补体C3、溶菌酶含量及血浆抗菌活性的影响,现将结果报告如下:
1 材料与方法
1.1 主要药品 补体C3含量测定药盒(批号:20141117),测试盒主要包括Tris缓冲液、PEG6000、C3抗血清;溶菌酶含量测定药盒(批号:20140917),测试盒包括菌粉、菌粉溶剂、溶菌酶标准品等。以上药盒均由南京建成生物工程研究所生产。
1.2 试验用标准肠杆菌 ATCC25922株,购于中国兽医药品监察所。
1.3 主要仪器 紫外可见分光光度计,电热鼓风恒温干燥箱,立式自动电热压力蒸汽灭菌器,超声波清洗机,电热恒温水槽,低温离心机,-40℃低温冰箱,格力空调,微量移液器,肝素锂一次性真空采血管、干湿温度计、玻璃匀浆器。
1.4 试验动物 70~80日龄成年新西兰健康肉兔16只,雄性,体重2~2.5kg/只。由西南大学荣昌校区动物科提供。
1.5 动物饲料 精深兔料860ZQA兔配合饲料,由成都某农牧发展有限公司生产,批号为20140624。其中粗蛋白质≥16.0%、粗纤维10.0%~12.0%、粗灰分≤10.0%、粗脂肪≥2.0%、钙0.5%~1.0%、钙磷比(%)2∶1、氯化钠 0.5%、水分≤12.5%、赖氨酸≥0.7%、消化能≥10.47MJ/kg。每千克饲料中主要微量元素的含量:铜(Cu)≤40mg、铁(Fe)≥80mg、锌(Zn)≥60mg;每千克饲料中主要维生素的含量:维生素A≥9000IU、维生素D≥900IU、维生素E≥40IU。
2 试验方法
2.1 动物分组 试验于2014年7月7日至20日在西南大学荣昌校区动物房内进行。将健康肉兔16只移入普通立体兔笼饲养,每笼两只,自由采食和饮水。试验期间外界环境温度为27~32℃,在常规饲养一周,采食、饮水无异常情况后,转入正式试验。将肉兔随机分为热应激组(舍温控制在35±1℃)和适温组(舍温控制在24±1℃),每组8只,每组单独饲养。
2.2 饲舍温度控制及热应激处理时间 热应激组:用200W红外线保温灯泡加热,于试验当天8:00开始逐渐升温,至当日12:00饲舍温度达到35±1℃(空气湿度变化范围为65%~75%),高温持续时间为72h;适温组:用空调降温,于试验当天8:00开始逐渐降温,至当日12:00饲舍温度达到24±1℃(空气湿度变化范围为65%~75%),适温持续时间也是72h。
2.3 饲养方式 肉兔自由采食和饮水,每日上午8:00、18:00各饲喂1次。试验期间测定兔采食、呼吸、心率、体温等常规生理指标。
2.4 血浆的收集及保存 正式试验从早上8:00开始,每隔 24 h后(即第 2 d早上 8:00),用肝素锂真空采血管于兔的后肢外侧静脉采抗凝血5 mL,4℃、3000r/min离心5min,收集血浆,分装于1.5mL指形管(0.5mL/管),-40℃保存,1月内待测。
2.5 血浆抗菌活性的测定 血浆抗菌活性测定采用王雷等[1]的改进方法进行。将标准肠杆菌用0.1mmol/L的磷酸钾盐缓冲液(pH 6.4)配成一定浓度的悬浊菌液(D570nm=0.3~0.5)。取 3mL该菌液与 50μL待测血浆于试管中混匀,测定其保温前在570nm处的光密度值(D0),然后置于 37℃水浴 30 min,取出后立刻置冰浴中10min终止反应,测定其保温后在570nm处的光密度值(D)。抗菌活力U按下式计算:U=[(D0-D)/D]1/2,菌液OD值每分钟下降0.001定义为一个活性单位。
2.6 血浆溶菌酶含量的测定
2.6.1 试剂配制 (1)贮备菌液的配制。取5mg/支菌粉1支,倒入匀浆管中,加菌粉溶剂1 mL,用玻璃匀浆器轻轻缓慢旋转研磨3min(切勿溅出),即得贮备菌液。将其取出后置2~8℃冰箱密封保存,一周左右内备用。
(2)应用菌液的配制。按贮备菌液与菌粉溶剂比例1∶19进行配制,现用现配,用时摇匀。
(3)溶菌酶标准品的配制。溶菌酶标准品贮备液的配制:在每支溶菌酶标准品内准确加入1.0mL双蒸水,即配成2 mg/mL溶菌酶标准品贮备液(2~8℃保存)。标准品应用液的配制:先将溶菌酶标准品贮备液用双蒸水10倍稀释至20μg/mL后,再倍比稀释至2.5μg/mL,即得溶菌酶标准品应用液,现用现配(2~8℃保存)。
2.6.2 溶菌酶含量测定 采用空白对照法测定溶菌酶含量,操作步骤见表1。

表1 空白对照法测定溶菌酶含量 mL
将表1中各管溶液分别混匀,37℃准确水浴15min,立即取出置于0℃以下的冰水浴中3min,逐管取出倒入1mL光径比色皿中,530nm处以双蒸水调透光度100%,比色,测各管透光度T15(T15即37℃水浴15min后的透光度值)。按下面公式计算溶菌酶含量:
溶菌酶含量(μg/mL)=[(测定透光度UT15-空白透光度OT15)/(标准透光度ST15-空白透光度OT15)]×2.5。2.5为标准品浓度(μg/mL)。
2.7 补体C3含量的测定 采用免疫比浊法进行,具体操作方法见补体C3含量测定药盒的使用说明书。
2.7.1 标准曲线的建立 将低温保存的特种蛋白校准品室温下平衡20min,准确加入生理盐水1mL溶解,即为1mg/mL蛋白校准液,再用生理盐水按表2稀释比例配成不同浓度的特种蛋白溶液。在波长340nm处用分光光度计测定OD值,以标准品浓度为X轴,吸光度OD值为Y轴,通过ELISACalc软件建立标准曲线。

表2 校准程序
2.7.2 样品C3含量的测定 将低温保存的样品常温解冻,3h内进行。操作步骤按表3进行。

表3 C3含量的测定步骤
2.8 统计分析 试验数据采用SPASS15.0统计软件进行显著性检验,结果用平均值±标准差(±S)表示。
3 试验结果
3.1 急性持续热应激下肉兔心率、呼吸频率、体温的变化 与适温组比较,热应激24h后心率呈增高趋势,但差异不显著(P>0.05),48h后极显著高于适温组(P<0.01),72 h后组间差异不显著(P>0.05);呼吸频率和体温的变化趋势基本一致,热应激24、48、72h后,组间差异显著或极显著。热应激组内不同时间点的比较:热应激24h后的呼吸频率与48、72h后比较差异极显著(P<0.01),24、48h的体温与72h比较差异极显著(P<0.01)。具体变化见表4。
表4 各组肉兔的心率、呼吸频率、体温变化情况(±S)
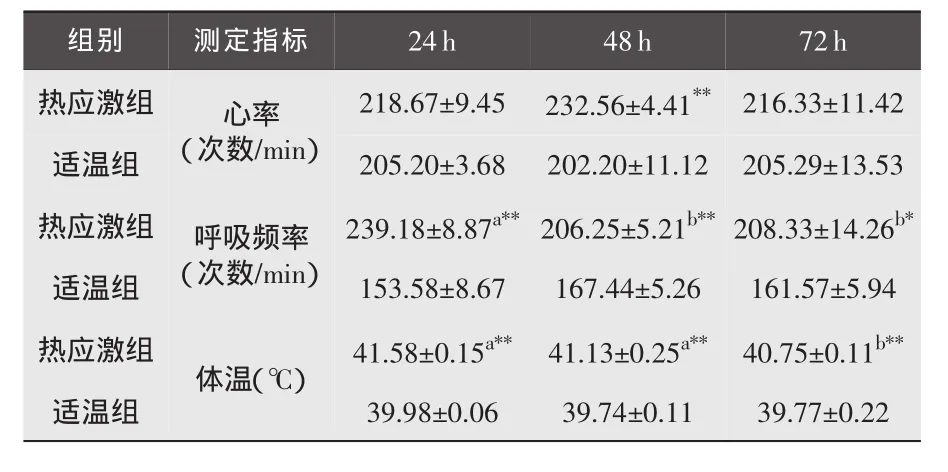
表4 各组肉兔的心率、呼吸频率、体温变化情况(±S)
注:肩标*表示同一时间点组间比较(**表示P﹤0.01,*示P<0.05);肩标字母表示组内不同时间点比较(不同字母表示差异显著或极显著,相同字母表示差异不显著P>0.05)。 下同。
组别 测定指标24h 48h 72h热应激组218.67±9.45232.56±4.41**216.33±11.42适温组心率(次数/min)205.20±3.68202.20±11.12205.29±13.53热应激组239.18±8.87a**206.25±5.21b**208.33±14.26b*适温组呼吸频率(次数/min)153.58±8.67167.44±5.26161.57±5.94热应激组41.58±0.15a**41.13±0.25a**40.75±0.11b**体温(℃)适温组39.98±0.0639.74±0.1139.77±0.22
3.2 不同急性持续热应激时间对肉兔采食量的影响热应激组采食量在24、48、72h时均极显著低于适温组(P<0.01),组内不同时间点肉兔采食量的差异均不显著(P>0.05)。具体结果见表 5。
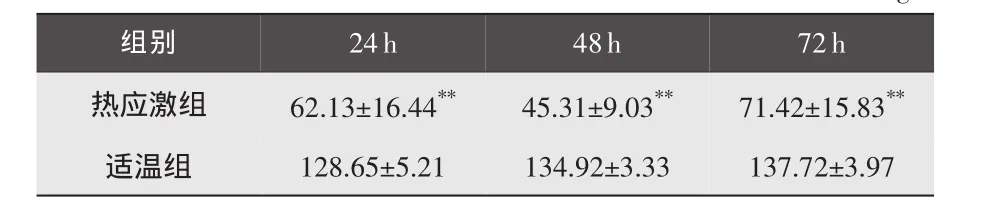
表5 各组肉兔试验期间的采食量变化 g/d
3.3 肉兔血浆抗菌活性的变化情况 与适温组比较,热应激 24h后差异极显著(P<0.01),48、72h时差异不显著;热应激24h后与热应激48、72h后相比差异显著(P<0.05)。具体结果见表6。

表6 各组肉兔试验期间的血浆抗菌活性变化 U
3.4 肉兔血浆溶菌酶含量变化 与适温组比较,热应激组在热应激24 h后差异极显著(P<0.01),热应激 48、72h后差异不显著(P>0.05),但均值均高于适温组;热应激组内不同时间点比较,热应激后24、48、72h,溶菌酶含量呈降低趋势,但不同时间点间差异不显著(P>0.05)。具体结果见表7。

表7 各组肉兔试验期间的血浆溶菌酶含量变化 μg/mL
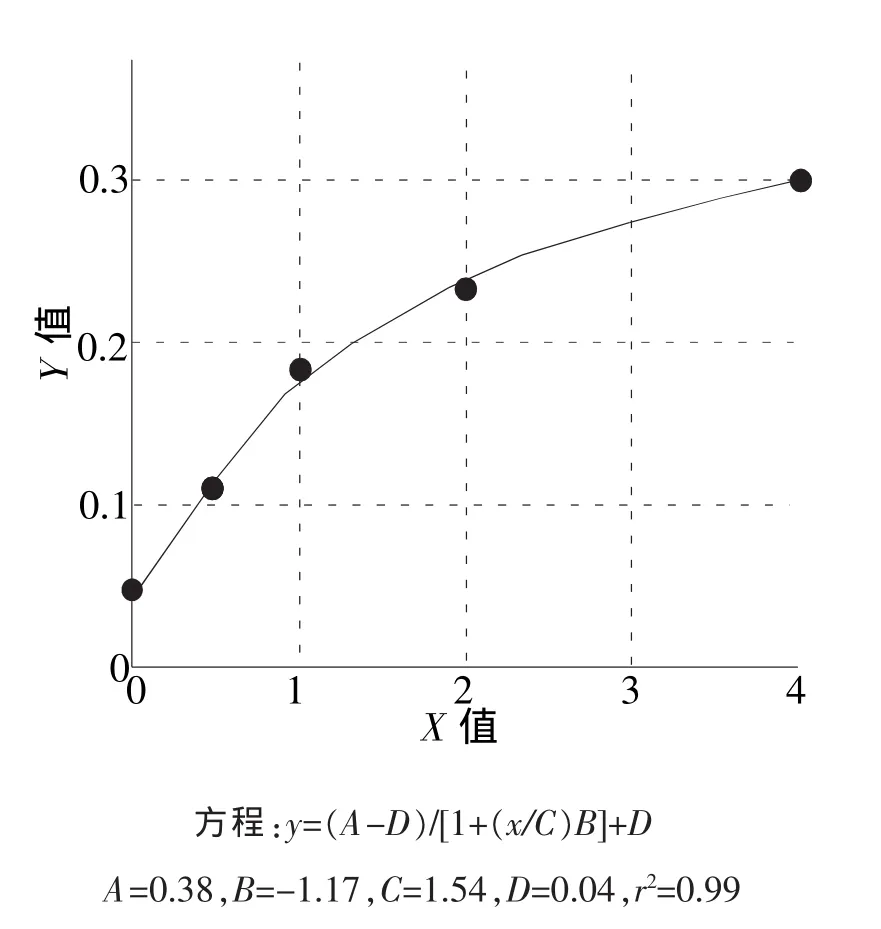
图1 C3含量标准曲线图
3.5 肉兔血浆补体C3含量的变化
3.5.1 补体C3含量标准曲线 以标准品浓度为X轴,吸光度OD值为Y轴,建立标准曲线,结果见图1。
3.5.2 补体C3含量的变化 与适温组比较,热应激24、48 h 后组间差异均不显著(P>0.05),热应激 72 h后差异显著(P<0.05);热应激组内比较,热应激24h后与48h后差异不显著(P>0.05),48h后与72h后差异显著(P<0.05)。结果见表 8。
表8 各组肉兔各时间点的血浆补体C3含量变化(±S)
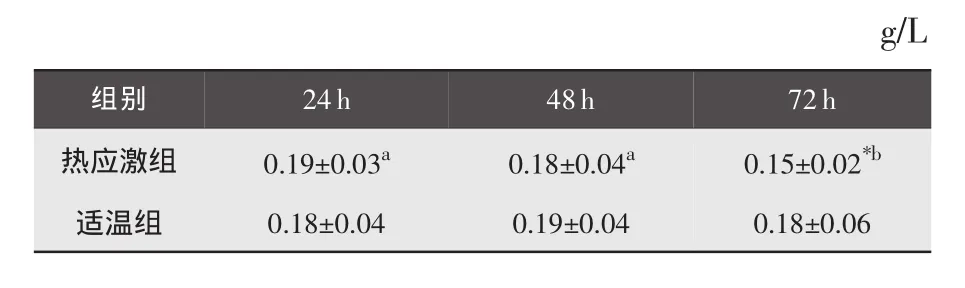
表8 各组肉兔各时间点的血浆补体C3含量变化(±S)
g/L组别 24h 48h 72h热应激组 0.19±0.03a 0.18±0.04a 0.15±0.02*b适温组 0.18±0.04 0.19±0.04 0.18±0.06
4 分析与讨论
4.1 本试验表明,35℃急性持续热应激下肉兔的心率、呼吸频率、体温整体呈升高变化,但采食量明显减少。其发生原因与动物热应激时中枢神经及外周交感神经兴奋性增强,中枢及外周血液中去甲肾上腺素及肾上腺素分泌迅速增加,导致摄食中枢抑制、胃肠运动减弱、心率加快有关[2]。
4.2 血浆溶菌酶含量、防御素、抗菌活性等是机体抗病力高低的重要指标,其中溶菌酶因其能非特异性地破坏或溶解进入机体微生物细胞壁而得名,这些物质含量或活性的变化与机体抗病能力密切相关。本试验结果表明,兔热应激24h后,血浆抗菌活性及溶菌酶活性均呈增高变化,而热应激48、72h后又基本恢复正常,提示肉兔热应激早期可能处于防御机制的快速动员期,表现为抗应激能力及抗病力迅速增强,但随着热应激持续时间延长,血浆抗菌活性及溶菌酶活性变化呈恢复趋势,可能与动物热适应或抗病力减弱有关。关于热应激对血浆溶菌酶及抗菌活力变化的影响,国内外报道得较多,但结果不尽相同。本试验与陈昌福等[3]、赵萌等[4]的研究结果基本类似,即:血浆抗菌活性及溶菌酶含量呈先升高后降低的变化趋势。
4.3 补体是存在于血清中的一组具有酶样活性的球蛋白,正常情况下补体蛋白多以非活化的蛋白前体存在于血清[5]。补体系统在体内具有一套有效的免疫效应机制,具有杀菌、溶菌作用,并辅助和加强吞噬细胞和抗体的防御功能,是重要的非特异性免疫因子[6]。补体C3是补体系统的核心,血清中C3含量变化常与补体总量相平行,临床上常作为检测补体系统功能的主要指标,补体C3水平降低常反映机体免疫功能受损[7]。本试验表明,在热应激早期补体C3含量基本稳定,但中后期迅速降低。本试验结果与张崇英等[8]报道的热应激对锦鲤血清中C3含量的影响基本一致。
5 结论
肉兔在急性热应激早期,抗病力会迅速增强,但中、后期抗病力或非特异性免疫力呈逐渐降低之势。
[1] 王雷,李光友,毛远兴,等.中国对虾血淋巴中的抗菌、溶菌活力与氧化酶活力的测定及其特性研究[J].海洋与湖沼,1995(2):179-185.
[2] 曾炯,黄兴国,邬理洋,等.肉鸡热应激机理及研究进展[J].江西饲料,2009(6):1-4.
[3] 陈昌福,罗宇良,蔡冰.饲养水温对草鱼溶菌酶活性的影响[J].中国水产科学,1996(3):25-31.
[4] 赵萌,宋琦如,戴广政.长期高温环境对大鼠免疫系统影响的研究[J].职业与健康,2014(18):2568-2570.
[5] 崔治中.兽医免疫学[M].北京:中国农业出版社,2004:70-80.
[6] 高晨,张建生,丁永忠,等.重型颅脑损伤患者血清免疫球蛋白和补体C3、C4的动态变化及临床意义 [J].中国急救医学,2006,26(12):895-898.
[7] 甘慧,杨军,孙萍,等.人类补体C3研究进展[J].国际检验医学杂志,2004,25(6):519-521.
[8] 张崇英,邢薇,李铁梁,等.热应激对大正三色锦鲤非特异性免疫指标及HSP70基因表达的影响[J].水产学报,2013,36(3):336-339.
