脂联素在重症急性胰腺炎脂肪组织中的表达及意义
2015-12-31韩超群
韩超群,杨 芬,刘 俊,钱 伟,丁 震
华中科技大学同济医学院附属协和医院消化内科,湖北 武汉430022
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床上常见危重症,其病情发展迅速,早期即可出现多器官功能障碍综合征(MODS),死亡率高达20% ~30%[1]。肥胖不仅作为急性胰腺炎的独立危险因素,它同时还增加急性胰腺炎的死亡率[2],但其机制尚未完全清楚,脂肪组织作为储脂器官,同时也分泌一系列脂肪因子和细胞因子,本研究主要探讨脂肪细胞因子脂联素(diponectin)及部分炎症因子在SAP 脂肪组织中的表达、作用及可能的意义。
1 材料与方法
1.1 材料及试剂 12 只SD 雄性大鼠购自华中科技大学同济医学院动物中心,牛磺胆酸钠购自ACROS ORGANICS,Trizol 购自invitrogen 公司,反转录试剂盒购自TaKaRa 公司,聚合酶链式反应PCR 扩增试剂盒购自QIAGEN 公司。
1.2 分组及模型制备 12 只SD 大鼠体质量240 ~350 g,平均体质量290 g,称重编号后随机分为2 组:假手术对照组(N 组)、SAP 组,每组6 只。实验前SD大鼠禁食不禁水,SAP 组采用1%戊巴比妥钠4 ml/kg腹腔麻醉、开腹,胰胆管推注5% 牛黄胆酸钠1 ml/kg制成SAP 模型,N 组SD 大鼠开腹后不经胰胆管推注5%牛黄胆酸钠,仅翻动十二指肠及胰腺组织数次后关腹。2 组分别于24 h 内处死取附睾旁脂肪组织。
1.3 脂肪组织内脂联素、IL-10、TGF-β1、TNF-α 表达的检测 用Trizol 提取脂肪细胞内的RNA(将混有Trizol 的脂肪组织研磨均匀放置5 min 并4 ℃、12 000 r/min 15 min 离心后EP 管最上层为油脂,尽量吸除油脂,提高纯度,氯仿可重复1 次)。RT-PCR 法检测mRNA 表达量,PCR 反应条件:95 ℃10 min、95 ℃15 s、60 ℃1 min,40 个循环。引物由上海英骏公司合成,序列如下:GAPDH 上游:TCTTCCAGGAGCGAGATCCC,下游:TTCAGGTGAGCCCCAGCCTT;脂联素上游:CTGGCTCCAAGTGTATGGGG,下游:TTTGATTCTCGGG GCTACGG;IL-10 上游:AGAAGGACCAGCTGGACAACAT,下 游:CAAGTAACCCTTAAAGTCCTGCAGTA;TGF-β1 上游:AACTACTGCTTCAGCTCCAC,下游TGTGTCCAGGCTCCAAATGTA;TNF-α 上游:CCGATTTGCCACT TCATACCA,下游:TAGGGCAAGGGCTCTTGATG。
1.4 脂肪组织病理学检查 取脂肪组织4%多聚甲醛固定,冰冻切片并行HE 染色。
1.5 统计学分析 采用SPSS 19.0 统计软件进行分析,采用单因素方差分析,所有数据用s 表示,P <0.05 为差异有统计学意义。
2 结果
2.1 脂肪组织肉眼改变 N 组:大鼠腹腔见极少量黄色腹水,附睾旁脂肪组织大致正常;SAP 组:腹腔可见少量血性腹水,附睾旁脂肪组织及周边脏器见大量皂化斑。
2.2 脂肪组织光镜下病理改变 N 组:脂肪组织大致正常;SAP 组:脂肪组织见周围毛细血管增生及单核巨噬细胞浸润增加。

图1 脂肪组织肉眼改变 A:N 组;B:SAP 组;图2 脂肪组织光镜下病理改变(HE 400 ×) A:N 组;B:SAP 组Fig 1 Adipose tissue changes by macroscopic observation A:N group;B:SAP group;Fig 2 Hispathological changes of adipose tissue (HE 400 ×) A:N group;B:SAP group
2.3 脂肪组织脂联素及炎症因子的表达
2.3.1 脂肪组织炎症因子的表达:与N 组相比,SAP 组促炎因子TNF-α 及IL-10 上升明显(P <0.05);抑炎因子TGF-β1 显著下降,差异有统计学意义(P <0.05)。
表1 两组脂肪组织炎症因子IL-10、TGF-β1、TNF-α 表达水平比较(ng/L,s)Tab 1 Comparison of expression levels of IL-10,TGF-β1,TNF-α between two groups (ng/L,s)
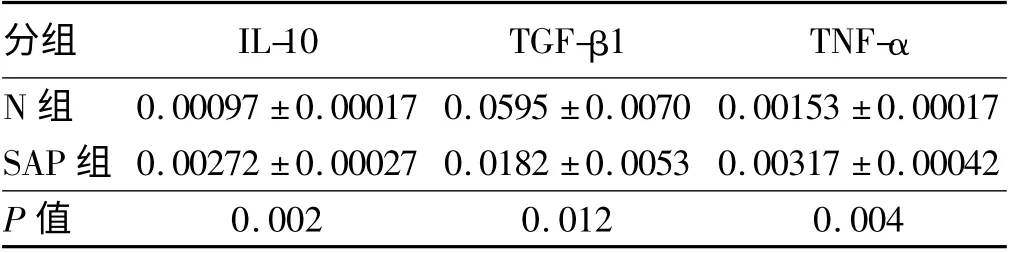
表1 两组脂肪组织炎症因子IL-10、TGF-β1、TNF-α 表达水平比较(ng/L,s)Tab 1 Comparison of expression levels of IL-10,TGF-β1,TNF-α between two groups (ng/L,s)
分组 IL-10 TGF-β1 TNF-α N 组 0.00097±0.00017 0.0595±0.0070 0.00153±0.0 0017 SAP 组 0.00272±0.00027 0.0182±0.0053 0.00317±0.00042 P 值0.002 0.012 0.004
2.3.2 脂肪组织脂联素的表达:与N 组相比,SAP 组脂联素下降明显,差异有统计学意义(P <0.01,见图3)。
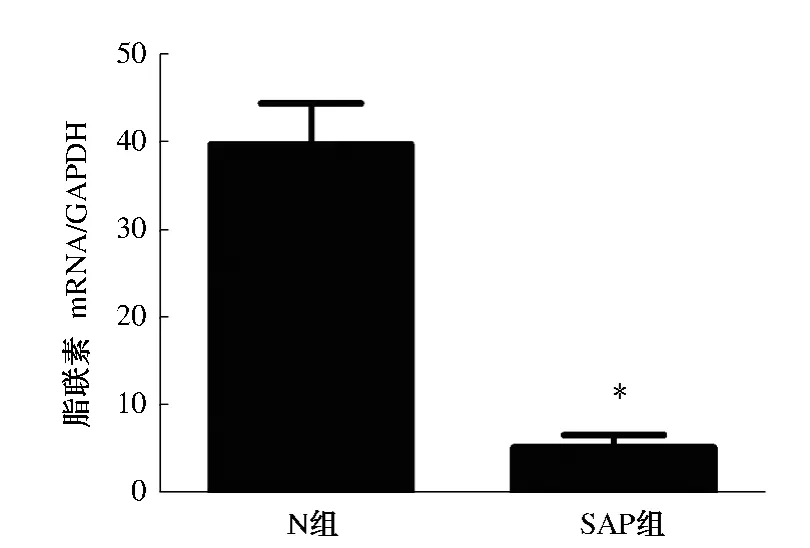
图3 脂肪组织脂联素的表达 A:N 组;SAP 组Fig 3 The expression levels of adiponectin in the adipose tissues of normal and SAP group A:N group;B:SAP group
3 讨论
目前普遍认为SAP 发生、发展的机制是各种病因导致一系列细胞因子、免疫细胞及补体系统参与的炎症级联放大效应,这些细胞因子和炎症介质呈网络交叉反应,协同形成对组织器官的损伤。TNF-α 主要由活化的单核-巨噬细胞产生,是SAP 发病机制中的启动介质,它可刺激促炎因子的表达、趋化、细胞死亡及内皮细胞活化[3]。IL-10 是一种重要的炎症负反馈调节因子,它能够抑制单核-巨噬细胞、T 细胞的激活和效应功能,抑制TNF-α、IL-6 等促炎细胞因子的合成[4]。TGF-β1 是一种具有多重生物学活性的细胞因子,主要调节免疫、促进蛋白多糖、胶原蛋白等细胞外基质合成,抑制其降解,刺激结缔组织形成,它的表达对调控细胞增殖、分化、促进创伤修复及纤维化起重要作用。研究认为,由于全身炎症刺激及胰腺受损,静止的胰腺星形细胞(pancreatic stellate cells,PSC)被激活并转化为肌纤维母细胞,合成纤维连接蛋白、胶原等细胞外基质,促进创伤部位的纤维化[5],而TGF-β 能使PSC 发生转化激活[6]。本实验中,TGF-β1 在SAP 脂肪组织中高表达,高度提示TGF-β1 可能与胰腺再生及修复密切相关。
脂肪组织不再被认为是单一的储脂器官,更重要的是内分泌及免疫功能,它同时也分泌TNF-α、TGFβ1、IL-1、IL-6 等细胞因子[7-8]。肥胖是SAP 及其并发症的危险因素[2],其机制尚未完全清楚,研究脂肪组织具有迫在眉睫的意义,脂联素在SAP 脂肪组织中的表达国内外尚未有报道。脂联素由Scherer 等在1995年首次报道,是主要由脂肪细胞分泌、含量丰富的补体因子(C1q),它参与糖脂代谢、抗炎、抗动脉粥样硬化、调节免疫、防止内皮细胞功能紊乱等许多重要的生理过程[9]。文献报道,SAP 血脂联素浓度与正常组相比,明显下降[10];而上调脂联素受体能减轻SAP 的严重程度[11]。Araki 等[12]用基因敲除的方法证实缺乏脂联素基因的急性胰腺炎肥胖大鼠,其胰腺炎严重程度较正常胰腺炎组明显加重。本实验结果同样证实与正常对照组相比,SAP 组脂肪组织脂联素mRNA 低表达(P <0.0001),提示脂肪组织脂联素与SAP 的发病可能具有一定的关联性,脂联素在SAP 中起保护性作用。
脂联素可能通过以下几种途径发挥在SAP 中的作用:(1)脂联素通过cAMP-PKA 途径抑制NF-κB 磷酸化,从而抑制TNF-α 介导的NF-κB 活化,进而抑制其诱生的血管黏附分子(VCAM)-1、细胞间黏附分子(ICAM)-1 的表达,且存在剂量依赖性[13]。体外实验给予外源性TNF-α,脂肪组织中脂联素mRNA 的表达量显著下调,脂联素受体1 表达明显上升[14],进一步支持脂联素对TNF-α 的抑制作用。(2)抗炎因子IL-10 通过抑制NF-κB 通路的激活,在转录水平抑制炎性介质的产生[15],而脂联素能诱导人类单核细胞合成IL-10 及可溶性IL-1 受体拮抗剂,体外实验中,Evans、Kumada 等[2,16]用人重组脂联素培养人类单核细胞源性巨噬细胞,均以剂量依赖性显著增加IL-10 mRNA及蛋白水平。(3)脂联素通过AMPK 信号传导途径促进内皮细胞eNOS 磷酸化,增强eNOS 在内皮细胞的表达和活性,内皮细胞NO 的生成有助于抑制血管炎症反应[17]。(4)SAP 患者肠黏膜屏障遭到破坏,肠黏膜的通透性增高,内毒素通过门静脉进入体循环,发生肠源性内毒素血症[18],内毒素也可活化肥大细胞,脱颗粒释放组胺,进一步引起肠黏膜通透性增高,此种恶性循环是导致SAP 并发多器官衰竭的主要原因之一,而脂联素能够直接中和内毒素,并且降低脓毒败血症大鼠内毒素活性[19]。
脂肪组织作为内分泌及免疫组织,其所分泌的细胞因子对机体物质代谢、肥胖、SAP 及其并发症等有重要作用,脂肪细胞因子是衔接肥胖与SAP 之间重要的桥梁,深入认识脂联素在SAP 中的作用有可能为SAP的治疗开辟新的途径。
[1] Zhu HH,Jiang LL. Serum inter-cellular adhesion molecule 1 is an early markerof diagnosis and prediction of severe acute pancreatitis[J].World J Gastroenterol,2012,18(20):2554-2560.
[2] Evans AC,Papachristou GI,Whitcomb DC. Obesity andthe risk of severe acute pancreatitis[J]. Minerva Gastroenterol Dietol,2010,56(2):169-179.
[3] Malleo G,Mazzon E,Siriwardena AK,et al. Role of tumor necrosis factor-alpha in acute pancreatitis:from biological basis to clinical evidence[J]. Shock,2007,28(2):130-140.
[4] Grutz G. New insights into the molecular mechanism ofinterleukin-10-mediated immunosuppression[J]. J Leukoc Biol,2005,77(1):3-15.
[5] Masamune A,Shimosegawa T. Signal transduction in pancreatic stellate cells[J]. J Gastroenterol,2009,44(4):249-260.
[6] Gao X,Cao Y,Yang W,et al. BMP2 inhibits TGF-β-induced pancreatic stellate cell activation and extracellular matrix formation [J].2013,304(9):G804-G813.
[7] Simons PJ,van den Pangaart PS,van Roomen CP,et al. Cytokinemediated modulation of leptin and adiponectin secretionduring in vitro adipogenesis:evidence that tumor necrosisfactor-alpha-and interleukin-1beta-treated human preadipocytesare potent leptin producers[J]. Cytokine,2005,32(2):94-103.
[8] Tilg H,Moschen AR. Adipocytokines:mediators linkingadipose tissueinflammation andimmunity[J]. Nat Rev Immunol,2006,6(10):772-783.
[9] Antoniades C,Antonopoulos AS,Tousoulis D,et al. Adiponectin:from obesity to cardiovascular disease[J]. ObesRev,2009,10(3):269-279.
[10] Zyromski NJ,Mathur A,Pitt HA,et al. A murine model of obesity implicates theadipokine milieu in the pathogenesis of severe acutepancreatitis[J]. Am J Physiol Gastrointest Liver Physiol,2008,295(3):G552-G558.
[11] Al-Azzawi HH,Ziegler KM,Swartz-Basile DA,et al. Does adiponectin upregulation attenuate the severity of acute pancreatitis in obesity[J]. J Gastrointest Surg,2011,15(8):1394-1400.
[12] Araki H,Nishihara T,Matsuda M,et al. Adiponectin plays a protective role in caerulein-inducedacute pancreatitis in mice fed a high-fat diet[J]. Gut,2008,57(10):1431-1440.
[13] Ouchi N,Kihara S,Arita Y,et al. Adiponectin,anadipocyte-derived plasmaprotein,inhibits endothelial NF-kappaB signaling through a cAMPdependentpathway[J]. Circulation,2000,102(11):1296-1301.
[14] Hector J,Schwarzloh B,Goehring J,et al. TNF-alpha alters visfatin and adiponectin levels in human fat[J]. Horm Metab Res,2007,39(4):250-255.
[15] Dhingra S,Sharma AK,Arora RC,et al. IL-10 attenuates TNF-α induced NF-κB pathway activation and cardiomyocyte apoptosis[J].Cardiovasc Res,2009,82(1):59-66.
[16] Kumada M,Kihara S,Ouchi N,et al. Adiponectin specifically increasedtissue inhibitor of metalloproteinase-1 through interleukin-10 expression inhuman macrophages[J]. Circulation,2004,109(17):2046-2049.
[17] Ouchi N,Kobayashi H,Kihara S,et al. Adiponectin stimulates angiogenesis by promoting cross-talk between AMP-activated protein kinase and Aktsignaling in endothelial cells[J]. J Biol Chem,2004,279(2):1304-1309.
[18] Zhang J,Yuan C,Hua G,et al. Early gut barrier dysfunction in patients withsevere acute pancreatitis:attenuated by continuousblood purification treatment [J]. Int J Artif Organs,2010,33(10):706-715.
[19] Tsuchihashi H,Yamamoto H,Maeda K,et al. Circulating concentrationsof adiponectin,anendogenous lipopolysaccharide neutralizing protein,decrease in rats with polymicrobial sepsis [J]. J Surg Res,2006,134(2):348-353.
