姜黄素治疗肝纤维化与肝星状细胞的关系
2015-12-31叶国荣舒建昌杨小红
叶国荣,舒建昌,吕 霞,杨小红
暨南大学医学院附属广州市红十字会医院消化内科,广东 广州510220
肝纤维化是肝脏受到各种慢性损伤后发生的一种 修复反应,其特征是以胶原为主的细胞外基质(extracellular matrix,ECM)在肝内过多沉积。目前国、内外已有不少相关的报道表明姜黄素对肝纤维化具有治疗作用[1-4],本研究拟在我们既往研究的基础上进一步观察姜黄素治疗大鼠肝纤维化中活化肝星状细胞(hepatic stellate cells,HSC)的数目、分布、凋亡等的变化,并探讨两者间的关系。
1 材料与方法
1.1 主要药物和试剂 姜黄素购自国药集团化学试剂有限公司;丹参产于四川,为人工栽培,水煎配制为1.0 g/ml 灌胃液;四氯化碳(CCl4)购自天津市北宏试剂厂生产;食用花生油;羧甲基纤维素钠购自广州器化医疗设备有限公司(进口分装);苏木素、伊红购自美国Sigma 公司;Masson 三色胶原试剂盒购自福建迈新有限公司。小鼠抗α-SMA 单克隆抗体、小鼠抗Desmin单克隆抗体及原位细胞凋亡检测试剂盒均购自武汉博士德生物工程有限公司。
1.2 实验动物和动物模型的建立
1.2.1 SD 大鼠:SPF 级,雄性,共80 只,体质量180 ~230 g,由广州中医药大学实验动物中心提供[动物质量合格证号:SCXK (粤)2003-0001 粤监证字2005A031]。于广东省药物研究所标准SPF 实验室(合格证号:粤监证字2005C125 号)进行动物饲养及实验。
1.2.2 肝纤维化模型的建立:腹腔注射CCl40.025 ml(用花生油1∶6 稀释),3 次/周,共14 周。
1.3 动物分组及治疗 动物随机分为正常组(15只)、溶剂组(10 只)、姜黄素治疗组(按给药剂量的不同分为低、中、高剂量组,各10 只)、模型组(15 只)、丹参组(10 只)。正常组不予处理;溶剂组前8 周予腹腔注射花生油(每次0.15 ml/只),3 次/周,第9 周起予0.5%羧甲基纤维素钠灌胃,每次10 ml/kg,3 次/周,共6 周;姜黄素治疗组从第9 周起予姜黄素(剂量分别为每100 g 体质量10、20、40 mg)与0.5%羧甲基纤维素钠混悬后以10 ml/kg 灌胃,3 次/周,共6 周;模型组则自第9 周起予0.5%羧甲基纤维素钠灌胃,10 ml/kg,3次/周,共6 周;丹参组自第9 周起予丹参10 ml/kg 灌胃,3 次/周,共6 周。
1.4 观察项目 于第8 周末处死正常组及模型组各5 只大鼠,进行血清及病理检测观察造模效果。14 周动物实验结束后,留取部分肝组织于10 g/L 中性甲醛液固定。
肝组织按常规方法行HE 染色,参照试剂盒方法行Masson 三色胶原染色,光镜下观察肝脏的病理改变,并按照肝纤维化半定量计分系统(SSS)方法,对各组大鼠肝纤维化程度评分,得分越高,表示纤维化程度越重;最高29 分,最低0 分[1]。SABC 免疫组化法检测肝组织α-SMA。采用专业显微图像分析软件(Axio-Vision,4.5 版,Germany)进行图像分析。
HSC 凋亡检测及鉴定:参照试剂盒说明书进行TUNEL 染色后,继续将切片于0.01 mol/L 柠檬酸缓冲液中微波煮沸修复10 min,常温冷却,蒸馏水洗2 min ×3次,加正常山羊血清室温封闭20 min,甩去多余液体,直接加小鼠抗Desmin 单克隆抗体(稀释度1 ∶100)50 μl,以PBS 代替一抗作为阴性对照,4 ℃冰箱过夜,同上洗涤,滴加生物素化山羊抗小鼠IgG 于37 ℃温箱中孵育20 min,同上洗涤,滴加SABC 试剂室温孵育20 min,PBS 洗4 次,每次5 min,新鲜配置的DAB 显色,显微镜下控制反应时间,终止反应,蒸馏水洗,核固红复染30 min,蒸馏水洗后,水溶性封片剂封片。显微镜下观察并计数HSC 凋亡数目,计算凋亡指数:(每100 个细胞中凋亡细胞的数目÷100)×100%。
1.5 统计学处理 采用SPSS 12.0 统计软件进行处理,数据用±s 表示,多组数据间比较采用单因素方差分析(One-Way ANOVA),进行方差齐性检验,若各组总体方差齐,采用Tukey(n >5)检验;若各组总体方差不齐,采用Tamhane’S T2 检验。P <0.05 为差异有统计学意义。
2 结果
2.1 造模效果 实验过程中,80 只SD 大鼠有3 只死亡,死亡率3. 75%,其中低姜黄素组1 只,模型组2只。比较第8 周末处死的正常组及模型组大鼠,模型组大鼠肝脏大体观色泽偏暗,表面欠光滑,体积未见明显变化,肝脏边缘变纯,质地较实,有结节感;血清ALT、AST、HA、LN、PC-Ⅲ明显升高;病理切片观察有较多纤维生成,证实肝纤维化形成,造模成功。
2.2 肝组织病理 HE 染色见正常组与溶剂组肝小叶结构完整,肝索排列整齐,无变性、坏死,无炎症细胞浸润;模型组肝小叶结构被破坏,肝索排列紊乱,有炎症细胞浸润,肝细胞水肿、脂肪变性明显,部分可见假小叶形成;高姜黄素治疗组及丹参组可见汇管区有少量的纤维组织增生,未见假小叶形成,有少量炎症细胞浸润,肝细胞水肿、脂肪变性明显减轻;低姜黄素治疗组与模型组比较,差异无统计学意义(P >0.05);中姜黄素治疗组情况介于低、高姜黄素治疗组之间(见图1)。
Masson 胶原染色:正常组与溶剂组肝组织结构完整,仅在汇管区有极少量胶原纤维存在,肝小叶间未见纤维组织增生,无假小叶形成;模型组见汇管区大量胶原纤维增生,增生的胶原纤维形成纤维分隔,破坏肝小叶结构,分割、包绕肝小叶,有假小叶形成;高姜黄素治疗组及丹参组胶原纤维明显减少,只见汇管区有较多的纤维组织增生,少部分见胶原向周边延伸,无假小叶存在;低姜黄素治疗组与模型组比较,差异无统计学意义(P >0.05);中姜黄素冶疗组情况介于低、高姜黄素治疗组之间(见图2)。
按照肝纤维化半定量评分方法,单盲读片并予以评分。结果显示:正常组、溶剂组得分比较,差异无统计学意义(P >0.05);与正常组、溶剂组比较,模型组肝纤维化评分明显升高(P =0.000);低姜黄素治疗组得分与模型组比较,差异无统计学意义(P >0.05);中姜黄素治疗组、高姜黄素治疗组、丹参组得分呈不同程度降低,与模型组比较,差异均有统计学意义(P <0.01,见表1)。
2.3 α-SMA 免疫组织化学染色 阴性对照片背景洁
净,无非特异性染色,阳性对照片可见阳性表达。正常组、溶剂组血管壁可见少量α-SMA 阳性表达,胆管壁不表达;模型组α-SMA 阳性表达细胞数明显增多,主要分布于门静脉、汇管区血管壁、纤维间隔、少量表达于邻近的肝实质窦周间隙、偶见于中央静脉壁,呈长椭圆形或梭形;低姜黄素治疗组、中姜黄素治疗组、高姜黄素治疗组α-SMA 阳性表达量逐渐减少,可见于血管壁,汇管区;丹参组阳性表达与高姜组类似(见图3)。各组图像分析结果见表1。结果显示:比较正常组、溶剂组两组,阳性染色所占面积比例差异无统计学意义(P >0.05);与正常组、溶剂组比较,模型组阳性部分所占面积比例明显升高(P =0.000);低姜黄素治疗组的阳性表达面积与模型组比较,差异无统计学意义(P >0.05);中姜黄素治疗组、高姜黄素治疗组的阳性表达面积比例均有所降低,随着姜黄素剂量的增加,降低幅度增大,与模型组相比,差异均有统计学意义(P <0.05);丹参组与高姜黄素治疗组类似,阳性表达的减少差异有统计学意义(P <0.05)。
2.4 HSC 凋亡检测及鉴定 观察凋亡细胞的位置、形态、大小等,结合Desmin 阳性表达分布情况,鉴定凋亡细胞是否为HSC,观察结果如下:正常组、溶剂组细胞凋亡数量极少,在一张切片偶可见1 ~2 个凋亡细胞;模型组细胞凋亡数量少;模型组细胞凋亡数量少,胞核呈紫蓝色(箭头所示);高姜黄素治疗组、丹参组可见较多凋亡细胞,可见双染阳性者,细胞胞核呈紫蓝色,细胞浆呈棕黄色(箭头所示),多分散于窦周;低姜黄素治疗组可见凋亡细胞,但数目明显较高姜组、丹参组少(见图4)。
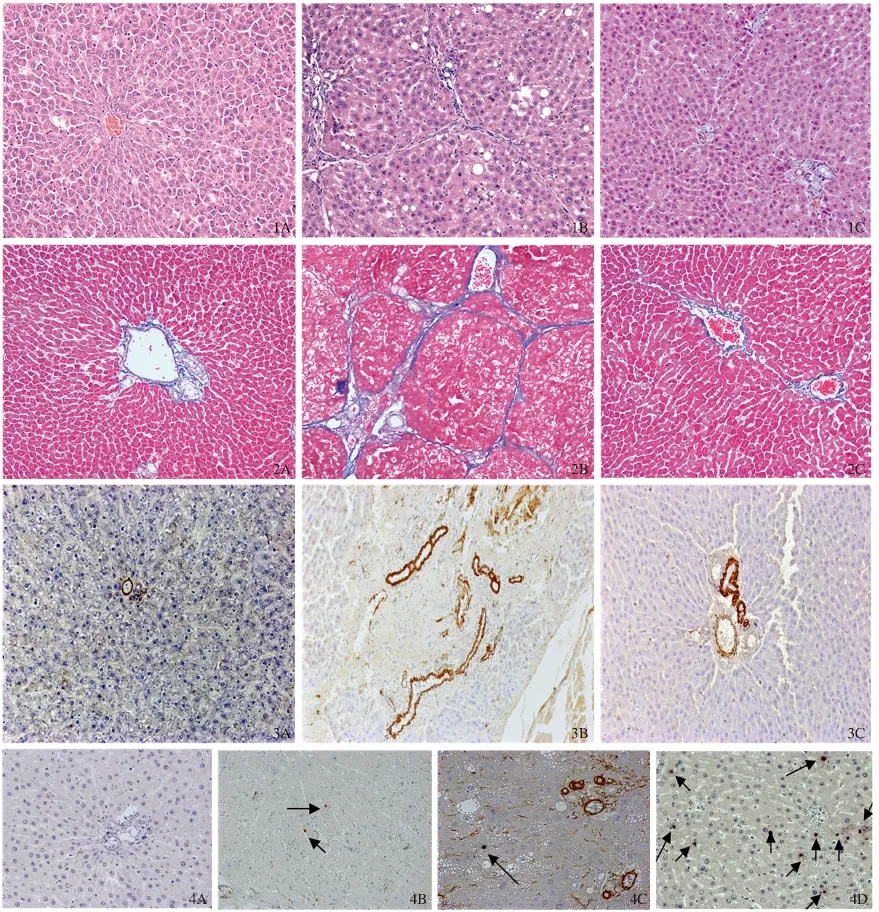
图1 肝组织切片HE 染色(200 ×) A:正常组;B:模型组;C:高姜黄素组;图2 肝组织切片Masson 染色(100 ×) A:正常组;B:模型组;C:高姜黄素组;图3 α-SMA 免疫组化染色结果(200 ×) A:正常组;B:模型组;C:高姜黄素组;图4 TUNEL 法结合Desmin 免疫组化双染色检测HSC 凋亡结果(400 ×) A:正常组;B:模型组;C:高姜黄素组Fig 1 HE staining for livers (200 ×) A:normal group;B:model group;C:high dose curcumin group;Fig 2 Masson staining for livers (100 ×) A:normal group;B:model group;C:high dose curcumin group;Fig 3 α-SMA immuohistochemistry staining for livers (200 ×) A:normal group;B:model group;C:high dose curcumin group;Fig 4 Double-stain of terminal deoxynucleotidyl transferase (TdT)dUTP nickend labeling (TUNEL)and Desmin immuohistochemistry staining to detect HSC apoptosis (400 ×)A:normal group;B:model group;C:high dose curcumin group
凋亡指数见表1,结果显示:正常组、溶剂组凋亡率比较,差异无统计学意义(P >0.05);姜黄素治疗组中,低姜黄素治疗组与模型组比较,凋亡率差异无统计学意义(P >0.05);中姜黄素治疗组、高姜黄素治疗组与模型组比较,凋亡率差异有统计学意义(P <0.05),且随着姜黄素剂量的增加而增加,说明姜黄素可以诱导HSC 凋亡;丹参组与高姜黄素治疗组类似,可增加凋亡率,与模型组比较,差异有统计学意义(P <0.05)。
表1 各组病理检查结果比较(±s)Tab 1 Comparison of pathologic examination results of each group (±s)
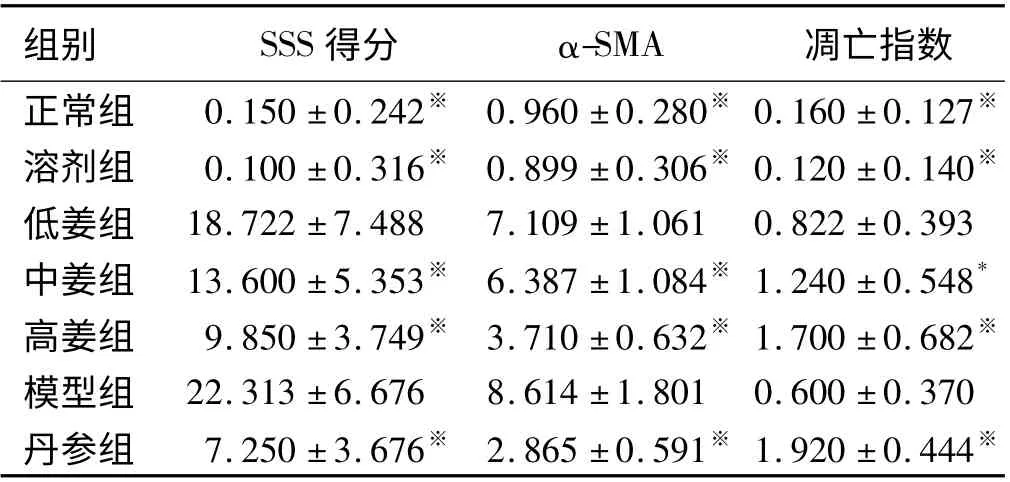
表1 各组病理检查结果比较(±s)Tab 1 Comparison of pathologic examination results of each group (±s)
注:与模型组比较,* P <0.05,※P <0.01。
组别 SSS 得分 α-SMA 凋亡指数正常组 0.150 ±0.242※ 0.960 ±0.280※ 0.160 ±0.127※溶剂组 0.100 ±0.316※ 0.899 ±0.306※ 0.120 ±0.140※低姜组 18.722 ±7.488 7.109 ±1.061 0.822 ±0.393中姜组 13.600 ±5.353※ 6.387 ±1.084※ 1.240 ±0.548*高姜组 9.850 ±3.749※ 3.710 ±0.632※ 1.700 ±0.682※模型组 22.313 ±6.676 8.614 ±1.801 0.600 ±0.370丹参组 7.250 ±3.676※ 2.865 ±0.591※ 1.920 ±0.444※
3 讨论
HSC 在各种刺激因子的作用下大量地活化、增殖,是肝纤维化发生发展的重要环节。许多研究表明,抑制HSC 活化、增殖是抗纤维化治疗的一个有效途径。抑制HSC 活化、增殖,可以从细胞因子及其信号转导途径进行调控,也可以通过清除肝细胞及内皮细胞损伤坏死时释放的氧化刺激因子,如氧自由基与炎性细胞因子等环节来进行。
姜黄素具有抑制、减少相关细胞因子表达的作用,干扰其信号转导,进而抑制HSC 活化、增殖[5]。Kang等[6]在细胞及活体水平均发现姜黄素可以抑制胶原合成及HSC 活化。PPAR-γ 表达于正常鼠肝脏的HSC,伴随着肝纤维化的发生、发展,PPAR-γ 水平显著降低。Zheng 等[7-8]研究表明,在细胞水平,姜黄素可通过诱导PPAR-γ 基因表达,抑制TGF-β 受体基因的表达,阻断TGF-β 信号转导通路而抑制HSC 的活化、增殖。姜黄素是一种抗氧化剂,它能清除肝纤维化发生、发展过程中各种细胞损伤后释放的有关氧化刺激因子,升高相关的酶类(如SOD)而发挥抑制HSC 活化的作用。
我们的前期研究工作证实:在细胞水平,姜黄素能显著抑制体外培养的大鼠HSC 增殖,使细胞周期停滞于G2/M 期,并诱导其凋亡,其作用具有明确的时间、剂量相关性,其作用机制与姜黄素可使促凋亡基因Fas、P53 表达增加,抑制凋亡基因Bcl-2 表达减少有关[9-12];在大鼠活体水平,姜黄素可通过抑制HSC 活化和增殖、诱导HSC 凋亡而发挥预防肝纤维化的作用[13]。本实验通过采用免疫组化方法,结合图像分析,观察肝组织中α-SMA 等判断HSC 活化情况。结果表明,模型组活化的HSC 明显增多;经姜黄素治疗后,活化的HSC 明显减少。提示抑制HSC 活化、增殖,可能是姜黄素治疗肝纤维化的另一作用机制。
关于姜黄素诱导HSC 凋亡的作用,近年来已成为研究的热点。在肝纤维化的逆转过程中,伴随有HSC的凋亡。在啮齿类动物的实验证明,增加HSC 的凋亡可促进肝纤维化的消退,因此,国内外学者在调节HSC 凋亡的决定性分子事件,寻找刺激HSC 凋亡的靶向性药物等方面进行了大量的研究。Zheng 等[14]研究表明通过诱导PPAR-γ 基因表达,可促进HSC 的凋亡。我们曾用不同浓度的姜黄素处理HSC 株HSCT6,以流式细胞仪、透射电镜和琼脂糖电泳法检测HSC 凋亡,结果姜黄素处理组凋亡指数明显高于对照组,差异有统计学意义;行免疫组化检测相关基因蛋白表达,提示姜黄素通过增加促凋亡基因Fas、P53 表达、减少抑制凋亡基因Bcl-2 表达而起到诱导HSC 凋亡的作用[9-12];而在大鼠活体水平,观察到姜黄素具有诱导HSC 凋亡的作用,我们认为这是姜黄素预防肝纤维化的重要作用机制之一[13]。
本实验中,我们用经典的TUNEL 凋亡检测方法,与Desmin 免疫组化染色结合的方法检测并鉴定肝组织中HSC 的凋亡,起到了定性的作用,实验操作简便、结果真实可靠。结果提示,在模型组,HSC 凋亡极少发生,而在姜黄素的治疗下,凋亡HSC 的数目明显增多,凋亡率随着姜黄素剂量的增加而增加,表明姜黄素具有促进HSC 凋亡的作用,这可能也是姜黄素治疗肝纤维化的重要作用机制之一。
关于姜黄素在发挥治疗肝纤维化作用时,其诱导HSC 凋亡的相关分子机制等仍有待进一步研究。可借鉴姜黄素在诱导肿瘤细胞凋亡方面的工作成果,采用分子生物学、免疫学、形态学及其他方面的相关理论和技术进行深入研究。
[1] Shu JC,Ye GR,Lv X,et al. Therapeutic effects of curcumin treatment on hepatic fibrosis [J]. Chin J Hepatol,2007,15 (10):753-757.舒建昌,叶国荣,吕霞,等. 姜黄素治疗肝纤维化及其作用机制的初步研究[J]. 中华肝脏病杂志,2007,15(10):753-757.
[2] Shu JC,Ye GR,He YJ,et al. Therapeutic effects of curcumin on hepatic fibrosis and variation of correlated cytokine[J]. Journal of Chinese Medicinal Materials,2007,30(11):1426-1432.舒建昌,叶国荣,何雅军,等. 姜黄素治疗肝纤维化及其与相关细胞因子变化的研究[J]. 中药材,2007,30(11):1421-1425.
[3] Shu JC,Ye GR,He YJ,et al. Therapeutic effects of curcumin on hepatic fibrosis of rat and its influence on expression of collagen alpha1 I and Ⅲin liver[J]. International Journal of Internal Medicine,2008,35(7):9-12.舒建昌,叶国荣,何雅军,等. 姜黄素治疗大鼠肝纤维化及其对肝组织Ⅰ、Ⅲ型胶原的影响[J]. 国际内科学杂志,2008,35(7):9-12.
[4] Tu CT,Yao QY,Xu BL,et al. Protective effects of curcumin against hepatic fibrosis induced by carbon tetrachloride:modulation of highmobility group box 1,Toll-like receptor 4 and 2 expression[J]. Food Chem Toxicol,2012,50(9):3343-3351.
[5] Chen N,Geng Q,Zheng J,et al. Suppression of the TGF-β/Smad signaling pathway and inhibition of hepatic stellate cell proliferation play a role in the hepatoprotective effects of curcumin against alcoholinduced hepatic fibrosis [J]. Int J Mol Med,2014,34 (4):1110-1116.
[6] Kang HC,Nan JX,Park PH,et al. Curcumin inhibits collagen synthesis and hepatic stellate cell activation in-vivo and in-vitro[J]. J Pharm Pharmacol,2002,54(1):119-126.
[7] Zheng S,Chen A. Activation of PPARgamma is required for curcumin to induce apoptosis and to inhibit the expression of extracellular matrix genes in hepatic stellate cells in vitro[J]. Biochem J,2004,384(Pt 1):149-157.
[8] Zheng S,Chen A. Disruption of transforming growth factor-beta signaling by curcumin induces gene expression of peroxisome proliferator-activated receptor-gamma in rat hepatic stellate cells[J]. Am J Physiol Gastrointest Liver Physiol,2007,292(1):G113-G123.
[9] Shu JC,Zhao JR,Yang DH,et al. Effect of curcumin on proliferation and apoptosis of hepatic stellate cell line[J]. Chin J Dig,2004,24(5):282-284.舒建昌,赵景润,杨冬华,等. 姜黄素对肝星状细胞增殖与凋亡的影响[J]. 中华消化杂志,2004,24(5):282-284.
[10] Shu JC,He YJ,Lv X,et al. Preliminary study on mechanism of apoptosis of hepatic stellate cells induced by curcumin[J]. Chin J Dig,2006,26(11):758-761.舒建昌,何雅军,吕霞,等. 姜黄素诱导肝星状细胞凋亡的相关分子机制的初步研究[J]. 中华消化杂志,2006,26(11):758-761.
[11] Shu JC,He YJ,Lv X,et al. Curcumin prevents liver fibrosis by inducing apoptosis and suppressing activation of hepatic stellate cells[J]. J Nat Med,2009,63(4):415-420.
[12] Shu JC,He YJ,Lv X,et al. Effect of curcumin on the proliferation and apoptosis of hepatic stellate cells[J]. Braz J Med Biol Res,2009,42(12):1173-1178.
[13] He YJ,Shu JC,Lv X,et al. Prophylactic effect of curcumin on hepatic fibrosis and its relationship with activated hepatic stellate cells[J]. Chin J Hepatol,2006,14(5):337-340.何雅军,舒建昌,吕霞,等. 姜黄素预防肝纤维化作用与肝星状细胞的关系[J]. 中华肝脏病杂志,2006,14(5):337-340.
[14] Zheng S,Chen A. Activation of PPARgamma is required for curcumin to induce apoptosis and to inhibit the expression of extracellular matrix genes in hepatic stellate cells in vitro[J]. Biochem J,2004,384(Pt1):149-157.
