电针对缺血缺氧性脑损伤大鼠p-AKT表达的影响
2015-12-31曹娜徐涛
曹 娜 徐 涛
青岛大学医学院中西医结合中心,山东青岛 266021
新生儿围产期窒息导致的缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是新生儿期的常见疾病,是导致儿童智能落后和脑性瘫痪、癫痫等神经系统伤残的主要原因之一。缺血缺氧性脑病后神经细胞坏死及凋亡而导致神经元大量缺失是其导致神经功能缺损的病理基础[1]。缺氧缺血脑损伤后PI3K-AKT信号通路中的p-AKT蛋白表达增加,并参与HIBD中的病理损伤过程,它通过影响下游多种效应分子的活化状态,在细胞内发挥着抑制凋亡、促进增殖的关键作用,同时具有减少氧自由基的生成、抑制炎症反应等作用。研究表明,PI3K-AKT通路的过度激活可导致肿瘤的出现[2],但p-Akt蛋白的增加对缺血缺氧性脑病有保护作用。既往研究[3-4]发现,缺血可诱导p-AKT蛋白表达,随着再灌注时间的延长其表达会下降。针刺治疗对缺血缺氧性脑损伤具有独特疗效,但具体机制尚不清楚。本实验通过建立新生大鼠缺血缺氧性脑损伤(hypoxic-ischemic encephalopatly,HIE)模型,观察针刺百会、大椎、曲池、涌泉四穴对神经细胞及p-AKT表达的影响,进一步探讨针刺对缺血缺氧性脑损伤的疗效及其机制。
1 材料与方法
1.1 材料及分组
SPF级7日龄SD大鼠90只,雌雄不限,体重14~18g,由青岛市药物检测中心提供,合格证号:scxk鲁20140003。室温20~25℃,母鼠喂养。按区组随机法分为两组假手术组24只及HIE模型组66只。HIE模型组造模期间死亡18只。将最终造模成功的48只大鼠随机分为两组:模型组、针刺组。每组24只,于术后3d、7d、21d进行取脑检测各项指标,每个时间段8只。
1.2 模型建立
大鼠经乙醚吸入麻醉。采用Rice方法并加以改进[5],结扎双侧颈总动脉,缝合切口。除假手术组,模型组和电针组大鼠置于透明密闭容器中以0.5L/min的速度通入低氧混合气体(浓度为8%氧气和92%氮气),建立缺氧缺血性脑损伤模型。缺氧1.5h后将大鼠放回鼠笼,术后2h仍未苏醒或死亡的动物剔除。
1.3 电针干预方法
(1)假手术组:仅分离双侧颈总动脉不作任何处理;(2)模型组:分离双侧颈总动脉并结扎,缝合切口,不另作任何治疗;(3)电针组:缺血缺氧后第2天起,用0.5寸毫针,直刺大椎5mm;沿皮斜刺百会5mm、直刺曲池10mm、速刺涌泉微出血即可。百会、曲池与电针治疗仪进行连接,以穴位周围皮肤微颤即适,非对称双向连续脉冲波、5~10Hz、3~5V,每日1次,每次10min。以上穴位定位参照大鼠常用的针灸穴位[6-7]。
1.4 观察指标
1.4.1 病理切片 每亚组随机选取4只动物,应用10%水合氯醛腹腔注射麻醉,经心脏灌注4%多聚甲醛溶液200mL,完整取脑,切取视交叉后脑组织(5mm)置4%多聚甲醛溶液后固定2h,蒸馏水浸泡4h。常规梯度乙醇脱水、二甲苯透明、石蜡包埋,连续切片,厚5μm,贴片,4℃保存。石蜡切片常规脱蜡水化,苏木精-伊红染色,光镜下神经细胞核呈蓝色,细胞质呈不同程度的红色。在400倍显微镜(德国,Leica DMI4000B)下,每张切片随机观察皮质区4个不重叠的视野计数细胞,取其均值。以变性细胞指数(denatured cell index,DCI=变性细胞数/细胞总数)表示损伤程度。
1.4.2 电镜观察 各组幼鼠于缺血缺氧后3d、7d、21d腹腔注射10%水合氯醛麻醉,心脏快速灌流生理盐水50mL,断头取脑。在鼠脑前囟前后做冠状切开,将脑皮质区组织切成1mm厚度置于2.5%戊二醛中固定24h,1%锇酸固定,梯度丙酮脱水,环氧丙烷置换,环氧树脂Epon812包埋,超薄切片50nm,醋酸铀+硝酸铅双染色,透射电镜观察神经元的超微结构。
1.4.3 酶联免疫吸附试验 各组剩余4只幼鼠于缺血缺氧后3d、7d、21d腹腔注射10%水合氯醛麻醉,心尖部取血,在室温下,血液自然凝固,以3000转/min离心15min,取上清。p-Akt Elisa试剂盒(Lot.#:SO30708D)由Biosource International,Inc.USA提供,操作步骤严格按照说明书进行。在全自动酶标仪450nm处读板,以OD值和蛋白浓度为横、纵坐标绘制标准曲线,得出p-AKT的原始数据,根据待测蛋白的浓度和稀释比例,即可计算出单位浓度总蛋白内p-AKT的含量(unit/mg)。
1.5 统计学处理
2 结果
2.1 HE染色
假手术组神经细胞结构正常,排列整齐紧密,胞浆呈淡红色,胞核呈蓝色,核仁清晰,各时间点DCI水平较低无明显差异(P>0.05)。模型组3d,细胞质染色不规则,细胞间隙扩大,神经细胞胞质浓缩、深染,DCI=0.60±0.03,较假手术组明显升高(t=14.46,P<0.05);7d神经元坏死明显,排列紊乱,着色较深,常有核膜破裂,细胞结构消失,可见大量细胞核固缩深染、裂解;21d可见大量神经细胞丢失,遗留大量空泡,DCI=0.78±0.05,为各组最高。电针组3d,神经细胞损伤状况同模型组,未见明显变化,DCI=0.54±0.06,较同时间点模型组略低(t=1.69,P>0.05);7d可见部分神经细胞固缩、深染,但坏死程度及DCI=0.42±0.04较同时间模型组(DCI=0.71±0.05)明显减轻(t=8.83,P<0.05);21d神经细胞肿胀变轻,排列有序,DCI=0.35±0.05,坏死细胞明显减少。见图1,表1~2。

图1 大鼠皮质区细胞结构,HE×400
表1 大鼠皮质区DCI(±s)

表1 大鼠皮质区DCI(±s)
注:同一时间点,与对照组比较,*P<0.05;与模型组比较,#P<0.05
组别 3d 7d 21d假手术组 0.13±0.05 0.12±0.04 0.13±0.04模型组 0.60±0.03* 0.71±0.05* 0.78±0.05*电针组 0.54±0.05* 0.42±0.04*# 0.35±0.05*#

表2 DCI方差分析
2.2 神经元超微结构
假手术组神经细胞排列整齐紧密,高倍镜下细胞膜完整、细胞核大而圆。模型组术后1d电镜下大鼠神经元胞膜尚完整,核仁稍增大,常染色质分布不均,线粒体轻度肿胀;3d镜界模糊,有神经细胞坏死征象,表现神经细胞消失,染色质聚集,双层核膜模糊不清,21d神经元损伤进一步加重,细胞质溶解,有空泡形成。电针组1d电镜下神经细胞的改变与模型组相比未见明显差异;3d电镜下,神经元胞体水肿减轻,细胞核核膜、核仁逐渐清晰,细胞质空白减少,针刺后21d大鼠神经元与假手术组差别不明显,胞膜尚完整,核质稍疏松,常染色质尚均匀,偶见肿胀的线粒体及扩张的粗面内质网。见图2。
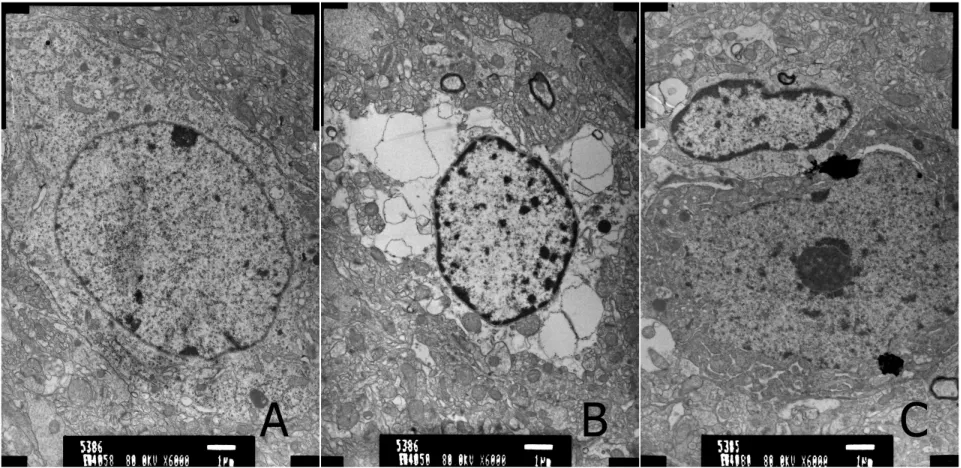
图2 大鼠皮质区神经细胞超微结构(21d),TEM×6K
2.3 ELISA
ELISA检测显示,假手术组大鼠p-Akt水平较低,各时间点间无明显差异(P>0.05)。模型组p-Akt表达升高,明显高于同时间点假手术组水平(P<0.05),但随着时间的延长,p-Akt表达逐渐下降。电针组p-Akt水平较高,且随着治疗时间的延长,p-Akt表达逐渐升高,3d时于模型组无明显差异(t=0.94,P>0.05),7d和21d时明显高于模型组(t=9.43,16.02,P<0.05)。见表3~4。
表3 大鼠血清pAkt表达(±s,units/mg)

表3 大鼠血清pAkt表达(±s,units/mg)
注:同一时间点,与对照组比较,*P<0.05;与模型组比较,#P<0.05
组别 3d 7d 21d假手术组 12.16±2.39 11.91±2.56 12.42±2.53模型组 41.76±2.66* 32.03±1.98* 20.35±1.79*电针组 43.42±3.34* 48.73±2.38*# 59.17±2.63*#
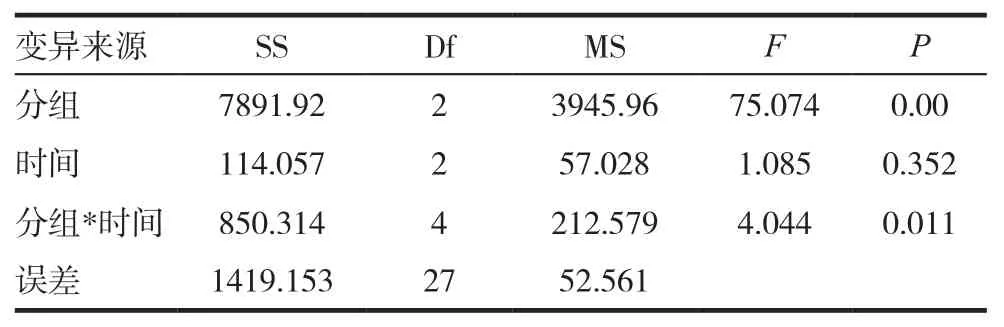
表4 Elisa检测大鼠血清Elisa方差分析
3 讨论
新生儿缺氧缺血性脑病是指各种围生儿期窒息引起的部分或完全缺氧,脑血流减少或暂停而导致胎儿或新生儿脑损伤,HIE是新生儿神经发育异常和死亡的主要原因之一,可导致各种病发症,如癫痫、脑瘫、智力下降等,重度HIE预后不良率仍高达20.8%[8],HIBD已经成为全球范围内一个影响孩子们生活质量的重要因素[9-10]。缺氧缺血性脑损伤的发病机制为二次损伤学说及细胞坏死,目前尚无有效的治疗方法。许多研究表明有效针刺治疗可抑制神经元凋亡,并促进各种内源性神经营养因子分泌,但电针抑制神经元凋亡的机制尚不明确,本文通过建立HIE大鼠模型,通过针刺百会、大椎、曲池、涌泉四穴,检测p-Akt通道蛋白浓度变化,了解针刺治疗缺血缺氧脑病的机制。
PI3K/Akt信号通路是与细胞凋亡有关的主要信号转导通路,是重要的细胞存活信号通路之一[11]。许多研究表明[12-14],通过激活PI3K/Akt信号通路可导致肿瘤的产生,抑制PI3K/Akt信号通路激活可达到治疗肿瘤的目的,缺血缺氧性脑病早期便可导致神经细胞的过度坏死及凋亡[15-16]。研究认为,激活PI3K/AKT信号通路是电针对脑细胞的神经保护机制之一[9,17],可在不同时间点不同程度的降低凋亡细胞百分率,通过本实验通过病理及电镜观察到针刺7d、21d神经元细胞损伤明显减轻,Elisa检测发现,电针组细胞中p-Akt蛋白浓度较模型组明显升高(P<0.05),可见针刺对缺血缺氧性脑病有治疗作用。且有研究显示电针百会、大椎及涌泉等穴可提高线粒体Na+-K+-ATP等酶的活性,进而提高线粒体的能量代谢能力,从而减轻脑缺血再灌注损伤[18-20]。由此提示,电针治疗缺血缺氧性脑病是通过多途径、作用于多环节或多靶点来实现的。目前针灸对缺血性脑损伤的诸多保护机制还尚未完全明了,需要应用生物化学、生理学等新知识及新技术进行进一步研究,电针对于p-Akt蛋白表达增加只是治疗HIE的很小的一部分,还需要进一步研究发现。
[1]Harteveld CL,Higgs DR.a-thalassaemia[J].Orphanet J Rare Dis,2010,28(5):13-19.
[2]Piotr G,Rychahou MD,Lindsey N,et al.Targetedmolecular therapy of the PI3K pathway therapeutic significance of PI3K subunit targeting in colorectal carcinoma[J].Ann Surg,2006,243(6):833-844.
[3]Li L,Qu Y,Mao M,et al.The involvement of phosphoinositid 3-kinase/Akt pathway in the activation of hypoxia-in-ducible factor-1alpha in the developing rat brain after hypoxia-is-chemia[J].Brain Res,2008,1197
(1):152-158.
[4]王志敏,杨玉欣.PKB/AKT与脑缺血神经细胞凋亡的研究[J].医学研究杂志,2008,37(7):68-70.
[5]尹晓娟,巨容,封志纯,等.建立新生鼠缺氧缺血性脑病模型的一种简单可靠的方法[J].实用儿科临床杂志,2005,20(8):744-746.
[6]林文注.实验针灸学[M].上海:上海科学技术出版社,1994:268.
[7]许能贵,周逸平,许冠荪,等.电针大椎、百会穴对局灶性脑缺血大鼠脑血流量和自发脑电的影响[J].中国医药科技,2001,8(1):3-4.
[8]新生儿窒息致缺氧缺血性脑病治疗协作组.新生儿缺氧缺血性脑病第二次多中心治疗的总结[J].中国实用儿科杂志,2003,18(9):558-560.
[9]施炳培,卜怀娣,史惟,等.针刺治疗小儿脑性瘫痪的临床研究[J].上海针灸杂志,2005,24(10):23-25.
[10]Versteegh FG,Arkesteijn SG,Bakker-Verweij M,et al.Hb Boskoop[HBA2c.112C>T p.Pro38Ser]:a new α2 chain variant observed in a Morrocan family[J].Hemoglobin,2011,35(2):97-102.
[11]林跃辉,王敏.PI3K/Akt信号转导途径与凋亡的关系[J].国际病理科学与临床杂志,2005,25(4):307-310.
[12]Maier,Daniel.The PTEN lipid phosphatase domain is not required to inhibit invasion of glioma cells[J].Cancer research,1999,59(21):5479-5482.
[13]Zhong Hua.Modulation of hypoxia-inducible factor 1α expression by the epidermal growth factor/phosphatidylinositol 3-kinase/PTEN/AKT/FRAP pathway in human prostate cancer cells:implications for tumor angiogenesis and therapeutics[J].Cancer Research,2000,60(6):1541-1545.
[14]Yau,Cindy YF.Inhibition of integrin-linked kinase by a selective smallmolecule inhibitor,QLT0254,inhibits the PI3K/PKB/mTOR,Stat3,and FKHR pathways and tumor growth,and enhances gemcitabine-induced apoptosis in human orthotopic primary pancreatic cancer xenografts[J].Cancer Research,2005,65(4):1497-1504.
[15]Sirén,Anna-Leena.Erythropoietin prevents neuronal apoptosis after cerebral ischemia and metabolic stress[J].Proceedings of the National Academy of Sciences,2001,98(7):4044-4049.
[16]Broughton BR,Reutens DC,Sobey CG.Apoptotic mechanisms after cerebral ischemia[J].Stroke,2009,40:e331-339.
[17]何二涛,张霞婧,马磊,等.PI3K/Akt通路在电针预处理诱导脑缺血耐受中的机制研究[J].现代生物医学进展,2012,12(7):1215-1218.
[18]穆艳云,李忠仁.电针对局灶性脑缺血再灌注大鼠纹状体线粒体ATP酶与总体抗氧化能力的影响[J].上海针灸杂志,2007,26(1):44-47.
[19]曾芳,赵纪岚.电针对老年性痴呆模型大鼠海马线粒体酶活性的影响[J].中国老年学杂志,2006,26(1):68-70.
[20]薄雪峰,刘庆凯,曹海勇,等.亚低温治疗脑卒中及颅脑损伤研究进展[J].北京生物医学工程,2013,32(4):428-430.
