桔梗多糖降血糖作用及其机制
2015-12-30乔彩虹,孟祥顺
桔梗多糖降血糖作用及其机制
乔彩虹孟祥顺
(吉林省前卫医院中医科,吉林长春130012)
摘要〔〕目的探讨桔梗多糖对糖尿病(DM)模型大鼠的作用及可能机制。方法采用腹腔注射链脲佐菌素(STZ)诱导的方法建立DM大鼠模型,灌胃给予模型大鼠低(150 mg·kg-1·d-1)、中(300 mg·kg-1·d-1)、高(600 mg·kg-1·d-1)剂量的桔梗多糖,28 d后检测大鼠体重、进水量、进食量和尿量;同时,检测空腹血糖(FBG)水平、空腹胰岛素水平(FINS)、胰岛素敏感指数(ISI)、葡萄糖耐量、肝组织超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量。结果桔梗多糖给药组大鼠进水量、进食量和尿量显著低于模型组,同时,FBG水平降低,胰岛素水平、ISI及对葡萄糖的耐受能力显著升高(P<0.05或P<0.01);桔梗多糖也能够提高肝组织SOD活性,降低MDA含量(P<0.05或P<0.01)。结论桔梗多糖具有降血糖作用,其机制可能与改善FINS、提高抗氧化能力有关。
关键词〔〕桔梗多糖;糖尿病;抗氧化
中图分类号〔〕R285.5〔文献标识码〕A〔
基金项目:吉林省卫生厅科研课题(2013Q013)
第一作者:乔彩虹(1973-),女,副主任医师,主要从事中医药防治糖尿病的研究。
现代药学研究〔1〕表明,桔梗的主要活性成分为桔梗皂苷,桔梗皂苷的抗肿瘤、抗炎、保肝、调节免疫及抗病毒等多方面的药理作用被广泛报道,多糖是广泛存在于植物根、茎、叶及果实中的一类生物活性大分子,具有免疫调节、抗氧化、抗肿瘤、抗衰老、抗病毒及辅助降血糖等多种生物活性,且由于其具有毒副作用小、安全性高的特点,在临床上已得到广泛应用〔2〕。而关于桔梗多糖的活性研究主要集中在提高免疫力方面,相关报道较少〔3,4〕。本文以桔梗多糖为研究对象,初步探讨其降血糖作用及可能机制,为进一步应用奠定基础。
1材料与方法
1.1实验材料及仪器桔梗药材购买于本地药材市场,经吉林大学药学院生药教研室鉴定为桔梗科植物的干燥根茎。链脲佐菌素(STZ)为美国Sigma公司产品;血糖检测试剂盒为北京康化试剂公司产品;胰岛素检测试剂盒为天津九鼎生物技术有限公司产品;超氧化物歧化酶(SOD)与丙二醛(MDA)检测试剂盒为南京建成生物技术有限公司产品。其他常规试剂均为国产分析纯。
药材粉碎机,济南天方机械有限公司;超声波清洗机,南京古奇机电有限公司;2550型紫外-可见分光光度计,日本岛津;5417R型低温超高速离心机,德国Eppendorf公司;GC-2100型γ放射免疫计数仪,合肥科大中佳公司;组织匀浆机,上海天呈科技有限公司。
1.2桔梗多糖的提取在60℃~90℃条件下,将购买的桔梗饮片用石油醚回流提取3次,每次4 h,除去脂溶性成分;减压回收石油醚后,再用80%的乙醇回流提取3次,2 h/次,除去醇溶性成分;减压回收乙醇后,再用蒸馏水回流提取3次,每次2 h,合并滤液;浓缩后,加入终浓度为75%的无水乙醇,静置过夜,离心收集、沉淀、干燥。常规方法进行脱色、除蛋白后,分别采用苯酚-硫酸法、间羟基联苯法及考马斯亮蓝法检测总糖、糖醛酸及蛋白质含量。
1.3小鼠糖尿病(DM)模型的建立、分组及给药Wistar雄性大鼠,体重(200~250)g,由吉林大学实验动物中心提供,适应性饲养7 d后,开始造模。造模前空腹12 h,腹腔注射60 mg/kg的STZ溶液(溶解于pH4.2,0.1 mol/L的柠檬酸缓冲液),而正常对照组只注射等体积的柠檬酸缓冲液。72 h后尾静脉采血,测空腹血糖(FBG),当FBG浓度>11.1 mmol/L时视为建模成功〔5〕。将建模成功的小鼠随机分为模型组,格列本脲组(25 mg·kg-1·d-1),桔梗多糖低(150 mg·kg-1·d-1)、中(300 mg·kg-1·d-1)、高剂量组(600 mg·kg-1·d-1);每天腹腔灌胃给药1次,模型组和对照组给予同体积的生理盐水,给药28 d。
1.4进水量、进食量、尿量及体重测定观察实验大鼠的精神状态及毛发改变情况;于给药第28 d时,测量大鼠体重,并采用代谢笼检测大鼠12 h的进水量、进食量及尿量。
1.5FBG、胰岛素含量测定及胰岛素敏感指数(ISI)计算给药结束后,尾静脉取血,分离血清,采用葡萄糖氧化酶法测定大鼠FBG水平;放射免疫法测定空腹胰岛素(FINS)水平;根据FBG及FINS水平,计算ISI:ISI=ln(FBG×FINS)-1。
1.6口服葡萄糖耐量试验在给药的最后1 w进行口服葡萄糖耐量试验。实验大鼠禁食12 h后,以2 g/kg体重的葡萄糖溶液灌胃,采用葡萄糖氧化酶法分别检测0、30、60、90和120 min的血糖水平。
1.7肝组织中SOD活性与MDA含量测定给药结束后,颈椎脱臼处死大鼠,取肝脏组织;预冷的生理盐水清洗后,用滤纸吸净表面血水,放于低温冰箱保存。检测前,称取一定量的肝脏组织,高速匀浆后,用生理盐水配成10%肝组织液,3 000 r/min离心10 min,取上清液备用。采用黄嘌呤氧化酶法测定SOD活性,采用硫代巴比妥酸法测定MDA含量。
2结果
2.1桔梗多糖的提取制得的桔梗多糖为浅黄色粉末,其收率为1.69%(按生药材干重计算),其总糖含量为74.5%,糖醛酸含量为14.2%,蛋白质含量为11.3%。
2.2桔梗多糖对DM大鼠进水量、进食量、尿量及体重的影响大鼠造模成功后,精神萎靡,出现多饮、多食、多尿及体重下降症状;给予桔梗多糖28 d后,与模型组比较,大鼠精神状态好转,DM典型的“三多一少”症状也得到一定程度的改善(P<0.05或P<0.01),见表1。
2.3桔梗多糖对DM大鼠FBG、胰岛素水平和ISI的影响给予桔梗多糖28 d后,与模型组比较,低、中、高剂量组的桔梗多糖均可以呈依赖性的抑制高血糖水平(P<0.05或P<0.01);同时,与模型组比较,桔梗多糖也可以增加FINS水平及ISI(P<0.05或P<0.01),见表1。
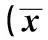
表1 桔梗多糖对各组大鼠进水量、进食量、尿量、体重及FBG、胰岛素水平和ISI的影响 ± s)
与模型组比较:1)P<0.05,2)P<0.01;下表同
2.4桔梗多糖对DM大鼠葡萄糖糖耐量的影响在口服葡萄糖耐量实验中,除模型组血糖峰值出现在口服葡萄糖60 min后,正常对照组及各给药组的血糖峰值均出现在口服葡萄糖30 min后。高、中、低剂量组的桔梗多糖,与模型组比较,均可以显著抑制血糖水平的增加,差异有统计学意义(P<0.05或P<0.01),见表2。
2.5桔梗多糖对DM大鼠肝组织SOD活性和MDA含量的影响模型组大鼠肝脏组织中SOD活性较对照组显著降低,MDA含量显著升高(P<0.01)。给予桔梗多糖28 d后,与模型组比较,SOD活性显著升高(P<0.01),且高剂量组的SOD活性高于格列本脲组;同时,中、低剂量组的MDA含量与模型组比较,下降明显(P<0.05或P<0.01),见表2。
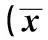
表2 桔梗多糖对各组大鼠葡萄糖糖耐量的影响及肝组织SOD活性和MDA含量的影响 ± s)
3讨论
采用腹腔注射STZ法建立的DM大鼠模型与人类1型糖尿病具有相似的临床症状。STZ可以通过选择性的作用于胰岛β细胞,生成超氧阴离子自由基,从而破坏胰岛β细胞结构,使胰岛细胞损伤或死亡,最终导致胰岛功能障碍。该方法具有成功率高、死亡率低、简便、快速的特点,目前已被广泛应用〔6〕。本研究发现,桔梗多糖具有提高胰岛素水平、ISI及糖耐量的作用,而降血糖作用与ISI的提高密切相关〔7〕。
多项研究表明氧化应激与DM的发生及发展密切相关,研究显示,糖尿病氧化应激水平增加、抗氧化能力下降〔8〕。高血糖环境可以使机体清除自由基能力下降,导致自由基在体内大量堆积,从而促进DM及其并发症的发生与发展。SOD是机体清除自由基中最为重要的抗氧化物酶之一,广泛存在于各种生物体内,能够阻断超氧阴离子对细胞造成的各类损伤;MDA为脂质过氧化产物,可以反映机体受脂质过氧化损伤的过程〔9〕。本研究结果证实,桔梗多糖可以剂量依赖性地提高糖尿病大鼠肝组织中SOD活性,并减少MDA的含量,表明桔梗多糖具有抗氧化应激,减少氧化损伤的作用。
综上所述,桔梗多糖能够改善STZ诱导DM大鼠的典型症状,降低血糖水平,其机制可能与改善胰岛素抵抗、提高抗氧化能力有关。
参考文献4
1Lim JH,Kim TW,Song IB,etal.Protective effect of the roots extract of Platycodon grandiflorum on bile duct ligation-induced hepatic fibrosis in rats〔J〕.Hum Exp Toxicol,2013;32(11):1197-205.
2陈旋,张翼,张剑波,等.植物多糖的研究进展〔J〕.中国新药杂志,2007;16(13):1000-5.
3Yoon YD,Kang JS,Han SB,etal.Activation of mitogen-activated protein kinases and AP-1 by polysaccharide isolated from the radix of platycodon grandiflorum in RAW 264.7 cells〔J〕.Int Immunopharmacol,2004;4(12):1477-87.
4Park MJ,Ryu HS,Kim JS,etal.Platycodon grandiflorum polysaccharide induces dendritic cell maturation via TLR4 signaling〔J〕.Food Chem Toxicol,2014;72(1):212-20.
5Li Z,Zhang T,Dai H,etal.Involvement of endoplasmic reticulum stress in myocardial apoptosis of streptozocin-induced diabetic rats〔J〕.J Clin Biochem Nutr,2007;41(1):58-67.
6高秋萍,阮红,刘森泉,等.紫心甘薯多糖对糖尿病大鼠血糖血脂的调节作用〔J〕.中草药,2010;41(8):1345-8.
7于淑池,苏涛,杨建民,等.安吉白茶多糖对实验性糖尿病小鼠的降血糖作用研究〔J〕.茶叶科学,2010;30(3):223-8.
8Lee HB,Yu MR,Yang YQ.Reactive oxygen species-regulated signaling pathways in diabetic nephropathy〔J〕.J Am Soc Nephrol,2003;14:241-5.
9田冬娜,吴斐华,马世超,等.风轮菜乙醇提取物的降血糖作用及其机制研究〔J〕.中国中药杂志,2008;11(33):1313-6.
〔2013-12-10修回〕
(编辑李相军/滕欣航)
