人乳头瘤病毒液态芯片基因分型和人乳头瘤病毒E6/E7mRNA检测的应用比较
2015-12-30陈勇,周华蓉,黄玉秀等
人乳头瘤病毒液态芯片基因分型和人乳头瘤病毒E6/E7 mRNA检测的应用比较
陈勇周华蓉1黄玉秀2刘灿王文华陈永东马跃飞
(福建医科大学附属第一医院检验科,福建福州350005)
摘要〔〕目的研究人乳头瘤病毒(HPV)液态芯片基因分型与HPV E6/E7 mRNA检测在宫颈癌早期筛查、预后、治疗中的应用。方法对680例患者进行HPV基因分型及E6/E7 mRNA检测,评价这两种方法对宫颈癌早期诊断、病变程度的效能。结果HPV液态芯片基因分型阳性检出率为79.6%,HPV E6/E7 mRNA检测阳性检出率为35.3%,两种方法阳性检出率差异有统计学意义;在3个宫颈病理细胞学分级中,HPV液态芯片基因分型与HPV E6/E7 mRNA检测的阳性检出率、敏感性、特异性、阳性预测值均具有统计学差异。结论宫颈癌筛查中,结合HPV液态芯片基因分型和HPV E6/E7mRNA检测对临床诊疗、疾病预后具有很好的价值。
关键词〔〕宫颈肿瘤;DNA;mRNA;人乳头状病毒;芯片分析技术
中图分类号〔〕R737.33〔文献标识码〕A〔
基金项目:福建省教育厅科技项目(JA10145);福建省卫生厅青年科研课题(2010-1-18)
1福建医科大学附属协和医院血液科
2福建医科大学附属第一医院妇产科
第一作者:陈勇(1977-),男,副主任技师,硕士,主要从事分子生物学临床诊断及法医学鉴定研究。
宫颈癌是目前女性最常见的恶性肿瘤之一,近年来其发生率有明显上升和年轻化的趋势〔1〕。现研究已表明,人乳头瘤病毒(HPV)是宫颈癌发生发展的重要因素,在99.8%的宫颈癌患者中均可检测到不同类别的HPV DNA〔2〕。迄今,已发现100多种HPV型,其中只有少数高危型的HPV易引起宫颈癌,高危型HPV(如HPV-16、18、31)与生殖道感染有关并且可以通过基因组整合入宿主细胞染色体中,引起细胞恶性转化,从而使生殖系统癌变。HPV基因组的早期区编码干扰细胞周期调控的E6/E7癌蛋白,高危型HPV的E6/E7癌蛋白能够与宿主细胞靶向结合,并与转录活性有关。E6蛋白通过泛素途径降解p53,因此在DNA受损伤时不能诱导细胞生长停滞或凋亡。E7结合pRB,p107,和p130,并使其降解,同时阻止Mi2组蛋白乙酰基转移酶,诱导C-Myc,抑制TGFβ信号转导通路。 HPV E6/E7的重要性已被人们所公认,通过HPV E6/E7 mRNA的定量检测可直观地了解宫颈细胞中HPV致癌基因表达的情况,为治疗、预后提供可靠的评估工具。
1资料与方法
1.1研究对象收集2010年10月至2011年12月在我院妇产科门诊及住院期间,因宫颈炎症、白带异常、阴道异常出血等原因就诊,并自愿接受宫颈细胞学检查、HPV DNA和mRNA检测及宫颈组织病理检查的妇女共680例,平均年龄为(39.5±13.4)岁,并对以上患者进行跟踪随访。
1.2方法
1.2.1样本采集使用窥阴器暴露宫颈,用新柏式公司的ThinPrep采样器置于宫颈口,逆时针方向转3圈,停留15 s,并存储专用的标本瓶中,4℃保存1 w内检测完毕。
1.2.2液基细胞学检测使用新柏氏液基细胞学检查系统对待检样本进行检测。
细胞学标本使用2001年贝塞斯达(Bethesda)报告系统的标准〔3〕:①未见上皮内病变/恶性细胞(NILM);②意义不明的非典型鳞状上皮细胞(ASC-US);③低度鳞状上皮内病变(L-SIL);④高度鳞状上皮内病变(H-SIL)。少数ASC-H结果报告在H-SIL,而不典型腺细胞(AGC)报告一起入ASC-US组。
1.2.3HPV液态芯片基因分型使用上海透景公司的HPV分型检测试剂盒,该试剂盒可以检测26种HPV亚型,其中高危型19种分别为HPV 16、18、26、31、33、35、39、45、51、52、53、55、56、58、59、66、68、82、83;低危型7种分别为:6、11、40、42、44、61、73。使用美国Luminex公司最新一代的标准化高通量检测技术平台Luminex 200流式荧光平台,采用专利的流式荧光技术,同时检测26种HPV亚型,严格按照试剂盒说明书进行,所得到的数据经软件分析后可以直接判断结果。
1.2.4HPV E6/E7 mRNA定量检测使用美国IncellDx公司的 HPV OncoTect E6/E7 mRNA检测试剂盒,可以一次性检出13种高危型HPV型别的mRNA,分别为:HPV 16、18、31、33、35、39、45、51、52、56、58、59、68型。取1 ml储存于ThinPrep储存液中的宫颈细胞学标本,将细胞离心沉淀和洗涤1次,在磷酸盐缓冲液(PBS)中,pH值7.4,将细胞固定和透化在环境温度下1 h。随着固定和透化,将细胞洗涤2次,并沉淀离心。用针对13种高危型HPV的E6/E7全长的mRNA 的寡核苷酸探针进行原位杂交,然后将细胞重新悬浮在2%胎牛血清PBS中,使用IncellDx Goldfish流式细胞仪进行分析,所得到的数据经软件分析后直接判读结果。
1.3统计学方法采用SPSS17.0软件行χ2检验,并计算HPV液态芯片基因分型与HPV E6/E7 mRNA的敏感性、特异性、阳性预测值和阴性预测值。
2结果
2.1HPV液态芯片基因分型和HPV E6/E7 mRNA检测HPV液态芯片基因分型的阳性率为79.6%(541/680),HPV E6/E7 mRNA检测的阳性率为35.3%(240/680)。两者差异显著(χ2=296,P<0.05)。
2.2两种方法对宫颈细胞学检测的意义对680例样本按细胞学分类进行分级,其中细胞学有异常的样本共640例,对细胞学有异常的患者随访,根据阴道镜及病理结果对HPV液态芯片基因分型和HPV E6/E7 mRNA检测的结果比较,其阳性率、敏感性、特异性、阳性预测值、阴性预测值见表1。
2.3两种方法在不同阶段对宫颈癌筛查的临床应用根据美国国立综合癌症网络(NCCN)2011.1版的宫颈癌临床实践指南,结合本研究HPV液态基因芯片和HPV E6/E7mRNA检测分析结果,可建立以下临床诊疗图谱,对临床的诊疗及预后防治具有较好的价值。见图1。
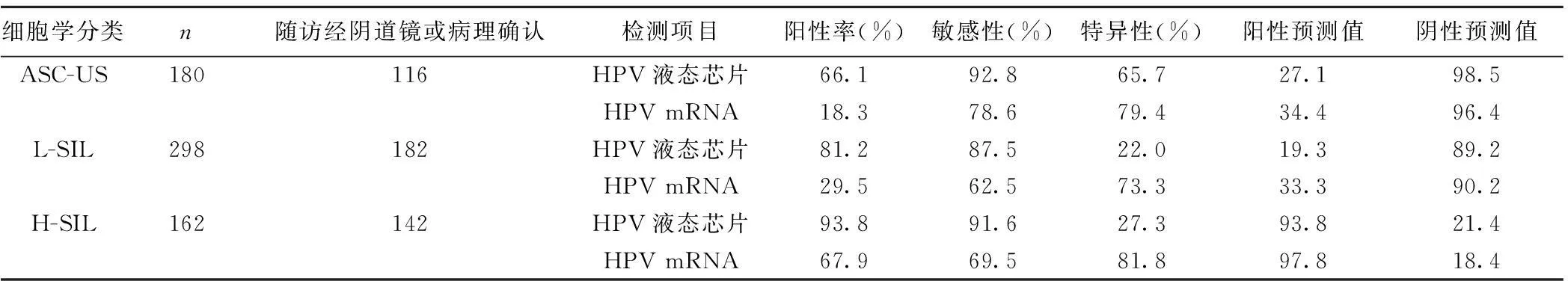
表1 HPV液态芯片基因分型和HPV E6/E7 mRNA检测在细胞学异常的不同阶段的检测准确性分析
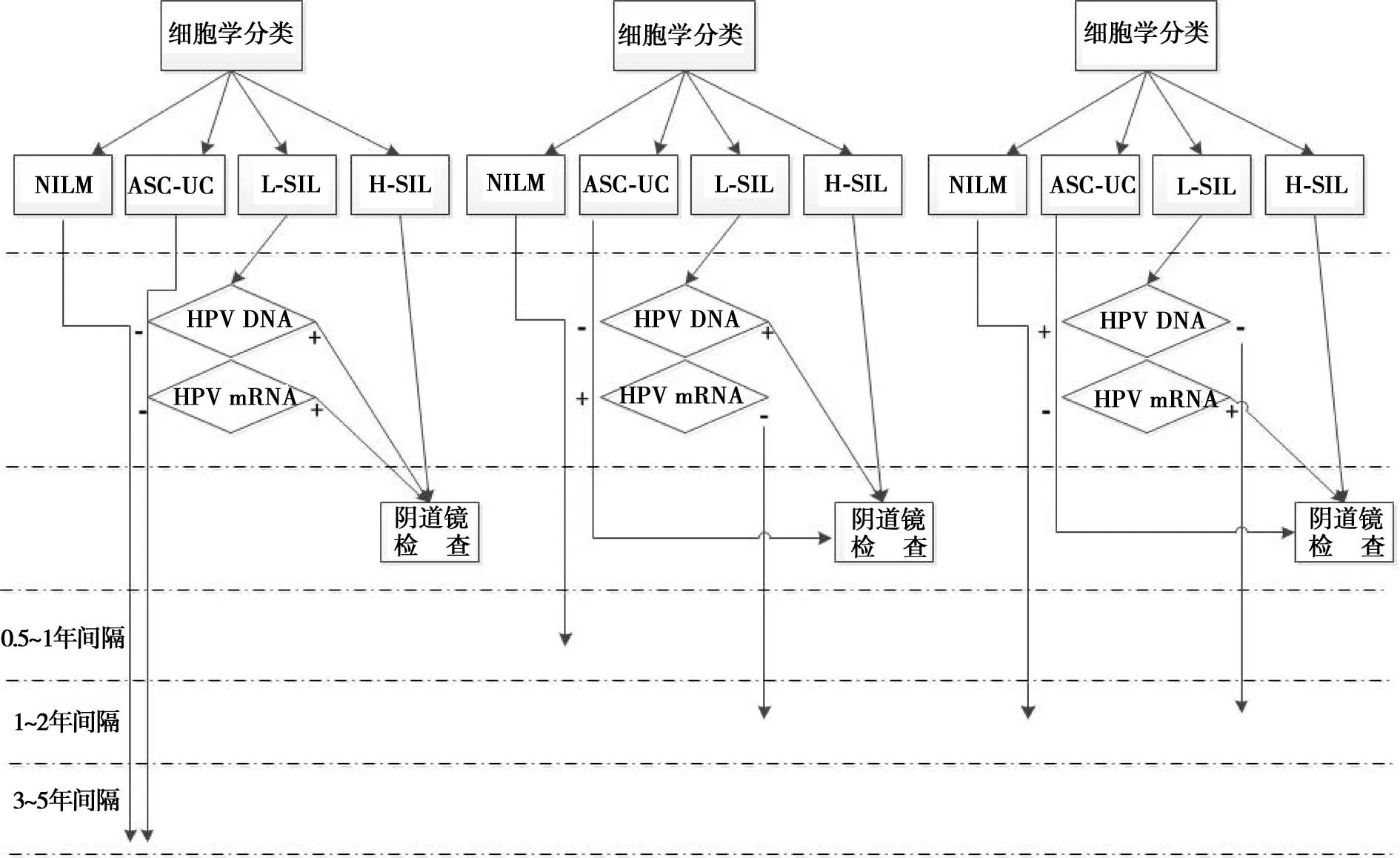
图1 HPV DNA分型与HPV mRNA检测在不同阶段对 宫颈癌筛查的临床应用
3讨论
HPV是最小的DNA病毒,也是人类癌瘤发病中唯一可以完全确认的致癌病毒。依据HPV型别与癌发生危险性的高低分为低危型HPV和高危型HPV。低危型HPV如HPV6,11,42,43,44等,常引起外生殖器湿疣等良性病变,高危型HPV如HPV16,18,31,33,35,39,45,51,52,56,58,59,68等,与宫颈癌及宫颈上皮内瘤变(CIN)的发生相关,但并不是所有的HPV 感染者都会进展为宫颈癌,在30岁以下(18~28岁)性生活活跃的年轻妇女中HPV感染机会在4%~15%,终身积累概率达60%以上,而多数的感染是“一过性”的,只是一种“一过性HPV携带状态”,即多数女性可自行清除,平均时间是8个月〔4〕,只有持续的HPV感染才会发生CIN或宫颈癌,一般平均8~24个月可发生CIN,再平均8~12年可发生浸润癌。HPV能否被消除,是否促成宫颈癌取决于:HPV的型别只有持续的高危型HPV感染才可能造成宫颈癌 宿主的免疫功能患者的产次、激素影响、营养状况等其他性行为因素、性传播疾病(STD)、重复HPV感染等。
本研究中HPV液态芯片检测在宫颈癌筛查中显示了较高的阳性率,其阳性率为79.6%,与相关的文献基本相符〔5〕,可能是由于液态芯片分型基本涵盖了中国人常见的HPV亚型,再加上检测方法的灵敏度比较高,因而其能作为宫颈癌基本筛查的检测手段,但HPV DNA检测阳性只能反映HPV存在与否,并且大多数妇女感染只是一过性的,只有高危型的HPV持续感染才可能导致宫颈癌的发生,过高的阳性率反而会增加患者的心理负担,因此若结合HPV mRNA检测,就更能综合地判断患者的HPV感染综合水平,这是由于HPV E6/E7 mRNA检测更能反映HPV感染后致癌蛋白是否表达,其对临床疗效对比,疾病的预后具有重要意义。
本研究中显示,2种方法在诊断的阳性率上都随着3个病理分级的增高而增高,但HPV液态芯片基因分型阳性率增高的比较明显,因此其在宫颈癌普查上具有重要的意义;在诊断的敏感性上,2种方法均具有较高的敏感性,但随着病理级别的增高没有明显的改变,因此这两种方法都可以用于宫颈癌筛查,而除了在ASC-US分级上两种方法没有统计学差异外,其他以上分级均具有统计学差异;在诊断的特异性上,HPV液态芯片基因分型检测随着病理分级的增高而降低,相反,HPV E6/E7 mRNA检测则随着病理分级的增高而增高,2种方法在病理分级的3个阶段均具有统计学差异,因此可以认为HPV E6/E7 mRNA检测对宫颈癌早期筛查具有较高的特异性,这主要是由于HPV E6/E7 mRNA更能反映HPV在细胞内是否表达,以及表达的量;在阳性预测值上,HPV E6/E7 mRNA检测的结果均大于HPV液态芯片基因分型,在统计学上具有差异,这与相关文献的报道相符〔6〕。
在本研究中HPV E6/E7 mRNA的检测显示比HPV DNA检测更高的特异性,当用作分流筛查中,其测定能大大减少了阴道镜的转诊检查,提高检测的效率。本研究结果显示这两种检测方法的阴性预测值较为接近,阳性预测值HPV mRNA定量检测高于HPV液态芯片分型,可以避免临床不必要的阴道镜检查,给临床医生提供更有价值的检测结果,可以指导临床用药及效果对比,有助于改善患者的诊疗质量。本研究通过分析两种方法的临床比较研究,结合NCCN2011.1版的宫颈癌临床实践指南,建立适合于我国的宫颈癌筛查指南,为临床提供更为有效的筛查方法,对降低宫颈癌的发病率、死亡率提供更为有效的手段。
参考文献4
1Rao PH,Arias-Pulido H,Lu XY.Chromosomal amplifications,3q gain and delections of 2q33-q37 are the frequent genetic changes in cervical carcinoma〔J〕.BMC Cancer,2004;4(6):4-5.
2Anhang R,Goodman A,Goldie SJ.HPV communication:review of existing research and recommendations for patient education〔J〕.CA Cancer J Clin,2004;54(5):248-59.
3Solomon D,Davey D,Kurman R,etal.Te 2001 Bethesda System:terminology for reporting results of cervical cytology〔J〕.JAMA,2002;287(16):2114-9.
4Kjaer SK,van den Brule AJ,Paull G,etal.Type specific persistence of high risk human papillomavirus as indicator of high grade cervial squamous intraepithelial lesions in young women:population based prospective follow up study〔J〕.Br Med J,2002;325(7364):572.
5卢文波,姜智南,陈顺美,等.单一时间点HC2-HPV-DNA和HPV E6/E7 mRNA检测的临床研究〔J〕.中华实验和临床病毒学杂志,2009;23(5):378-80.
6Spathis A,Kottaridi C,Chranioti A,etal.mRNA and DNA detection of human papillomaviruses in women of all ages attending two colposcopy clinics〔J〕.PloS One,2012;7(11):e49205.
〔2013-09-17修回〕
(编辑赵慧玲/曹梦园)
