米诺环素保护大鼠缺血再灌注损伤脑作用的时间窗
2015-12-30熊建忠,易飞,揭文妙
米诺环素保护大鼠缺血再灌注损伤脑作用的时间窗
熊建忠易飞揭文妙
(萍乡市人民医院神经内科,江西萍乡337000)
摘要〔〕目的观察米诺环素对大鼠脑缺血再灌注后损伤的脑保护作用的时间窗。方法72只雄性SD大鼠随机分为假手术组、生理盐水组、预处理组、30 min组、4 h组及12 h组,每组12只。采用线栓法制作大脑中动脉缺血再灌注模型。用免疫组织化学法、放射免疫法、RT-PCR、Hoechst染色评估脑缺血再灌注损伤后环氧化酶(COX)-2、前列腺素(PG)E2、白细胞介素-1β转化酶(ICE)的表达及细胞凋亡的情况。用核磁共振DWI扫描及增强扫描观察各组大鼠细胞性脑水肿及血管源性脑水肿情况。结果预处理组、30 min组、4 h组能明显抑制缺血再灌注后COX-2、PGE2、ICE的表达,减轻细胞及血管源性脑水肿,抑制细胞凋亡。12 h组对脑缺血再灌注后COX-2、PGE2、ICE的表达,细胞及血管源性脑水肿及细胞凋亡无明显抑制作用。结论米诺环素对脑缺血再灌注后脑损伤的保护作用有一定的时间窗。
关键词〔〕米诺环素;缺血再灌注;脑保护;时间窗
中图分类号〔〕R741〔文献标识码〕A〔
基金项目:江西省科技计划支撑项目(SBB01800)
第一作者:熊建忠(1974-),男,博士,副主任医师,主要从事脑血管疾病研究。
脑血管病致死致残率非常高,缺血性脑血管病占脑血管病的70%左右。对于缺血性脑血管病目前尚无有效的治疗手段。尽管有许多药物在动物实验中被证实有神经保护作用,但在临床中试验却以失败告终。临床试验失败的原因不是毒副作用太大,就是治疗时间窗太窄。因此广大学者一直在寻找一种治疗效果好,副作用少的神经保护药。脑缺血再灌注后立即出现炎症反应,脑水肿及细胞凋亡。因此如能抑制缺血后炎性反应,脑水肿及细胞凋亡将对缺血性脑损伤起到非常好的脑保护作用。米诺环素(MC)是一种半合成的第二代四环素衍生物。对革兰阳性及革兰阴性球菌等都有较好的抗菌作用。米诺环素较其他四环素类药物具有较高亲脂性,容易透过血脑屏障到达中枢神经系统。因而在神经系统疾病治疗中发挥重要作用。最近在中枢神经系统动物模型中的研究表明MC具有抗炎、抗凋亡、抗氧化等神经保护作用。本课题采用线栓法制作大鼠局灶性脑缺血再灌注模型,术后不同时段给大鼠腹腔注射MC,用免疫组织化学法、放射免疫法、RT-PCR、Hoechst染色评估脑缺血再灌注损伤后环氧化酶(COX)-2、前列腺素(PG)E2、白细胞介素-1β转化酶(ICE)的表达及细胞凋亡的情况,采用核磁共振DWI扫描及增强扫描观察各组大鼠脑水肿情况,探讨其对脑缺血再灌注损伤后脑保护作用及时间窗。
1材料与方法
1.1材料雄性SD大鼠,体重250~300 g,中南大学动物实验室。MC:中国惠式制药有公司(批号:0812080)。ICE引物,上海生物工程技术有限公司合成。COX2检测试剂盒:广州森达生物科技公司。Hoechst33258液:上海碧云天生物技术有限公司。PGE2放射免疫试剂盒:北京华英生物技术有限公司。1.5T高场核磁共振:美国GE公司。荧光显微镜:日本Nikon公司。
1.2动物分组将72只雄性 SD大鼠随机分为6组 ,每组12只 ,即假手术组(术后30 min腹腔注射MC 45 mg/kg),生理盐水组(大鼠缺血后 30 min腹腔注射生理盐水),预处理组(大鼠缺血前12 h腹腔注射MC 45 mg/kg),30 min组(大鼠缺血后30 min腹腔注射MC 45 mg/kg),4 h组(大鼠缺血后4 h腹腔注射MC 45 mg/kg),12 h组(大鼠脑缺血后12 h腹腔注射MC45 mg/kg)。
1.3模型的制备采用改良的Zea Longa线栓法建立右侧大脑中动脉闭塞再通模型,于缺血1.5 h后拔出线栓,形成脑缺血再灌注。假手术组(线栓插入深度为10 mm,不造成脑缺血)其余处理相同。
1.4核磁共振扫描采用GE1.5T超导MR成像设备,3英寸环形表面线圈为接收线圈。大鼠缺血再灌注24 h后核磁共振扫描。扫描参数:DWI:TR/TE/NEX =4 975/103/16,T1WI:TR/TE/NEX=1 835/12.4/6。增强扫描时从股静脉留置针静缓慢注入Gd-DTPA(0.2 mmol/kg)。注药后10 min进行增强扫描。磁共振成像(MRI)原始数据传入工作站,由同一名影像专业医师在同一天进行分析。血管源性脑水肿的评价:选取包括两侧侧脑室的层面为测量层面,在患侧皮层和纹状体区病灶中心及对侧对应区分别测量感兴趣区(ROI)的平均信号强度(SI)。以 Re表示增强扫描患侧SI的变化率,Re=病侧增强扫描SI/对侧增强扫描SI×100%。细胞性脑水肿的测量,在DWI图像上取3点兴趣区,1点为中心区,3点为边缘区,2点为第1、3点的中心点。计算平均扩散系数。计算时采用相对表现扩散系数 (rADC)=病侧ADC值/健侧相应区域ADC值×100%。然后比较各组的rADC。
1.5免疫组织化学染色大鼠缺血再灌注24 h后,用10%水合氯醛麻醉,等渗生理盐水和4%多聚甲醛PBS液进行心脏灌注,断头取脑,取距嗅球尖端后7~11 mm间的脑组织块,置于4%多聚甲醛中固定,脱水,包埋,连续切片,片厚 6 μm 。免疫组织化学染色严格按照说明书操作进行。染色成功后用高倍显微镜进行拍照,每张切片选取5个视野,采用Image-Pro Plus 6.0图像分析软件分析光密度值。
1.6PGE2水平测定大鼠麻醉后用等渗生理盐水快速灌洗,断头取患侧脑组织,分离额顶部皮质,置微型匀浆器中加0.1 ml 无水乙醇研磨,再加等渗生理盐水0.9 ml充分研磨成匀浆,4℃离心3 500 r/min,15 min,取匀浆上清液200 μl,按放免试剂盒说明操作,测出样品溶度。
1.7ICE mRNA检测大鼠缺血再灌注24 h后,10%水合氯醛麻醉后断头取脑,取缺血半暗带脑组织,迅速用液氮冷冻,并放置-70℃保存。RNA提取及引物合成提取采用异硫氰酸胍法:正义链引物5′-TCCACCACCCTGTTGCTGTA-3′,反义链引物:5'-TGG TGT GGA AGA GCA GAA AGC-3';γ-actin正义链引物5'-ACC ACA GTC CAT GCC ATC AC-3',反义链引物:5'-TCC ACC ACC CTG TTG CTG TA-3'。逆转录及cDNA扩增,参考文献方法进行,ICE扩增28个循环。PCR产物在1.5%琼脂糖凝胶上电泳。通过图像分析软件读取目的电泳条带的灰度值,以ICE基因片段与相应模板GAPDH片段灰度值的比值作为其mRNA相对表达水平数值。
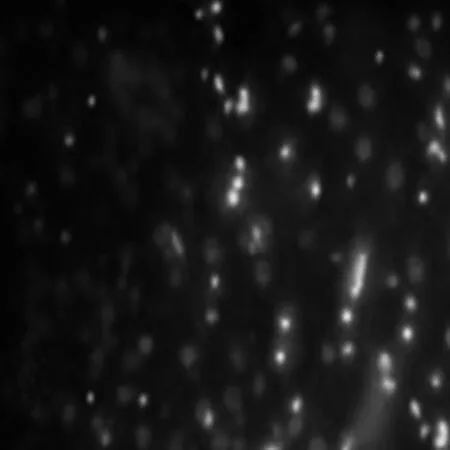
1.8Hoechst染色切片常规脱蜡透明后,置于6孔板上以0.9%生理盐水洗3遍,每次3 min,吸尽液体,然后加入0.5 ml的Hoechst 染色液,手摇晃动以充分染色,染色5 min,完成后将切片置于载玻片上,滴上1滴抗淬灭液,盖上洁净的盖玻片,在荧光显微镜下观察神经细胞凋亡形态并进行拍照。并计算出细胞凋亡百分率。
1.9统计学处理采用SPSS13.0软件进行单因素方差分析,方差齐用Bonferroni法,方差不齐采用Welch法和Dunnett'3法。
2结果
2.1COX-2免疫组化表达假手术组可见少量COX-2阳性细胞。生理盐水组缺血灶周围可见大量COX-2 染色阳性细胞。与假手术组相比,其平均光密度值增高(P<0.05)。与生理盐水组相比,预处理组、30 min、4 h组平均光密度值下降(P<0.05)。12 h组COX-2光密度值下降不明显,与生理盐水组相比,差别无统计学意义(P>0.05)。见表1,图1。
2.2PGE2的表达假手术组只有少量PGE2表达,生理盐水组PGE2表达明显增高,预处理组30 min、4 h组PGE2表达水平相对于生理盐水组有明显下降(P<0.05)。12 h组PGE2含量与假手术组相比,差别无统计学意义(P>0.05)。见表1。
2.3ICE的表达假手术组大鼠的大脑皮层只有少量ICE表达,生理盐水组在缺血半暗带ICE表达增强。与生理盐水组相比,预处理组、30 min、4 h组ICE的表达降低(P<0.05),12 h组ICE的表达无明显下降(P>0.05)。见表1。
2.4磁共振弥散加权成像假手术组磁共振DWI扫描无异常信号,生理盐水组DWI扫描可见大片异常信号区,rADC值下降,与假手术组相比,差异有统计学意义。各模型组DWI扫描均可见高信号区,预处理组、30 min组rADC有所上升,与生理盐水组相比差异显著(P<0.05)。与生理盐水组相比,4、12 h组rADC值亦有相应上升。见表2,图1。
2.5核磁共振T1WI增强扫描假手术组T1WI增强扫描无异常表现,各模型组增强扫描后均出现不同程度的强化。与假手术组相比,生理盐水组增强扫描可见强化,相对信号强度增高。预处理组,30 min组、4 h增强扫描后其信号强度与生理盐水组相比有所下降,差异有统计学意义。12 h组与生理盐水组相比增强扫描信号强度无明显下降(P>0.05)。见表2,图1。
2.6Hoechst染色结果与假手术组相比,假手术组大脑皮层只有少量凋亡细胞,生理盐水组在脑缺血灶周围中可见大量凋亡细胞(P<0.05)。预处理组、30 min、4 h组细胞凋亡百分率下降,与生理盐水组相比差别有统计学意义(P>0.05)。与生理盐水组相比,12 h组细胞凋亡百分率无明显下降(P>0.05)。见表2,图1。

表1 各组大鼠的COX-2光密度值、PGE2的含量、
与生理盐水组比较:1)P<0.05,2)P<0.01,下表同
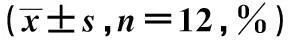
表2 各组大鼠增rADC值、强扫描相对信号强度、

COX-2表达(×400)

DWI扫描图

增强扫描图
Hoechst染色
3讨论
神经元凋亡是一种多基因控制的细胞主动死亡过程,在不同刺激信号的影响下,涉及多个基因表达及相互作用的复杂过程。ICE是Caspase家族中最早克隆的凋亡相关基因。ICE能使IL-1β前体转化成为成熟形式,成熟的IL-1β促进凋亡的发生,是凋亡的增强因子〔1〕。Hoechst染色后在荧光显微镜下能迅速区分出正常细胞与凋亡细胞,被广泛地用于细胞凋亡研究。近来动物模型研究发现米诺环素具有抗微生物特性外,还具有细胞凋亡等作用〔2〕。
本实验结果进一步证实MC在脑缺血前后一定时间段给药具有抗细胞凋亡作用,与Arvin等〔3〕研究结果相一致。
MC的抗凋亡作用可能与阻止细胞内钙离子(Ca2+)超载、细胞色素C和Smac/Diablo的释放,缩小线粒体的皱缩和肿胀,抑制线粒体的死亡有关。同时MC还能抑制ICE的表达及ICE的活性;另外米诺环素还能抑制小胶质细胞激活,稳定线粒体膜,减少线粒体对细胞色素C(Cyt-C),Smac/Diablo和AIF的通透性〔4〕,上调抗凋亡因子bcl-2〔5〕。
脑缺血引起的脑水肿是影响病人急性期与亚急性期生存的重要因素。 脑缺血再灌注损伤后导致的脑水肿,涉及多种因素,多个环节,其中炎性反应,自由基的形成,金属基质蛋白酶的活化在缺血后脑水肿起重要作用。
MRI是脑缺血的神经保护药物疗效监测、作用效果对比等研究一种简单、有效且实用的方法〔6〕。DWI对急性脑缺血非常敏感,是评价脑缺血后细胞性水肿的一个很好指标。急性脑缺血区DWI信号直接与ADC值有关,两者呈反比,即ADC值越低,DWI信号越高;ADC值越高,DWI信号越低。Gd-DTPA是一种顺磁性金属离子螯合物。正常脑组织中,静脉注射的顺磁性造影剂Gd-DTPA不能通过血脑屏障(BBB),只有在BBB完整性破坏时,T1WI增强扫描才会出现信号强化,其强化范围和信号强度均反映出BBB的受损情况。本研究结果进一步表明,在脑缺血前后一定时间段内给予MC能减轻脑缺血再灌注损伤后脑水肿。MC在脑缺血再灌注损伤中抑制脑水肿的作用机制可能是:抑制氧自由基的形成〔7〕;抑制基质金属蛋白酶的活性;MC能结合Ca2+及锌离子(Zn2+),从而抑制了依赖这些离子的胶原酶〔8〕;MC还能减少基质金属蛋白(MMP)-9的产生,从而减轻脑水肿〔9〕;MC还通过抗炎作用起到抑制脑缺血再灌注后脑水肿〔10〕。
缺血性脑血管疾病存在一系列的脑组织损伤、细胞致死过程。目前越来越多的证据表明,炎症在缺血性脑卒中的发生和发展中具有关键作用。脑梗死后炎性因子包括COX-2、PGE2、肿瘤坏死因子等。研究表明COX-2、PGE2参与了脑缺血后脑损伤的发生、发展 ,并与脑缺血的预后关系密切。本组数据显示生理盐水组,COX-2,PGE2的表达较假手术组明显增多,MC预处理组,30 min组、4 h组均能明显降低COX-2、PGE2的表达,以预处理组及30 min组效果明显。12 h不能降低COX-2、PGE2的表达。米诺环素抑制脑缺血后炎性反应可能是通过抑制诱导型一氧化氮合酶(iNOS),减少一氧化氮的产生,抑制还原型辅酶Ⅱ氧化酶的活性,降低缺血后COX-2的表达及脑组织内PGE2的含量〔11〕;另外MC还具有抑制小胶质细胞(MG)细胞的激活及其与T细胞的交互作用,降低了T细胞接触MG的能力,从而减少小胶质细胞释放或分泌一些炎性因子和酶类,达到抑制脑缺血后炎性反应的作用〔10〕。减少炎性因子的释放达到抑制炎性反应的作用。
本研究提示米诺环素对神经系统疾病有一定的保护作用,其作用机制不是单一的,而是多因素多途径的。相信随着研究的深入,米诺环素的神经保护作用机制会得到更好的解释,米诺环素有可能成为治疗神经系统疾病新的有效药物。米诺环素对缺血后脑保护作用有一定的时间窗,在缺血前12 h,缺血后30 min给药效果最好。脑缺血后12 h给药,效果不佳。但目前对米诺环素的研究大多停留在动物实验阶段,其临床效果及最佳作用时间还需要更多的实验证实。
参考文献4
1Ravizza T,Noe F,Zardoni D,etal.Interleukin converting enzyme inhibition impairs kindling epileptogenesis in rats by blocking astrocytic IL-1beta production〔J〕.Neurobiol Dis,2008;31(3):327-33.
2Pabreja K,Dua K,Sharma S,etal.Minocycline attenuates the development of diabetic neuropathic pain:possible anti-inflammatory and anti-oxidant mechanisms〔J〕.Eur J Pharmacol,2011;661(1-3):15-21.
3Arvin KL,Han BH,Du Y,etal.Minocycline markedly protects the neonatal brain against hypoxic-ischemic injury〔J〕.Ann Neurol,2002;52(1):54-61.
4Mansson R,Hansson MJ,Morota S,etal.Re-evaluation of mitochondrial permeability transition as a primary neuroprotective target of minocycline〔J〕.Neurobiol Dis,2007;25(1):198-205.
5Kernt M,Neubauer AS,Eibl KH,etal.Minocycline is cytoprotective in human trabecular meshwork cells and optic nerve head astrocytes by increasing expression of XIAP,survivin,and Bcl-2〔J〕.Clin Ophthalmol,2010;4:591-604.
6Meyer JR,Gutierrez A,Mock B,etal.High-b-value diffusion-weighted MR imaging of suspected brain infarction〔J〕.AJNR Am J Neuroradiol,2000;21(10):1821-9.
7Schildknecht S,Pape R,Muller N,etal.Neuroprotection by minocycline caused by direct and specific scavenging of peroxynitrite〔J〕.J Biol Chem,2011;286(7):4991-5002.
8Lee CZ,Yao JS,Huang Y,etal.Dose-response effect of tetracyclines on cerebral matrix metalloproteinase-9 after vascular endothelial growth factor hyperstimulation〔J〕.J Cereb Blood Flow Metab,2006;26(9):1157-64.
9Nelissen I,Martens E,Van den Steen PE,etal.Gelatinase B/matrix metalloproteinase-9 cleaves interferon-beta and is a target for immunotherapy〔J〕.Brain,2003;126(Pt 6):1371-81.
10Cai ZY,Yan Y,Chen R.Minocycline reduces astrocytic reactivation and neuroinflammation in the hippocampus of a vascular cognitive impairment rat model〔J〕.Neurosci Bull,2010;26(1):28-36.
11Leite LM,Carvalho AG,Ferreira PL,etal.Anti-inflammatory properties of doxycycline and minocycline in experimental models:an in vivo and in vitro comparative study〔J〕.Inflammopharmacology,2011;19(2):99-110.
〔2013-09-11修回〕
(编辑赵慧玲/曹梦园)
