体外转染Klotho基因对原代成骨细胞活性的影响
2015-12-30杨秋晨,马厚勋,李运奎等
体外转染Klotho基因对原代成骨细胞活性的影响
杨秋晨马厚勋李运奎邓小琴唐芸吴平
(重庆医科大学附属第一医院老年病科,重庆400016)
摘要〔〕目的探讨转染克老素(KL)基因对成骨细胞活性的影响。方法提取原代骨髓间充质干细胞(BMSCs)并培养,用倒置显微镜观察BMSCs形态。BMSCs培养至第三代时做流式鉴定,之后换为诱导培养基培养14~21 d,诱导为成骨细胞,用茜素红染色鉴定是否诱导成功。通过重组腺相关病毒(rAAV)介导小鼠KL基因转染成骨细胞。实验分为五组:空白对照组(control组),KL转染组(KL组),klotho转染+FGFR1抑制剂(BGJ398)组(KL+ BGJ398组),空载体组(rAAV组),空载体+FGFR1抑制剂(BGJ398)组(rAAV+BGJ398组)。分组处理72 h后,荧光倒置显微镜观察成骨细胞腺病毒表达情况,RT-PCR检测成骨细胞的 KL mRNA 的表达,ELISA检测上清液 KL 蛋白的含量;RT-PCR检测成骨细胞分泌物:骨钙素(OCN)、 骨桥蛋白(OPN)的mRNA表达。结果成功提取原代骨髓间充质干细胞,并且成功向成骨方向诱导。通过rAAV转染KL后,成骨细胞高表达外源性KL蛋白(P<0.01),并在KL-FGF23-FGFR1通路正常的情况下可显著促进成骨细胞分泌OCN(P<0.05),显著抑制成骨细胞分泌OPN(P<0.05)。结论KL可以促进成骨细胞的活力,可能是通过KL-FGF23-FGFR1通路发挥作用。
关键词〔〕成骨细胞;klotho;骨钙素;骨桥蛋白
中图分类号〔〕R592〔文献标识码〕A〔
基金项目:国家自然科学基金面上项目(No.30672212);重庆市卫生局医学科研计划项目(No.20B-2-029);国家临床重点专科建设项目(国卫办医函〔2013〕544号)
通讯作者:马厚勋(1966-),男,教授,主任医师,主要从事老年心血管病基础与临床研究。
The effect of klotho gene transfection on the vitality of primary osteoblasts
YANG Qiu-Chen,MA Hou-Xun,LI Yun-Kui,etal.
Department of Gerontics,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
Abstract【】ObjectiveTo investigate the effect of klotho(KL) gene transfection on the vitality of primary osteoblasts,and to reveal the effect of KL via fibroblast growth factor(FGF)-23 signal path on bone metabolism.MethodsThe primary mesenchymal stem cells (BMSCs) were abstracted from male rats.The morphologies of BMSCs was observed by inverted microscope.After the third generation culture,the specific surface markers of them were identified by flow cytometer.Then BMSCs were cultured by conditioned medium particularly for inducing into osteoblasts for 14~21 days.Alizarin red staining was used to test whether the induction was successful.After successfully inducted,the primary osteoblasts were transfected by adeno associated virus mouse KL gene(rAAV/kL).The experiment was divided into control ,KL,KL with BGJ398(FGFR1 inhibitor) ,adenovirus empty vector,adenovirus empty vector with BGJ398(FGFR1 inhibitor) groups.After treatments,the expression of KL in osteoblasts was detected by RT-PCR,inversed fluorescent microscope and ELISA.The expression of osteoblast discharges: osteopontin (OPN),osteocalcin(OCN) were detected by RT-PCR.ResultsBMSCs were successfully abstracted from rats,and also primary osteoblasts were inducted.After transfected ,the exogenous KL -derived genes were highly expressed (P<0.01).KL improved discharge of OCN(P<0.05) and inhibited OPN(P<0.05) in osteoblasts when KL-FGF23-FGFR1 pathway was normal.ConclusionsKL could promote the vitality of primary osteoblast probably through KL-FGF23-FGFR1 pathway.
【Key words】Osteoblasts;klotho;Osteopontin;Osteocalcin
第一作者:杨秋晨(1988-),女,硕士,主要从事老年心血管疾病的基础与临床研究。
克老素(KL)基因突变与人类多种衰老表型相关,其中包括骨质疏松〔1〕。研究发现在培养来自KL缺陷小鼠的成骨细胞时,其成骨细胞增殖正常但其碱性磷酸酶活性减低,矿化的基质形成显著减少〔2〕。KL蛋白在成纤维生长因子(FGF)23信号转导中,作为成纤维细胞生长因子受体(FGFR)1的辅助因子形成KL-FGF23-FGFR1形式,共同参与对钙、磷稳态的调节〔3〕。本课题组在前期研究中应用携带小鼠KL基因的腺相关病毒载体(rAAV/KL)作用于去势大鼠骨质疏松模型,发现KL表达上调可以明显减缓骨质疏松的病情并改善骨质疏松骨微结构的破坏程度〔4〕。本文推测KL在原发性骨质疏松发生、发展中起重要作用,但其细胞及分子层面的具体机制国内外鲜有报道。本文拟在细胞水平探索klotho刺激成骨细胞因子分泌的能力,揭示KL经FGF23 信号通路对骨代谢调节的分子机制。
1材料与方法
1.1主要试剂和仪器四周龄左右的SD雄性大鼠10只,由重庆医科大学动物实验中心提供(实验过程按照动物伦理学要求处置动物〔5〕);DMEM/F12细胞培养基、胎牛血清为Hyclone公司产品;胰蛋白酶、PBS购于博士德生物公司;RNAiso Plus试剂、PrimeScript RT reagent 试剂盒、Premix TaqTM试剂、DL500DNA Maker购于大连宝生物公司;PCR引物由上海生工生物有限公司提供;DEPC购于Sigma公司;FGFR1抑制剂BGJ398(Selleckchem公司);小鼠KL ELISA试剂盒购于北京博奥森生物公司;4%多聚甲醛(含DEPC)为博士德生物公司产品;SD大鼠骨髓间充质干细胞(BMSCs)成骨诱导分化培养基和茜素红染色试剂(cyagen公司);Anti-Rat CD45 PE、Anti-Rat CD90.1 PE、Anti-Rat CD44H PE均购于eBioscience公司。
1.2方法
1.2.1携带小鼠KL基因的rAAV/KL及带有荧光的重组腺空载体病毒(rAAV/GFP)的构建由本课题组前期完成,参照文献〔4〕。
1.2.2BMSCs的分离、培养SD大鼠采用10%水合氯醛(2 ml/kg)腹腔注射麻醉,0.5%无菌碘伏擦拭大鼠全身,无菌条件下剪开大鼠皮肤,分离肌肉,取双侧股骨和胫骨,用无菌纱布除去骨表面的附着组织(骨膜、肌肉),置于无菌PBS中。用剪刀剪断股骨和胫骨中段,暴露骨髓腔。用10 ml无菌注射器从骨的断端注入0.9%无菌生理盐水反复冲洗骨髓腔。将收集的骨髓液置于无菌10 ml玻璃离心管中。1 500 r/min,10 min离心后用 4~5 ml DMEM/F12培养液(含体积分数10%的胎牛血清)吹匀细胞,重悬。将细胞用25 cm2无菌塑料培养瓶均匀收集。然后置于温度37℃、CO2饱和度为5%的恒温细胞培养箱中继续培养。72 h后首次全量换液,之后每3 d全量换液1次。当倒置显微镜观察细胞密度达到85%左右时,用0.25%无菌胰蛋白酶37℃消化5 min,镜下观察约80%细胞变圆形后用新鲜培养基终止消化,1 000 r/min、3 min离心后,轻柔吹打使之成为单细胞悬液,然后按1∶2比例传代培养。显微镜下观察BMSCs形态。
1.2.3流式细胞术鉴定BMSCs将BMSCs培养至第三代,观察细胞密度达85%时消化成单细胞悬液,分装置EP管中。用预冷PBS清洗3次,各EP管分别加入CD44、CD45、CD90抗体3 μl,并设立同型阴性对照。冰上孵育40 min后,用预冷PBS清洗3次,最后加入500 μl/管PBS重悬细胞,送至重庆医科大学生命科学院做流式检测。
1.2.4BMSCs诱导为成骨细胞取生长均匀,密度达80%以上的第三代BMSCs消化为单细胞悬液,计数后按照每孔3×104/cm2接种于24孔板中。观察细胞密度达70%~80%时换为SD大鼠BMSCs成骨诱导分化培养基培养。每3 d全量换液。培养14~21 d后茜素红染色鉴定是否诱导成功。同时相同条件下接种一块24孔板,培养期间使用DMEM培养液(含10%胎牛血清),其余培养条件相同,作为阴性对照。
1.2.5成骨细胞鉴定(茜素红染色方法)诱导后,将诱导培养液用塑料移液管吸尽,再用1 ml PBS清洗孔板。用2 ml/孔4%多聚甲醛固定30 min。30 min后,将孔板用PBS清洗2次,加入茜素红染剂1ml/孔,作用3~5 min。最后,将孔板用PBS清洗3遍,倒置相差显微镜观察有无出现被染红的特异钙结节。
1.2.6实验分组处理空白对照组(Control组),成骨细胞培养基中不加任何干预因素;KL组,通过载有KL基因的重组小鼠腺相关病毒rAAV/KL转染成骨细胞作用72 h;KL+BGJ398组,rAAV/KL转染成骨细胞24 h后加入BGJ398(3 μmol/L)处理48 h;空载体组(rAAV组),通过rAAV/GFP(对照空病毒载体)转染成骨细胞,作用72 h;rAAV+BGJ398组,rAAV/GFP转染成骨细胞24 h后加入BGJ398(3 μmol/L)处理48 h。
1.2.7荧光倒置显微镜观察成骨细胞rAAV/KL表达情况转染rAAV/KL及rAAV/GFP 72 h后,荧光倒置显微镜下观察荧光表达情况。
1.2.8ELISA检测各组细胞上清液 KL蛋白表达水平各组细胞分组处理后收集细胞上清液,用 ELISA试剂盒检测上清液中 KL蛋白的含量,按说明书操作后,用ELISA绘图软件CurveExpert1.3 绘制标准曲线,得到回归方程后根据样品OD值查找样品浓度。
1.2.9RT-PCR检测成骨细胞KL及骨钙素(OCN)、骨桥蛋白(OPN)mRNA 的表达按照RNAiso Plus试剂说明书提取细胞总RNA,NanoDrop 2000超微量分光光度计下检测RNA 260/280 比值为1.9,10 μl体系反转录合成cDNA,然后25 μl体系扩增,按照:94℃、4 min→94℃、30 s→60℃、30 s→72℃、45 s→循环至94℃、30 s→72℃、1 min→4℃、4 min。PCR引物序列见表1。反应结束后,电泳、成像,用Quantity One图像分析软件分析图像灰度值。
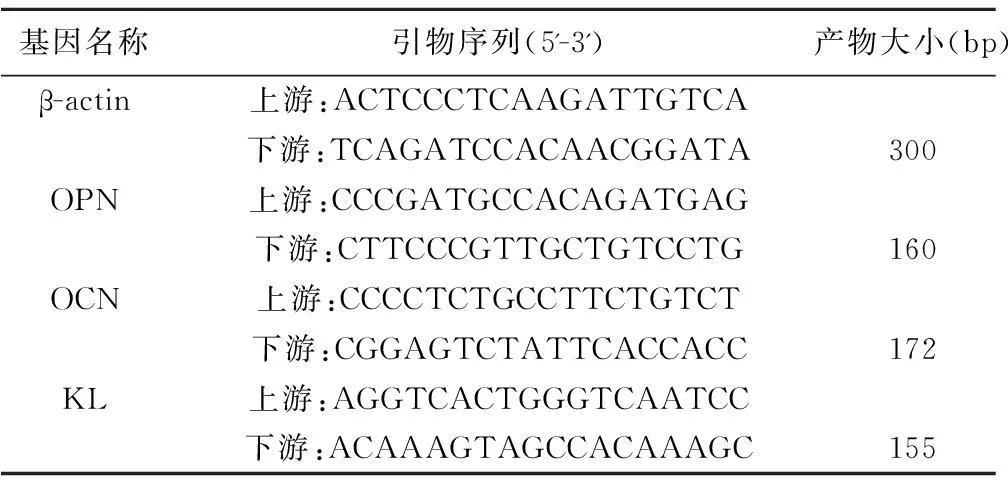
表1 PCR引物序列及产物大小
2结果
2.1BMSCs细胞生长情况原代培养24 h后可见大量造血细胞漂浮,有少量肌肉碎片,培养液浑浊略发黄。72 h首次换液,可见少量贴壁细胞,呈短梭形或多角形;培养第6天可见细胞开始呈集落打旋生长,密度可达50%;培养至第13天,观察到细胞密度可达85%以上,以长梭形为主,用0.25%胰酶消化后以1∶2比例传代。见图1。
2.2流式鉴定BMSCs结果流式细胞仪分析结果显示BMSCs表达CD90、CD44、CD45分别为98.41%,91.70%,1.27%。
2.3茜素红染色结果诱导培养3 d后细胞体积增大,主要呈短梭形;6 d时见细胞开始变为多角形,胞质内细胞颗粒增多;11d观察见胞质内充满颗粒,开始出现金属光泽的钙质沉积;13 d左右见结节中心的细胞逐渐融合失去正常细胞结构;诱导14~21 d后茜素红染色可见红色钙盐沉积,而对照组无。见图2。
2.4各组大鼠成骨细胞表达KL情况转染了rAAV/KL及rAAV/GFP的细胞荧光强度明显高于其他各组,且表达荧光细胞多,表明rAAV在成骨细胞中可以表达,见图3。RT-PCR检测结果表明:转染rAAV/KL组细胞显著表达KL mRNA,其他组未见表达,见图4。ELISA 结果显示,转染了rAAV/KL上清液中的分泌性 KL蛋白表达〔(76.33±0.59)pg/ml〕明显高于其他组〔Control、rAAV、rAAV+BGJ398组分别为(4.94±0.48)、(4.77±0.39)、(4.94±0.10)pg/ml(P<0.01);KL+BGJ398组K蛋白含量为〔(75.84±0.28)pg/ml〕。表明KL已成功转染至成骨细胞。

图1 BMSCs细胞生长情况(×100)
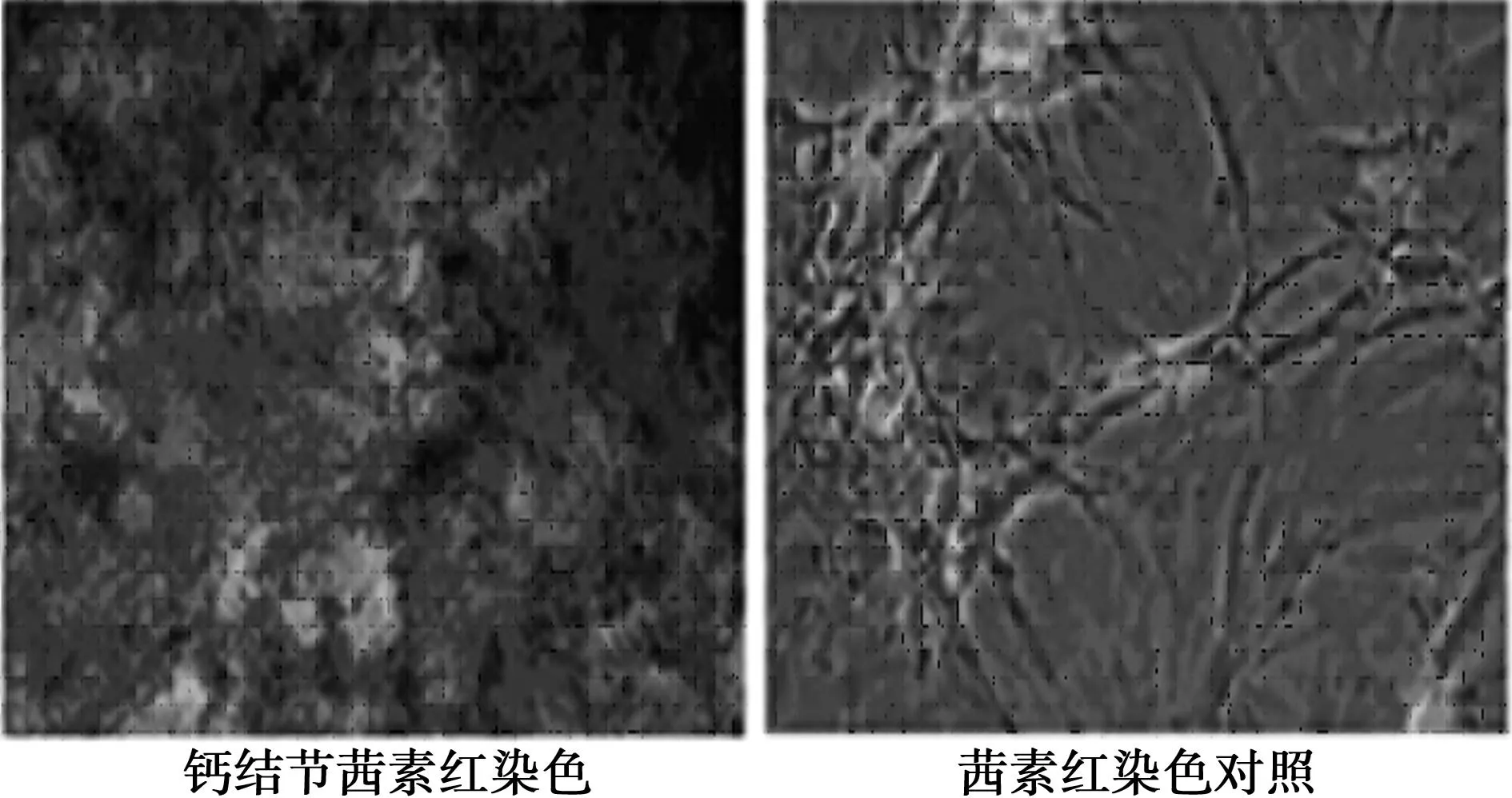
图2 成骨细胞茜素红染色结果(×100)
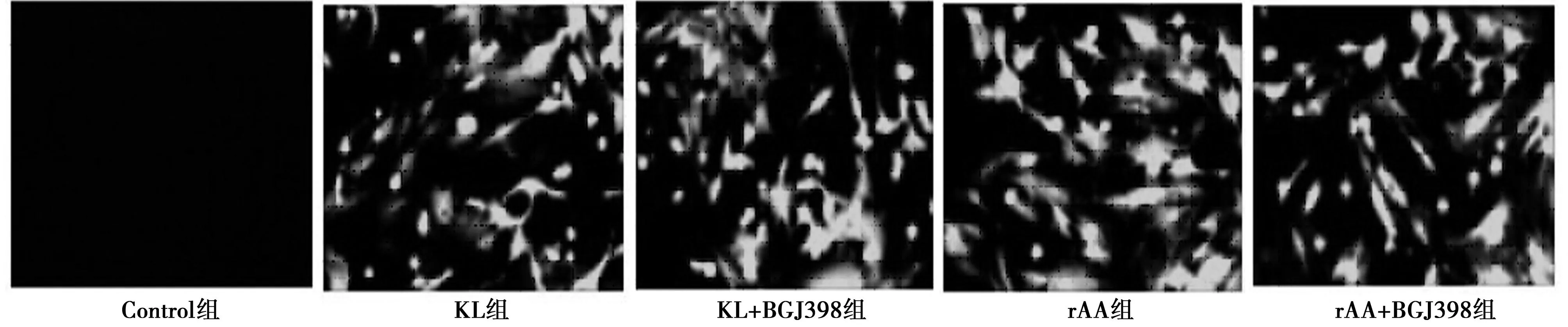
图3 荧光倒置显微镜观察成骨细胞荧光表达情况(×100)
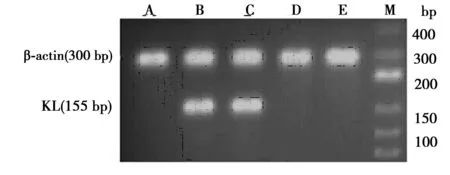
A: Control组,B: KL组,C: KL+BGJ398组,D: rAAV组,E: rAAV+BGJ398组;M:marker,下图同 图4 RT-PCR检测成骨细胞KL mRNA的表达
2.5各组细胞骨桥蛋白(OPN)mRNA表达RT-PCR结果显示,rAAV/KL单独处理72 h后,OPN表达量(0.320)明显低于Control组(0.825)(P<0.05);转染KL组较BGJ398(0.812)及KL联合干预组(0.812)表达OPN的量显著减少(P<0.05);BGJ398组与BGJ398 及KL联合干预组OPN表达量无显著性差异;KL组较空载体组(0.819)表达OPN量明显减少(P<0.05);空载体组与空载病毒及BGJ398联合干预组表达OPN量无显著性差异。见图5。
2.6各组细胞OCN mRNA表达rAAV/KL单独处理72 h后,OCN表达量(0.638)明显高于Control组(0.339)(P<0.05);转染KL组较BGJ398(0.339)及KL联合干预组(0.323)表达OCN的量显著增加(P<0.05);BGJ398组与BGJ398 及KL联合干预组OCN表达量无显著性差异;KL组较空载体组(0.294)表达OCN量明显增加(P<0.05);空载体组与空载病毒及BGJ398联合干预组表达OCN量无显著差异。见图6。

图5 RT-PCR检测成骨细胞OPN mRNA的表达
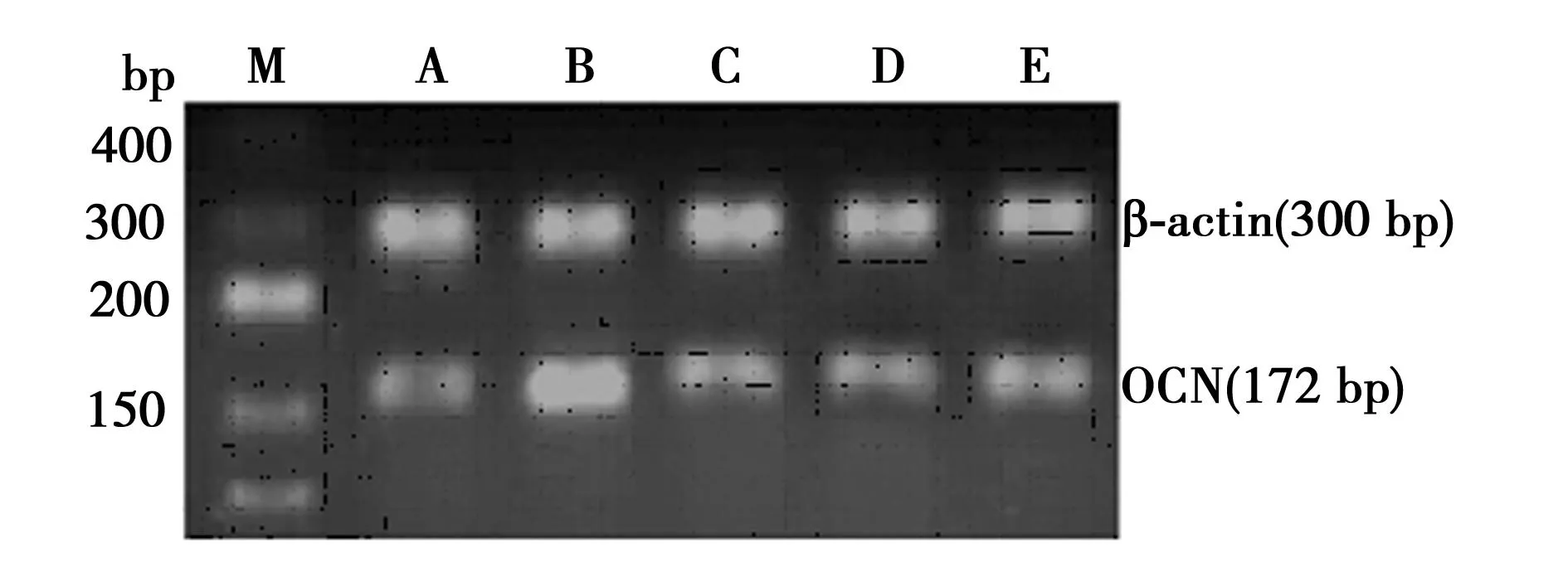
图6 RT-PCR检测成骨细胞OCN mRNA的表达
3讨论
如前所述,转型升级、知识服务与融合发展之间的关系在于:转型升级是个过程,是个有起点无终点的过程,新闻出版业将处于并将长期处于转型升级的过程中;融合发展是一种状态,是传统媒体与新兴媒体、传统出版与新兴出版、传统业态与新兴技术相互交融、通融、互融、共融的状态;知识服务是目标,是新闻出版业转型升级的最终目标,只有当传统的新闻出版企业由资讯提供商、图书提供商成功转型为全方位、立体化、多层次的知识服务提供商时,转型升级的初衷才会实现,提质增效的目标也才会达成,传统出版与新兴出版、传统媒体与新兴媒体融合发展的状态也才会出现。
随着社会人口老龄化,骨质疏松(OP)发生率明显增高,已成为影响老年人生活质量、导致社会家庭负担增加的常见疾病之一〔6〕。本实验提取原代大鼠BMSCs并向成骨方向诱导分化,茜素红染色结果表明诱导成功,为后续实验成骨细胞的来源做好了铺垫。
rAAV具有多种优点,包括安全性好、免疫原性低、能感染分裂细胞和非分裂细胞等,被认为是目前最有应用潜力的基因载体〔7〕。OPN是一种在骨、牙齿等组织高度表达的分泌性糖蛋白〔8〕。OPN在钙化组织中有以下生物学功能:①调节骨细胞的黏附;②调节破骨细胞的功能;③调节基质矿化功能〔9〕。前期体外研究表明OPN抑制矿化可能是通过抑制羟磷灰石的形成和晶体的形成 ,从而负向调节钙化〔10〕。本实验结果间接说明了KL具有促进成骨细胞矿化、成骨的功能。
OCN是骨中最丰富的非胶原蛋白之一〔11〕,其主要功能是维持骨组织正常矿化,通过维持骨正常矿化速率,抑制异常羟磷灰石结晶的形成,促进骨组织矿化物质沉积〔12〕。本实验结果表明KL蛋白可以促进成骨细胞分泌OCN,促进了成骨细胞的活力与功能。
FGF23属于FGFs中的一员,因其以激素形式表达功能,又被称为内分泌FGF。FGF23主要在骨细胞和成骨细胞中表达,其主要功能是抑制肾脏对磷的再吸收和控制维生素D含量,在骨-肾轴中发挥重要的作用〔13〕。Klotho蛋白主要在肾脏远曲小管和脑脉络丛表达,有两种存在形式:跨膜型蛋白和分泌性蛋白〔14〕。研究表明,跨膜型KL作为FGF23的特有的受体辅助因子,通过形成KL-FGF23-FGFR1复合物形式影响FGF23发挥作用〔15〕。Smith等〔14〕通过在体内实验研究发现经基因转染方式增加循环中cKL蛋白(来源于模型KL蛋白的胞外区部分,经锚定在细胞膜上的金属蛋白酶水解脱落而产生的,简称cKL)能刺激FGF23的产生而发挥磷代谢调节作用,其机制可能是通过在骨组织cKL-FGF23-FGFR相互作用而实现的。Kuro-o等〔15〕发现缺失KL的小鼠会出现骨量减少的表现:与野生型小鼠相比,其股骨,胫骨,椎骨的皮质骨厚度减少了20%~40%,而这种骨量减少并不同于女性绝经期骨量减少,其表现为同时伴有骨形成和骨吸收的减少,其中骨形成的减少大于骨吸收的减少。本实验结果表明只有在KL表达增加并且FGF23通路正常的情况下,才会出现成骨细胞活力增加;而当FGF23信号通路被抑制或者KL几乎不表达时,成骨细胞的活力并无增强。上述研究结果表明KL有可能是通过FGF23-FGFR1信号通路参与调节OP的发生、发展过程。
参考文献4
1Wang Y,Sun Z.Current understanding of klotho〔J〕.Aging Res Rev,2009; 8:43-51 .
2Kawaguchi H,Manabe N,Chikuda H,etal.Cellular and molecular mechanism of low-turnover osteopenia in the klotho-deficient mouse〔J〕.Cell Mol Life Sci,2000;57:731-7.
3Taketani Y,Yamamoto H,Takeda E,etal.Vitamin D and phosphate metabolism:relationship with aging-regulating gene〔J〕.Clin Calcium,2006;16:1137-42.
4王艳娇,马厚勋,李宝善,等.腺相关病毒介导的klotho基因表达对去势大鼠骨Runx2及MMP-13表达的影响〔J〕.基础医学与临床,2012;32(5):487-92.
5Kanis J A,Melton L J,Christiansen C,etal.The diagnosis of osteoporosis〔J〕.J Bone Miner Res,1994;9:1137-41.
6Pacak CA,Byrne BJ.AAV vectors for cardiac gene transfer:experimental tools and clinical opportunities〔J〕.Mol Ther,2011;19(9):1582-90.
7Gecilia MG,Susan Steitz.Mini review-osteopontin:a versatilereulato of inflammation and biomineralization〔J〕.Matrix Biol,2000;19(7):615-22.
8Huang W,Carlsen B,Rudkin G,etal.Osteopontin is a negative regulator of proliferation and differentiation in MC3T3-E1 pre-osteoblastic cells〔J〕.Bone,2004;34(5):799-808.
9Ferron M,Lacombe J.Regulation of energy metabolism by the skeleton:Osteocalcin and beyond〔J〕.Arch Biochem Biophys,2014;23(2):100-9.
10Gundberg CM,Lian JB,Booth SL.Vitamin K-dependent carboxylation of osteocalcin:friend or foe〔J〕?Adv Nutr,2012;3(2):149-69.
11Martin A,David V,Quarles LD.Regulation and function of the FGF23/klotho endocrine pathways〔J〕.Physiol Rev,2012;92(1):131-48.
12Kurosu H,Yamamoto M,Clark JD,etal.Suppression of aging in mice by the hormone klotho〔J〕.Science ,2005;309 (10): 1829-33.
13Kuro-o M.Klotho and aging〔J〕.Biochim Biophys Acta,2009;1790(10):1049-68.
14Smith RC,O’Bryan LM,Farrow EG,etal.Circulating α Klotho influences phosphate handling by controlling FGF23 production〔J〕.J Clin Invest,2012;122(12):4710-5.
15Kuro-o M,Matsumura Y,Aizawa H,etal.Mutation of the mouse klotho gene leads to a syndrome resembling ageing〔J〕.Nature,1997;390 (10) 45-51.
〔2014-08-25修回〕
(编辑徐杰)
