Akt-GSK3β细胞信号通路在血管性痴呆大鼠认知障碍中的作用机制
2015-12-30赵雪艳
Akt-GSK3β细胞信号通路在血管性痴呆大鼠认知障碍中的作用机制
赵雪艳
(河南大学淮河医院神经内科,河南开封475000)
摘要〔〕目的探讨Akt-GSK3β细胞信号通路在血管性痴呆大鼠认知障碍中的作用机制。方法通过Morris水迷宫实验、跳台实验以及生化指标测定比较模型组和正常组的差异,分析Akt-GSK3β细胞信号通路的作用机制。结果模型组逃避潜伏期、通过原平台次数、原平台所在象限停留百分比与正常组差异显著(P<0.05);模型组的反应时间、学习错误次数、潜伏时间、记忆错误次数与正常组差异显著(P<0.05);术后2、4、6 w模型组视野内正常神经元数目均明显低于同时期的正常组;术后2 w、术后4 w模型组的p-Akt蛋白表达和p-GSK-3β蛋白表达明显高于同时期正常组(P<0.05)。结论对于血管性痴呆大鼠,Akt-GSK3β细胞信号通路可调控细胞凋亡,在保护神经元和改善认知的过程中发挥重要作用。
关键词〔〕血管性痴呆;信号通路
中图分类号〔〕R743〔文献标识码〕A〔
第一作者:赵雪艳(1975-),女,硕士,副主任医师,主要从事脑血管病、神经免疫学研究。
血管性痴呆(VD)是由于出血性脑血管病、缺血性脑血管病等导致的持续性、获得性智能障碍综合征,主要临床表现为学习和记忆功能障碍〔1~3〕。在我国,脑血管病呈逐年上升的趋势,VD作为老年期痴呆的主要组成部分给人们带来严重的心理和经济负担〔4,5〕。研究表明脑源性神经营养因子可激活下游Akt-GSK3β信号通路发挥抗细胞凋亡作用,保护神经元。本研究探讨Akt-GSK3β细胞信号通路在VD大鼠认知障碍中的作用机制。
1资料和方法
1.1实验动物8月龄昆明种大鼠,雌雄各半,体重(21±2)g。实验前先适应性饲养1 w,饲养于通风、干燥、安静的环境中,普通饲料喂养。实验前为排除有游泳障碍的动物,将大鼠放入水迷宫内自由游泳30 s。
1.2方法
1.2.1动物分组将动物随机分成正常组30只和模型组30只,正常组、模型组根据不同时期分为术后2 w、4 w、6 w三个小组,每组10只,共30只。
1.2.2模型制备大鼠腹腔注射350 mg/kg 10%水合氯醛进行麻醉,颈部消毒,切开颈部皮肤及皮下组织,钝性分离双侧颈总动脉,用4号丝线同时结扎阻断双侧血流20 min,之后松开丝线恢复血流10 min,然后再次阻断20 min,恢复10 min,如此进行3次。相当于进行3次20 min缺血,3次10 min再灌注。大鼠心跳、呼吸平稳后缝合皮肤,正常饲养72 h后不死亡就作为模型组。
1.2.3行为学测试术后对正常组和模型组进行行为学测试,分别为Morris水迷宫实验和跳台实验,测试均在光线偏暗、安静的环境下进行。
Morris水迷宫实验:水迷宫主要由一个一个圆形水池和可移动位置的平台组成。水池高45 cm,直径80 cm,平台直径6 cm。注入清水到水池中至水深30 cm,平台低于水面1 cm。加入牛奶使池水变为不透明乳白色,使大鼠无法看到乳白色平台。将水池平均分为4个象限,任选的一个象限把平台放置于中央。测试内容包括:①定位航行实验:每天上、下午各1次,历时4 d,每个象限均进行1次。选择任一象限将大鼠面向池壁放入水中,大鼠找到平台后记录时间,即为逃避潜伏期。让大鼠在平台上休息15 s,如果60 s后还无法找到平台,帮助大鼠上平台休息15 s。休息之后按顺时针顺序到下一个象限进行实验。②空间探索实验:第5天把平台撤除,从任一点将大鼠放入水中,观察60 s内大鼠在原平台所在象限的停留时间百分比,计算通过原平台位置次数和。
跳台实验:被动回避反应箱为10 cm×10 cm×40 cm,箱底放置可通电铜栅,铜栅直径3 mm。反应箱一角距离箱底4.5 cm处放置一直径为4.5 cm的绝缘橡皮垫,作为回避电击的安全台。先将大鼠放入箱内适应3 min,之后给铜栅通36 V交流电,持续5 min。每天上、下午各1次,历时4 d,记录大鼠受电击后第一次找到安全台的时间作为反应时间,5 min内跳下安全台的次数作为学习错误次数。第5天直接将大鼠放在安全台上,同时给铜栅通电,持续5 min。记录大鼠第一次从安全台跳到铜栅上的时间作为潜伏时间,5 min内跳下安全台的次数作为记忆错误次数。
1.2.4正常神经元计数两项行为学检测结束后,立即断髓处死大鼠,迅速取出脑组织,制备石蜡组织标本。每只大鼠选取2张相同部位的切片,在10×40倍光镜下观察海马CA1区的2个连续视野,计算各视野正常神经元数目。神经元正常标准为细胞核无细胞皱缩和水肿表现、呈圆形或椭圆形。
1.2.5术后p-Akt、GSK-3β和p-GSK-3β蛋白表达标本选取自断髓处死大鼠的海马组织,提取蛋白,应用Western印迹技术检测p-Akt、GSK-3β和p-GSK-3β蛋白表达,试剂分别使用p-Akt Ser473抗体、GSK-3β抗体和p-GSK-3β Ser9抗体。p-Akt为活化Akt,p-GSK-3β为磷酸化GSK-3β。以术后2 w正常组数据为1,各组P-AKt、GSK-3β、p-GSK-3β蛋白表达与术后2 w正常组的比值作为其表达量。
1.3统计学方法采用SPSS13.0软件行t及χ2检验。
2结果
2.1两组大鼠行为学测试结果比较模型组的逃避潜伏期明显高于正常组(P<0.05);模型组通过原平台次数、原平台所在象限停留百分比明显低于正常组(P<0.05)。见表1。模型组的反应时间、学习错误次数、记忆错误次数明显高于正常组(P<0.05);模型组的潜伏时间明显低于正常组(P<0.05)。见表2。
2.2两组大鼠脑组织正常神经元计数比较术后2 w、术后4 w、术后6 w模型组视野内正常神经元数目均明显低于同时期的正常组(P<0.05)。见表3。
2.3各组p-Akt蛋白表达术后2 w、术后4 w模型组的p-Akt蛋白表达明显高于同时期的正常组(P<0.05);术后6 w模型组的p-Akt蛋白表达与同时期的正常组的差异不明显(P>0.05)。见表4。

表1 两组大鼠Morris水迷宫实验结果比较

表2 两组大鼠跳台实验结果比较
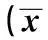
表3 两组大鼠脑组织正常神经元数目比较 ± s, n=10)
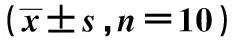
表4 两组术后p-Akt蛋白表达的比较
2.4各组GSK-3β蛋白表达术后2 w、术后4 w、术后6 w模型组的GSK-3β蛋白表达与同时期的正常组的差异不明显(P>0.05)。见表5。
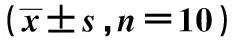
表5 两组术后GSK-3β蛋白表达的比较
2.5各组p-GSK-3β蛋白表达术后2 w、术后4 w模型组的p-GSK-3β蛋白表达明显高于同时期的正常组(P<0.05);术后6 w模型组的p-GSK-3β蛋白表达与同时期的正常组的差异不明显(P>0.05)。见表6。
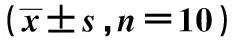
表6 两组术后p-GSK-3β蛋白表达的比较
3讨论
VD会严重影响患者的日常生活能力、生活质量和社会职业功能,增加医药费用,缩短患者寿命,加重家庭和社会的负担,其主要表现为语言、记忆、认知能力、视觉功能、人格或情商等方面的改变,特别是以高级认知功能减退、记忆丧失为主〔5~8〕。痴呆已经成为继脑卒中、癌症和心血管病之后的第四大死亡杀手〔9〕。
短暂性脑缺血可导致静止性梗死、细胞凋亡、选择性神经元坏死,如果出现反复发生的情况,会导致认知下降。由缺血再灌注诱导的损伤会导致炎性反应,作为神经生长因子的脑源性神经营养因子的表达在脑缺血时会出现增高,结合细胞膜表面的酪氨酸激酶受体B(TrkB),从而激活下游的PI3K-Akt信号通路。文献报道证实,脑缺血后的神经元凋亡过程中有PI3K-Akt信号通路的参与,学习记忆与PI3K-Akt信号通路存在密切相关性〔10〕。PI3K-Akt信号通路是细胞中一种重要的存活/凋亡途径,参与细胞有丝分裂、分化、迁移和存活〔11〕。GSK-3是一种丝氨酸/苏氨酸蛋白激酶,具有多种功能〔12〕。GSK-3α和GSK-3β是GSK-3主要的2种亚型,GSK-3β属于Akt下游主要靶激酶之一,包含十几种转录因子,可磷酸化几十种蛋白,是细胞内多种信号通路的重要组成成分。GSK-3β诱导凋亡途径主要包括:抑制促存活转录因子,促进促凋亡转录因子;激活凋亡相关蛋白激酶;磷酸化eIF2B而抑制蛋白合成。PI3K-Akt信号通路在调控凋亡过程中会对GSK-3β产生很大的影响,GSK-3β的Ser9位点会被激活的Akt磷酸化,下调GSK-3β的活性,磷酸化β连环蛋白,促进细胞生存。
本研究结果显示,经过反复脑缺血再灌注手术的大鼠,其海马CA1区的正常神经元数目明显少于正常组大鼠,术后4 w的正常神经元数目最少。Black〔13〕研究认为与学习记忆功能关系密切的海马神经元对反复脑缺血再灌注损伤的敏感性最高,本研究结果与该报道相一致。在这一病理改变的影响下,正常组和模型组的Morris水迷宫实验、跳台实验结果差异显著。Morris水迷宫实验中模型组的逃避潜伏期明显高于正常组,通过原平台次数、原平台所在象限停留百分比明显低于正常组。跳台实验中模型组的反应时间、学习错误次数、记忆错误次数明显高于正常组,潜伏时间明显低于正常组。范鸣玥〔14〕通过线栓法再灌注大脑建立血管性痴呆大鼠模型行Morris水迷宫实验,发现模型组大鼠的学习记忆能力明显差于正常组。Endo等〔15〕研究显示,对缺血敏感的海马CA1区总GSK-3β的表达未发生变化,而p-GSK-3β的表达增加。本研究与上述研究结果一致,提示对于VD大鼠,Akt-GSK3β细胞信号通路可调控细胞凋亡,在保护神经元和改善认知的过程中发挥重要作用。
4参考文献
1张允岭,高芳,孟繁兴,等.从转化医学的理念谈血管性痴呆和轻度认知障碍的中医防控〔J〕.中华中医药杂志,2011;26(12):2766-70.
2庞睿娟,肖军.胆碱酯酸抑制剂在血管性痴呆中的治疗进展〔J〕.中华临床医师杂志,2012;6(10):2727-9.
3Woolf NJ,Butcher LL.Cholinergic systems mediate action from movement to higher consciousness〔J〕.Behav Brain Res,2011;221(1):488-98.
4张华,李娜,吴瑞鹏,等.缺血性小血管病变的影像学特点与血管性痴呆的相关研究〔J〕.中华脑血管病杂志,2011;5(5):367-72.
5张慧.脑缺血预处理通过PI3K/Akt/GSK3β信号通路减轻缺血性脑损伤及抑制凋亡的机制研究〔D〕.大连:大连医科大学,2011.
6李灵真,张华.血管性认知功能障碍及痴呆患者血浆内皮素-1和血管内皮生长因子含量变化及意义〔J〕.中华脑血管病杂志,2010;4(6):434-9.
7郝卫平,康美清,郭富城.针药联合治疗血管性痴呆临床疗效观察〔J〕.中医药临床杂志,2012;24(11):1048-9.
8周小青,危玲,何军锋,等.丹龙醒脑方对老年肾虚血管性痴呆大鼠模型的海马Bax,Bcl-2蛋白表达及神经元凋亡的影响〔J〕.中华中医药杂志,2012;27(10):2681-3.
9李晓梅,杨毅宁,马依彤,等.再灌注抢救激酶在肥厚心肌缺血后适应中的作用〔J〕.中华高血压杂志,2011;19(3):263-8.
10Song JQ,Teng X,Cai Y,etal.Activation of Akt/GSK-3beta signaling pathway is involved in intermedin(1-53) protection against myocardial apoptosis induced by ischemia/reperfusion〔J〕.Apoptosis,2009;14 (11):1299-307.
11张玲.165例血管性痴呆患者医院感染临床分析〔J〕.中华医院感染学杂志,2011;21(2):276-7.
12郑里翔,邓科穗,乔玉丹,等.补骨脂汤对血管性痴呆大鼠海马内雌激素受体-β、NMDAR2B基因表达的影响〔J〕.中华中医药杂志,2010;25(9):1496-8.
13Black SE.Vascular cognitive impairment:epidemiology,subtypes,diagnosis and management〔J〕.JR Coll Physicians Edinb,2011;41(1):49-56.
14范鸣玥.血管性痴呆小鼠海马组织病理学变化及Akt-GSK3β细胞信号通路表达变化〔D〕.石家庄:河北医科大学,2011.
15Endo H,Nito C,Kamada H,etal.Activation of the Akt/GSK3beta signaling pathway mediates survival of vulnerable hippocampal neurons after transient global cerebral ischemia in rats〔J〕.J Cereb Blood Flow Metab,2006;26(12):1479-89.
〔2014-06-17修回〕
(编辑安冉冉/曹梦园)
